2. 肥城市行政审批服务局,271600,山东肥城
-
项目名称
- 内蒙古自治区科技重大专项项目"物理-化学-(微)生物复合型固沙改土材料精准配施工艺的研发"(2019ZD003-3-1);山东省农业科技资金(林业科技创新)课题"黄泛沙地防风治沙型优良经济林草高效栽培技术研究与示范"(2019LY005-03);欧洲投资银行贷款山东沿海防护林工程项目监测与评价(SCSFP-JC)
-
第一作者简介
- 窦晓慧(1997-), 女, 硕士研究生。主要研究方向: 水土保持生态修复。E-mail: 17854337082@163.com
-
通信作者简介
- 董智(1971-), 男, 博士, 教授。主要研究方向: 荒漠化防治与生态修复。E-mail: nmgdz@163.com
-
文章历史
-
收稿日期:2022-07-04
修回日期:2023-11-18
2. 肥城市行政审批服务局,271600,山东肥城
2. Feicheng Administrative Examination and Approval Service Bureau, 271600, Feicheng, Shandong, China
重金属镉(cadmium,Cd)由于其强大的迁移性、抗降解性和高毒性,对人类构成极大威胁。Cd污染是一个严重的全球性问题。近年来,随着工业污染和高Cd含量的农业肥料的应用,Cd污染问题日益严重,已成为众多学者关注的焦点之一。植物修复应用于重金属污染治理,不仅可以吸收富集重金属,还具有植被重建、景观修复和改良土壤等功能[1]。高浓度的重金属可能会通过降低代谢活性并诱导氧化损伤、影响光合作用、诱导植物异常形态、破坏营养平衡、导致细胞膜功能紊乱等影响作物生长和产量[2-3]。因此,筛选具有抗性强、耐受重金属浓度高和吸收转运能力强的植物种,仍是植物修复重金属污染领域的热点。
内生真菌常应用于与植物根系形成共生关系,通过这种共生关系来提高植物对高浓度Cd的耐受性[4],并且能增加植物的生物富集系数,降低转移系数,达到在非再利用部分积累Cd的目的,在收获良好生态效益的基础上获得经济效益[5-6]。越来越多的研究者开始关注利用植物与内生真菌联合的手段来修复重金属污染土壤,以期促进植物对重金属污染修复的功能[7]。
紫花苜蓿(Medicago sativa)作为一种多年生豆科植物,对Cd有较强的吸收富集能力[8],对Cd污染的土壤有巨大的修复潜力[9],但在Cd胁迫下紫花苜蓿生长存在“低促高抑”的现象及品种差异性[10]。印度梨形孢(Piriformospora indica)是一种内生真菌,首次发现于印度西北部塔尔沙漠的植物根系,可以进行人工离体培养,能促进宿主植物生长和增加产量[11],提高植物的抗氧化活性及其在重金属胁迫下的生存能力。目前,有关于印度梨形孢联合紫花苜蓿的抗性研究,主要集中于对干旱和耐盐方面,对于印度梨形孢—紫花苜蓿共生体对重金属镉的响应研究较少,更缺乏生理机制方面研究。基于此,笔者以紫花苜蓿作为试验材料,通过水培实验研究印度梨形孢—紫花苜蓿共生体幼苗对不同质量浓度Cd胁迫下的响应,分析印度梨形孢-紫花苜蓿共生体幼苗的生长和生理特性、抗氧化活性以及重金属Cd的积累、富集和转移以期揭示植物与印度梨形孢共生后早期幼苗对Cd污染的生理特性的响应,为微生物—植物抗逆性研究和重金属Cd水土污染的修复提供理论依据。这对进一步加强加速水土保持生态修复具有重要意义。
1 材料和方法 1.1 试验材料供试草种为WL354HQ紫花苜蓿,由济南高夫草坪有限公司提供。供试菌种为印度梨形孢,由山东省林业科学研究院提供。
1.2 试验设计试验于2021年3月至10月在山东农业大学林学实验站进行。试验设置2个处理组,分别为接菌处理组(P+)和不接菌组(P-)。选择成熟且饱满的紫花苜蓿草种,先用次氯酸钠溶液(3%)浸泡20 min,再用乙醇(70%)浸泡20 min,最后用去离子水冲洗3遍,播种于种植槽内。1个月后移苗,挑选长势一致的5株健康幼苗为1组,移栽到含有1/2霍格兰营养液的水中,重复3次。1周后,在接菌组中加入印度梨形孢菌丝,每1 L水培基质中加入3 g印度梨形孢菌丝,使水培基质中的印度梨形孢菌丝质量浓度为3 g/L[12],对照组不做任何处理。定殖25 d后,使用台盼蓝染色法[13]观察共生体根系印度梨形孢的定殖情况。将2组处理的植株幼苗转移到含有营养液的清水中,再加入Cd。Cd质量浓度梯度设置为0、5、10、30、50和100 mg/L。
1.3 指标测定Cd胁迫7 d后,测量紫花苜蓿幼苗株高、叶片数、黄叶数及生物量(根、茎、叶)等生长指标,并采集新鲜叶片于超低温冰箱(-80 ℃)冷冻保存,用于生理指标的测定。采用考马斯亮蓝G-250法测可溶性蛋白;采用蒽酮比色法测可溶性糖[14];采用茚三酮比色法测定脯氨酸;采用硫代巴比妥酸法测丙二醛;采用愈创木酚比色法测过氧化物酶;采用紫外分光光度计法测过氧化氢酶;采用NBT光还原法测超氧化物歧化酶[15];用电感耦合等离子发射光谱法(ICP)测不同器官内Cd含量[16]。转移系数和生物富集系数[17]计算式如下:
| $ T_{\mathrm{F}}=S / R \text {; } $ | (1) |
| $ B_{\mathrm{CF}}=C_{\mathrm{p}} / C_{\mathrm{s}} \text { 。} $ | (2) |
式中:TF为转移系数,量纲为1;S为植物地上部分重金属质量分数,mg/kg;R为植物根部重金属质量分数,mg/kg;BCF为生物富集系数,量纲为1;Cp为植物重金属质量分数,mg/kg;Cs为营养液中重金属质量分数,mg/kg。
采用Excel 2010和SPSS 22.0软件进行显著性分析,显著性水平为P<0.05,绘图采用Origin 2019。
2 结果与分析紫花苜蓿幼苗在含有印度梨形孢的水培基质中培养25 d后,用台盼蓝染色法对紫花苜蓿幼苗根部组织进行染色,在正置荧光显微镜下进行观察。如图 1所示,印度梨形孢的厚垣孢子呈蓝色梨状,在紫花苜蓿幼苗主根和侧根的根端部分密集分布着大量的厚垣孢子。这说明印度梨形孢能在紫花苜蓿根部定殖,且主要分布在根端部分,二者成功建立共生关系。
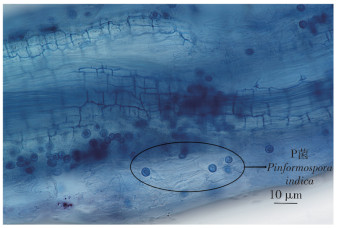
|
图 1 紫花苜蓿幼苗根系侵染状况(100X) Fig. 1 Root infection status of Medicago sativa (100X) |
由表 1可知,在低质量浓度(5 mg/L)下,P+和P-紫花苜蓿幼苗叶片数、株高和干质量较0均呈增加,但随着Cd质量浓度增加,紫花苜蓿幼苗叶片数、株高和干质量在2种处理下均随质量浓度增加而呈降低趋势,而黄叶数呈增加趋势。在相同Cd质量浓度下,P+与CK组之间紫花苜蓿幼苗叶片数和株高无显著差异。P+紫花苜蓿幼苗干质量仅在10和30 mg/L较P-有显著增加(P<0.05),分别增加18.9%、5.6%。另外,在中高质量浓度Cd胁迫下,如10、30、50和100 mg/L,P+幼苗黄叶数较P-有所减少,分别减少12.73%、26.6%、13.4%和27.28%,但仅在100 mg/L质量浓度下有显著性差异(P<0.05)。
| 表 1 Cd胁迫对印度梨形孢—紫花苜蓿共生体幼苗生长的影响 Tab. 1 Effects of Cd stress on the growths of Piriformospora indica- Medicago sativa symbiotic seedlings |
P-紫花苜蓿幼苗可溶性蛋白含量随Cd质量浓度的增加呈先增后降趋势(图 2a),但接菌后幼苗可溶性蛋白质量分数显著提高(P<0.05),尤其是在中高Cd质量浓度(30、50、100 mg/L)处理下,分别提高26.71%、38.54%、119.83%;在5、10 mg/L无显著差异(P>0.05)。随着Cd质量浓度的增加,2组处理可溶性糖含量整体上均呈增加趋势(图 2b),且在不同Cd质量浓度下,P+可溶性糖质量分数均显著大于P-(P<0.05)。在不同Cd质量浓度(5、10、30、50和100 mg/L)下,P+脯氨酸质量分数较P-显著增加(P<0.05)(图 2c),分别增加24.42%、29.86%、13.24%、12.13%和17.25%。
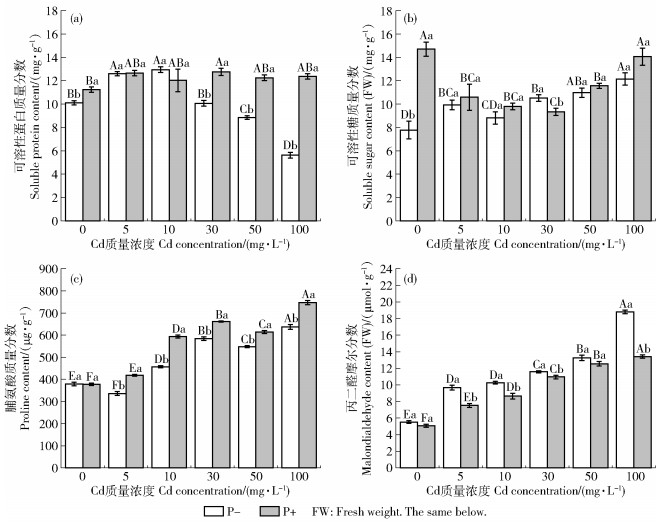
|
图 2 Cd胁迫对印度梨形孢—紫花苜蓿共生体幼苗渗透调节物质的影响 Fig. 2 Effects of Cd stress on osmotic regulatory substances in Piriformospora indica- Medicago sativa symbiotic seedlings |
随着Cd质量浓度的增加,接菌与不接菌2组处理下,丙二醛摩尔分数均逐渐上升(图 2d),在100 mg/L下达到最大,接菌后丙二醛摩尔分数低于不接菌处理。在0、5、10、30、50和100 mg/L处理下,P+较P-丙二醛摩尔分数分别降低8.19%、22.15%、15.84%、5.38%、5.49%和28.65%。在最高质量浓度100 mg/L处理下,接菌组较不接菌组丙二醛摩尔分数降低效果最明显。
2.2.3 对叶片抗氧化酶活性的影响随着Cd质量浓度增加,P+与P-过氧化物酶活性均呈现先增加后降低的趋势(图 3a),在10 mg/L时达到最大值。在0、5、10、30和50 mg/L处理下,P+过氧化物酶活性显著高于P-,分别提高37.97%、37.18%、4.33%、33.91%和27.48%;但在100 mg/L处理下P+显著低于P-(P<0.05),降低5.09%。
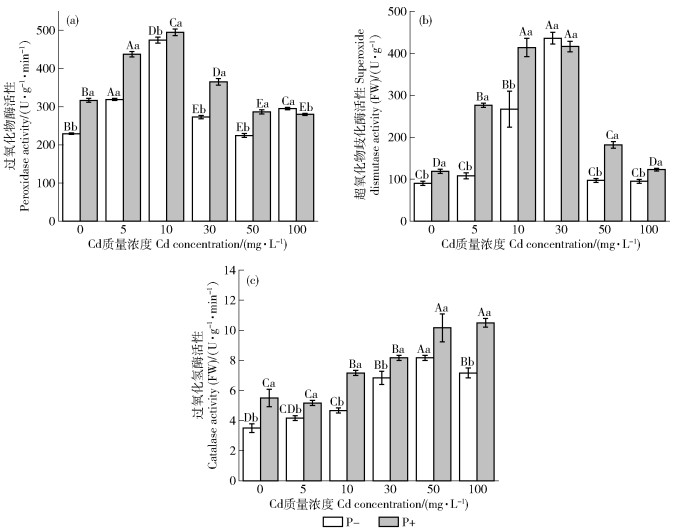
|
图 3 Cd胁迫对印度梨形孢-紫花苜蓿共生体幼苗抗氧化酶活性的影响 Fig. 3 Effects of Cd stress on the antioxidant enzyme activity of Piriformospora indica- Medicago sativa symbiotic seedlings |
随着Cd质量浓度增加,P+与P-超氧化物歧化酶活性也呈现先增加后降低的趋势(图 3b)。在同一质量浓度下,除30 mg/L变化不明显外,其他质量浓度处理P+较P-均显著增加植株超氧化物歧化酶活性(P<0.05),分别为32.16%、155.74%、54.98%、87.03%和29.32%。
过氧化氢酶活性随着Cd质量浓度的增加呈波动变化(图 3c),并且接菌提高幼苗过氧化氢酶活性。除50 mg/L质量浓度外,P+较P-过氧化氢酶活性显著增加(P<0.05),分别为57.14%、24%、53.57%、19.51%、24.49%和46.51%。P-在100 mg/L下超出植物的耐受范围,较其他质量浓度不再增加,但接菌后过氧化氢酶活性显著增加。
2.3 幼苗体内Cd的富集、分布和转移特征由表 2可知,紫花苜蓿幼苗不同器官对吸收的Cd分布总体呈现根>叶>茎。随着Cd质量浓度增加,2组处理下紫花苜蓿幼苗根、茎和叶内Cd含量均呈增加趋势。在同一质量浓度下,接菌组(P+)根内Cd含量均显著高于P<0.05,但在茎和叶内Cd含量P+显著低于P-(P<0.05)。在无Cd处理条件下,紫花苜蓿接菌和对照组根部Cd含量无明显差异(P>0.05),在5、10、30、50和100 mg/L接菌显著提高紫花苜蓿幼苗根部的Cd含量,分别提高1.47、0.91、0.16、0.03和0.015倍,接菌后紫花苜蓿幼苗根部Cd含量随Cd质量浓度的增幅下降。不同Cd质量浓度下P+和对照组茎中Cd含量差异显著(P<0.05),在10、30、50和100 mg/L质量浓度下,P+茎中Cd含量显著降低(P<0.05),分别降低0.16、0.66、0.42和0.5倍。在5、10 mg/L下,P+比对照组叶部Cd含量增加85.36%、30.77%;在30、50 mg/L下差异不明显,在100 mg/L质量浓度下降低13.04%。
| 表 2 Cd胁迫对印度梨形孢-紫花苜蓿共生体幼苗Cd的分布、富集和转移特征 Tab. 2 Distribution, enrichment and transfer of Cd under Cd stress in Piriformospora indica-Medicago sativa symbiotic seedlings |
在低质量浓度时(5、10 mg/L),P+的生物富集系数较P-显著增加(P<0.05),接菌会促进紫花苜蓿幼苗对Cd的吸收,但在高质量浓度时(100 mg/L),P+的生物富集系数较对照组显著减少(P<0.05)。
在不同Cd质量浓度下P+较P-转移系数显著降低(P<0.05),分别降低67.1%、55.88%、68.48%、43.14%、24%和35.29%。P+转移系数均<0.5,印度梨形孢会抑制重金属从共生体地下部分向地上部分转移,减小对地上部分的伤害,并且减少地上部分Cd的富集,提高地上部分的利用。
3 讨论 3.1 接种印度梨形孢对紫花苜蓿生长发育的影响低浓度的重金属(如Cu、Zn)对植物有一定的促生作用[18],但在有毒重金属(如Cd、As)的胁迫下,重金属含量越高植物的生长情况越差[19]。笔者发现,低Cd质量浓度(5 mg/L)也能起到促进植物生长的作用,但随着Cd质量浓度的不断增加,紫花苜蓿幼苗生长状况变差。印度梨形孢可以通过不断发展的生化途径增加生长速率来增加宿主的适应性和竞争能力,以产生生长激素如生长素和细胞分裂素和增强宿主植物对营养元素的吸收。印度梨形孢—紫花苜蓿共生体幼苗叶片数和株高显著高于紫花苜蓿;随着Cd质量浓度增加接菌组(P+)与对照组生长状况均变差,但接菌组(P+)显著提高叶片数、株高和干质量,减少黄叶数。有研究表明,植物接种后生长状况得到改善,但菌根侵染率受重金属浓度的影响,表现为浓度越高侵染率越低[19]。可见印度梨形孢—紫花苜蓿共生体幼苗能更好地在不同Cd质量浓度下生长,在试验质量浓度下均表现出促生效应,低质量浓度下更为明显。
3.2 接种印度梨形孢对紫花苜蓿幼苗生理抗性的影响重金属除对植物细胞造成直接毒害外,还会使植物产生过量活性氧,造成细胞膜功能紊乱,对整个新陈代谢过程造成氧化损伤[20]。植物细胞膜脂过氧化程度可通过丙二醛含量体现。笔者发现,印度梨形孢-紫花苜蓿共生体幼苗丙二醛含量较对照组明显降低。与Shahabivand等[19]的研究结果一致。同时发现,印度梨形孢—紫花苜蓿共生体幼苗较对照组可溶性蛋白含量和可溶性糖含量均有明显增加,即共生体叶片中2种渗透调节物质的含量随Cd质量浓度的增加呈增加趋势。植物叶片中脯氨酸含量在Cd胁迫下不断积累,能够起到减少细胞酸性、消除氨毒性以及平衡细胞氧化还原等作用。此外,在Cd胁迫下,接种印度梨形孢的植物叶片中抗氧化酶的活性较对照组明显升高,如过氧化物酶、超氧化物歧化酶、过氧化氢酶等。这说明印度梨形孢—紫花苜蓿共生体幼苗在Cd胁迫下通过调节防御酶活性和防御性物质的含量,减少紫花苜蓿幼苗的细胞膜脂过氧化程度,减轻膜系统氧化损伤,从而增强共生体对Cd的耐受性。
3.3 接种印度梨形孢对紫花苜蓿幼苗Cd的分布和转移的影响接种印度梨形孢后Cd在植物不同器官内积累程度一般为根>叶>茎>果实[21]。笔者发现,接种于不接种印度梨形孢紫花苜蓿幼苗不同器官对Cd的积累量总体上均呈现根>叶>茎。这说明印度梨形孢并不会改变紫花苜蓿幼苗不同器官的Cd积累顺序。但研究结果表明,接种印度梨形孢会改变紫花苜蓿幼苗的生物富集系数和转移系数。
生物富集系数用来表征元素在植物系统内迁移的难易程度。笔者发现,在同一质量浓度下,接种印度梨形孢增加紫花苜蓿幼苗的生物富集系数,降低Cd在紫花苜蓿幼苗体内的转移系数,并且随着Cd质量浓度增加,转移系数呈下降趋势,但生物富集系数呈下降趋势。这是植物的自我保护机制,植物解除重金属的一个重要途径是细胞内沉淀[22]。印度梨形孢可以在根系中螯合Cd,从而减少Cd运输到叶有关[5],接种后印度梨形孢菌丝可以通过分泌与重金属进行络合的物质吸收富集重金属,阻挡重金属直接接触共生体根部[23],从而减少重金属对植物细胞的破坏作用,减少植物对根内外重金属的吸收、转运和积累,从而增强共生体对重金属的耐受性[18]。但同时印度梨形孢孢子萌发率和菌丝生长速率受Cd质量浓度的影响,虽然在较高镉浓度下仍然具有功能性,但其效果减弱[5]。因此对共生体的生物富集系数产生负面影响。
4 结论1) 印度梨形孢—紫花苜蓿共生体幼苗较对照组生物量提高,黄叶数减少,接种印度梨形孢后明显改善紫花苜蓿幼苗的生长状况。
2) 印度梨形孢—紫花苜蓿共生体幼苗通过调控抗御性物质、抗氧化酶活性来增强紫花苜蓿幼苗抗氧化防御体系,减少共生体细胞膜脂过氧化程度,增强共生体对Cd胁迫的耐性。
3) 印度梨形孢—紫花苜蓿共生体幼苗不同器官对重金属Cd的积累量分配总体呈现根>叶>茎。在同一Cd质量浓度下,接种印度梨形孢增加紫花苜蓿幼苗的生物富集系数,降低Cd在紫花苜蓿幼苗体内的转移系数,并且随着Cd质量浓度增加,转移系数呈下降趋势,但生物富集系数呈下降趋势。这对紫花苜蓿茎叶的高效利用有不可忽视的影响。
| [1] |
石润, 吴晓芙, 李芸, 等. 应用于重金属污染土壤植物修复中的植物种类[J]. 中南林业科技大学学报, 2015, 35(4): 139. SHI Run, WU Xiaofu, LI Yun, et al. Plant species applied in phytoremediation of heavy metal contaminated soils[J]. Journal of Central South University of Forestry and Technology, 2015, 35(4): 139. |
| [2] |
EDELSTEIN M, BEN-HUR M. Heavy metals and metalloids: Sources, risks and strategies to reduce their accumulation in horticultural crops[J]. Scientia Horticulturae, 2018, 234: 431. DOI:10.1016/j.scienta.2017.12.039 |
| [3] |
AGOMUO E N, AMADI P U. Accumulation and toxicological risk assessments of heavy metals of top soils from markets in Owerri, Mo state, Nigeria[J]. Environmental Nanotechnology, Monitoring and Management, 2017, 8: 121. DOI:10.1016/j.enmm.2017.07.001 |
| [4] |
ETESAMI H. Bacterial mediated alleviation of heavy metal stress and decreased accumulation of metals in plant tissues: Mechanisms and future prospects[J]. Ecotoxicology and Environmental Safety, 2018, 147: 175. DOI:10.1016/j.ecoenv.2017.08.032 |
| [5] |
HUI Feiqiong, LIU Jian, GAO Qikang, et al. Piriformospora indica confers cadmium tolerance in Nicotiana tabacum[J]. Journal of Environmental Sciences, 2015, 37: 184. DOI:10.1016/j.jes.2015.06.005 |
| [6] |
惠非琼. 印度梨形孢对烟草耐盐、抗旱及重金属作用及机理的初步研究[D]. 杭州: 浙江大学, 2014: 60. HUI Feiqiong. Preliminary study on effects and mechanisms of salt and drought resistance and heavy metals in Nicotiana tobacum conferred by Piriformosporea indica[D]. Hangzhou: Zhejiang University, 2014: 60. |
| [7] |
先露露, 董智, 李红丽, 等. 不同镉浓度下接种印度梨形孢对高丹草生长与生理特性的影响[J]. 干旱区资源与环境, 2022, 36(5): 171. XIAN Lulu, DONG Zhi, LI Hongli, et al. Effects of inoculation of Piriformosporea indica with different cadmium concentrations on growth and physiological characteristics of Sorghum hybrid sudangrass[J]. Journal of Arid Land Resources and Environment, 2022, 36(5): 171. |
| [8] |
李希铭, 宋桂龙. 镉胁迫对紫花苜蓿镉吸收特征及根系形态影响[J]. 草业学报, 2016, 25(2): 178. LI Ximing, SONG Guilong. Cadmium uptake and root morphological changes in Medicago sativa under cadmium stress[J]. Acta Prataculturae Sinica, 2016, 25(2): 178. |
| [9] |
杨姝, 李元, 毕玉芬, 等. 紫花苜蓿对Cd胁迫的响应及品种差异研究进展[J]. 农业环境科学学报, 2017, 36(8): 1453. YANG Shu, LI Yuan, BI Yufen, et al. Response and intraspecific differences of alfalfa to cadmium(Cd)stress[J]. Journal of Agro-Environment Science, 2017, 36(8): 1453. |
| [10] |
尹国丽, 师尚礼, 寇江涛, 等. Cd胁迫对紫花苜蓿种子发芽及幼苗生理生化特性的影响[J]. 西北植物学报, 2013, 33(8): 1638. YIN Guoli, SHI Shangli, KOU Jiangtao, et al. Seed germination and physiological and biochemical characteristics of alfalfa under cadmium stress[J]. Acta Botanica Boreali-Occidentalia Sinica, 2013, 33(8): 1638. |
| [11] |
BAGDE U S, PRASAD R, VARMA A. Influence of culture filtrate of Piriformospora indica on growth and yield of seed oil in Helianthus annus[J]. Symbiosis, 2011, 53(2): 83. DOI:10.1007/s13199-011-0114-6 |
| [12] |
刘慧春, 朱开元, 张加强, 等. 印度梨形孢液体发酵产物的制备及其在日本青葱上的应用[J]. 浙江农业科学, 2019, 60(5): 779. LIU Huichun, ZHU Kaiyuan, ZHANG Jiaqiang, et al. Preparation of liquid fermentation product from Piriformospora indica and its application on Japanese scallion[J]. Journal of Zhejiang Agricultural Sciences, 2019, 60(5): 779. |
| [13] |
吴金丹, 陈乾, 刘晓曦, 等. 印度梨形孢对水稻的促生作用及其机理的初探[J]. 中国水稻科学, 2015, 29(2): 200. WU Jindan, CHEN Qian, LIU Xiaoxi, et al. Preliminary study on mechanisms of growth promotion in rice colonized by Piriformospora indica[J]. Chinese Journal of Rice Science, 2015, 29(2): 200. DOI:10.3969/j.issn.1001-7216.2015.02.012 |
| [14] |
王小松, 万燕, 乐梨庆, 等. 赤霉素对铅胁迫下苦荞种子萌发及幼苗生理特性的影响[J]. 山西农业科学, 2021, 49(11): 1269. WANG Xiaosong, WAN Yan, LE Liqing, et al. Effects of gibberellin on seed germination and seedling physiological characteristics of tartary buckwheat under lead stress[J]. Journal of Shanxi Agricultural Sciences, 2021, 49(11): 1269. DOI:10.3969/j.issn.1002-2481.2021.11.04 |
| [15] |
文欢欢, 郑新宇, 肖清铁, 等. 镉污染条件下水稻对假单胞菌TCd-1微生物修复的生理响应[J]. 生态学报, 2022, 42(5): 1. WEN Huanhuan, ZHENG Xinyu, XIAO Qingtie, et al. Physiological response of rice(Oryza stiva L.)to the microbial remediation by Pseudomonas TCd-1 under cadmium contaminated conditions[J]. Acta Ecologica Sinica, 2022, 42(5): 1. |
| [16] |
李东坡, 任思敏, 高叶俊, 等. 微波消解-ICP-MS法同时测定金银花中重金属元素[J]. 广东化工, 2021, 48(18): 187. LI Dongpo, REN Simin, GAO Yejun, et al. Simultaneous determination of heavy metal elements in flos Lonicerae by microwave digestion-ICP-MS[J]. Guangdong Chemical Industry, 2021, 48(18): 187. DOI:10.3969/j.issn.1007-1865.2021.18.080 |
| [17] |
何小三, 王微, 肖清铁, 等. 铜绿假单胞菌对镉胁迫水稻苗期生长与镉积累的影响[J]. 中国生态农业学报, 2018, 16(6): 884. HE Xiaosan, WANG Wei, XIAO Qingtie, et al. Effects of Pseudomonas aeruginosa on the growth and cadmium accumulation in rice (Oryza sativa L.) seedling under Cd stress[J]. Chinese Journal of Eco-Agriculture, 2018, 16(6): 884. |
| [18] |
PADASH A, SHAHABIVAND S, BEHTASH F, et al. A practicable method for zinc enrichment in lettuce leaves by the endophyte fungus Piriformospora indica under increasing zinc supply[J]. Scientia Horticulturae, 2016, 213: 367. DOI:10.1016/j.scienta.2016.10.040 |
| [19] |
SHAHABIVAND S, PARVANEH A, ALILOO A A. Root endophytic fungus Piriformospora indica affected growth, cadmium partitioning and chlorophyll fluorescence of sunflower under cadmium toxicity[J]. Ecotoxicology and Environmental Safety, 2017, 145: 496. DOI:10.1016/j.ecoenv.2017.07.064 |
| [20] |
THAPA G, SADHUKHAN A, PANDA S K, et al. Molecular mechanistic model of plant heavy metal tolerance[J]. Bio Metals, 2012, 25(3): 489. |
| [21] |
郭辰彤. 印度梨形孢降低烟叶重金属含量机理的初步研究[D]. 杭州: 浙江大学, 2017: 45. GUO Chentong. Preliminary study on mechanisms of reducing heavy metal contents in Nicotiana tabacum leaves conferred by Piriformospora indica[D]. Hangzhou: Zhejiang University, 2017: 45. |
| [22] |
NANDA R, AGRAWAL V. Piriformospora indica, an excellent system for heavy metal sequestration and amelioration of oxidative stress and DNA damage in Cassia angustifolia Vahl under copper stress[J]. Ecotoxicology and Environmental Safety, 2018, 156: 409. DOI:10.1016/j.ecoenv.2018.03.016 |
| [23] |
王晓慧, 常伟, 宋福强. 印度梨形孢-植物共生关系的建立及共生体对重金属胁迫的响应[J]. 中国科学: 生命科学, 2021, 51(4): 427. WANG Xiaohui, CHANG Wei, SONG Fuqiang. Roles of serendipita indica in phytoremediation of heavy metal pollution[J]. Scientia Sinica Vitae, 2021, 51(4): 427. |
 2024, Vol. 22
2024, Vol. 22 
