氢氧化镁是现代生产生活中应用极其广泛的无机环境友好型材料,常被应用到阻燃剂、水处理剂、抗菌材料、传感器等领域[1-4],而它还常作为前驱体制备氧化镁[5]。氧化镁因其特殊的微观结构和优异的性能,通常被用作抗菌剂、吸附剂、催化剂、陶瓷材料等[6-9]。实验中可采用多种方法制备氢氧化镁和氧化镁,如直接沉淀法、水热反应法、溶胶凝胶法、微波法、微乳液法等[10],获得的形貌有片状、棒状、线状、花状和球状等[5, 8]。
氢氧化镁的热分解转变为氧化镁通常被认为是一个相变过程,发生在280~450 ℃,其相转变的温度区间通常会根据其合成方法和微结构的不同而有一定差别[11-13]。研究者们已经从动力学、热力学、形态学和晶体学等方面出发,探索和分析了氢氧化镁热分解过程的内在转变机制。Goodman等[14]认为,氢氧化镁/氧化镁相转变过程分为两个阶段,开始是晶体基面的轻微收缩,后来形成的水分子的迁移控制着整个相转变过程,由晶体基面扩散到表面后脱离;Anderson等[15]认为,氢氧化镁热分解反应遵循二维界面反应机制,反应过程在线性速度下从晶体边界发展到基面;Yoshioka等[16]结合形核和二维界面生长,提出了一种动力学模型,即氢氧化镁晶体的分解持续发生在已经成核的晶粒上,单个晶粒的分解遵循二维收缩模型,该模型很好地解释了不同热处理方式对晶粒尺寸的作用;更多的研究则表明氢氧化镁/氧化镁相转变过程符合Avrami-Erofeev成核和生长机理[13, 17-18]。
尽管人们采用各种微观分析方法对氢氧化镁热分解过程进行了大量研究,但是文献中很少从原子尺度研究纳米氢氧化镁/氧化镁相转变过程的报道。正电子湮没谱学(Positron Annihilation Spectroscopy, PAS)是近几十年发展的核技术研究的新方法,它反映正电子所在处电子密度或电子动量分布的信息,具有对原子尺度缺陷十分敏感的特点,可探测极低浓度(> 10-6)的微小缺陷(> 0.1 nm),可以很好地研究金属氧化物中空位型缺陷及孔洞结构[19-20]。Yang等[21]利用正电子湮没寿命谱学探究了氢氧化镁热分解过程中缺陷和微孔的变化机制,但是对热分解中孔结构的变化及其对性能的影响仍然缺乏深入的分析。由于氧化镁在吸附和催化方面的应用与其丰富的孔结构密切相关[22-23],且其相转变过程中孔结构的变化过程对制备氧化镁极为重要,因此,本文采用直接沉淀法制备纳米氢氧化镁,采用正电子湮没寿命谱等方法对其在不同温度下煅烧的微结构进行了表征,特别是分析氢氧化镁相转变温度前后微孔和介孔的变化,为制备多孔结构的氧化镁提供了有效依据。
1 实验部分 1.1 样品制备实验原料有氨水(NH3∙H2O)、四水合乙酸镁(Mg(CH3COO)2∙4H2O)、聚乙二醇(PEG6000)和无水乙醇(ETOH)等,所有化学药品均为分析纯,实验用水均为超纯去离子水。本实验使用聚乙二醇作为表面活性剂,用于控制晶粒形貌和提高样品分散性。
实验中将0.2 g聚乙二醇加入200 mL去离子水中,搅拌10 min至完全溶解,再将21.5 g四水合乙酸镁添加到上述溶液中,搅拌至完全溶解,然后将上述澄清溶液置于60 ℃油浴锅中恒温,在持续搅拌下,逐步滴入质量分数25%的氨水20 mL至溶液pH达到10,所得白色悬浊液在60 ℃恒温搅拌2 h后,用去离子水洗涤两次,无水乙醇洗涤一次,最后将白色沉淀置于100 ℃干燥箱中12 h后即得白色粉末样品。
将制备的样品在100~700 ℃煅烧,煅烧时间为2 h,间隔温度为50~100 ℃,每个温度下煅烧的样品取约0.4 g,在常温条件下,用6 MPa的恒压将上述粉末压成直径15 mm、厚度1 mm的表面光滑的圆片型样品,用于正电子湮没寿命谱测量,剩余粉末用于其他测试。
1.2 仪器与表征本研究使用的是快-快符合正电子寿命谱仪测量不同温度下煅烧样品的正电子寿命谱,采用22Na正电子源,由Kapton高分子膜封装,源强约为0.5×106 Bq,谱仪时间分辨率为300 ps,测试时用两片相同的圆片型样品夹住正电子源,每个谱的总计数为2×106,每个样品重复2~3次;实验中使用单晶硅作为标样测量正电子在源及Kapton膜中湮没的源成分。采用LT(V9)程序包,在扣除源成分的基础上,对实验数据进行拟合。
D8Advance型X射线衍射仪(Bruker AXS)用于样品进行物相分析,X射线来自Cu的Kα射线,其中λ=0.15406 nm,扫描范围10°~90°,扫描速度是4°∙min-1;使用Zeiss SIGMA场发射扫描电子显微镜(卡尔蔡司公司)观察样品形貌和颗粒尺寸;使用JW-BK200B比表面积及孔径分析仪(精微高博公司)测量样品比表面积和孔径孔容,样品质量取0.2g,预处理温度为100 ℃。
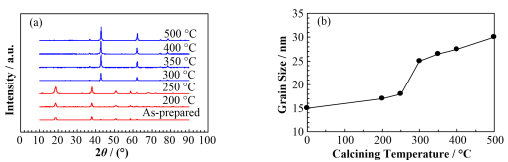
2 结果与讨论 2.1 微结构表征图 1(a)是原始的样品在不同温度下煅烧的X射线衍射(X-ray Diffraction, XRD)图谱。由图 1(a)可以看出,在250 ℃之前,显示仅为氢氧化镁的特征峰,而300 ℃开始,图谱中的特征峰显示样品已经完全转变为氧化镁,可以推测原始氢氧化镁的热分解温度在250~300 ℃之间,说明在300 ℃之前氢氧化镁就已经转变为氧化镁。根据谢乐公式[24],可以通过衍射峰的半波宽计算平均晶粒尺寸,公式如下:
| $ D\left( {hkl} \right) = 0.89\lambda /\beta \cos \theta $ | (1) |
式中:D是平均晶粒尺寸;λ是X射线的波长(0.15406 nm);β是衍射峰的半波宽;θ是对应晶面的衍射峰位。
计算得到的平均晶粒尺寸随煅烧温度变化的曲线如图 1(b)所示。可以看出,在随着煅烧温度的提高,晶粒尺寸在250 ℃之前缓慢增大,氢氧化镁晶粒有一定的团聚长大。在250~300 ℃的过程中,晶粒尺寸迅速增大,说明转变后的氧化镁晶粒尺寸大于其前驱物氢氧化镁,在更高温度其晶粒尺寸继续缓慢增加。
|
图 1 原始样品在不同温度下煅烧的XRD衍射谱(a)和平均晶粒尺寸随温度的变化曲线(b) Figure 1 XRD diffraction spectrum of the original sample calcined at different temperatures (a) and the average grain size as a function of calcining temperature (b) |
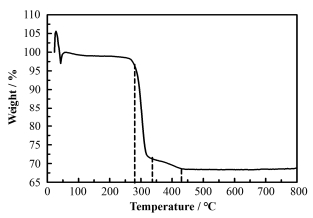
对制备的原始样品进行热重分析,结果如图 2所示。可以看到,在280 ℃之前失重2%,一般为吸附的水分子的蒸发;在280~330 ℃区间,热重曲线急速下滑,失重27%,与图 1的XRD结果一致,对应的就是氢氧化镁到氧化镁的相转变过程,脱去水分子,导致质量急剧减少。我们认为相转变温度较低且速度较快,应该是和纳米氢氧化镁合成条件、产物形貌和晶粒尺寸有关[25]。煅烧温度在330~430℃之间,样品重量又继续缓慢地减少了3%,至此共失重百分之33%,考虑到开始时少量水分子的蒸发,基本与氢氧化镁热分解的理论失重30.8%吻合。超过430 ℃以后,热重线保持水平,表明没有继续失重,氧化镁产物保持稳定。
|
图 2 原始样品的热重曲线 Figure 2 TG curve of the as-prepared sample in the temperature range of 25~800 ℃ with a heating range of 10 ℃∙min-1 |
图 3(a)为制备的氢氧化镁的扫描电镜(Scanning Electron Microscope, SEM)照片,可以清晰地看出,原始氢氧化镁是薄片形状,厚度约为15 nm,相互堆叠团聚成较大宽度的片层结构。图 3(b)是400 ℃煅烧后分解产物氧化镁的电镜图片,可以看到,氧化镁呈现直径30 nm左右的球状,分散性较好,大小均匀,与XRD衍射实验所计算得到的晶粒尺寸基本吻合。对比文献[5]所描述的实验结果,可以发现本实验制备的氢氧化镁/氧化镁尺寸较小,但形貌变化与其基本一致。

|
图 3 氢氧化镁SEM照片(a)和400 ℃煅烧得到的氧化镁(b) Figure 3 SEM images of magnesium hydroxide (a) and the as-prepared sample (b), the sample calcined at 400 ℃ |
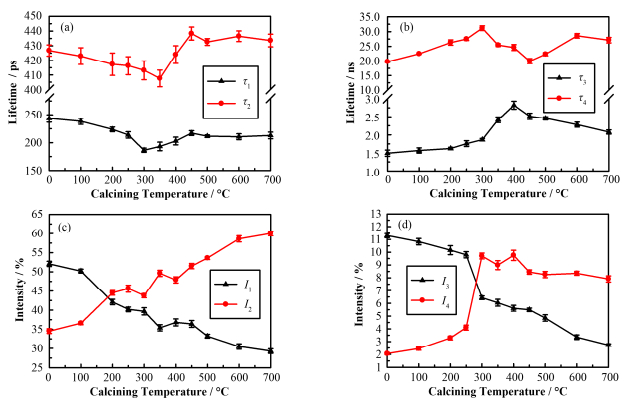
为了更详细地表征氢氧化镁热分解过程中微观结构的变化,我们对不同温度下煅烧的氢氧化镁样品产物进行了正电子寿命测量。对于低密度的纳米氢氧化镁/氧化镁,利用LT(V9)程序对得到的正电子湮没寿命谱进行4个寿命分量的拟合,τ1、τ2是短寿命分量,其中:τ1与体态湮没和单空位(或者简单的空位复合体)缺陷有关,τ2与空位团缺陷有关,它们对应的强度分别为I1和I2,正电子湮没寿命和相对强度分别与缺陷的尺寸和浓度相关联[26];而τ3、τ4是长寿命分量,来源于被测样品中正电子素的形成,在低密度或多孔材料中,正电子容易与一个电子结合形成亚稳态的电子偶素[27]。电子偶素有两种自旋态,分别为自湮没寿命125 ps的p-Ps和自湮没寿命142 ns的o-Ps,然后在固体物质中,o-Ps形成后会拾取周围的一个电子使其寿命大大缩短。根据Brandt[28]提出的自由体积理论,把局域电子偶素的自由体积看成是小孔洞,孔洞数量越多,形成电子偶素的概率越大;孔洞越大,内部电子密度就越低,电子偶素的寿命越长。也就是说τ3、τ4可以反映出待测样品内部孔洞状态信息,其中τ3主要代表微孔,主要由空位团增大导致的微孔洞;τ4主要代表介孔,尺寸通常是2 nm以上,主要是由晶粒围成的孔隙。
由图 4(a)可以看出,τ1和τ2均在300 ℃附近明显下降到最低值,对应氢氧化镁相转变为氧化镁;当煅烧温度继续升高时,τ1基本保持稳定,τ2则突然出现较为快速的上升,说明在高于转变温度的200 ℃内,空位团缺陷迅速长大。与τ1和τ2相对应的是图 4(c)中I1和I2变化曲线,可以明显看出两者呈完全相反的变化趋势,表明随着煅烧温度的提高,单空位或空位复合体数量不断减少和界面空位团缺陷数量不断增加。图 4(b)显示出在相转变温度附近长寿命成分τ4增大到最大值,说明在300 ℃煅烧得到的氧化镁具有较大的孔洞结构;τ3则在300~400℃时有较大的上升,这与τ2的变化基本同步,表明这个温度区间更容易形成较大尺寸的空位团和微孔。总体上看,τ4一直处于20~35 ns之间,根据改进的Tao-Eldrup模型[29-30]计算得到的孔径为2~3 nm。根据图 4(d)显示的结果,在250 ℃之前,I3变化不明显,同时I4也仅是缓慢的小幅度增大,当煅烧温度升高到300 ℃时,I3突然下降,同时I4急速上升,这明显相反的变化趋势表明微孔数量迅速减少的同时体积较大的介孔数量迅速增加,有理由推测在氢氧化镁发生相转变时有大量微孔发生迁移聚集成了较大的介孔。一方面晶相的改变导致晶界的运动,有助于形成新的空位团缺陷和微孔结构;另一方面水分子从晶界边缘的蒸发,促进了较大的空位团和微孔的迁移和聚集。另外,可以看出,在更高温度下,由于介孔具有很好的稳定性,界面处的微孔数量却一直在减少,很可能是因为晶粒的生长对界面的挤压使微孔逐渐分裂,而由几个晶粒交界处的介孔因相互的牵制而难以恢复。
|
图 4 正电子寿命随煅烧温度变化(a) τ1和τ2, (b) τ3和τ4,(c)I1和I2,(d) I3和I4 Figure 4 The positron lifetimes τ1 and τ2 (a), τ3 and τ4 (b) and the corresponding relative intensities I1, I2 (c) and I3, I4 (d) as a function of calcining temperature |
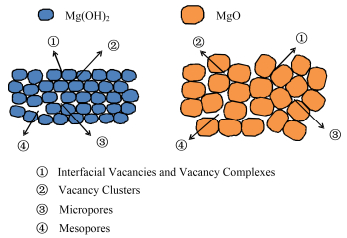
根据以上正电子实验结果可见,随着煅烧温度的升高和物相的转变,界面缺陷和孔洞都发生了明显的变化。Schaefer等[31]基于正电子湮没寿命谱结果提出了一个正电子湮没捕获模型,用于解释Fe纳米晶的界面空位型缺陷和微孔洞情况。Yang等[21]在该模型的基础上发展了一个适用于纳米氢氧化镁热分解的正电子捕获模型。然而在本实验制备的样品中含有更多尺寸较大的孔洞,并且发现了纳米氢氧化镁相转变过程中微孔和介孔的联系,因此我们可以进一步改进其正电子捕获模型,更全面地来解释相转变中缺陷和孔洞的变化机制。如图 5所示,正电子主要被捕获和湮没在晶界处的单空位或空位复合体(τ1)、晶界交叉处的空位团(τ2)、空位团聚集形成的微孔(τ3)以及多个晶粒围成的介孔(τ4)中。纳米氢氧化镁是薄片状结构,晶粒较小,排列较完整,反映出微孔(τ3)的数量较大,介孔(τ4)较少;而发生相转变成球状的纳米氧化镁后,纳米粒子长大重组形成了更多的界面空位团缺陷(τ2),以此同时,水分子在晶界处的迁移蒸发,加剧了晶界运动,促进了原先微孔的聚集和扩张形成介孔,介孔数量的增多导致更多正电子在其中形成电子偶素,表现出I4的迅速增大。正电子湮没示意图对理解氢氧化镁/氧化镁相转变过程中微结构变化机制有很重要的价值。
|
图 5 正电子在氢氧化镁和氧化镁中湮没的捕获模型 Figure 5 A positron trapping model in magnesium hydroxide and magnesium oxide |
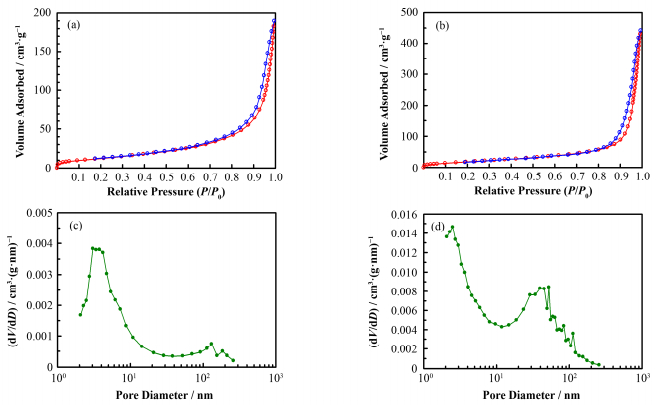
为了证实正电子测量结果的推测,我们进一步对氢氧化镁和在400 ℃下煅烧得到的氧化镁进行了氮气吸附脱附实验,得到如图 6所示的等温吸附脱附曲线,并且根据Barrett-Joyner-Halenda模型由脱附分支计算出孔径分布。由两者的等温吸附脱附曲线可以看出,氧化镁的最大吸附脱附量明显大于氢氧化镁,通过Brunanuer-Emmett-Teller模型计算出氢氧化镁的比表面积为40 m2∙g-1,氧化镁70m2∙g-1。观察两者的孔径分布曲线,可以看出氢氧化镁和氧化镁的孔径在2~4 nm均有较为集中的分布,这与前面根据电子偶素自由体积模型计算出来的孔径大小基本一致。值得注意的是,氧化镁的小孔洞在2~4nm集中分布的数量要比氢氧化镁更多,这与前面正电子寿命测量结果显示的氧化镁I4明显大于氢氧化镁实验结果一致。另外,氧化镁中还出现了较多20~40 nm尺寸的较大孔洞,根据前面对扫描电镜图片的观察,可以判断应该是小颗粒围成的空隙。
|
图 6 原始样品(a)和400 ℃煅烧(b)的氮气吸附脱附曲线以及原始样品(c)和400 ℃煅烧(d)的孔径分布曲线 Figure 6 N2 adsorption/desorption isotherms of as-prepared sample (a) calcined at 400 ℃ (b) and pore size distribution curves of as-prepared sample (c) calcined at 400 ℃ (d) |
综上所述,通过X射线衍射、热重分析、扫描电镜、正电子湮没寿命谱和氮气吸附脱附实验对氢氧化镁/氧化镁相转变过程中微结构变化的研究,更好地了解其微观缺陷及孔洞的变化情况,特别是微孔和介孔的转变过程的分析,对制备多孔氧化镁有一定的价值。但为了得到更普遍的实验结论,还需要进一步对不同条件合成的不同形貌的纳米氢氧化镁/氧化镁进行更深入、更系统的研究。
3 结语1) XRD、TG和SEM研究表明:直接沉淀法制备的纳米氢氧化镁为厚度15 nm左右的片状形貌,在300 ℃左右热分解为直径30 nm左右的纳米球状氧化镁,颗粒大小均匀,分散性较好。
2) 正电子寿命测量分析指出:短寿命分量τ1和τ2均在相转变温度附近降低到最小值;I2随煅烧温度而不断增大,这主要是由于温度升高使空位团缺陷不断增多。长寿命分量τ3和τ4反映出样品内部微孔和介孔的信息,在250~300 ℃的相转变温度区间,I4显著升高,同时I3却迅速减小,说明热分解产物氧化镁介孔数量突然增大,而微孔的数量迅速减少。
3) 氮气吸附脱附结果显示:氢氧化镁相转变为氧化镁后,比表面积明显增大,这与转变后介孔数量增加密切相关;氢氧化镁与氧化镁的最可几孔径分布均在2~4 nm处,这与前面正电子长寿命结果得到的孔径尺寸基本吻合。此外,氧化镁中还出现了较多孔径在20~40 nm的大孔洞,可判断是扫描电镜中观察到的多个晶粒相互接触所围成的空隙。
| [1] |
Qiu L Z, Xie R C, Ding P, et al. Preparation and characterization of Mg(OH)2 nanoparticles and flame-retardant property of its nanocomposites with EVA[J]. Composite Structures, 2003, 62(3-4): 391-395. DOI:10.1016/j.compstruct.2003.09.010 |
| [2] |
Liu M H, Wang Y H, Chen L T, et al. Mg(OH)2 supported nanoscale zero valent iron enhancing the removal of Pb(Ⅱ) from aqueous solution[J]. ACS Applied Materials & Interfaces, 2015, 7(15): 7961-7969. DOI:10.1021/am509184e |
| [3] |
Dong C X, Cairney J, Sun Q H, et al. Investigation of Mg(OH)2 nanoparticles as an antibacterial agent[J]. Journal of Nanoparticle Research, 2010, 12(6): 2101-2109. DOI:10.1007/s11051-009-9769-9 |
| [4] |
Al-Hazmi F, Umar A, Dar G N, et al. Microwave assisted rapid growth of Mg(OH)2 nanosheet networks for ethanol chemical sensor application[J]. Journal of Alloys and Compounds, 2012, 519: 4-8. DOI:10.1016/jallcom.2011.09.089 |
| [5] |
Samodi A, Rashidi A, Marjani K, et al. Effects of surfactants, solvents and time on the morphology of MgO nanoparticles prepared by the wet chemical method[J]. Materials Letters, 2013, 109: 269-274. DOI:10.1016/j.matlet.2013.07.085 |
| [6] |
Makhluf S, Dror R, Nitzan Y, et al. Microwave-assisted synthesis of nanocrystalline MgO and its use as a bacteriocide[J]. Advanced Functional Materials, 2005, 15(10): 1708-1715. DOI:10.1002/adfm.200500029 |
| [7] |
Tian P, Han X Y, Ning G L, et al. Synthesis of porous hierarchical MgO and its superb adsorption properties[J]. ACS Applied Materials & Interfaces, 2013, 5(23): 12411-12418. DOI:10.1021/am403352y |
| [8] |
Ganguly A, Trinh P, Ramanujachary K V, et al. Reverse micellar based synthesis of ultrafine MgO nanoparticles (8-10 nm):characterization and catalytic properties[J]. Journal of Colloid and Interface Science, 2011, 353(1): 137-142. DOI:10.1016/j.jcis.2010.09.041 |
| [9] |
Obradovic N, Mitric M, Nikolic M V, et al. Influence of MgO addition on the synthesis and electrical properties of sintered zinc-titanate ceramics[J]. Journal of Alloys and Compounds, 2009, 471(1-2): 272-277. DOI:10.1016/j.jallcom.2008.03.090 |
| [10] |
Pilarska A A, Klapiszewski Ł, Jesionowski T. Recent development in the synthesis, modification and application of Mg(OH)2 and MgO:a review[J]. Powder Technology, 2017, 319: 373-407. DOI:10.1016/j.powtec.2017.07.009 |
| [11] |
Kumari L, Li W Z, Vannoy C H, et al. Synthesis, characterization and optical properties of Mg(OH)2 micro-/nanostructure and its conversion to MgO[J]. Ceramics International, 2009, 35(8): 3355-3364. DOI:10.1016/j.ceramint.2009.05.035 |
| [12] |
Jin D L, Gu X Y, Yu X J, et al. Hydrothermal synthesis and characterization of hexagonal Mg(OH)2 nano-flake as a flame retardant[J]. Materials Chemistry and Physics, 2008, 112(3): 962-965. DOI:10.1016/j.matchemphys.2008.07.058 |
| [13] |
景殿策, 王宝和, 张伟, 等. 纳米氢氧化镁粉体的制备及热分解动力学研究[J]. 中国粉体技术, 2006, 12(5): 24-27. JING Diance, WANG Baohe, ZHANG Wei, et al. Preparation and thermal decomposition kinetics of nano magnesium hydroxide powder[J]. China Powder Science and Technology, 2006, 12(5): 24-27. DOI:10.13732/j.issn.1008-5548.2006.05.008 |
| [14] |
Goodman J F. The decomposition of magnesium hydroxide in an electron microscope[J]. Proceedings of the Royal Society of London Series A-Mathematical and Physical Sciences, 1958, 247(1250): 346-352. DOI:10.1098/rspa.1958.0188 |
| [15] |
Anderson P J, Horlock R F. Thermal decomposition of magnesium hydroxide[J]. Transactions of the Faraday Society, 1962, 58: 1993-2004. DOI:10.1039/TF9625801993 |
| [16] |
Yoshioka H, Amita K, Hashizume G. The nucleation-two dimensional interface growth equation for the thermal decomposition of Mg(OH)2[J]. Netsu Sokutei, 1984, 11(3): 115-118. DOI:10.11311/jscta1974.11.115 |
| [17] |
宁志强, 翟玉春, 孙立芹, 等. 氢氧化镁分解动力学的研究[J]. 分子科学学报, 2009, 25(1): 27-30. NING Zhiqiang, ZHAI Yuchun, SUN Liqin, et al. Decomposition kinetics of magnesium hydroxide[J]. Journal of Molecular Science, 2009, 25(1): 27-30. DOI:10.13563/j.cnki.jmolsci.2009.01.003 |
| [18] |
李歌, 李增和, 马鸿文, 等. 热重分析法研究氢氧化镁纳米粉体的非等温分解动力学[J]. 化工学报, 2014, 65(2): 576-582. G e, LI Zenghe, MA Hongwen, et al. Thermal gravimetric analysis analysis of non-isothermal decomposition kinetics of magnesium hydroxide nanopowder[J]. CIESC Journal, 2014, 65(2): 576-582. DOI:10.3969/j.issn.0438-1157.2014.02.030 |
| [19] |
苏爱国, 郑裕芳, 吴奕初, 等. 纳米SnO2和SnO2/SiO2材料的正电子湮没研究[J]. 核技术, 1998, 20(3): 138-142. SU Aiguo, ZHENG Yufang, WU Yichu, et al. Positron annihilation study on nano SnO2 and SnO2/SiO2 materials[J]. Nuclear Techniques, 1998, 20(3): 138-142. |
| [20] |
李喜贵, 魏淑桃, 张瑞英, 等. Sol-gel方法制备ZnO陶瓷材料的正电子寿命谱研究[J]. 核技术, 2000, 23(6): 371-375. LI Xigui, WEI Shutao, ZHANG Ruiying, et al. Positron lifetime spectroscopy study on ZnO ceramic materials prepared by sol-gel method[J]. Nuclear Techniques, 2000, 23(6): 371-375. DOI:10.3321/j.issn:0253-3219.2000.06.005 |
| [21] |
Yang W, Zhu Z J, Shi J J, et al. Characterizations of the thermal decomposition of nano-magnesium hydroxide by positron annihilation lifetime spectroscopy[J]. Powder Technology, 2017, 311: 206-212. DOI:10.1016/j.powtec.2017.01.059 |
| [22] |
Nga N K, Hong P T T, Dai Lam T, et al. A facile synthesis of nanostructured magnesium oxide particles for enhanced adsorption performance in reactive blue 19 removal[J]. Journal of Colloid and Interface Science, 2013, 398: 210-216. DOI:10.1016/j.jcis.2013.02.018 |
| [23] |
Choudhary V R, Rane V H, Pandit M Y. Comparison of alkali metal promoted MgO catalysts for their surface acidity/basicity and catalytic activity/selectivity in the oxidative coupling of methane[J]. Journal of Chemical Technology and Biotechnology, 1997, 68(2): 177-186. DOI:10.1002/(SICI)1097-4660(199702)68 |
| [24] |
Ciupină V, Zamfirescu S, Prodan G. Evaluation of mean diameter values using Scherrer equation applied to electron diffraction images[M]. Nanotechnology-Toxicological Issues and Environmental Safety and Environmental Safety. Springer Netherlands, 2007, 231-237. DOI:10.1007/978-1-4020-6076-2_15
|
| [25] |
翟学良. 氢氧化镁热分解行为与机理研究[J]. 矿产综合利用, 2000(3): 11-14. ZHAI Xueliang. Thermal decomposition behavior and mechanism of magnesium hydroxide[J]. Multipurpose Utilization of Mineral Resources, 2000(3): 11-14. DOI:10.3969/j.issn.1000-6532.2000.03.004 |
| [26] |
Puska M J, Nieminen R M. Defect spectroscopy with positrons:a general calculational method[J]. Journal of Physics F:Metal Physics, 1983, 13(2): 333. DOI:10.1088/0305-4608/13/2/009 |
| [27] |
Brandt W, Paulin R. Positronium diffusion in solids[J]. Physical Review Letters, 1968, 21(4): 193. DOI:10.1103/PhysRevLett.21.193 |
| [28] |
Brandt W, Berko S, Walker W W. Positronium decay in molecular substances[J]. Physical Review, 1960, 120(4): 1289. DOI:10.1103/PhysRev.121.1864.4 |
| [29] |
Tao S J. Positronium annihilation in molecular substances[J]. The Journal of Chemical Physics, 1972, 56(11): 5499-5510. DOI:10.1063/1.1677067 |
| [30] |
Ito K, Nakanishi H, Ujihira Y. Extension of the equation for the annihilation lifetime of ortho-positronium at a cavity larger than 1 nm in radius[J]. The Journal of Physical Chemistry B, 1999, 103(21): 4555-4558. DOI:10.1021/jp9831841 |
| [31] |
Schaefer H E, Würschum R, Birringer R, et al. Structure of nanometer-sized polycrystalline iron investigated by positron lifetime spectroscopy[J]. Physical Review B, 1988, 38(14): 9545. DOI:10.1021/jp9831841 |


