2. 南方医科大学附属南方医院 核医学科 广州 510515
2. Department of Nuclear Medicine, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
表皮生长因子受体(Epithelial Growth Factor Receptor, EGFR)信号通路在肿瘤的增殖、侵袭、转移及新生血管形成等方面起重要作用,针对EGFR的靶向治疗在临床中已被广泛应用。但由于病患个体差异,几代靶向EGFR的临床药物的总体疗效偏低[1-2]。如何明确EGFR表达及突变情况进而指导靶向用药成为临床亟待解决的问题,运用正电子核素标记靶向EGFR的小分子抑制剂进行PET显像能很好地指导临床靶向治疗。目前有多种此类探针被报道研究[3-4],但仅有11C-PD153035及11C-Erlotinib(11C-埃罗替尼)被用于临床研究[5-6],其中Memon等[7]最先研发的11C-Erlotinib显像更具应用价值与潜力,第一例32岁EGFR基因19号外显子突变患者显像发现脑部转移灶明显摄取[8]。Weber等[9]对13例Erlotinib治疗的非小细胞患者进行11C-Erlotinib显像,发现4例患者体内的一处或多处肺癌或淋巴转移部位放射性浓聚。但由于11C半衰期短,不适合中转与运输,仅适用于有回旋加速器的单位生产使用,限制了11C-Erlotinib的广泛应用,临床发展急需半衰期较长的此类正电子示踪剂。本研究拟通过国产氟多功能模块自动化标记埃罗替尼,获得一种靶向EGFR的新型分子探针,并对其进行体外稳定性评价。
1 材料与方法 1.1 试剂与材料氨基聚醚(Kryptofix2.2.2, K2.2.2)(德国ABX公司);埃罗替尼(Erlotinib)(美国MCE公司);对甲苯磺酸叠氮乙酯,自制;无水乙腈(MeCN)、无水碳酸钾(K2CO3)、2-氟乙醇、对甲基苯磺酰氯(4-toluene sulfonyl chloride, TsCl)、L-抗坏血酸钠(sodium L-ascorbate)、N, N-二甲基甲酰胺(N, N-dimethylformamide, DMF)、二甲基亚砜(Dimethyl sulfoxide, DMSO)(百灵威科技有限公司);三[(1-苄基-1H-1, 2, 3-三唑-4-基)甲基]胺(tris[(1-benzyl-1H-1, 2, 3-triazol-4-yl)Methyl]amine, TBTA)、叠氮化钠(NaN3)、4-二甲氨基吡啶(4-dimethylaminopyridine, DMAP)(梯希爱(上海)化成工业发展有限公司);三乙基胺(Triethylamine, TEA)、五水硫酸铜(CuSO4·5H2O)、乙酸乙酯、石油醚等其他试剂均购自国药集团上海化学试剂有限公司。Sep-Pak light QMA、Sep-Pak plus C-18、Sep-Pak light Al2O3柱(美国Waters公司)。
1.2 仪器PETtrace回旋加速器(美国GE公司);Inveon Micro-PET/CT扫描仪(德国SIEMENS公司);氟多功能化学合成模块(PET-MF-2V-IT-I)(北京派特生物有限公司);400 MHz核磁共振波谱仪、质谱仪(瑞士Bruker公司);GC-911γ-放免计数器(科大创新股份有限公司中佳分公司);CRC-15PET放射性活度计(美国Capintec公司);AR-2000放射性薄层色谱仪(Radio thin layer chromatograph, Radio-TLC)(美国Bioscan公司);RE5002旋转蒸发仪(巩义市予华仪器有限责任公司);二氧化碳培养箱(上海一恒科技有限公司);干式恒温器(杭州奥盛仪器有限公司)。PET-MF-2V-IT-I模块配备半制备高效液相色谱(High Performance Liquid Chromatography, HPLC),Alltech 626双泵;Alltech201紫外检测器,波长254 nm;放射性检测器;色谱柱:Agilent ZORBAX SB-C18 (9.4×250mm,5 μm);流动相为梯度(0min,乙腈/水(15/85,V/V,流速0 mL·min-1);2 min,乙腈/水(15/85,V/V,流速4 mL·min-1);20 min,乙腈/水(60/40,V/V,流速4 mL·min-1);30 min,乙腈/水(60/40,V/V,流速4 mL·min-1);35 min,乙腈/水(15/85,V/V,流速4 mL·min-1))。分析型岛津LC-20A高效液相色谱仪(日本Shimadzu公司),二极管阵列检测器(SPD-M20A);放射性检测器(美国Bioscan公司);色谱柱:Kromasil 100-5C18 (4.6×250 mm,5 μm);流动相乙腈/水(40/60),流速1 mL·min-1。
1.3 标准品19F-FEA-Erlotinib的合成标准品19F-FEA-Erlotinib的合成从2-氟乙醇出发,经三步反应得到,如图 1所示。
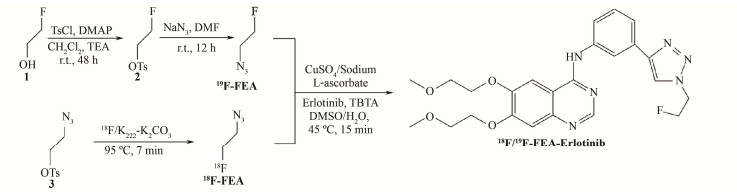
|
图 1 18F-FEA-Erlotinib及参比化合物19F-FEA-Erlotinib的合成路线 Figure 1 Synthetic scheme of 18F-FEA-Erlotinib and reference compound 19F-FEA-Erlotinib. |
冰浴下将对甲基苯磺酰氯(13.3 g,70 mmol)溶于80 mL二氯甲烷中,搅拌下依次加入三乙胺(35mL,0.25 mol)和DMAP (0.4 g,3.3 mmol)。充分溶解后缓慢滴加2-氟乙醇(1) (4.6 mL,80 mmol)的CH2Cl2 (30 mL)溶液,滴加完毕后撤掉冰浴室温反应48 h。真空下浓缩反应液,经柱层析分离得无色油状物9.15 g。产率为60%。
1.3.2 2-氟叠氮乙烷(19F-FEA)在对甲苯磺酰氟乙酯(2) (4.36 g,20 mmol)的30mL DMF溶液中,分三批加入叠氮化钠(3.9 g,60 mmol),室温搅拌反应12 h,TLC监测无对甲苯磺酰氟乙酯后过滤除去固体,得到无色19F-FEA的DMF溶液。产物无需纯化而用于下步反应。
1.3.3 标准品(19F-FEA-Erlotinib)1 mL无水硫酸铜(5 mg,20 μmol)水溶液搅拌下加入2 mL L-抗坏血酸钠(15.8 mg,80 μmol)溶液中,待颜色变成均匀黄色后加入TBTA (2.7 mg,5 μmol)的DMF溶液(500 μL),然后加入前体Erlotinib (393mg,1 mmol)的DMF溶液(30 mL),搅拌15 min后加入19F-FEA的DMF溶液(2 mmol,2 mL)。45 ℃搅拌反应12 h,加200 mL水稀释后乙酸乙酯萃取(20 mL×3次),合并有机相后加饱和氯化钠溶液30 mL混合分层,减压蒸馏有机相得粗产物,经柱层析分离纯化后得白色固体309 mg。产率64%。
1.4 18F-FEA-Erlotinib的自动化合成18F-FEA-Erlotinib的合成包括两步放化反应(图 1),需要两个反应瓶,通过北京派特氟多功能(PET-MF-2V-IT-I)合成模块实现自动化合成,流程示意图如图 2所示,合成模块中各原料和试剂瓶中试剂填装如表 1。
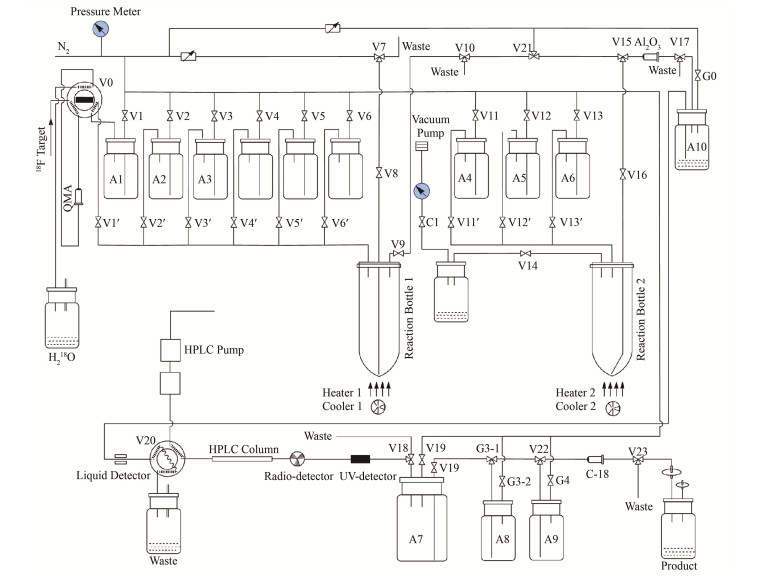
|
图 2 18F-FEA-Erlotinib在PET-MF-2V-IT-I合成模块中自动化合成流程示意图 Figure 2 Schematic diagram of the automated synthesis of 18F-FEA-Erlotinib on the PET-MF-2V-IT-I synthesis module. |
| 表 1 18F-FEA-Erlotinib自动化合成所需试剂及安装位置 Table 1 Reagents and the place for the automated synthesis of 18F-FEA-Erlotinib. |
在PET-MF-2V-IT-I模块中相关管路作如下调整:断开原V7接V10、V9接A11管道,V9出接V10进,堵住原V9出通向安全瓶A11管道,V15与V17间接一阴离子交换柱(Sep-Pak light Al2O3),V22与V23间接一分离纯化柱(Sep-Pak plus C-18),其他管路均按原路线连接,1号反应管在加热除水过程中打开V9,V10向下通废液,在模块流程库编辑软件LibEditor中编写程序实现自动化控制。另外A4瓶中混合溶液配置如§1.3.3中顺序,在其他试剂均配置安装好后,传靶水前现配现用。18F-FEA-Erlotinib的自动化合成具体操作步骤如下。
PETtrace回旋加速器通过18O(p, n)18F核反应得到18F-离子,经NaHCO3活化后的QMA柱富集俘获后,用A1瓶中K2.2.2/K2CO3溶液淋洗到1号反应瓶中;通氮气(110 mL·min-1) 116 ℃加热蒸发溶剂,然后打开V2加入A2中无水乙腈到反应管1中,116℃下通氮气蒸干溶剂,得到干燥的[K/K2.2.2]18F-;加入A3中对甲苯磺酸叠氮乙酯(3)的无水乙腈溶液,95 ℃下密封反应7 min,冷却反应瓶;打开V11将A4中混合溶液加入到2号反应瓶中,然后依次打开V14、V16、V9、C1,并65 ℃加热1号反应瓶,期间间断打开V8 (5 s)通入氮气,减压蒸馏10 min后,关闭阀门密闭2号反应瓶,45 ℃反应15 min,期间间断通入氮气鼓动反应液;反应结束后加入A5中乙腈,打开V16-V15-V17到液相上样瓶A10的通路,转移液体至A10,再将A6溶液加入到2号反应管,后同上步骤转移至A10中;用半制备HPLC分离,分离条件如§1.2所述,监测18F-FEA-Erlotinib出峰位置并切换V18收集目标产物于A7中;控制V23到废液方向,打开V19将18F-FEA-Erlotinib富集于C-18柱上;用30 mL水(A8)洗C-18柱并吹干,切换V23到产品瓶,然后用乙醇(A9)洗脱C-18柱产品到产品瓶(10 mL无菌西林瓶)中,即得高放化纯度的18F-FEA-Erlotinib,使用时按需用生理盐水稀释即可。
1.5 脂水分配系数取10 μL配制好的18F-FEA-Erlotinib注射液于装有1 mL正辛醇与990 μL水的3 mL离心管中,密闭置于干式恒温器中常温震荡10 min,静置20min使两相分层,用移液器从两相中分别各取500μL置于γ计数管中,用γ计数器测定计数。平行进行两批次实验,每批重复三次。据式(1)计算得到logP值。
| $ {\rm{log}}P=\rm{log}\left[\rm{CP}{{\rm{M}}_{\rm{oil}}}\rm{/CP}{{\rm{M}}_{\rm{water}}} \right] $ | (1) |
式中:CPMoil为正辛醇相每分钟计数;CPMwater为水相每分钟计数。
1.6 产品质量控制用经酸度计校正过的精密pH试纸测定注射液pH值,目测其颜色及澄清度;取现制备18F-FEA-Erlotinib注射液74 MBq,用活度计测定不同时间点(0 min、10 min、20 min、30 min、40 min、50 min)的活度值,通过原子核衰变规律公式计算半衰期并估测核纯度;用分析型HPLC通过比对18F-FEA-Erlotinib与标准品19F-FEA-Erlotinib保留时间鉴定产物,分析注射液的化学纯度和放射化学纯度,并通过外标法计算比活度。
配置不同浓度的K2.2.2溶液(100 mg·L-1,50mg·L-1,10 mg·L-1),取衰变完全的18F-FEA-Erlotinib注射液采用薄层色谱氯铂酸和碘化钾染色法测定溶液中K2.2.2残留量[10],测量结果应低于50mg·L-1[11];按2015版中国药典[11]检查注射液的溶剂残留、内毒素和无菌性,应符合要求。
取18F-FEA-Erlotinib (20 μL,≈2 MBq)分别置于PBS (2 mL)和胎牛血清(2 mL)中,置于细胞培养箱中37 ℃,5% CO2下孵育(0 min,30 min,60 min,90 min,120 min)后,用放射性TLC层析法(展开剂为100%乙酸乙酯)测定其放射化学纯度,评价其体外稳定性。
取5只SPF级健康昆明小鼠,雌雄不限,体重18-22 g,每只小鼠分别于4-5 s内静脉注射0.5 mL 18F-FEA-Erlotinib注射液。观察小鼠48 h内生存情况,评价18F-FEA-Erlotinib注射液异常毒性。
2 结果与讨论 2.1 标准品19F-FEA-Erlotinib的合成标准品用于标记时HPLC分离分析方法的建立及放射性标记产物的确认。19F-FEA-Erlotinib的合成以2-氟乙醇为起始原料经磺酰化反应活化醇羟基,再经取代反应叠氮化,得关键中间体19F-FEA,最后通过“点击化学”反应得到。实验发现,点击反应在传统的催化条件(Cu(Ⅱ)/L-抗坏血酸钠)基础上,添加催化剂量的Cu(Ⅰ)稳定剂TBTA[12]后产率从42%增加至65%左右。
所有反应中间体及参比化合物均通过1H NMR表征确认,标准品19F-FEA-Erlotinib进行了高分辨率质谱检测确证。对甲苯磺酰氟乙酯(2):1H NMR (400MHz,CDCl3) δ 7.81 (m,2H),7.36 (d,J=8.0 Hz,2H),4.57 (m,2H),4.26 (m,2H),2.46 (s,3H);2-氟叠氮乙烷(19F-FEA):1H NMR (400 MHz,DMSO-d6) 4.61 (m,2H),3.62 (m,2H);19F-FEA-Erlotinib:1H NMR (400 MHz,DMSO-d6) δ 9.57 (s,1H),8.63 (s,1H),8.49 (s,1H),8.28 (t,J=1.7 Hz,1H),7.91 (dd,J=10.3 Hz,2.2 Hz,2H),7.51 (m,2H),7.23 (s,1H),4.96 (m,1H),4.83 (dt,J=7.9 Hz,4.5 Hz,2H),4.75 (m,1H),4.31 (m,4H),3.77 (m,4H),3.38 (s,3H),3.36 (s,3H)。HRMS (ESI,m/z):计算M (C24H28FN6O4):483.2151,检测:483.215 4。
2.2 18F-FEA-Erlotinib的自动化合成采用国产的PET-MF-2V-IT-I型多功能合成模块,以对甲苯磺酸叠氮乙酯为原料,经亲核氟化反应得到Click合成子2-18F-氟叠氮乙烷(18F-FEA)[13],再通过“点击化学”反应得到目标产物18F-FEA-Erlotinib,后经半制备HPLC分离、C-18柱富集,最后经乙醇淋洗即得18F-FEA-Erlotinib。
第一步放化反应亲核反应结束后,中间体18F-FEA通过改装多功能模块后实现低温减压蒸馏纯化,并在此之前将铜催化的叠氮-炔基Husigen环加成(CuAAC)反应的催化体系及前体加入到2号反应管用以吸收18F-FEA馏份。此方法可避免未反应的叠氮前体3的蒸出,提高18F-FEA的浓度,进而提高“点击化学”产率、减少副产物。
18F-FEA-Erlotinib由Erlotinib与18F-FEA经CuAAC反应制备,反应条件温和(45 ℃)、时间短(15min)、操作简便,标记率达90%(n > 5,从18F-FEA计,衰变校正)。通过标准品的合成研究发现,传统的催化体系(Cu(Ⅱ)/L-抗坏血酸钠)中添加微量的TBTA能稳定提高反应产率,所以我们采用了Cu(Ⅱ)/L-抗坏血酸钠/TBTA的催化体系。自动化合成实验中,催化剂体系的配制方式对产率影响较大。将0.5 mol·L-1 CuSO4·5H2O溶液、1 mol·L-1 L-抗坏血酸钠溶液、TBTA及Erlotinib的DMF溶液分别或者组合式加入于2号反应管中混合的催化效果不理想,与4者按§1.3.3所述顺序混合后一次性加入2号反应管且现配现用方法相比,反应产率及稳定性相差较大。
18F-FEA-Erlotinib反应液上半制备HPLC分离(图 3),其中几乎无游离18F-离子,少量未反应完全18F-FEA保留时间为14 min左右,产品18F-FEA-Erlotinib在22 min左右出峰,接收该范围HPLC洗脱液于预先装有大量稀释用水的中转瓶后富集于C-18柱上,再用大量水冲洗C-18并吹干,乙醇淋洗即可得到高放化纯度(> 99%)的18F-FEA-Erlotinib。
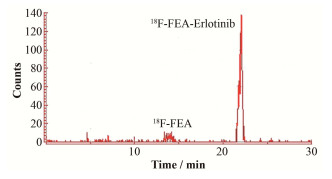
|
图 3 半制备HPLC分离18F-FEA-Erlotinib的放射峰图谱 Figure 3 Radioactive semi-preparative HPLC chromatogram of 18F-FEA-Erlotinib. |
18F-FEA-Erlotinib自动化合成时间为70 min,总放射化学产率为(54±2)%(n > 5,从18F-计,衰变校正)。通过“点击化学”自动化合成18F-FEA-Erlotinib的方法高效可靠,适合于大规模生产。
2.3 脂水分配系数18F-FEA-Erlotinib的脂水分配系数logP为2.36±0.01,为亲脂性物质,与Erlotinib亲脂性相近[14]。因此18F-FEA-Erlotinib具有像11C-Erlotinib一样进行体内PET显像的应用潜力。
2.4 质量控制结果18F-FEA-Erlotinib注射液为无色或浅黄色透明、澄清溶液,pH值约为7.0,18F-FEA-Erlotinib注射液核素物理半衰期约为110 min,放射性核纯度大于99%。分析型放射性HPLC测定典型18F-FEA-Erlotinib谱图示于图 4,其中标准品19F-FEA-Erlotinib保留时间为8.38 min(图 4(a)),18F-FEA-Erlotinib保留时间为8.55 min(图 4(b)),表明18F-FEA-Erlotinib为目标产物,放射化学纯度大于99%,放射性比活度高于200 MBq·μmol-1。
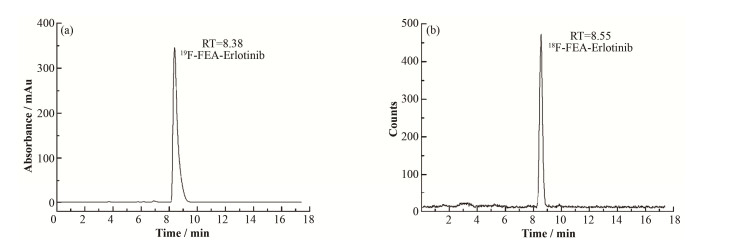
|
图 4 标准品19F-FEA-Erlotinib (a)与18F-FEA-Erlotinib (b) HPLC谱图 Figure 4 HPLC chromatograms of reference compound 19F-FEA-Erlotinib (a) and 18F-FEA-Erlotinib (b). |
衰变完全的18F-FEA-Erlotinib注射液薄层色谱氯铂酸和碘化钾染色法测定K2.2.2残留量显示,样品点显色斑点基本无色、无色环,明显低于10 mg·L-1标准液显色点颜色,符合我国药典中关于18F-FDG注射液中K2.2.2残留低于50 mg·L-1的要求。注射液溶剂残留、内毒素和无菌性均符合要求,其中三批质量控制结果如表 2所示。
| 表 2 18F-FEA-Erlotinib注射液质量控制结果 Table 2 Quality control results of 18F-FEA-Erlotinib. |
体外稳定性实验结果显示,18F-FEA-Erlotinib在PBS及胎牛血清中孵育2 h后,均未发现脱氟反应,表明18F-FEA-Erlotinib具有良好的体外稳定性。急性毒性实验中小鼠均健康存活,生活状态良好,无异常反应,显示18F-FEA-Erlotinib注射液在体内安全。这为显像剂的进一步体内评价研究奠定了基础。
3 结语本实验通过“点击化学”方法制备了一种潜在的EGFR显像剂18F-FEA-Erlotinib,并成功对其进行了自动化合成。18F-FEA-Erlotinib的自动化合成工艺简单高效,产物具有较高的放射化学产率、比活度和放射化学纯度。18F-FEA-Erlotinib体外稳定性良好,无明显脱氟显像,同时具有与母体化合物Erlotinib相似的亲脂性,为进一步开展该探针的体内研究奠定了良好基础。
| [1] |
Comis R L. The current situation: Erlotinib (Tarceva) and Gefitinib (Iressa) in non-small cell lung cancer[J]. Oncologist, 2005, 10(7): 467-470. DOI:10.1634/theoncologist.10-7-467 |
| [2] |
Liao B C, Lin C C, Yang J C. Second and third-generation epidermal growth factor receptor tyrosine kinase inhibitors in advanced nonsmall cell lung cancer[J]. Current Opinion in Oncology, 2015, 27(2): 94-101. DOI:10.1097/CCO.0000000000000164 |
| [3] |
Slobbe P, Poot A J, Windhorst A D, et al. PET imaging with small-molecule tyrosine kinase inhibitors: TKI-PET[J]. Drug Discovery Today, 2012, 17(21-22): 1175-1187. DOI:10.1016/j.drudis.2012.06.016 |
| [4] |
Hicks J W, VanBrocklin H F, Wilson A A, et al. Radiolabeled small molecule protein kinase inhibitors for imaging with PET or SPECT[J]. Molecules, 2010, 15(11): 8260-8278. DOI:10.3390/molecules15118260 |
| [5] |
Meng X, Loo BW Jr, Ma L, et al. Molecular imaging with 11C-PD153035 PET/CT predicts survival in non-small cell lung cancer treated with EGFR-TKI: a pilot study[J]. Journal of Nuclear Medicine, 2011, 52(10): 1573-1579. DOI:10.2967/jnumed.111.092874 |
| [6] |
Bahce I, Smit E F, Lubberink M, et al. Development of [11C]erlotinib positron emission tomography for in vivo evaluation of EGF receptor mutational status[J]. Clinical Cancer Research, 2013, 19(1): 183-193. DOI:10.1158/1078-0432.CCR-12-0289 |
| [7] |
Memon A A, Jakobsen S, Dagnaes-Hansen F, et al. Positron emission tomography (PET) imaging with [11C]-labeled erlotinib: a micro-PET study on mice with lung tumor xenografts[J]. Cancer Research, 2009, 69(3): 873-878. DOI:10.1158/0008-5472.CAN-08-3118 |
| [8] |
Memon A A, Weber B, Winterdahl M, et al. PET imaging of patients with non-small cell lung cancer employing an EGF receptor targeting drug as tracer[J]. British Journal of Cancer, 2011, 105(12): 1850-1855. DOI:10.1038/bjc.2011.493 |
| [9] |
Weber B, Winterdahl M, Memon A, et al. Erlotinib accumulation in brain metastases from non-small cell lung cancer: visualization by positron emission tomography in a patient harboring a mutation in the epidermal growth factor receptor[J]. Journal of Thoracic Oncology, 2011, 6(7): 1287-1289. DOI:10.1097/JTO.0b013e318219ab87 |
| [10] |
桂媛, 徐志宏, 张晓军, 等. 细胞凋亡显像剂18F-ML-10前体合成及放射性标记[J]. 核化学与放射化学, 2016, 38(3): 188-192. GUI Yuan, XU Zhihong, ZHANG Xiaojun, et al. Synthesis precursor of apoptosis imaging agent 18F-ML-10 and its radiolabing with 18F[J]. Journal of Nuclear and Radiochemistry, 2016, 38(3): 188-192. DOI:10.7538/hhx.2016.38.03.0188 |
| [11] |
国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2015, 1559-1660. Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China[M]. Beijing: China's Medical Science and Technology Publishing House, 2015, 1559-1660. |
| [12] |
Chan T R, Hilgraf R, Sharpless K B, et al. Polytriazoles as copper(Ⅰ)-stabilizing ligands in catalysis[J]. Organic Letters, 2004, 6(17): 2853-2855. DOI:10.1021/ol0493094 |
| [13] |
贾丽娜, 江大卫, 程登峰, 等. 一种靶向TGR5的胆汁酸类化合物的18F标记与初步评价[J]. 核化学与放射化学, 2014, 36(4): 247-252. JIA Lina, JIANG Dawei, CHENG Dengfeng, et al. Synthesis and preliminary evaluation of 18F-labeled bile acid compound for TGR5[J]. Journal of Nuclear and Radiochemistry, 2014, 36(4): 247-252. DOI:10.7538/hhx.YX.2014.2013076 |
| [14] |
Truong D H, Tran T H, Ramasamy T, et al. Development of solid self-emulsifying formulation for improving the oral bioavailability of erlotinib[J]. AAPS PharmSciTech, 2016, 17(2): 466-473. DOI:10.1208/s12249-015-0370-5 |


