2. 中国农业科学院衡阳红壤实验站,湖南祁阳 426182
2. Red Soil Experimental Station in Hengyang, Chinese Academy of Agriculture Sciences, Qiyang, Hunan 426182, China
土壤微生物是土壤生态系统的重要组成部分,是土壤有机质和养分等转化、循环的动力,它调控土壤中能量和养分循环等各个生化过程[1–2]。因此,土壤微生物生物量的多少及变化是土壤肥力高低及变化的重要依据之一[3]。土壤微生物生物量碳 (SMBC) 是土壤有机质中最为活跃的部分,可以敏感地反映出土壤有机碳的变化,是土壤生物学评价的重要指标之一[4];土壤微生物生物量氮 (SMBN) 是土壤活性氮的重要储备库,是植物氮营养的重要来源[5],因此土壤微生物生物量特性的改变可作为土壤耕作管理措施效果的评价指标之一。
秸秆中富含有机碳、氮、磷、钾以及中微量营养元素,还田后在土壤微生物作用下腐解,释放出的碳氮能够增加土壤有机质含量,改善有机质品质,是重要的有机资源[6–7]。微生物对秸秆的腐解受环境因子的影响,此外,秸秆质量也是重要的影响因子,包括秸秆C/N、氮素含量、木质素含量及可溶性有机物含量[8]。微生物自身的C/N较低,因此低C/N和难分解有机物含量低的秸秆腐解速率较快,能够提高氮素矿化量和微生物活性;相反,高C/N和难分解有机物含量高的秸秆腐解缓慢且会造成土壤氮素固持[9–10]。Parr等[11]认为,一般情况还田有机物料含氮量大于1.5%~1.7%,不需要补充氮素营养即可满足分解过程中微生物对氮素的需要,这相当于C/N比值为 (25~30)∶1。禾本科作物秸秆碳氮比一般较大,因此大量还田后可能会造成土壤氮素的固定并降低土壤微生物活性,造成腐解缓慢。秸秆还田配施氮肥可促进秸秆降解,提高土壤养分含量和微生物生物量[12–13]。
近年来对秸秆还田后施氮调节碳氮比对土壤肥力及微生物的影响,许多学者做了研究。张丹等[14]研究发现秸秆还田配施氮肥提高土壤微生物熵,降低微生物生物量C/N,增强土壤微生物体的氮素固持能力;但也有研究表明秸秆还田配施氮肥相比单施化肥,降低了土壤速效养分含量,同时降低脲酶及转化酶活性[15]。秸秆腐解是一个动态过程,腐解过程中碳源、氮源及气象条件等均有很大变化,秸秆还田后土壤微生物生物量的时间动态变化规律如何,尚不清楚。阐明该过程机制,对于合理配施氮肥、促进还田秸秆的腐解具有重要的理论意义。红壤地区是我国经济作物和粮食作物重要的生产基地,秸秆资源丰富,但红壤退化已成为制约区域农业可持续发展的重要因素,秸秆还田是提高红壤肥力的重要措施[16]。在田间条件下,尼龙网袋对水分传递所产生的影响较小,特别适用于旱地土壤中有机物料分解规律的研究[17]。因此,本文通过尼龙袋田间填埋法研究红壤旱地玉米秸秆还田并通过施氮调节碳氮比后,土壤微生物生物量碳、氮的动态变化及秸秆和氮肥在不同阶段的影响,为揭示红壤旱地秸秆还田后土壤养分循环规律和调控化肥与秸秆配比提供科学依据。
1 材料与方法 1.1 研究区概况试验设在湖南祁阳的中国农业科学院红壤实验站 (东经111°52′32″,北纬26°45′12″)。祁阳海拔高度约为120 m,年平均气温18.0℃,大于或等于10.0℃的积温5600℃,年降雨量1250 mm,年蒸发量1470 mm,无霜期约为300天,年日照时数1610~1620 h,太阳辐射量4550 MJ/m2。
1.2 试验设计与供试材料试验土壤为采自当地的第四纪红土母质发育的典型红壤,有机碳含量为10.1 g/kg,全氮1.14 g/kg,土壤C/N为8.9∶1,全磷0.92 g/kg,全钾17.7 g/kg。试验采用田间尼龙袋填埋法,即将秸秆或肥料与土壤混合后放入尼龙袋于田间填埋。共设置6个处理:纯土 (无氮肥无秸秆,CK)、土壤 + 0.157 g尿素 (N1)、土壤 + 0.939 g尿素 (N2)、土壤 + 9 g玉米秸秆 (S)、土壤 + 低量尿素 + 玉米秸秆 (SN1) 和土壤 + 高量尿素 + 玉米秸秆 (SN2),每袋装过2 mm筛的风干土200 g。
供试玉米秸秆采自当地农田,60℃烘干粉碎后,过2 mm筛,其碳氮含量分别为396 g/kg和7.47 g/kg,玉米秸秆C/N为53∶1。供试氮肥为尿素,全氮含量为46%。尼龙袋长25 cm,宽15 cm,孔径为48 μm。由于秸秆腐解是一个长期过程,本试验为期4年,共设置12次取样,但土壤微生物生物量的变化主要发生于有机物料添加的初期,本文重点对前期150 d内微生物生物量的结果进行了分析。参考林心雄等[18]的研究腐解时间大于两年的秸秆添加量应为土重10%左右。S、SN1和SN2处理秸秆添加量为土重的11%,每袋秸秆碳添加量为9 g。N1和SN1中尿素添加量为0.157 g/袋,N2和SN2中尿素添加量为0.939 g/袋。因此,S、SN1和SN2的C/N分别为53∶1、37∶1和15∶1。
1.3 田间布置供试土壤样品按上述处理分别添加尿素和秸秆,在塑料布上充分混匀后装入尼龙袋内用于填埋腐解。填埋区深15 cm,放置好尼龙袋后表土回填并平整地面,地表洒适量水使填埋土壤湿润,确保填埋的尼龙袋内土壤湿润,并和周围土壤密切接触,地表未出现明显积水。填埋后该区域不种植作物,处于撂荒状态。
1.4 样品采集与分析于2012年11月4日进行填埋,最后一次取样为2013年4月3号,填埋时土壤温度为17℃左右。在填埋后第7、14、21、28、49、150 d采样。每次取出24个尼龙袋,包含6个处理,4次重复,取回后鲜样过2 mm筛,于4℃条件下保存,用于微生物生物量碳氮的测定。部分土样室温风干后过0.15 mm筛,用于全氮和有机碳的测定。土壤含水量采用烘干法进行测定;土壤有机碳 (SOC) 测定采用重铬酸钾容量法-外加热法;土壤全氮 (TN) 测定采用半微量凯氏法,铵态氮和硝态氮采用2 mol/L KCl溶液浸提[19];SMBC和SMBN测定采用氯仿熏蒸—硫酸钾浸提法[20]。
1.5 数据处理方法SMBC = EC / kEC (1)
式中:EC为熏蒸与未熏蒸土壤总有机碳的差值;kEC为转换系数,取值0.45[21]。
SMBN = EN / kEN (2)
式中:EN为熏蒸与未熏蒸土壤总氮的差值;kEN为转换系数,取值0.54[22]。
微生物熵为土壤微生物生物量碳与土壤总有机碳比值,即SMBC/SOC。
秸秆 (A) 和氮肥 (B) 水平对土壤微生物的交互作用,按以下公式进行计算[23]。
| $ {\rm{A}} \times {\rm{B}} = [\left( {{\rm{AB}} + {{\rm{A}}_0}{{\rm{B}}_0}} \right) - \left( {{\rm{AB}}_0 + {{\rm{A}}_0}{\rm{B}}} \right)]/2 $ | (3) |
式中:AB为秸秆和氮肥均添加;A0B0为秸秆和氮肥均不添加 (CK);AB0为单施秸秆;A0B为单施氮肥。
试验数据利用Microsoft Office Excel 2013整理后,用Sigmaplot 12.5软件作图。差异显著性检验 (ANOVA) 采用SPSS 22.0软件 (P < 0.05),多重比较采用Duncan法进行分析。
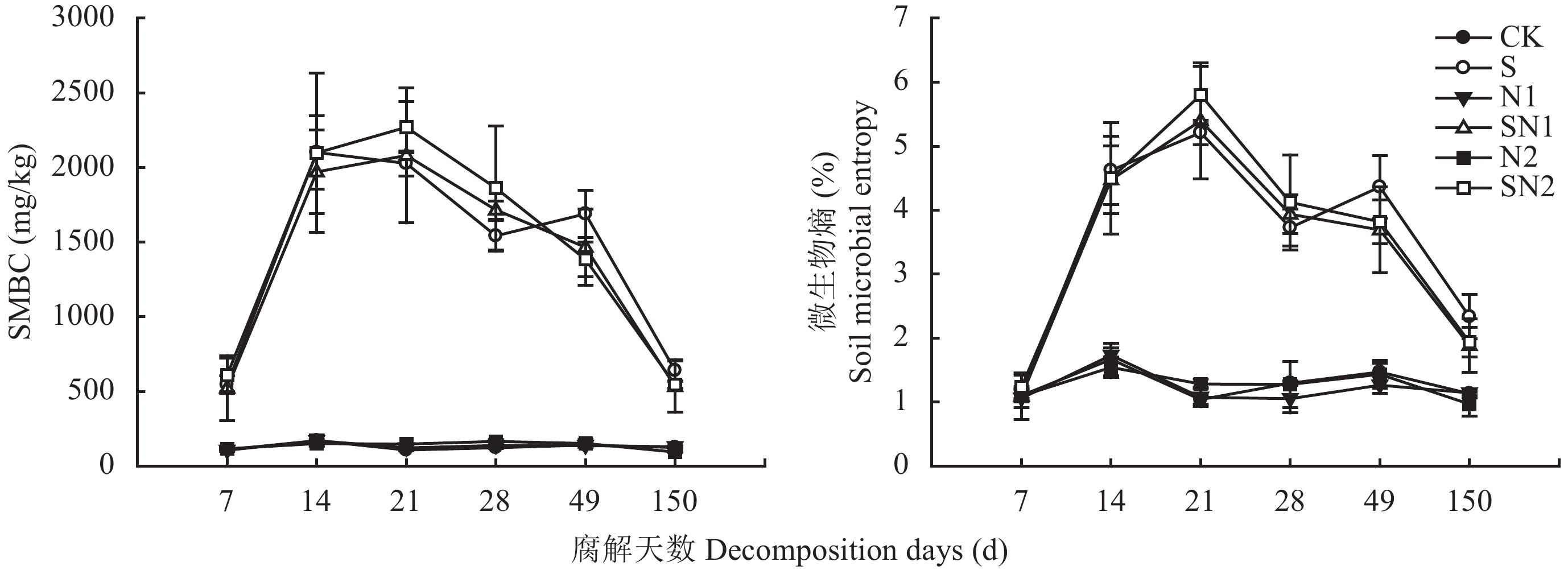
2 结果与分析 2.1 秸秆还田后红壤微生物生物量碳及微生物熵在CK、N1和N2处理下,土壤微生物生物量碳 (SMBC) 无显著差异,且随时间无显著变化 (图1)。S处理下,SMBC在14 d时即已达到最大值2101 mg/kg,随后逐渐降低,至150 d时约为640 mg/kg。SN1和SN2处理下,SMBC在7~21 d增加,21~28 d降低,28~49 d保持相对稳定,49~150 d降低。均在21 d时达到最大值2080 mg/kg和2270 g/kg,在150 d降至最低值530 mg/kg和550 mg/kg。S、SN1和SN2处理下SMBC显著高于其他三个处理,秸秆还田显著提高了SMBC。S、SN1和SN2三个处理下,SMBC在150 d内的平均值分别为1420、1380和1460 mg/kg,三者无显著差异。
图1表明,微生物熵随腐解时间的变化与SMBC基本一致,不同时间各处理间的差异也与SMBC一致。秸秆还田处理 (S、SN1和SN2) 土壤微生物熵在1.1%~5.8%之间波动,平均值为3.5%;未添加秸秆处理 (CK、N1和N2) 土壤微生物熵在0.97%~1.73%之间波动,平均值为1.26%。与SMBC一致,腐解21 d秸秆还田处理表现出较高的微生物熵。
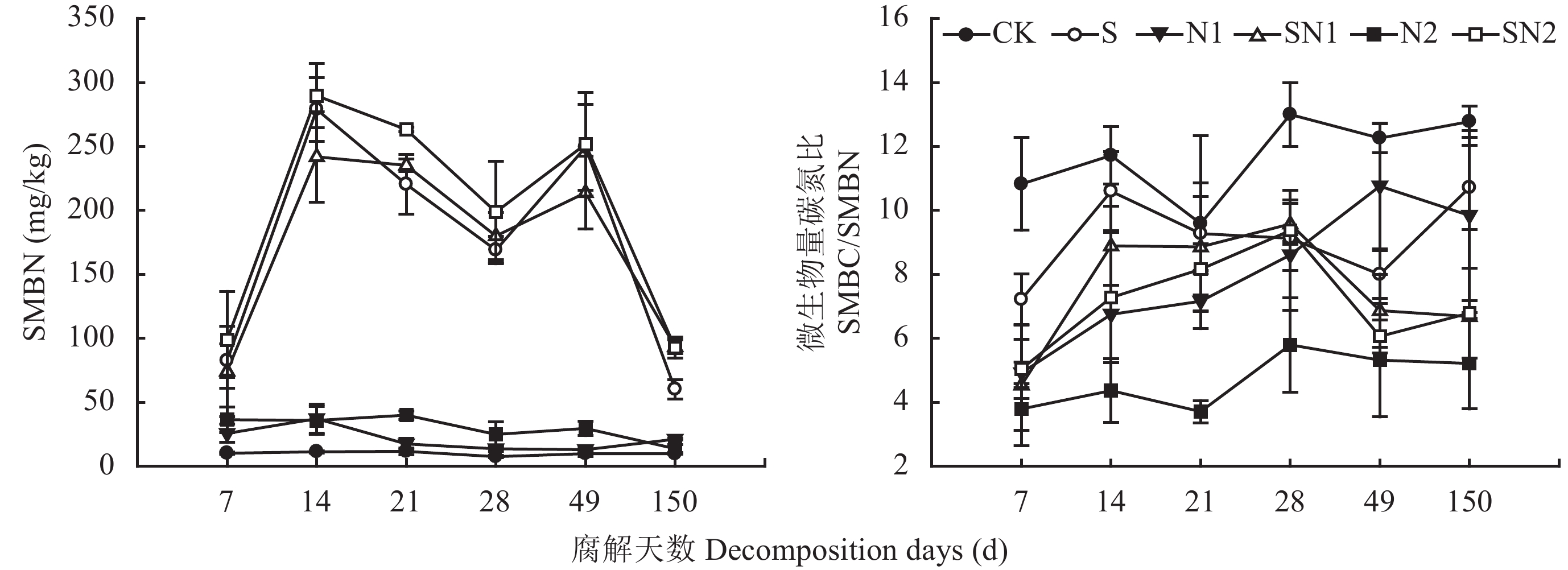
2.2 秸秆还田后红壤微生物生物量氮CK处理下SMBN在150 d内保持稳定,约为10 mg/kg (图2)。N1处理SMBN在7~21 d稳定在20 mg/kg,28~150 d稳定在15 mg/kg;N2处理SMBN在7~49 d稳定在30 mg/kg,至150 d时约15 mg/kg。S、SN1和SN2处理下,SMBN均在14 d时达到最高值,分别为279 mg/kg、242 mg/kg和290 mg/kg,14~28 d下降,28~49 d保持相对稳定,49~150 d快速下降,150 d时SMBN与7 d时相近。
秸秆还田处理的SMBN均显著高于未添加秸秆处理。未添加秸秆处理SMBN为8.2~40.0 mg/kg,而秸秆还田处理为60.2~289.7 mg/kg。N1处理SMBN在21 d内显著高于CK,N2处理SMBN在49 d内显著高于CK,说明施用氮肥可在短期内提高SMBN,且增加氮肥用量可延长SMBN提高持续的时间。S、SN1和SN2处理SMBN前期无显著差异,但150 d时SN1和SN2显著高于S处理。
2.3 秸秆还田后土壤微生物生物量碳氮比各时期土壤微生物生物量碳氮比表现出一定的波动 (图2)。CK、N1、N2、S、SN1和SN2处理6次取样平均值分别为13.2、6.9、5.1、8.5、7.8和7.7,表现为氮素添加量越大其比值越低,但秸秆和氮肥配合施用可减缓降低效应。CK处理下SMBC/SMBN值较为稳定且比值最高,150 d内在9.6~13.0之间波动;N1处理下,SMBC/SMBN值随时间呈上升趋势,在49 d时达到稳定值10左右,而N2处理下SMBC/SMBN值一直较低,150 d时仍为5。S、SN1和SN2处理SMBC/SMBN值在21~49 d内没有显著差异,而在21 d前和49~150 d内均为S > SN1 > SN2。
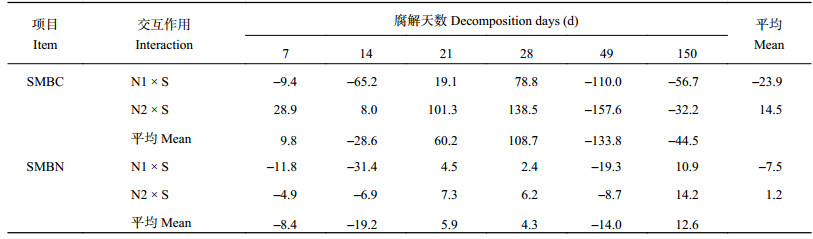
2.4 秸秆和氮肥的交互作用对微生物生物量碳氮的影响秸秆还田配施氮肥显著提高了土壤微生物生物量碳氮 (图1、图2),且SMBC和SMBN均随腐解时间变化出现波动。秸秆和氮肥的交互作用对SMBC和SMBN的影响也随腐解时间而变化 (表1)。就SMBC而言,低量尿素与秸秆仅在21~28 d表现为正交互作用,28 d时最大为78.8 mg/kg,150 d内平均值为–23.9 mg/kg。高量尿素与秸秆在7~28 d均表现为正交互作用,150 d内平均值为14.5 mg/kg。就SMBN而言,低量尿素和高量尿素与秸秆的交互作用变化规律一致,均只在21~28 d和150 d表现为正值,但低量尿素和秸秆的交互作用150 d内平均值为–7.5 mg/kg,而高量尿素与秸秆的交互作用平均值为1.2 mg/kg。总的来说秸秆与高量尿素的交互作用对微生物量碳氮的提高效果较明显。
| 表1 秸秆和氮肥的交互作用对土壤微生物生物量碳氮的影响 (mg/kg) Table 1 Effect of interaction of straw and nitrogen fertilizer on SMBC and SMBN |
 |
土壤微生物生物量是土壤有机质中活性较高的部分,作为土壤养分周转的中间库土壤微生物生物量虽然绝对含量不大,但对于土壤中的养分转化和供应至关重要[24],其多少及其变化是土壤肥力高低及变化的重要依据之一[3]。秸秆还田后SMBC和SMBN均显著增加,150 d时秸秆还田处理微生物生物量碳氮仍显著高于秸秆不还田处理,说明秸秆还田显著促进了土壤微生物的生长,这与前人的研究结果一致[25]。腐解过程中SMBC和SMBN分别在21 d和14 d达到最大值,之后呈下降趋势。但在28~49 d微生物生物量碳氮均表现出一个相对稳定的状态。这可能是由于秸秆还田后,易于分解的小分子有机化合物首先被一些能利用小分子有机物的发酵性微生物所同化利用,微生物数量快速增加,随着这些有机物的减少微生物数量下降。之后能够分解大分子有机物的土生性微生物开始利用这些物质繁殖,微生物数量又出现相对稳定或略微增加的阶段。
土壤微生物生长不仅受碳源的影响,氮肥的调控也会影响土壤微生物生物量[26],李世清等[23]研究表明有机物料和氮肥对土壤微生物生物量的影响有着显著的交互作用,交互作用的正负与物料类型及腐解时间相关。本研究结果还表明,150 d内秸秆和氮肥交互作用对SMBC和SMBN的影响与氮肥配施量有关,秸秆与高量氮肥表现为正交互作用,秸秆与低量氮肥表现为负交互作用。说明施氮调节C/N为37∶1仍未满足微生物腐解对氮素的需求,与前人的研究结果一致[11]。秸秆和氮肥交互作用的大小还受腐解时间的影响,无论是配施高量氮肥还是低量氮肥,秸秆和氮肥的交互作用对SMBC的影响均在49~150 d为负值,与李世清等[23]的研究结果“负交互作用均出现在腐解后期”一致。说明秸秆还田配施氮肥仅对腐解前期有促进作用。一方面尿素氮易分解转化,有研究表明尿素施用后两周即可完全水解[27],且尼龙袋填埋后一周内有一轮降水过程,最大降水量达24小时42.3 mm,7 d内累积降水量达120.6 mm,尿素水解产生的矿质氮可能被淋失;另一方面氮肥的添加促进了前期微生物的繁殖,大量易分解有机物被分解,造成后期腐解难度较大,且有研究表明营养充足条件下微生物种群多样性降低,少数优势种群处于支配地位,但难分解有机物的腐解需多种微生物种群共同完成[28],故氮肥的前期促进作用在后期反而可能不利于秸秆腐解和微生物量的增长。
土壤微生物熵 (SMBC/SOC) 是土壤有机质变化的灵敏指标,能有效指示有机物质施入土壤后微生物生物量碳转化的效率和土壤碳损失等[29],土壤中微生物熵一般为1%~4%[30]。本试验中,与对照处理相比,N1和N2处理下微生物熵并没有显著差异,且均处于一种较低水平 (图1),表明在常规施肥条件下土壤微生物对土壤中碳的利用率很低,且单施氮肥对土壤微生物熵并无显著影响。秸秆还田后土壤微生物熵有了显著提升,说明秸秆还田促进了土壤有机碳转化为更容易被微生物利用的形态,从而提高土壤养分有效性。
土壤微生物生物量碳氮比 (SMBC/SMBN) 经常被用于描述微生物的群落结构信息[31],一般来说,真菌的C/N值在7~12之间,细菌在3~6之间[32]。本试验结果中对照处理微生物生物量碳、氮的比值一直较大,维持在10左右 (图2),说明该土壤中真菌数量比较高。有研究表明,细菌的相对丰度与土壤pH值呈正比,而真菌的丰度对pH变化不敏感[33]。红壤的pH值较低 (5.25),会抑制细菌生长,因此真菌的相对丰度较高。秸秆还田后,易于分解的小分子有机化合物首先被一些能利用小分子有机物的发酵性微生物所同化利用,微生物数量快速增加,随着这些有机物的减少微生物数量下降。然后能够分解大分子有机物的土生性微生物开始利用这些物质繁殖,微生物生物量又出现一个快速增加阶段 (图1)。7 d时施氮处理SMBC/SMBN均小于6,可能是因为氮素的添加激发了嗜氮微生物,随着氮素浓度的降低,嗜氮微生物减少,28 d时N1、SN1和SN2处理SMBC/SMBN已接近8,表明微生物群落由“细菌型”转变为“真菌型”。至150 d时,N2处理SMBC/SMBN低于5,SN1和SN2处理SMBC/SMBN接近6。前者可能是由于尿素施用量较大,尿素氮虽易水解淋失,但N2处理矿质氮含量占全氮的比例仍相对较高,适合细菌的生长;后者则是由于土壤养分状况得以改善,细菌和真菌都得以大量繁殖。王慧颖等[33]也发现有机无机配施微生物数量和多样性都显著提高。可见调控肥料类型及比例可有效协调不同种群微生物生长,进而提高土壤生物肥力。
 |
| 图1 不同时期各处理土壤微生物生物量碳、微生物熵 Fig. 1 Dynamics of soil microbial biomass carbon and microbial entropy under different treatments |
 |
| 图2 不同时期各处理土壤微生物生物量氮和微生物生物量碳氮比 Fig. 2 Dynamics of SMBN and SMBC/SMBN ratio under different treatments |
红壤旱地上玉米秸秆还田可显著提高SMBC、SMBN和微生物熵。秸秆和氮肥对土壤微生物生物量碳氮的影响有显著的交互作用,在一定范围内氮肥用量越大交互作用越大。施用氮肥调节C/N为37∶1时,秸秆和氮肥的交互作用对微生物生物量碳氮的影响在150 d内平均值为负值。秸秆和氮肥的交互作用仅在前期促进SMBC的增长。因此,在秸秆还田及施氮调节C/N时需要调节该比值至37∶1以下,且改变氮肥单次大量施入的模式,可进一步促进秸秆还田后养分的释放和微生物量的增长。
| [1] |
曹慧, 杨浩, 孙波, 等. 不同种植时间菜园土壤微生物生物量和酶活性变化特征[J].
土壤, 2002, (4): 197–200.
Cao H, Yang H, Sun B, et al. Changes of microbial biomass and enzyme activity in vegetable garden soil at different planting times[J]. Soils, 2002, (4): 197–200. DOI:10.3321/j.issn:0253-9829.2002.04.005 |
| [2] | Jenkinson D S. Determination of microbial biomass carbon and nitrogen in soil[A]. Wilson J R. Advances in nitrogen cycling in agricultural ecosystems[M]. Wallingford, England: CAB International, 1988. 368–386. |
| [3] |
俞慎, 李振高. 熏蒸提取法测定土壤微生物量研究进展[J].
土壤学进展, 1994, 22(6): 42–50.
Yu S, Li Z G. Research progress on the determination of soil microbial biomass by fumigation[J]. Advance in Soil Science, 1994, 22(6): 42–50. |
| [4] |
胡婵娟, 刘国华, 吴雅琼. 土壤微生物生物量及多样性测定方法评述[J].
生态环境学报, 2011, 20(增刊2): 1161–1167.
Hu C J, Liu G H, Wu Y Q. Evaluation of soil microbial biomass and diversity[J]. Journal of Ecological Environment, 2011, 20(Z1): 1161–1167. |
| [5] |
王淑英, 樊廷录, 丁宁平, 等. 长期施肥下黄土旱塬黑垆土供氮能力的变化[J].
植物营养与肥料学报, 2015, 21(6): 1487–1495.
Wang S Y, Fan T L, Ding N P, et al. Changes of nitrogen supply capacity in Loess Plateau under long-term fertilization in loessial soil[J]. Journal of Plant Nutrition and Fertilizer, 2015, 21(6): 1487–1495. |
| [6] |
黄运湘, 王改兰, 冯跃华, 等. 长期定位试验条件下红壤性水稻土有机质的变化[J].
土壤通报, 2005, (2): 181–184.
Huang Y X, Wang G L, Feng Y H, et al. Changes of organic matter in paddy soil derived from red soil in a long-term located experiment[J]. Journal of Soil Science, 2005, (2): 181–184. DOI:10.3321/j.issn:0564-3945.2005.02.009 |
| [7] |
任仲杰, 顾孟迪. 我国农作物秸秆综合利用与循环经济[J].
安徽农业科学, 2005, (11): 2105–2106.
Ren Z J, Gu M D. The comprehensive utilization and circulation economy of crop straw in China[J]. Journal of Anhui Agricultural Science, 2005, (11): 2105–2106. DOI:10.3969/j.issn.0517-6611.2005.11.064 |
| [8] | Georgieva S, Christensen S, Petersen H, et al. Early decomposer assemblages of soil organisms in litterbags with vetch and rye roots[J]. Soil Biology and Biochemistry, 2005, 37(6): 1145–1155. DOI:10.1016/j.soilbio.2004.11.012 |
| [9] | Yanni S F, Whalen J K, Simpson M J, et al. Plant lignin and nitrogen contents control carbon dioxide production and nitrogen mineralization in soils incubated with Bt and non-Bt corn residues[J]. Soil Biology and Biochemistry, 2011, 43(1): 63–69. DOI:10.1016/j.soilbio.2010.09.012 |
| [10] | Moritsuka N, Yanai J, Mori K, et al. Biotic and abiotic processes of nitrogen immobilization in the soil-residue interface[J]. Soil Biology and Biochemistry, 2004, 36(7): 1141–1148. DOI:10.1016/j.soilbio.2004.02.024 |
| [11] | Parr J F, Parkinson D, Norman A G. A glass micro-bead system for the investigation of soil microoganisms[J]. Nature, 1963, (200): 1227–1288. |
| [12] | Henriksen T M, Breland T A. Nitrogen availability effects on carbon mineralization, fungal and bacterial growth, and enzyme activities during decomposition of wheat straw in soil[J]. Soil Biology and Biochemistry, 1999, 31(8): 1121–1134. DOI:10.1016/S0038-0717(99)00030-9 |
| [13] | Shaukat A A, Tian X H, Wang D, et al. Decomposition characteristic of maize straw with different carbon to nitrogen (C/N) ratios under various moisture regimes[J]. African Journal of Biotechnology, 2011, 10(50): 10149–10156. DOI:10.5897/AJB |
| [14] |
张丹, 付斌, 胡万里, 等. 秸秆还田提高水稻–油菜轮作土壤固氮能力及作物产量[J].
农业工程学报, 2017, 33(9): 133–140.
Zhang D, Fu B, Hu W L, et al. Increasing soil nitrogen fixation capacity and crop yield of rice-rape rotation by straw returning[J]. Transactions of the Chinese Society of Agricultural Engineering, 2017, 33(9): 133–140. |
| [15] |
唐晓雪, 刘明, 江春玉, 等. 不同秸秆还田方式对红壤性质及花生生长的影响[J].
土壤, 2015, 47(2): 324–328.
Tang X X, Liu M, Jiang C Y, et al. Effects of different ways of straw retuning on red soil properties and peanut growth[J]. Soils, 2015, 47(2): 324–328. |
| [16] |
孔宏敏, 何圆球, 吴大付, 等. 长期施肥对红壤旱地作物产量和土壤肥力的影响[J].
应用生态学报, 2004, (5): 782–786.
Kong H M, He Y Q, Wu D F, et al. Effect of long-term fertilization on crop yield and soil fertility of upland red soil[J]. Chinese Journal of Applied Ecology, 2004, (5): 782–786. DOI:10.3321/j.issn:1001-9332.2004.05.010 |
| [17] |
林心雄, 吴顺龄, 车玉萍. 干旱和半干润地区测定有机物分解速率的尼龙袋法[J].
土壤, 1992, (6): 315–318.
Lin X X, Wu S L, Che Y P. Nylon bag method for determining the decomposition rate of organic matter in arid and semi dry areas[J]. Soils, 1992, (6): 315–318. |
| [18] |
林心雄, 文启孝, 徐宁. 广州地区土壤中植物残体的分解速率[J].
土壤学报, 1985, 22(1): 47–56.
Lin X X, Wen Q X, Xu N. Study on decomposition of plant residual in soils of Guangzhou and Wuxi[J]. Acta Pedologica Sinica, 1985, 22(1): 47–56. |
| [19] |
鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000. 128–129.
Lu R K. Analysis methods of soil and agricultural chemistry[M]. Beijing: China Agricultural Science and Technology Press. 2000. 128–129. |
| [20] | Jenkinson D S, Powlson D S. The effects of biocidal treatments on metabolism in soil—V: A method for measuring soil biomass[J]. Soil Biology and Biochemistry, 1976, 8(3): 167–177. DOI:10.1016/0038-0717(76)90001-8 |
| [21] | Vance E D, Brookes P C, Jenkinson D C. An extraction method for measuring soil microbial biomass C[J]. Soil Biology and Biochemistry, 1987, 19(6): 703–707. DOI:10.1016/0038-0717(87)90052-6 |
| [22] | Brookes P C, Landman A, Pruden G, et al. Chloroform fumigation and the release of soil nitrogen: A rapid direct extraction method to measure microbial biomass nitrogen in soil[J]. Soil Biology and Biochemistry, 1985, 17(6): 837–842. DOI:10.1016/0038-0717(85)90144-0 |
| [23] |
李世清, 李生秀. 有机物料和氮肥相互作用对微生物体氮的影响[J].
微生物学通报, 2000, 27(3): 157–163.
Li S Q, Li S X. Interaction between organic material and nitrogen fertilizer on microbial biomass nitrogen[J]. Microbiology China, 2000, 27(3): 157–163. DOI:10.3969/j.issn.0253-2654.2000.03.001 |
| [24] | AndeCKon J P E, Domsch K H. Quantities of plant nutrients in the microbial biomass of selected soils[J]. Soil Science, 2006, 130(4): 211–216. |
| [25] |
杨滨娟, 黄国勤, 钱海燕. 秸秆还田配施化肥对土壤温度、根际微生物及酶活性的影响[J].
土壤学报, 2014, 51(1): 150–157.
Yang B J, Huang G Q, Qian H Y. Effect of straw incorporation plus chemical fertilizer on soil temperature, root micro-organisms and enzyme activities[J]. Acta Pedologica Sinica, 2014, 51(1): 150–157. |
| [26] |
臧逸飞, 郝明德, 张丽琼, 等. 26年长期施肥对土壤微生物量碳、氮及土壤呼吸的影响[J].
生态学报, 2015, 35(5): 1445–1451.
Zang Y F, Hao M D, Zhang L Q, et al. Effect of wheat cultivation and fertilization on soil microbial biomass carbon, soil microbial biomass nitrogen and soil basal respiration in 26 years[J]. Acta Ecologica Sinica, 2015, 35(5): 1445–1451. |
| [27] |
李君, 刘涛, 褚贵新. 脲酶抑制剂对石灰性土壤尿素转化及N2O排放的影响
[J].
农业环境科学学报, 2014, 33(9): 1866–1872.
Li J, Liu T, Chu G X. Response of urea transformation dynamics and nitrous oxide to three urea inhibitors in calcareous soil[J]. Journal of Agro-Environment Science, 2014, 33(9): 1866–1872. |
| [28] | Dilly O, Bloem J, Vos A, et al. Bacterial diversity in agricultural soils during litter decomposition[J]. Applied and Environmental Microbiology, 2004, 70: 468–474. DOI:10.1128/AEM.70.1.468-474.2004 |
| [29] |
张伟东, 汪思龙, 颜绍馗, 等. 杉木根系和凋落物对土壤微生物学性质的影响[J].
应用生态学报, 2009, (10): 2345–2350.
Zhang W D, Wang S L, Yan S K, et al. Effects of root system and litter of Chinese fir on soil microbial properties[J]. Chinese Journal of Applied Ecology, 2009, (10): 2345–2350. |
| [30] | Sparing G P. Ratio of microbial biomass carbon to soil organic carbon as a sensitive indicator of changes in soil organic matter[J]. Australian Journal of Soil Research, 1992, 30(2): 195–207. DOI:10.1071/SR9920195 |
| [31] |
蔡晓布, 钱成, 张元, 等. 西藏中部地区退化土壤秸秆还田的微生物变化特征及其影响[J].
应用生态学报, 2004, (3): 463–468.
Cai X B, Qian C, Zhang Y, et al. Microbial characteristics of straw amended degraded soils in central Tibet and its effect on soil fertility[J]. Chinese Journal of Applied Ecology, 2004, (3): 463–468. DOI:10.3321/j.issn:1001-9332.2004.03.021 |
| [32] | Vries F T D, Hoffland E, Eekeren N V, et al. Fungal/bacterial ratios in grasslands with contrasting nitrogen management[J]. Soil Biology and Biochemistry, 2006, 38(8): 2092–2103. DOI:10.1016/j.soilbio.2006.01.008 |
| [33] |
王慧颖, 徐明岗, 周宝库, 等. 黑土细菌及真菌群落对长期施肥响应的差异及其驱动因素[J].
中国农业科学, 2018, 51(5): 914–925.
Wang H Y, Xu M G, Zhou B K, et al. Response and driving factors of bacterial and fungal community to long-term fertilization in black soil[J]. Scientia Agricultura Sinica, 2018, 51(5): 914–925. |
 2018, Vol. 24
2018, Vol. 24  doi:
doi: 

