2. 中国农业科学院农田灌溉研究所,河南新乡 453002;
3. 安徽科技学院资源与环境学院,安徽凤阳 233100;
4. 江苏省农垦农业发展股份有限公司新曹分公司,江苏东台 224246
2. Farmland Irrigation Research Institute, Chinese Academy of Agricultural Sciences & Ministry of Water Resources, Xinxiang, Henan 453002, China;
3. College of Resource and Environmental Science, Anhui Science and Technology University, Fengyang, Anhui 233100, China;
4. Jiangsu Provincial Agricultural Reclamation and Development Co., Ltd., Xincao Branch, Dongtai, Jiangsu 224246, China
分蘖是水稻个体强壮程度的重要特征[1],也是决定作物产量的重要农艺性状[2–3]。水稻分蘖除受自身遗传因素的作用外, 还受营养条件、温度、光照、水分、种植密度等外界因素的影响。其中,又以氮素对分蘖的影响尤为明显。氮素不仅是氨基酸、核糖核酸、叶绿体、ATP和植物激素的重要组成部分,同时还参与碳氮代谢、蛋白质合成等生物学过程。因而,缺氮会严重影响植株的正常生长,最终导致减产[4–5]。已有研究表明,氮素对水稻群体的生长,特别是分蘖的发生至关重要[6]。
在传统栽培模式下,人们普遍通过增施氮肥来增强水稻的分蘖能力,致使我国氮肥的施用严重过量,利用率显著低于世界平均水平,且对环境造成了极大的威胁[7–8]。这种现象在江苏省尤为突出[9–11],因而进一步探索提高稻苗分蘖能力的其他途径尤为重要。合适的栽培密度是调控水稻分蘖的关键技术之一[12–13],可促使水稻形成具有高产能力的群体。本试验通过研究氮水平及移栽密度对水稻分蘖的主效应及其交互效应,将对水稻的实际生产有很好的理论指导和实践意义。
1 材料与方法 1.1 试验点概况和试验材料试验1:田间试验于2014年5—12月在江苏省如皋市农业科学研究所 (120.49°E、32.44°N) 的南京农业大学6年长期定位试验田进行,供试土壤为由江淮冲积物发育而成的薄层高砂土。试验田的地力均匀,种植制度为稻麦轮作。耕层 (0—20 cm) 土壤的基本理化性状如下:土壤有机质11.97 g/kg、全氮1.02 g/kg、有效磷23.96 mg/kg、速效钾83.53 mg/kg、pH 7.07。供试水稻品种为适宜在江苏省沿江及苏南地区种植的早熟晚粳稻“镇稻11号”,分别于每年5月中旬播种育秧,6月25日前后移栽,10月底收获。
试验2:溶液培养试验同时在南京农业大学温室进行。
1.2 试验设计田间长期定位试验为氮肥用量与种植密度的两因素试验。设置5个氮肥用量水平:0、90、180、270和360 kg/hm2,作为主区,分别以N0、N90、N180、N270和N360 表示。以种植密度为副区,设置2个密度水平:高密度 (High density,HD,32.5 × 104 穴/hm2),行株距为22 cm× 14 cm;低密度 (Low density,LD,25.5 × 104 穴/hm2),行株距为28 cm × 14 cm。共10个处理,设3个区组,随机排列,共30个小区,小区面积50 m2 (5 m × 10 m)。每个小区均单设进、排水口,小区间田埂用防水布覆盖隔离防渗,且每个小区四周均设保护行。
营养液培养试验在容积约7 L (长315 mm × 宽216 mm × 高105 mm) 的周转箱中进行:设置低、中、高,即,5、40、80 mg/kg 3个氮浓度和高密度 (24株/箱)、低密度 (12株/箱) 2个栽培密度。
1.3 试验实施方法 1.3.1 田间试验水分管理方式薄水移栽,寸水活棵;苗期浅水勤灌,在每公顷分蘖数达到约300万时,进行烤田;孕穗期保持浅水层,深水抽穗扬花、抽穗1周后干湿交替灌溉,水稻成熟前7~10天断水。氮肥、磷肥和钾肥分别以尿素 (含N 46%)、过磷酸钙 (含P2O5 14%) 和氯化钾 (含K2O 60%) 的形式施用。其中,氮肥分 4 次施用,即,基肥∶分蘖肥∶促花肥∶保花肥 = 4∶2∶2∶2;磷肥 (P2O5) 用量为75 kg/hm2,于移栽前1天一次性施入;钾肥 (K2O) 用量为90 kg/ hm2,按基肥∶促花肥为2∶1的比例施用。在插秧的前1天施基肥,插秧后7~10天施分蘖肥,促花肥在倒四叶时施入,保花肥在倒二叶时施入。病虫草害管理根据当地水稻病虫害防治常规方法进行。
1.3.2 营养液培养试验水稻种子用10% H2O2溶液消毒30 min后,洗净并转移至育苗筐中,培养至两叶一心,再选取长势一致的健壮幼苗移栽到周转箱中,培养30 d后收获。营养液采用国际水稻所 (IRRI) 建议的修正营养液 (pH5.7)[14],其中Fe2+用 Fe (EDTA-Na2) 代替,营养液中K+、Na+、Ca2+、Mg2+的浓度保持不变。在培养过程中,每3 d更换1次营养液。
1.4 测定项目与方法 1.4.1 田间试验水稻移栽后施分蘖肥的前1天进行第一次取样,之后每10天取1次样。每次取样时,在每个小区选取长势一致的3穴植株,分叶、茎鞘两部分,先用自来水将植株冲洗干净,然后去离子水冲洗,于105℃杀青30 min,75℃烘至恒重。冷却后,称重各器官重量,并根据取样穴数,分别计算每平方米种植面积的水稻各器官的重量,用于计算养分的总累积量。使用高速万能不锈钢粉碎机将样品粉碎,用于养分含量测定。
采用Vario EL Ⅲ元素分析仪 (德国Elementar公司) 测定植株全氮、全碳;
采用LAI-2200(美国LI-COR公司) 植物冠层分析仪测定水稻的LAI、PAR。
相对分蘖速率 (tiller/d) = [ln (N2) – ln (N1)] /(T2 – T1)
式中:N2和N1分别是时间T2和T1时每平方米的分蘖数。
相对生长速率 [g/(g∙d)] = [ ln (W2) – ln (W1) ]/(T2 – T1)
式中:W2和W1分别是时间T2时和时间T1时的生物量。
1.4.2 溶液培养试验移栽后每隔7 d取1次样,每次取样时,每个处理选取长势一致的3株植株,用自来水冲洗干净,将其从根基部剪下,均匀散铺在扫描盘中,采用根系扫描仪 (Epson Expression 10000XL,USA) 进行扫描,利用图像分析软件 (WinRHIZO,Canada) 对扫描结果进行定量化分析;同时人工计数每株苗的不定根数。
1.5 数据处理与分析数据采用SigmaPlot 12.5、Spss 16.0、Microsoft Office Excel 2010、Photoshop等软件进行作图、分析、统计,所有数据运用LSD法进行方差分析和多重比较。
2 结果与分析 2.1 氮水平及栽培密度对水稻分蘖和成穗率的影响由图1可知,随分蘖的持续,各处理下单位面积的水稻分蘖数均呈先增加后下降的趋势。水稻在5个氮水平下的最大分蘖数分别达每平方米184个、295个、360个、365个、382个,随氮水平的增加而增加,但增幅逐渐降低。高栽培密度 (HD) 下单位面积的水稻分蘖数始终明显大于低栽培密度 (LD),而HD下单穴水稻分蘖数则始终小于LD (图1)。5个氮水平下,水稻的有效分蘖数分别为163、257、290、293、285个/m2,氮水平低于180 kg/hm2时,各氮水平下有效分蘖数存在显著差异。且氮水平大于180 kg/hm2时,单位面积的水稻有效分蘖达最高水平。当氮水平低于180 kg/hm2时,在HD下,单位面积的水稻有效分蘖数明显大于LD,而当氮水平高于180 kg/hm2时,HD和LD下单位面积的水稻有效分蘖数无明显差异。进一步分析发现,随氮水平的升高,水稻的成穗率呈下降趋势,其成穗率分别为88.6%、87.1%、80.6%、80.3%、74.6%。
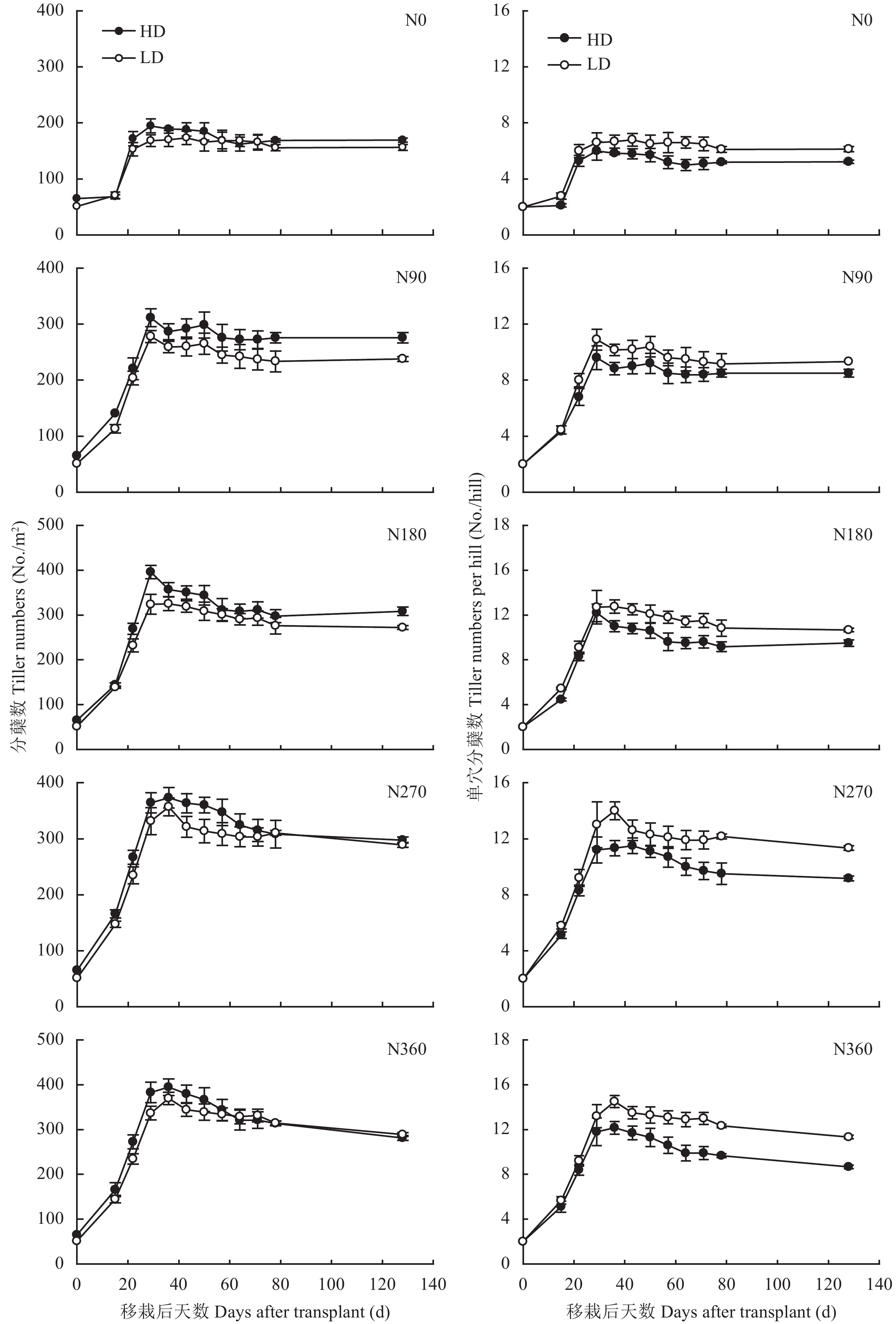 |
| 图1 氮水平及栽培密度对水稻分蘖动态的影响 Fig. 1 The effect of N level and transplant density on the dynamic of tillering |
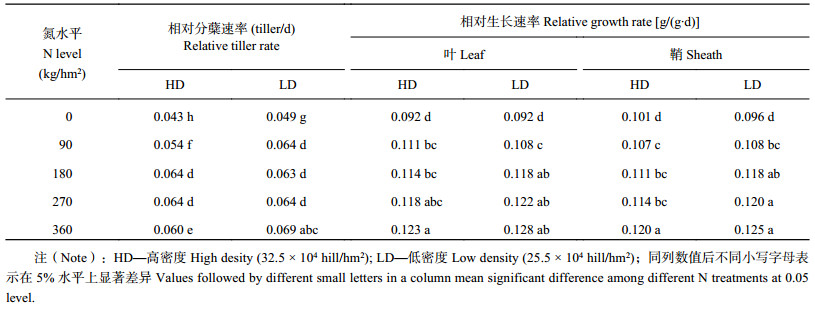
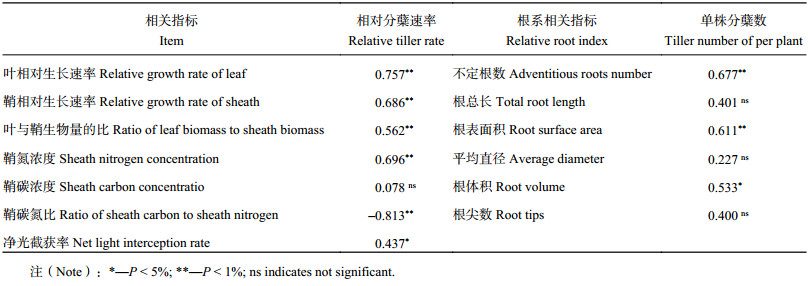
水稻植株体内的养分含量是影响其分蘖的主要因素。随氮水平增加水稻鞘的氮浓度增加 (图2A),从N0到N360,氮水平间水稻鞘的氮浓度间均存在显著的差异,其氮浓度从2.1%升高至3.3%,且分析表明水稻鞘的氮浓度与水稻的相对分蘖速率存在极显著的正相关关系 (表3)。但是,两种栽培密度间水稻鞘的氮浓度无显著差异。
碳素是水稻干物质的主要组成元素之一。然而水稻鞘的碳浓度不受氮水平及栽培密度的影响 (图2B),各处理下水稻鞘的碳浓度均无显著差异,且水稻鞘碳浓度与其相对分蘖速率间无显著的相关关系 (表3)。但是,由图2C可知,随氮水平的增加,水稻鞘的碳氮比从18.1降低至11.8,且两个栽培密度间无显著的差异。分析表明,水稻的相对分蘖速率与其鞘的碳氮比呈极显著的负相关关系 (表3)。由于不同氮水平处理间水稻鞘碳浓度差异不大,碳氮比差异主要是由其氮浓度差异所致,因此,水稻鞘的碳氮比是否确实能影响水稻的相对分蘖速率有待进一步的研究。
| 表1 氮水平及栽培密度对水稻分蘖中期相对分蘖速率及相对生长速率的影响 Table 1 The effect of N level and transplant density on relative tiller rate at middle-tillering stage |
 |
 |
| 图2 水稻叶鞘氮、碳浓度、叶鞘干物质分配、群体冠层净光截获率 Fig. 2 Sheath nitrogen (N) and carbon (C) concentration, biomass distribution of leaf and sheath, and canopy net light interception rate of rice |
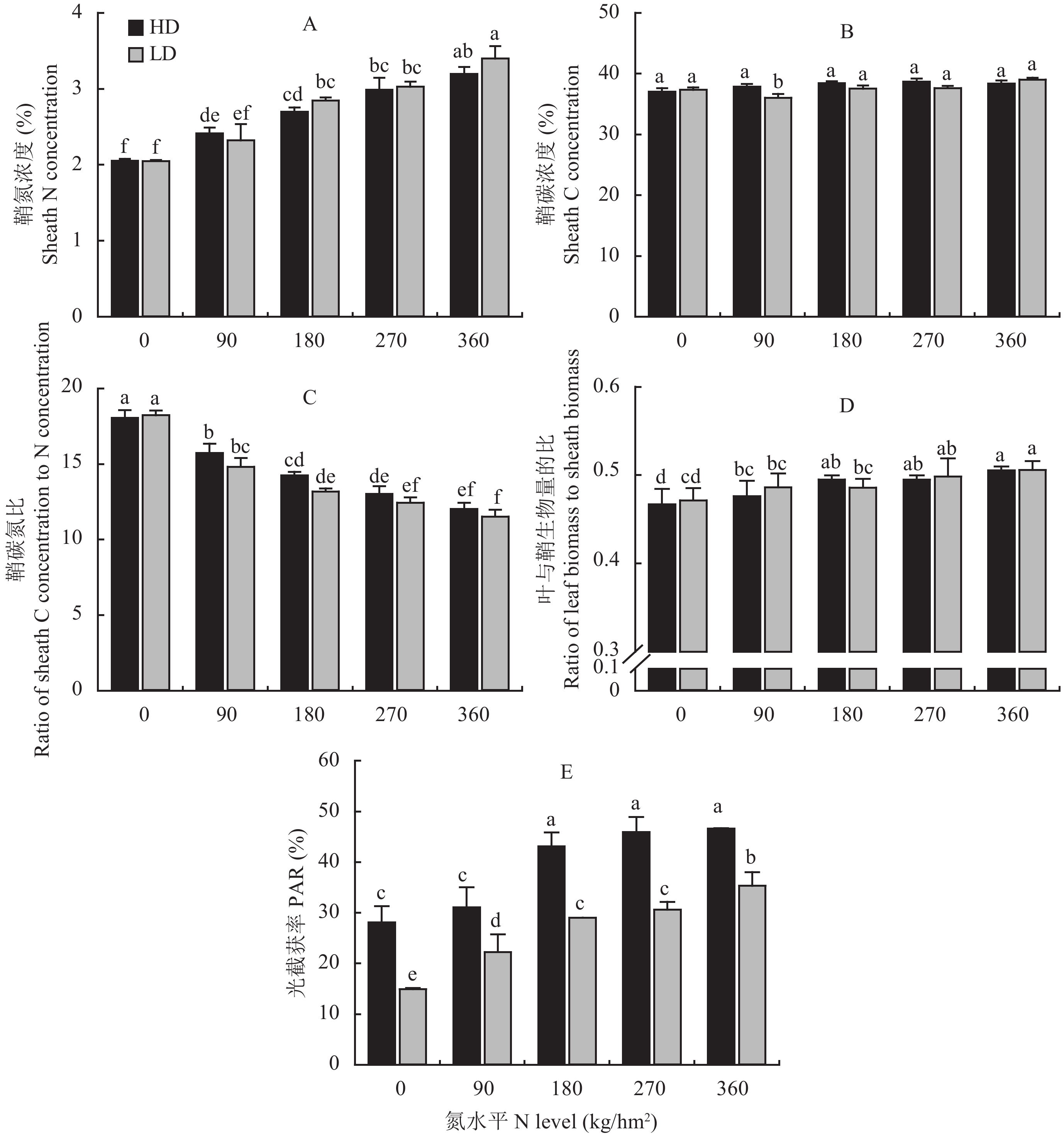
进一步分析各处理下的分蘖动态可发现,随氮水平的升高,水稻达到有效分蘖所需时间变长,且HD下达到有效分蘖的时间总体上少于LD下。由表1可知,随氮水平的增加,水稻的相对分蘖速率从0.46 tiller/d升高至0.64 tiller/d。在HD下,当氮水平为180 kg/hm2时,水稻的相对分蘖速率达最高水平;而在LD下,当氮水平为90 kg/hm2时,水稻的相对分蘖速率达最高水平。说明在不同的栽培密度下,氮水平对水稻的相对分蘖速率的影响存在一定的差异。由表1可知,水稻叶、鞘的相对生长速率随氮水平的升高而加快,且以LD下各处理总体高于HD各处理,但两密度间无显著差异。具体表现为:在HD和LD下,水稻叶的平均相对生长速率分别为0.1116、0.1136 g/(g∙d),而鞘的平均相对生长速率分别为0.1106、0.1134 g/(g∙d)。同时,表3表明,在水稻分蘖时,植株叶、鞘的相对生长速率都与其相对分蘖速率呈显著正相关关系 (P < 0.05)。因此,氮水平通过影响单穴 (个体) 植株的生长速率进而影响了水稻的相对分蘖速率。
此外,水稻的相对分蘖速率与其干物质向叶的分配比例也存在极显著的正相关关系 (表3)。由图2D可知,氮水平低于180 kg/hm2时,随氮水平升高,水稻干物质向叶片的分配比例从0.47升高至0.51;但是,在HD和LD下,相同氮水平处理下的水稻干物质向叶片的分配比例没有明显差异。
2.4 水稻冠层净光截获率对水稻相对分蘖速率的影响图2E表明,在分蘖中期,水稻冠层净光截获率 (PAR) 随氮水平的增加而增加,且HD净光截获率显著高于LD。在HD下,当氮水平为N180 kg/hm2时,水稻冠层的PAR约为43%,当氮水平大于180 kg/hm2时,水稻冠层的PAR增幅明显降低;在LD下时,随氮水平的升高,水稻冠层的PAR持续增加,从15%增加至35%。这说明,栽培密度明显影响了水稻冠层的PAR。此外,由图2E和表3可以看出,在HD和LD两个栽培密度下,水稻冠层的PAR与其相对分蘖速率呈显著的正相关关系。
| 表2 不同氮及栽培密度苗期单株水稻根系形态参数 Table 2 Root morphology parameters of individual rice seedling affected by N levels and transplant densities |
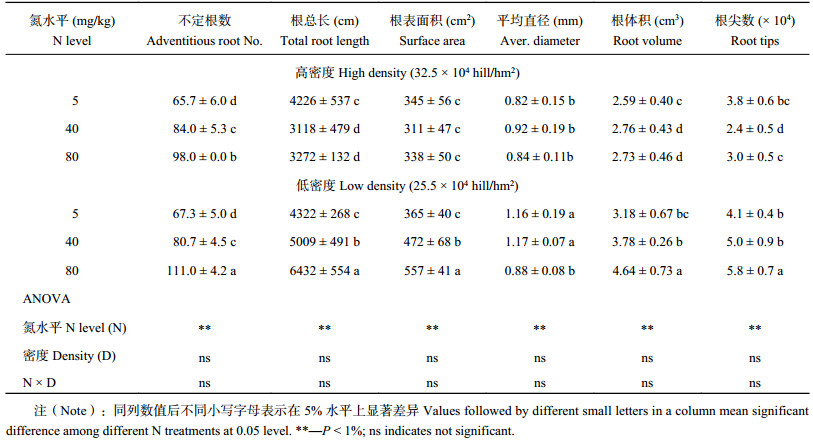 |
对苗期水稻根系的分析结果表明 (表2),随氮浓度的增加,单株的不定根数增加,且在较高氮水平时LD下单株的不定根数显著大于HD下;并且HD和LD下,单株根系形态特征存在显著差异,具体表现为:HD和LD处理的平均根总长分别为3539、5254 cm/株,平均根表面积分别为331、464 cm2/株,平均根直径分别为0.86 mm、1.07 mm,平均根系总体积分别为2.69、3.87 cm3/株,平均根尖数分别为3.07 × 104/株、5.00 × 104 /株;然而,由于单个周转箱HD下水稻的移栽数是LD下的两倍,因此从整体来看,HD下群体的根系要明显优于LD下。
| 表3 叶片生长及根系特征相关系数 (r) Table 3 Correlation coefficients (r) between leaf development and root characteristics of rice |
 |
分蘖是与水稻群体质量和籽粒产量密切相关的农艺性状[1, 15],由茎鞘基部的蘖芽发育而成,是一个可以调节的动态过程[16]。氮水平和栽培密度是影响水稻分蘖动态的两个最主要的因素[17–18]。冯来定等[19]研究表明,水稻的分蘖数与土壤NH4+含量呈显著的正相关关系,而栽培密度也是协调水稻群体的关键生产技术之一,但是,关于氮水平和栽培密度对水稻分蘖产生的研究却少见。本研究分别从水稻分蘖期的干物质生产、干物质分配、植株体内的养分含量、水稻群体冠层对光的截获及水稻根系的形态差异,综合解释氮水平及栽培密度的交互作用对水稻分蘖能力的影响。
3.1 水稻鞘养分浓度对其分蘖能力的影响在本试验中,水稻的相对分蘖速率与其鞘氮浓度、碳浓度、碳氮比之间分别呈极显著正相关关系、无相关关系、显著负相关关系。相关研究表明,茎鞘氮浓度的增加,一方面使水稻蘖芽或茎鞘基部的玉米素和植物生长素的含量增加,脱落酸的含量降低,进而促使水稻的蘖芽从休眠状态中释放得以生长[20–21];另一方面,植株体内较高的氮素含量可促进其光合产物的合成,进而为分蘖的生长提供足够的同化物,因此,植株体内的氮浓度可从激素和干物质生产两个方面调控分蘖的发生和生长。由于水稻鞘的碳氮比差异是由鞘氮浓度的差异引起的,并且有关水稻植株碳氮比对其分蘖影响的相关报道甚少,因此,鞘碳氮比与水稻相对分蘖速率关联的生理依据尚有待进一步研究。在相同氮水平下,由于HD的基础苗较多,因此,可更早更快地达到群体最大叶面积,进而造成水稻基部光强和光质的差异[22–24];此外,栽培密度能直接影响水稻主茎与其分蘖对养分吸收和空间利用的竞争关系[25],即茎鞘氮浓度与植株叶面积两者相互依赖,进而影响着水稻的分蘖动态[17]。此现象在本研究中表现为:在HD下,氮水平大于N180时,水稻单位面积分蘖的增加幅度明显变小或有下降趋势,而在LD下,当氮水平大于N270时才明显降低。
3.2 干物质生产能力对水稻分蘖能力的影响Lafarge等[26]对高粱的研究表明,同化物供给充足时便会有分蘖的发生和生长,而当同化物的供给不足时分蘖的发生将停止或已发生的分蘖将死亡。在本试验中,随氮水平的增加,水稻叶片氮浓度增加,提高了植株的光合速率,加快了干物质的生产速率[27],叶和鞘的相对生长速率逐渐增加,而水稻分蘖中期的相对分蘖速率与其叶、鞘的相对生长速率均存在显著的正相关关系。此外,随氮水平的增加,LD下叶和鞘的相对生长速率普遍大于HD下。氮水平相同时,HD和LD下植株的氮浓度无差异,因此,两者的光合速率无差异;但LD下单穴水稻对光的截获大于HD下,因此,LD下单穴水稻的干物质生产能力大于HD下,相对生长速率快,进而具有较大的相对分蘖速率和较强的分蘖能力。另外,随氮水平的增加,干物质向叶片的分配比例增大,因而,随氮水平的增加,水稻群体的叶面积指数和光能的利用率增高,干物质的生产速率增加[27–28],进而使水稻获得了较充足的干物质供其分蘖的发生和生长。
3.3 净光截获率对水稻分蘖能力的影响光能的利用是影响水稻生长的重要因素,由图2E、表3可知,HD和LD下的净光截获率存在显著差异,此时HD和LD下的平均PAR分别是39%、26%,说明两个栽培密度下水稻分蘖期对光能的利用存在显著差异。这可能是因为群体未完成建立时,植株尚未封行,水稻群体的叶面积指数随栽培密度的增加而增加[29],并将进一步从干物质的生产和水稻基部光强、光质两方面对水稻群体的分蘖产生影响。
3.4 水稻根系特征对其分蘖能力的影响根系是植物获取养分、水分、合成各种激素、有机酸、氨基酸及支撑植物的重要部位[30]。根系形态和生理特性与地上部的生长和发育密切相关[31–33]。Li[34]研究表明,水稻的蘖长在主茎上,依赖于属于自身的不定根总根长。在本试验中,水稻单株分蘖数与其不定根数呈极显著正相关关系;且HD下群体不定根数、根长等明显优于LD下。因此,两个栽培密度下根系特征的差异可以从一定程度上解释单穴 (个体) 水稻的分蘖能力的差异。
综上所述,氮水平及栽培密度通过影响水稻干物质的生产能力、干物质的分配比例、植株体内氮素浓度、群体冠层对光能的利用及根系的生长发育,影响水稻的分蘖能力。所有指标均表明,相同氮水平时,低栽培密度下个体生长优于高栽培密度下;但对于群体而言,高栽培密度下更利于高产水稻群体的建立,且需氮水平低于低栽培密度下。
| [1] | Li X, Qian Q, Fu Z, et al. Control of tillering in rice[J]. Nature, 2003, 422(6932): 618–621. DOI:10.1038/nature01518 |
| [2] | Khush G S. Green revolution: preparing for the 21st century[J]. Genome, 1999, 42(4): 646. DOI:10.1139/g99-044 |
| [3] | Conway G, Toenniessen G. Feeding the world in the twenty-first century[J]. Nature, 1999, 402(6761 Suppl.): C55–C58. |
| [4] | Stitt M, Krapp A. The interaction between elevated carbon dioxide and nitrogen nutrition: the physiological and molecular background[J]. Plant, Cell and Environment, 1999, 22: 583–621. |
| [5] | Good A G, Shrawat A K, Muench D G. Can less yield more? Is reducing nutrient input into the environment compatible with maintaining crop production?[J]. Trends in Plant Science, 2004, 9(12): 597–605. DOI:10.1016/j.tplants.2004.10.008 |
| [6] |
丁艳锋. 氮素营养调控水稻群体质量指标的研究[D]. 南京: 京农业大学博士学位论文, 1997.
Ding Y F. Regulations of rice population quality by nitrogen nutrition [D]. Nanjing: PhD Dissertation of Nanjing Agricultural University, 1997. |
| [7] | Peng, S B, Huang, J L, Zhong X H, et al. Challenge and opportunity in improving fertilizer-nitrogen use efficiency of irrigated rice in China[J]. Agricultural Sciences in China, 2002, 1(7): 776–785. |
| [8] | Roelcke M, Schleef K H, Richter J. Recent trends and recommendations for nitrogen fertilization in intensive agriculture in eastern China[J]. Pedosphere, 2004, 14(4): 449–460. |
| [9] | Chen X, Cui Z, Fan M, et al. Producing more grain with lower environmental costs[J]. Nature, 2014, 514(7523): 486. DOI:10.1038/nature13609 |
| [10] | Ju X T, Xing G X, Chen X P, et al. Reducing environmental risk by improving N management in intensive Chinese agricultural systems[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(9): 3041. DOI:10.1073/pnas.0813417106 |
| [11] |
马立珩, 张莹, 隋标, 等. 江苏省水稻过量施肥的影响因素分[J].
扬州大学学报(农业与生命科学版), 2011, 32(2): 48–52.
Ma L H, Zhang Y, Sui B, et al. The impact factors of excessive fertilization in Jiangsu Province[J]. Journal of Yangzhou University (Agricultural and Life Science Edition), 2011, 32(2): 48–52. |
| [12] | Leakey R R B. Effect of changing plant density on floral initiation and development of barley (cv. Sultan)[J]. Journal of Agricultural Science, 1971, 77(1): 135–139. DOI:10.1017/S0021859600023571 |
| [13] | Baker R J, Briggs K G. Effects of plant-density on the performance of 10 barley cultivars[J]. Crop Science, 1982, 22(6): 1164–1167. DOI:10.2135/cropsci1982.0011183X002200060018x |
| [14] |
毛达如. 植物营养研究方法[M]. 北京: 北京农业大学出版社, 1994. 16.
Mao D R. Methods of plant nutrition[M]. Beijing: Beijing Agricultural University Press, 1994. 16. |
| [15] |
凌启鸿. 作物群体质量[M]. 上海: 上海科学技术出版社, 2000.
Ling Q H. Crop population quality [M]. Shanghai: Shanghai Science and Technology Press, 2000. |
| [16] | Kariali E, Mohapatra P K. Hormonal regulation of tiller dynamics in differentially-tillering rice cultivars[J]. Plant Growth Regulation, 2007, 53(3): 215–223. DOI:10.1007/s10725-007-9221-z |
| [17] | Huang M, Yang C, Ji Q, et al. Tillering responses of rice to plant density and nitrogen rate in a subtropical environment of southern China[J]. Field Crops Research, 2013, 149(2): 187–192. |
| [18] | Fagade S O, Datta S K D. Leaf area index, tillering capacity, and grain yield of tropical rice as affected by plant density and nitrogen level[J]. Agronomy Journal, 1971, 63(3): 503–550. DOI:10.2134/agronj1971.00021962006300030047x |
| [19] |
冯来定, 蒋彭炎, 洪晓富, 等. 土壤铵态氮浓度与水稻分蘖的发生和终止的关系[J].
浙江农业学报, 1993, 5(4): 203–207.
Feng L D, Jiang P Y, Hong X F, et al. Concentrations of nitrogen in soil and growth of tillers in rice plants[J]. Acta Agriculturae Zhejiangensis, 1993, 5(4): 203–207. |
| [20] | Liu Y, Ding Y, Wang Q, et al. Effects of nitrogen and 6-benzylaminopurine on rice tiller bud growth and changes in endogenous hormones and nitrogen[J]. Crop Science, 2011, 51(2): 786–792. DOI:10.2135/cropsci2010.04.0217 |
| [21] | Jiang P, Ma Y. Studies on the sensitive stage to environment during differentiation and development of tiller buds in rice plant[J]. Acta Agronomica Sinica, 1994, 20: 290–296. |
| [22] | Kirby E J M, Faris D G. The effect of plant density on tiller growth and morphology in barley[J]. The Journal of Agricultural Science, 1972, 78(2): 281–288. DOI:10.1017/S0021859600069124 |
| [23] | Masle J. Competition among tillers in winter wheat: consequences for growth and development of the crop [A]. Day W, Atkin R K. Wheat Growth and Modeling[M]. New York: Plennm Press, 1985. 5821–5828. |
| [24] | Power J, Alessi J. Tiller development and yield of standard and semidwarf spring wheat varieties as affected by nitrogen fertilizer[J]. The Journal of Agricultural Science, 1978, 90(1): 97–108. DOI:10.1017/S0021859600048632 |
| [25] | Nagai I. Japonica rice: its breeding and culture [M]. Tokyo: Yokendo Ltd. 1959. |
| [26] | Lafarge T, Hammer G. Predicting plant leaf area production: shoot assimilate accumulation and partitioning, and leaf area ratio, are stable for a wide range of sorghum population densities[J]. Field Crops Research, 2002, 77(2): 137–151. |
| [27] | Li Y, Gao Y, Xu X, et al. Light-saturated photosynthetic rate in high-nitrogen rice (Oryza sativaL.) leaves is related to chloroplastic CO2 concentration [J]. Journal o Experimental Botany, 2009, 60(8): 2351–2360. DOI:10.1093/jxb/erp127 |
| [28] | Lafarge T, Broad I, Hammer G. Tillering in grain sorghum over a wide range of population densities: identification of a common hierarchy for tiller emergence, leaf area development and fertility[J]. Annals of Botany, 2002, 90(1): 87–98. DOI:10.1093/aob/mcf152 |
| [29] |
刘文祥, 青先国, 艾治勇. 氮肥和密度对双季杂交稻干物质 累和产量的影响[J].
生态学杂志, 2012, 31(12): 3094–3101.
Liu W X, Qing X G, Ai Z Y. Effects of nitrogen fertilization rate and transplanting density on the dry matter accumulation and grain yield of double season rice[J]. Chinese Journal of Ecology, 2012, 31(12): 3094–3101. |
| [30] | Yang C, Yang L, Yang Y, Ouyang Z. Rice root growth and nutrient uptake as influenced by organic manure in continuously and alternately flooded paddy soils[J]. Agricultural Water Management, 2004, 70(1): 67–81. DOI:10.1016/j.agwat.2004.05.003 |
| [31] | Bazzaz F A, Ackerly D D, Reekie E G. Reproductive allocation in plants[A]. Fenner M. Seeds: The ecology of regeneration in plant communities[M]. Wallingford, Oxfordshire, UK: CAB International, 2000. 1–29. |
| [32] | Waines J G, Ehdaie B. Domestication and crop physiology: roots of green-revolution wheat[J]. Annals of Botany, 2007, 100(5): 991–998. DOI:10.1093/aob/mcm180 |
| [33] | Yang L, Wang Y, Kobayashi K, et al. Seasonal changes in the effects of free-air CO2 enrichment (FACE) on growth, morphology and physiology of rice root at three levels of nitrogen fertilization [J]. Global Change Biology, 2008, 14(8): 1844–1853. DOI:10.1111/gcb.2008.14.issue-8 |
| [34] | Li Y H. Morphology and anatomy of grass family crops[M]. Shanghai: Shanghai Science and Technology Press, 1979, 138–142. |
 2018, Vol. 24
2018, Vol. 24  doi:
doi: 

