氮素是果树必需矿质元素中的核心元素,对果实产量形成和品质提高具有重要作用[1]。氮素示踪研究表明,早春苹果根系从土壤中摄取的氮素极少,从花期到采收前这段时期则是当年施氮肥发挥效用的有效期。目前我国苹果生产上氮肥施用标准不明确,多采用早春一次性大量施氮或关键物候期大量追氮方式。早春大量施氮前期根层氮素浓度高,随时间延长后期易出现氮肥供应不足。而花期至采收前恰逢夏季多雨期,氮肥淋失风险大,此期再大量追氮易造成根层氮素浓度的剧烈变化。这些施氮方式下氮素利用率低、树体贮藏营养不足,导致产量不稳、果品质量下降[2–3]。近年来,总量控制分期调控、缓控释氮肥及水肥一体化等技术逐渐在果园中得到应用,通过调控根层氮素浓度,直接或间接实现了氮素养分的稳定供应,有效减少了氮素损失,提高了氮素利用率[4–5],但这种养分稳定供应方式对果树生长及养分吸收具体的效用机理缺乏深层次的分析。
近年来,关于根层氮素浓度与植株生长发育的关系引起了科研人员的重点关注。局部供应低浓度NO3– 刺激拟南芥侧根生长,高浓度NO3– 抑制侧根发育[6]。与高氮相比,低NO3– 胁迫下油菜幼苗氮素和干物质累积量显著下降,但氮素利用效率显著升高[7]。苹果是喜硝植物,NO3–不仅对苹果的生长起营养作用,还可作为信号物质调控苹果的代谢与发育过程。苹果吸收NO3– 后,绝大部分需要在叶片中同化,硝酸盐在硝酸还原酶 (nitrate reductase, NR) 和亚硝酸还原酶 (nitrite reductase, NiR) 的共同作用下转变为铵,合成氨基酸和核苷酸等成分,并进一步影响植物碳素代谢过程。NR是氮素同化过程中控制反应重要的限速酶,在NR缺失突变体的烟草中发现,植株NR活性低,地上部NO3– 积累导致地上部及根系的相对生长速率均受到影响[8],说明植物生长不仅受外源NO3– 水平的影响,还受自身氮素营养状况的调节,其中NR活性的变化起着决定性的调节作用[9]。因此,研究苹果植株氮素吸收、体内NO3– 含量及NR活性的关系,对阐明不同供氮浓度对苹果生长的生理机制具有重要意义。
高产、稳产和优质是苹果栽培管理的核心,而根层氮素供应浓度的高低及稳定程度是造成低产和高产苹果园产量差异的关键因素[10],因此保证苹果关键物候期根层氮素供应稳定、充足而不过量既是保障高产苹果氮素需求的关键,又是降低氮素向环境损失的核心。目前,在苹果上关于施氮效应的评价体系不够健全,以往的研究多以产量和品质为评价指标集中在不同施氮期[11–12]及施氮量[2–3]对苹果氮素利用率、产量、品质及土壤质量[13]、环境污染[14]等方面,而关于根层氮素浓度及稳定程度对苹果根系及地上部生长发育的研究较少,苹果植株在不同NO3– 供应条件下响应的生理机制尚不明确。因此,本试验以M9T337矮化自根砧苹果幼苗为试材,采用 15N同位素示踪及非损伤微测技术,并设置不同氮素浓度变换方式,分析比较了苹果幼苗在不同氮素供应水平及氮素稳定与非稳定供应方式下根系形态、地上部生长及氮素吸收利用的生理差异,旨在明确苹果植株在不同氮素供应条件下响应的生理机制,从而丰富苹果氮素需求理论,并为果树生产上氮素适量稳定供应方式的效用机理提供理论依据。
1 材料与方法 1.1 试验材料与设计供试苹果试材为M9T337矮化自根砧幼苗。将长至6片真叶左右的幼苗定植于泡沫板上,每板15孔,每孔定植1株,每盆加入营养液2 L。先用1/2浓度Hoagland营养液培养7 d,然后转入全浓度Hoagland营养液,每隔2 d换一次营养液,每日定时通气。待幼苗长至 10片真叶左右时,选取生长一致的幼苗用蒸馏水进行饥饿处理7 d,以消耗幼苗中积累的硝态氮。
正式试验后采用全硝态氮[Ca(15NO3)2,上海化工研究院生产,丰度为10.16%]为唯一氮源。根据预试验设计的硝态氮浓度 (0、2.5、5、10和20 mmol/L) 处理后,5 mmol/L硝态氮处理下苹果幼苗长势最好,因此适宜供氮浓度设为5 mmol/L。设置5个供氮方式:1) 先用0.5 mmol/L NO3– 培养10 d,然后更换为25 mmol/L NO3– 再培养10 d (即,NO3– 浓度由低变高处理,N1);2) 先用25 mmol/L NO3– 培养10 d,然后更换为0.5 mmol/L NO3– 再培养10 d (即,NO3– 浓度由高变低处理,N2);3)5 mmol/L NO3– 持续培养20 d (即,适宜稳定供氮处理,N3);4) 0.5 mmol/L NO3– 持续培养20 d (即,持续低氮处理,N4);5) 25 mmol/L NO3– 持续培养20 d (即,持续高氮处理,N5)。在低浓度硝酸盐处理中,用CaCl2将Ca2+ 补充到和5 mmol/L NO3– 处理相同的钙水平[15]。每个处理6次重复,每个处理各90株幼苗。每隔2 d换一次营养液,试验所用溶液均用蒸馏水配制,用H3PO4或NaOH将营养液pH调至6.0 ± 0.1,每个处理均加硝化抑制剂双氰胺。人工气候室培养条件为14 h光照 (22℃),10 h黑暗 (18℃),相对湿度约75%,冠层光强600 μmol/(m2·s)。
分别于处理后第11 d (变换浓度后第1 d) 和第20 d (变换浓度后第10 d) 分析各处理 15N吸收、利用状况,根系形态指标、根系NO3– 吸收流量及根系和叶片硝态氮含量,每隔4 d测定幼苗根系和叶片硝酸还原酶 (NR) 活性。
1.2 样品采集与测定 1.2.1 植株解析样品测定将苹果幼苗解析成根、茎、叶三部分,放入牛皮纸信封105℃杀青30 min,80℃烘干至恒重,用万分之一电子天平称量各器官的干物质量,并计算根冠比。随后用不锈钢电磨粉碎,过0.25 mm筛后测定各器官 15N丰度和器官全氮量。全氮用凯氏定氮法测定,15N丰度在中国农业科学院原子能利用研究所用MAT-251质谱仪 (美国菲尼根公司) 测定。
1.2.2 根系形态指标测定根系经清水冲洗后用透射扫描仪 (ESPON Perfection V750) 对根系样品进行扫描,获取单株幼苗根系图像,再利用WinRHIZO(Regent Instruments Inu.,加拿大) 根系分析软件进行根系长度、根系表面积、根尖数分析。
1.2.3 硝酸还原酶 (NR) 活性及硝态氮含量测定根系和叶片硝酸还原酶 (NR) 活性参照李合生[16]的方法测定,硝态氮含量采用任同辉[17]的水杨酸比色法。
1.2.4 根系NO3– 吸收流量的测定采用非损伤微测技术测定了不同处理苹果幼苗根系NO3– 动态流量。选取幼苗距根尖2~3 cm白色吸收根用小玻璃块固定好浸泡于含10 mL测试液 [0.25 mmol/L KNO3、0.625 mmol/L KH2PO4、0.5 mmol/L MgSO4、0.25 mmol /L Ca(NO3)2、pH 6.0] 的培养皿中进行30 mim的平衡处理。待根部表面NO3– 流速稳定后将电极尖端置于距离根表面10 μm,在垂直于根表面的方向从根尖开始沿根轴向上进行测试,每个测试点测1~2 min,10 min后待流速稳定后结束测试[18–19],获得稳定的离子流速,每个处理重复测定3次。不同处理经测定,约距根尖12 mm左右根毛密集区NO3– 的离子流速最大,故在此处每个样品再随机选择3个点进行重复测试及数据采集,此处每个处理检测6个样品,每个样品稳定测量16 min。
测试完成后数据分析采用旭月公研发的数据分析软件Mageflux进行,将结果代入Fick第一扩散定律公式J = –D (dc/dx) 制作的流速换算表 (Jcal V3. 3),流速值J正值为外流,负值为内流。
1.3 数据处理主要计算公式:
Ndff (%) = [植物样品中 15N丰度 (%) – 自然丰度 (%)]/[肥料中 15N丰度 (%) – 自然丰度 (%)] × 100;
器官全氮量 (g) = 器官生物量 (g) × 氮含量 (%);
器官 15N吸收量 (g) = Ndff × 器官全氮量 (g)。
采用Excel 2003对数据进行统计分析,采用DPS7.05数据处理系统进行单因素方差分析,多重比较采用LSD法。利用Excel 2003软件作图,图表中数据为平均值 ± 标准差。
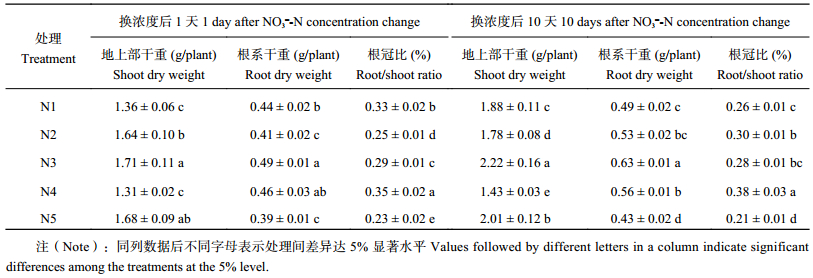
2 结果与分析 2.1 供氮浓度变化对苹果矮化砧M9T337幼苗生长的影响表1表明,不同处理11 d后 (即NO3– 浓度变换1 d后),苹果幼苗地上部干重以N3处理最高,其次为N5处理,两处理间差异不显著。N1和N4处理地上部干重显著低于其他处理。N1、N2、N4和N5处理根系干重分别比N3处理低11.4%、19.5%、6.5%和25.6%,幼苗根冠比随供氮浓度的增加显著降低,差异达显著水平。不同处理20 d后 (即NO3– 浓度变换10 d后),苹果幼苗地上部干重为N3 > N5 > N1 > N2 > N4。与N3处理相比,N1、N2、N4及N5处理根系干重分别降低了28.6%、18.9%、12.5%和46.5%。幼苗根冠比以N4处理最大,其次为N2处理,最小的为N5处理。
随处理时间的延长,各处理生物量的变化不仅体现在总量上,也表现在其增量的比例上。两次取样间隔内,N1、N2、N3、N4和N5处理苹果幼苗地上部生物量的增幅分别为38.8%、8.5%、29.8%、9.4%和19.6%,而根系生物量增幅则以N2处理最大,N5处理最小。幼苗根冠比也表现为N4处理下越大,N5处理下越低的趋势,说明增加NO3– 浓度促进苹果幼苗地上部生长,降低根系生物量。
| 表1 不同供氮水平和稳定性下苹果矮化砧M9T337幼苗地上部干重、根系干重及根冠比 Table 1 The dry weight of shoot and root and root/shoot ratio of M9T337 dwarf rootstocks seedlings under different nitrogen concentrations and stabilities |
 |
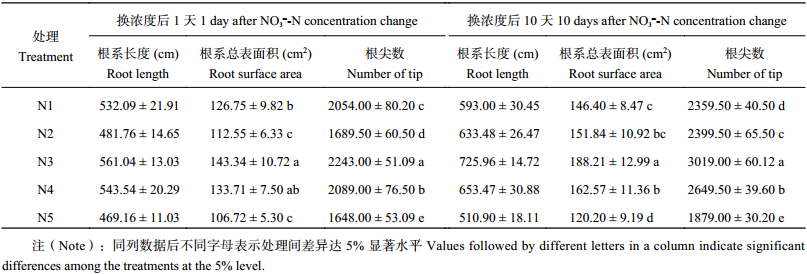
在影响植株对硝酸盐吸收能力方面,根系形态特征对氮素的获取起重要作用。不同NO3– 供应条件对苹果幼苗根系生长影响的差异较大 (表2)。整个处理期间,均以N3处理根系长度、总表面积最大,根尖数最多,其次为N4处理,最小的为N5处理。NO3– 浓度变换1 d后,N1处理根系长度和总表面积与N4处理差异不显著,但均显著高于N2处理。随处理时间的延长,浓度变换对苹果幼苗根系生长的影响加大。NO3– 浓度变换10 d后,N1处理根系长度、总表面积及根尖数均小于N4和N2处理,且与N4处理间差异达显著水平。与NO3– 浓度变换1 d时相比,N2处理的根系长度、总表面积及根尖数增幅最大,分别为31.5%、34.9%和42.0%,增幅最小的为N5处理,分别为8.9%、12.6%和14.0%。说明苹果幼苗根系通过感受外界NO3– 浓度变化做出反应,低氮下促进根系生长,而高氮处理时间越长越不利于其根系的生长。
| 表2 不同供氮水平和稳定性下苹果幼苗根系长度、根系总表面积及根尖数 Table 2 The root length, root surface area and tip quantity of M9T337 dwarf rootstocks seedlings under different nitrogen concentrations and stabilities |
 |
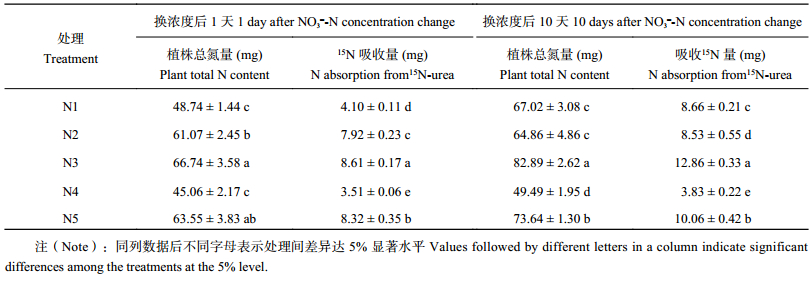
由表3可知,不同处理11 d后 (即NO3– 浓度变换1 d后),随外界NO3– 浓度的增加,苹果幼苗总氮量和 15N吸收量增加,在N3处理下累积到最大值,分别为66.74 mg和8.61 mg。N5处理下幼苗总氮量和N3处理间差异不显著,而 15N吸收量显著小于N3处理,表明过量施氮下幼苗氮素吸收量并非与施氮量成正比增加。与N4处理相比,N1处理幼苗总氮量及 15N吸收量分别增加了8.2%和16.8%。N2与N5处理相比,幼苗总氮量差异不显著,15N吸收量降低了5.0%,但两者总氮量和 15N吸收量均显著高于N1和N4处理。
不同处理20 d后 (即NO3– 浓度变换10 d后),N1处理总氮量和N2处理间无显著差异,但比N4处理高35.4%。N2处理下幼苗总氮量比N5处理低13.9%,15N吸收量趋势相同。两次取样间隔内,以N1处理的幼苗总氮量增幅最大,为37.5%,其次为N3处理,增幅最小的为N2处理,15N吸收量也呈相同趋势。此时幼苗总氮量及 15N吸收量仍以N3处理最高,N4处理最低,且与其他处理间差异达显著水平。由此可见,低氮胁迫后大量增加NO3– 浓度在一定时间内虽会显著促进苹果幼苗对氮素的吸收,但始终以适宜稳定供氮处理最有利于幼苗总氮量的积累及氮素吸收量的持续增加,而低氮处理时间越长越不利于苹果幼苗对氮素的吸收。
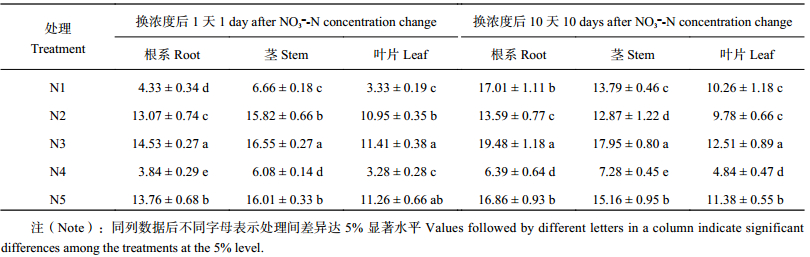
2.3.2 供氮浓度变化对苹果矮化砧M9T337幼苗各器官Ndff的影响Ndff是指植株器官从肥料 15N中吸收分配到的 15N量对该器官全氮量的贡献率,它反映了植株器官对肥料 15N的吸收征调能力。表4表明,NO3– 浓度变换1 d后,N3处理下苹果幼苗各器官Ndff值最高,其次为N5处理,最低的为N4处理,N3和N5处理间叶片Ndff值差异不显著。与N4处理相比,N1处理根系和茎部Ndff值分别增加12.76%和9.5%,叶片Ndff值无显著差异。N2处理根系Ndff值比N5处理降低了5.3%,茎部和叶片Ndff值差异不显著。表明大幅度变换NO3– 浓度1 d主要影响苹果幼苗根系的氮素吸收征调能力,而对茎部和叶片的影响较小。
随处理时间的延长,NO3– 浓度变换对苹果幼苗各器官Ndff值均产生较大影响。NO3– 浓度变换10 d后,N1处理根系、茎部和叶片Ndff值分别是N4处理的2.66、1.89和2.12倍。与N5处理相比,N2处理根系、茎部和叶片Ndff值分别降低了24.1%、17.8%和16.4%,差异均达显著水平。N3处理下幼苗各器官Ndff值显著高于其他处理,说明适宜稳定供氮下苹果幼苗各器官始终保持最高的氮素吸收征调能力。
| 表3 不同供氮水平和稳定性下苹果幼苗总氮量及15N吸收量 Table 3 The total N content and 15N absorption of M9T337 dwarf rootstocks seedlings under different nitrogen concentrations and stabilities |
 |
| 表4 不同供氮水平和稳定性下苹果幼苗各器官Ndff (%) Table 4 The Ndff values in different organs of M9T337 dwarf rootstocks seedlings under different nitrogen concentrations and stabilities |
 |
采用非损伤微测技术测定了不同NO3– 浓度及变换NO3– 浓度后不同时间苹果幼苗根系NO3– 的流量变化情况。从图1可以看出,NO3– 浓度变换1 d时以N1处理的苹果幼苗根系NO3– 平均吸收速率最大,为46.37 pmol/(cm2·s),其次为N3处理,两处理间无显著差异,N5处理最低。NO3– 浓度变换10 d后,其NO3– 平均吸收速率则以N3处理最高,N2处理次之,最低的为N5处理,此时N5处理根系NO3– 流量显示为外排。NO3– 浓度变换10 d与1 d相比,N4及N2处理苹果幼苗根系NO3– 流量分别增加了20.83%和16.1%,而N1处理则降低了62.0%。由此可见,短时间内大幅度增加NO3– 浓度虽会显著改善植株氮素吸收状况,但高氮处理时间越长,根系NO3– 吸收速率下降越快,甚至会由吸收变为外排,适宜稳定供氮处理则始终保持较高的NO3– 吸收速率。
2.5 供氮浓度变化对苹果矮化砧M9T337幼苗根系及叶片硝态氮含量的影响图2表明,不同处理第11 d (即NO3– 浓度变换1 d后) 苹果幼苗根系和叶片硝态氮含量在N5处理下达到最大值,分别为460.92 μg/g FW和325.70 μg/g FW,其次为N3处理,两处理间无显著差异,最小的为N4处理。说明增施硝态氮肥可提高苹果体内硝态氮含量,但其含量不同硝态氮施用量成比例增加。与N4处理相比,N1处理幼苗根系和叶片硝态氮含量分别增加了15.4%和8.2%。N2处理幼苗根系硝态氮含量比N5处理降低了9.6%,而叶片硝态氮含量无显著差异。可见,提高NO3– 浓度1 d后苹果幼苗根系和叶片硝态氮含量均会增加,而降低NO3– 浓度1 d后对叶片硝态氮含量影响较小。
不同处理第20 d (即NO3– 浓度变换10 d后),与N4处理相比,N1处理幼苗根系和叶片硝态氮含量增幅分别为52.6%和42.9%。N2处理下幼苗根系和叶片硝态氮含量分别比N5处理低22.3%和31.6%。说明随处理时间的延长,NO3– 浓度变换对苹果幼苗体内硝态氮含量的影响显著增大,增加NO3– 浓度促进幼苗体内硝态氮含量积累,降低NO3– 浓度则抑制其对硝酸盐的吸收。此时,根系硝态氮含量仍以N3处理最大,N5处理次之,N4处理最小。叶片硝态氮含量则以N5处理最大,N3处理显著低于N5处理,表明适宜稳定供氮处理下叶片硝态氮可能同化为其他形态氮素,而持续过高硝态氮供应造成硝态氮在叶片的累积。试验还发现,不同处理20 d与11 d时相比,N2、N3、N4和N5处理下叶片硝态氮含量均有所下降,以N5处理降幅最小,仅降低了4.8%,而N1处理叶片硝态氮含量则增加了24.8%。
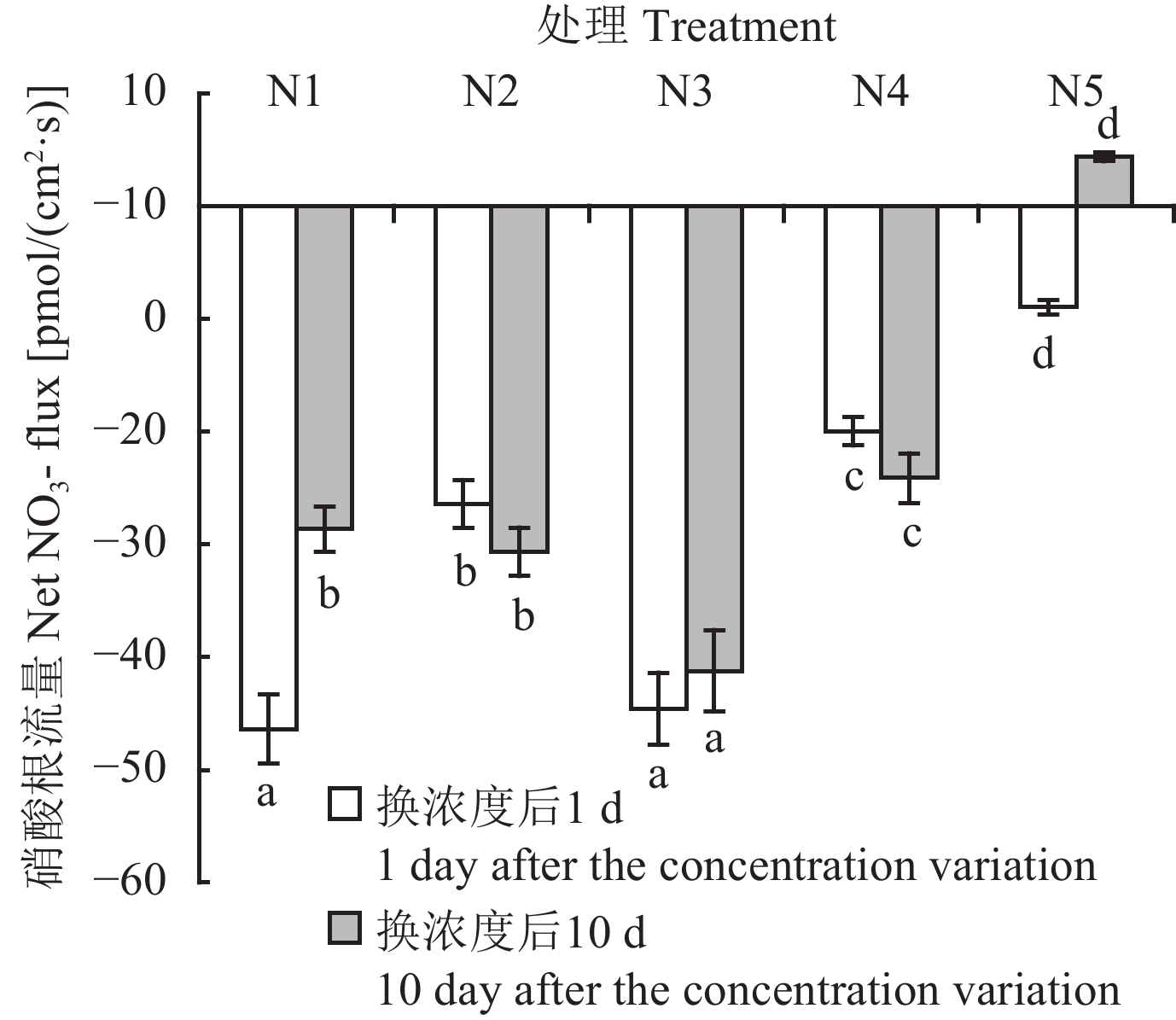 |
| 图1 不同供氮水平和稳定性下苹果矮化砧M9T337幼苗根部NO3–流量 Fig. 1 The NO3– uptake flux in roots of M9T337 dwarf rootstocks seedlings under different nitrogen concentrations and stabilities [注(Note):方柱下或上不同字母表示不同处理间在5%水平差异显著 Different letters below or above the bars indicate significantly different among different treatments at the 5% level.] |
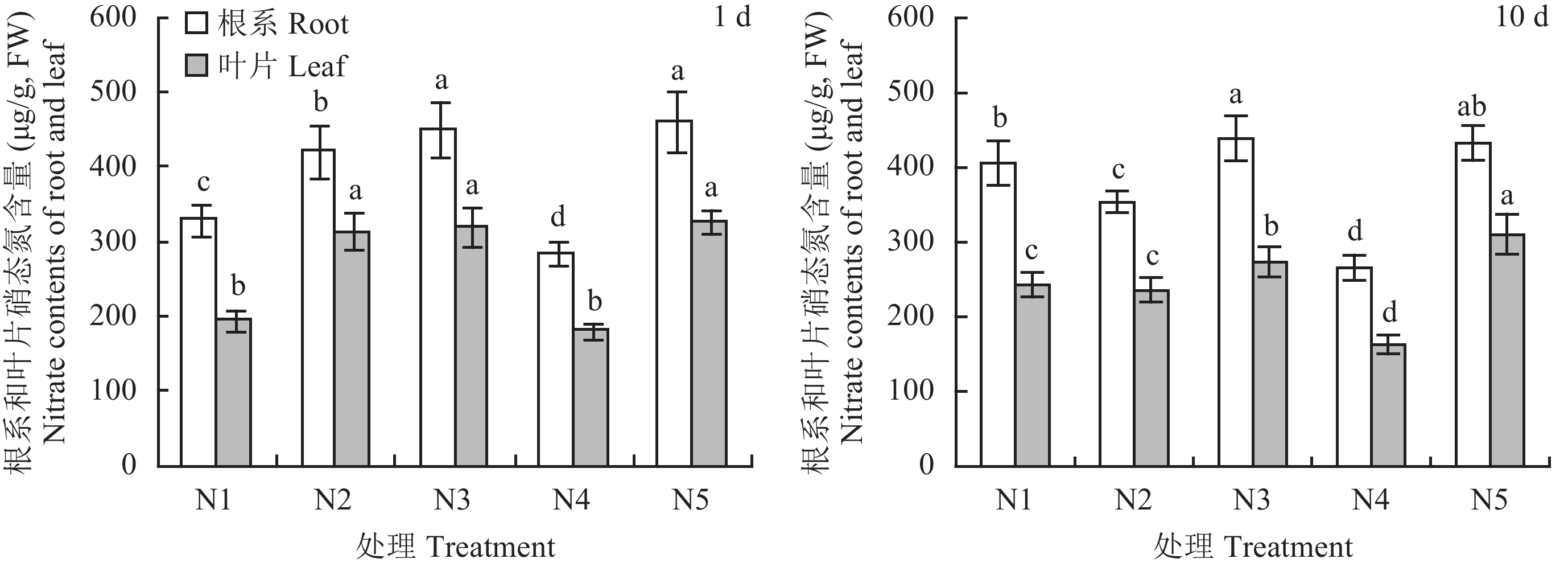 |
| 图2 NO3–-N浓度变化1 d 及10 d 后苹果矮化砧M9T337幼苗根系及叶片硝态氮含量 Fig. 2 NO3– contents in the roots and leaves at 1 day and 10 days after changing NO3–-N concentration for M9T337 dwarf rootstocks seedlings [注(Note):柱上不同字母表示不同处理间在5%水平差异显著Different letters above the bars indicate significantly different among different treatments at the 5% level.] |
苹果幼苗经硝酸盐饥饿处理后体内硝态氮含量较低,转移到全硝态氮营养液后迅速吸收硝态氮,从而诱导NR活性的提高。由图3可知,N4处理根系NR活性一直显著低于其他处理,且在处理期间变化幅度最小。各处理根系NR活性在第4 d时快速上升,并在第8 d时均达到最大值,其大小为N5 > N2 > N3 > N4 > N1。NO 3– 浓度变换后对幼苗根系NR活性影响较大,处理12 d后,N1处理根系NR活性显著增大,N2处理根系NR活性则显著降低,至处理第16 d时,根系NR活性大小为N1 > N5 > N3 > N2 > N4,N3和N5间差异不显著,其他处理间差异显著。处理第20 d时除N1处理外,其他处理间无显著差异。综上表明,苹果幼苗根系NR活性受生长介质中NO 3– 浓度的制约,一定处理时间内,NO3– 浓度与其NR活性呈正相关。
各处理叶片NR活性与根系变化趋势不同,不同NO3– 水平对叶片NR活性的影响因处理时间长短而异。不同NO3– 水平处理4 d后,各处理叶片NR活性上升到最大值,大小为N5 > N2 > N3 > N4 > N1,随后各处理叶片NR活性逐渐下降,至处理第8 d时各处理间无显著差异。处理12 d后,N2处理叶片NR活性一直降低,其他处理叶片NR活性则又逐渐上升,至处理第16 d时,N1和N3处理叶片NR活性显著高于其他处理,且两者之间无显著差异。随后各处理叶片NR活性均逐渐降低,至处理第20 d时,各处理叶片NR活性大小顺序为N3 > N1 > N5 > N2 > N4。可见随处理时间的延长,适宜稳定供氮处理越有利于叶片NR活性的提高。
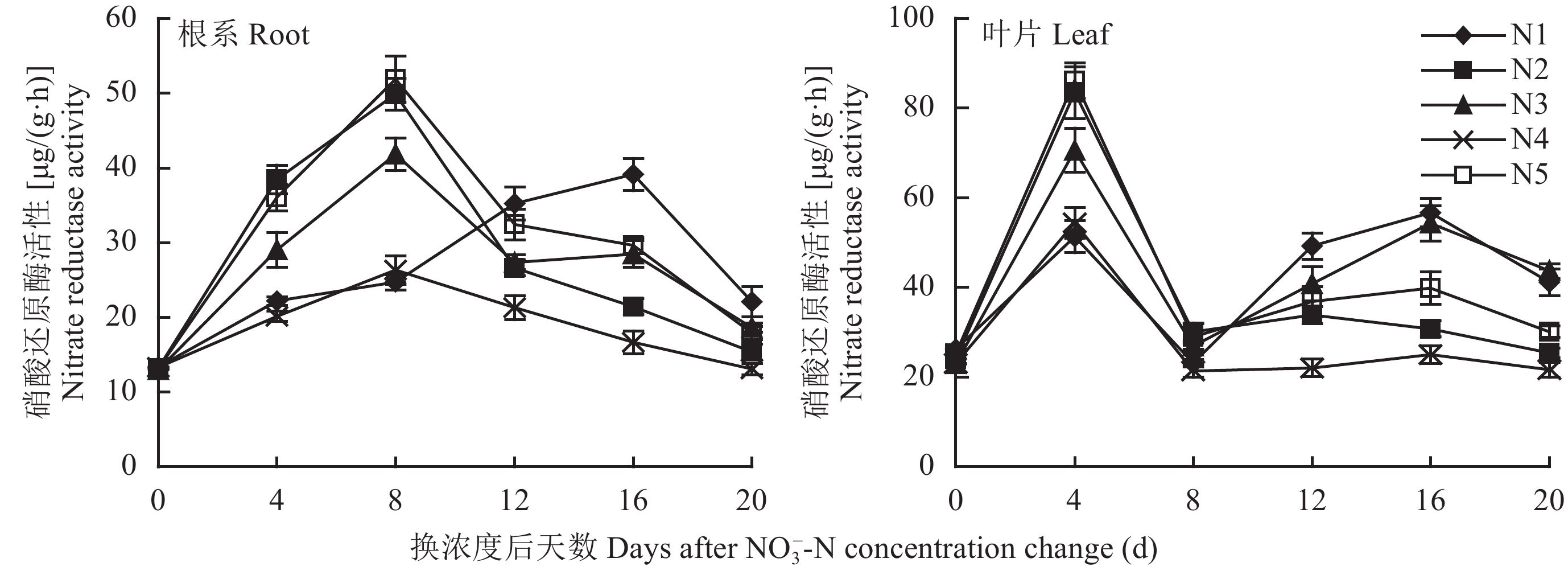 |
| 图3 不同供氮水平和稳定性下苹果矮化砧M9T337幼苗根系及叶片硝酸还原酶活性 Fig. 3 Nitrate reductase activities in root and leaves of M9T337 dwarf rootstocks seedlings under different nitrogen concentrations and stabilities |
已有研究表明,施氮可以促进植物的生长,且对地上部生长的促进作用优于根系[20]。本研究高氮处理下苹果幼苗地上部生物量显著高于低氮处理,NO3– 浓度由低变高后地上部干物质积累量的大幅增加更体现出与前人研究结果的一致性。但苹果幼苗生物量并未随施氮量的增加呈正比增加,至处理结束时,持续高氮及NO3– 浓度由低变高处理地上部干重显著低于适宜稳定供氮处理。在玉米幼苗上也发现,超过一定浓度NO3– 后,地上部生物量不受NO3– 水平的影响[15],与生产上过多施用氮肥作物产量反而降低及“报酬递减率”现象结果相似。低氮处理下由于供氮不足导致植物体内蛋白质合成量降低,细胞分裂减慢,造成地上部生长受阻[21–22],NO3– 浓度由高变低后幼苗地上部干重增幅最小进一步体现出低氮对植物生长的抑制作用。
植物遇到养分供应强度的改变首先会调节根系的生长及生理学反应,根系形态的适应性变化无疑是最重要的[23]。根据Ingestad等[24]的植物稳态矿质营养理论,养分适量稳定供应下可实现植物最适生长。适宜稳定供氮处理下苹果幼苗地上部生物量最大,同时根系各形态指标也显著高于其他处理,充分挖掘了苹果幼苗的生长潜力。持续低氮处理根长、根系总表面积及根尖数显著高于高氮处理,NO3– 浓度由高变低后苹果幼苗根系生长增幅也最为明显,说明供氮不足情况下植物会通过促进根系的生长,来提高对养分的吸收。低氮处理下苹果幼苗地上部干重明显下降,而根系干重的相对增加导致根冠比增大,这与孙虎威等[21]在水稻、郭芸珲等[25]在菊花上的研究结果一致。
在拟南芥上研究表明,高浓度NO3– 抑制侧根生长,但一定时间内把高浓度NO3– 培养下的植株材料换到低浓度NO3– 下培养可解除这种抑制效应[26]。本试验中也发现NO3– 浓度由高变低10 d后苹果幼苗根长、根系总表面积及根尖数分别增加了31.5%、34.9%和42.0%,增幅显著高于其他处理。Zhang等认为高浓度NO3– 下植株地上部硝态氮累积产生长距离信号抑制了根系的生长[6]。而李晶等[3]研究表明,过量施氮下大量盈余NO3– 会持续刺激细胞分裂素含量增加,拮抗生长素,显著降低根中3-吲哚乙酸含量和促进乙烯的产生[27–28],从而抑制幼苗根系的生长。本试验持续高氮处理下叶片硝态氮含量始终最高可能是其抑制根系生长的一个因素,NO3– 浓度由低变高后苹果幼苗根系生长逐渐受抑,但其叶片硝态氮含量显著低于持续高氮及适宜稳定供氮处理,其抑制根系生长的机理还需进一步研究。
3.2 供氮浓度变化对苹果矮化砧M9T337幼苗氮素吸收、利用的影响同一物种,pH等条件一致情况下,外源氮浓度是影响氮吸收的主要因素之一[29],但NO3– 吸收速率也受植物体内氮状况的调节。向氮饥饿的大麦幼苗中供应NO3–,根中NO3– 流入速度迅速增加,十几小时后达到高峰,随着根中NO3– 浓度的增加,NO3– 的流入速率下降,推测认为植株的氮营养状况对NO3– 的吸收起负反馈调节作用[30]。本试验中NO3– 浓度由低变高24 h后苹果幼苗根毛密集区NO3– 吸收速率最高,而NO3– 浓度增加10 d后与24 h时相比,其NO3– 吸收速率降低了62.0%,降幅最大,持续高氮处理20 d后NO3–流量变为外排。Lainé等发现NO3–吸收速率受植株内部含氮化合物浓度的影响,与地上部NO3–浓度呈负相关[31]。试验期间持续高氮处理下叶片硝态氮含量始终最大,NO3– 浓度由低变高10 d后其叶片硝态氮含量增幅也最高,这可能是导致高氮处理时间越长,根系NO3– 吸收速率下降越快的原因之一,植株体内NO3– 浓度的增加逐渐对NO3– 吸收产生了负反馈调节作用。
在杨树上发现,将高氮处理下幼苗转移到低氮培养基中24 h后,根系NO3–流速由外排转为吸收[32]。本试验NO3– 浓度由高变低后根系NO3– 吸收速率也显著高于持续高氮处理,且随处理时间的延长,其NO3– 吸收速率有所提高,这可能是植物在感受外界低NO3– 浓度后通过促进根系生长,提高根系NO3– 吸收速率来促进氮素吸收的一种响应机制。但供氮不足始终限制了幼苗对氮素的吸收,从而导致持续低氮处理下幼苗总氮量及 15N吸收量最小,NO3– 浓度由高变低后幼苗总氮量及 15N吸收量的增幅也显著小于其他处理,不利于苹果幼苗氮素营养。处理期间适宜稳定供氮处理苹果根系NO3– 吸收速率一直保持在较高水平,同时各器官Ndff值最大,从而提高了对氮素吸收征调能力,因而其总氮量及 15N吸收量最高。
硝酸还原酶 (NR) 由外源NO3– 诱导产生,其活性受介质中NO3– 浓度影响[33]。处理16 d内,苹果幼苗根系NR活性与NO3– 浓度呈正相关,而持续高氮处理叶片NR活性在处理12 d后低于适宜稳定供氮处理,至处理第16 d时低36.1%,处理20 d时以适宜稳定供氮处理叶片NR活性最大。说明随处理时间延长,过量施氮会抑制叶片NR活性,适宜施氮则有利于叶片NR活性的提高,与王雨等在菘蓝幼苗上研究结果一致[34]。叶片是NO3– 还原的主要场所,培养中后期,叶片NR活性较高,叶片硝态氮含量降低,且根系保持较高的NO3– 吸收速率,说明植物吸收的大部分无机氮已转变为其他形态氮素,可见适宜稳定供氮能促进苹果幼苗氮素的吸收与同化。处理中后期持续高氮处理叶片NR活性降低,阻碍了NO3– 同化还原,NO3– 在叶片积累,从而不利于幼苗对NO3– 的吸收转化。至处理20 d时,持续高氮处理幼苗总氮量及 15N吸收量分别比适宜稳定供氮处理低12.6%和27.8%,这可能是高氮处理逐渐抑制植株氮素吸收的一个重要原因。本研究分析比较了不同氮素供应条件下苹果苗期生长与氮素吸收的生理差异,以期为生产上氮素适宜稳定供应方式的效应机理提供科学参考,其结果还需在大田试验条件下进行验证,以提高试验结果的可靠性。
4 结论随时间延长,供氮不足限制幼苗氮素吸收,主要抑制地上部生长。供氮过量导致硝态氮在叶片累积,氮素同化及根系生长受抑。适宜稳定供氮处理通过保持较高的NO3– 吸收速率和Ndff值,促进根系对氮素吸收。同时逐渐提高叶片NR活性,促进体内硝态氮同化,达到对氮素的高效吸收利用,从而实现苹果幼苗最适生长。
| [1] |
李文庆, 张民, 束怀瑞. 氮素在果树上的生理作用[J].
山东农业大学学报 (自然科学版), 2002, 33(1): 96–100.
Li W Q, Zhang M, Shu H R. The physiological effects of nitrogen on fruit trees[J]. Journal of Shandong Agricultural University (Natural Science Edition), 2002, 33(1): 96–100. |
| [2] |
李洪娜, 许海港, 任饴华, 等. 不同施氮水平对矮化富士苹果幼树生长、氮素利用及内源激素含量的影响[J].
植物营养与肥料学报, 2015, 21(5): 1304–1311.
Li H N, Xu H G, Ren Y H, et al. Effect of different N application rates on plant growth, 15N-urea utilization and hormone content of dwarf apple trees [J]. Journal of Plant Nutrition and Fertilizer, 2015, 21(5): 1304–1311. DOI:10.11674/zwyf.2015.0525 |
| [3] |
李晶, 姜远茂, 魏绍冲, 等. 不同施氮水平苹果矮化中间砧幼树光合产物的周年分配利用[J].
植物营养与肥料学报, 2015, 21(3): 800–806.
Li J, Jiang Y M, Wei S C, et al. Annual utilization and allocation of urea-13C by M. hupehensis Rehd. under different N rates [J]. Journal of Plant Nutrition and Fertilizer, 2015, 21(3): 800–806. DOI:10.11674/zwyf.2015.0328 |
| [4] | Neilsen D, Neilsen G H. Efficient use of nitrogen and water in high-density apple orchards[J]. Hort Technology, 2002, 12(1): 19–25. |
| [5] |
丁宁, 彭玲, 安欣, 等. 不同时期施氮矮化苹果对15N的吸收、分配及利用
[J].
植物营养与肥料学报, 2016, 22(2): 572–578.
Ding N, Peng L, An X, et al. Absorption, distribution and utilization of dwarf apple trees to 15N applied in different growth stages [J]. Journal of Plant Nutrition and Fertilizer, 2016, 22(2): 572–578. DOI:10.11674/zwyf.14321 |
| [6] | Zhang H, Rong H, Pilbeam D. Signaling mechanisms underlying the morphological responses of the root system to nitrogen in Arabidopsis thaliana [J]. Journal of Experimental Botany, 2007, 58(9): 2329–2338. DOI:10.1093/jxb/erm114 |
| [7] |
荣楠, 韩永亮, 荣湘民, 等. 油菜NO3–的吸收、分配及氮利用效率对低氮胁迫的响应
[J].
植物营养与肥料学报, 2017, 23(4): 1104–1111.
Rong N, Han Y L, Rong X M, et al. Response of NO3– uptake and distribution and nitrogen use efficiency in oilseed rape to limited nitrogen stress [J]. Journal of Plant Nutrition and Fertilizer, 2017, 23(4): 1104–1111. DOI:10.11674/zwyf.16305 |
| [8] | Scheible W R, Gonzalezfontes A, Lauerer M, et al. Nitrate acts as a signal to induce organic acid metabolism and repress starch metabolism in tobacco[J]. Plant Cell, 1997, 9(5): 783–798. DOI:10.1105/tpc.9.5.783 |
| [9] | Sun C H, Yu J Q, Hu D G. Nitrate: A crucial signal during lateral roots development[J]. Frontiers in Plant Science, 2017, 8: 485. |
| [10] |
赵林, 姜远茂, 彭福田, 等. 稳产与变产果园氮磷钾差异性研究[J].
山东农业大学学报(自然科学版), 2010, 41(4): 549–554.
Zhao L, Jiang Y M, Peng F T, et al. Study on the difference in stable orchard and unstable orchard[J]. Journal of Shandong Agricultural University (Natural Science Edition), 2010, 41(4): 549–554. |
| [11] | Dong S, Cheng L, Scagel C F, et al. Nitrogen mobilization, nitrogen uptake and growth of cuttings obtained from poplar stock plants grown in different N regimes and sprayed with urea in autumn[J]. Tree Physiology, 2004, 24: 355–359. DOI:10.1093/treephys/24.3.355 |
| [12] | Neilsen G, Neilsen D. Fertigation and nutrition of apple orchards[J]. Revista Agropecuária Catarinense, 2014, 27: 34–43. |
| [13] |
赵佐平, 同延安, 刘芬, 等. 长期不同施肥处理对苹果产量、品质及土壤肥力的影响[J].
应用生态学报, 2013, 24(11): 3091–3098.
Zhao Z P, Tong Y A, Liu F, et al. Effects of different long-term fertilization patterns on Fuji apple yield, quality, and soil fertility on Weibei Dryland, Shaanxi Province of Northwest China[J]. Chinese Journal of Applied Ecology, 2013, 24(11): 3091–3098. |
| [14] | Munodawafa A. Assessing nutrient losses with soil erosion under different tillage systems and their implications on water quality[J]. Physics & Chemistry of the Earth, 2007, 32(15-18): 1135–1140. |
| [15] | Tian Q Y, Chen F J, Liu J X, et al. Inhibition of maize root growth by high nitrate supply is correlated with reduced IAA levels in roots[J]. Journal of Plant Physiology, 2008, 165(9): 942–951. DOI:10.1016/j.jplph.2007.02.011 |
| [16] |
李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000, 123–128.
Li H S. Experimental principle and technique for plant physiology and biochemistry [M]. Beijing: Higher Education Press, 2000, 123–128. |
| [17] |
任同辉. 萝卜硝酸盐含量分析的初步研究[D]. 南京: 南京农业大学博士学位论文, 2005.
Ren T H. Primary studies on nitrate content in radish (Raphanussativus L.) [D]. Nanjing: PhD Dissertation of Nanjing Agricultural University, 2005. |
| [18] |
王俊英, 王华青, 梁晓东, 等. 水培燕麦根系形态和氮吸收流量对硝态氮供应浓度的响应[J].
植物营养与肥料学报, 2016, 22(4): 1049–1055.
Wang J Y, Wang H Q, Liang X D, et al. Response of root morphology and N absorption to nitrate nitrogen supply in hydroponic oats[J]. Journal of Plant Nutrition and Fertilizer, 2016, 22(4): 1049–1055. DOI:10.11674/zwyf.15094 |
| [19] |
黄翠香, 夏燕飞, 王荣, 等. 菲和芘胁迫对平邑甜茶根毛细胞钙、钾和氢离子流动性的影响[J].
中国农业科学, 2013, 46(20): 4321–4327.
Huang C X, Xia Y F, Wang R, et al. Effects of phenanthrene and pyrene on Ca2+, K+ and H+ liquidity in root hair cells of Malus hupehensis [J]. Scientia Agricultura Sinica, 2013, 46(20): 4321–4327. DOI:10.3864/j.issn.0578-1752.2013.20.015 |
| [20] |
姜琳琳, 韩立思, 韩晓日, 等. 氮素对玉米幼苗生长、根系形态及氮素吸收利用效率的影响[J].
植物营养与肥料学报, 2011, 17(1): 247–253.
Jiang L L, Han L S, Han X R, et al. Effects of nitrogen on growth, root morphological traits, nitrogen uptake and utilization efficiency of maize seedlings[J]. Plant Nutrition and Fertilizer Science, 2011, 17(1): 247–253. DOI:10.11674/zwyf.2011.0134 |
| [21] |
孙虎威, 王文亮, 刘尚俊, 等. 低氮胁迫下水稻根系的发生及生长素的响应[J].
土壤学报, 2014, 51(5): 1096–1102.
Sun H W, Wang W L, Liu S J, et al. Formation of rice root regulation by nitrogen deficiency[J]. Acta Pedologica Sinica, 2014, 51(5): 1096–1102. |
| [22] | Krapp A, Berthome R, Orsel M, et al. Arabidopsis roots and shoots show distinct temporal adaptation patterns toward nitrogen starvation [J]. Plant Physiology, 2011, 157(3): 1255–1282. DOI:10.1104/pp.111.179838 |
| [23] | Forde B G. Nitrogen signaling pathways shaping root system architecture: an update[J]. Current Opinion in Plant Biology, 2014, 21: 30–36. DOI:10.1016/j.pbi.2014.06.004 |
| [24] | Ingestad T, Lund A B. Theory and techniques of steady-state mineral nutrition and growth of plant[J]. Scandinavian Journal of Forest Research, 1986, 1(4): 439–453. |
| [25] |
郭芸珲, 于媛媛, 温立柱, 等. 硝态氮影响菊花根系形态结构变化的分子基础[J].
中国农业科学, 2017, 50(9): 1684–1693.
Guo Y H, Yu Y Y, Wen L Z, et al. Molecular basis of the effects of nitrate signal on root morphological structure changes of chrysanthemum[J]. Scientia Agricultura Sinica, 2017, 50(9): 1684–1693. DOI:10.3864/j.issn.0578-1752.2017.09.014 |
| [26] |
汪洪, 高翔, 陈磊, 等. 硝态氮供应下植物侧根生长发育的响应机制[J].
植物营养与肥料学报, 2011, 17(4): 1005–1011.
Wang H, Gao X, Chen L, et al. The mechanisms underlying plant lateral root development in response to nitrate[J]. Plant Nutrition and Fertilizer Science, 2011, 17(4): 1005–1011. DOI:10.11674/zwyf.2011.0298 |
| [27] | Liu J X, An X, Cheng L, et al. Auxin transport in maize roots in response to localized nitrate supply[J]. Annals of Botany, 2010, 106(6): 1019–1026. DOI:10.1093/aob/mcq202 |
| [28] | Kiba T, Kudo T, Kojima M. Hormonal control of nitrogen acquisition: roles of auxin, abscisic acid, and cytokinin[J]. Journal of Experimental Botany, 2011, 62(4): 1399–1409. DOI:10.1093/jxb/erq410 |
| [29] | Hawkins B J, Robbins S. pH affects ammonium, nitrate and proton fluxes in the apical region of conifer and soybean roots[J]. Physiologia Plantarum, 2010, 138(2): 238–247. DOI:10.1111/ppl.2010.138.issue-2 |
| [30] | Siddiqi M Y, Glass A D M, Ruth T J, et al. Studies of the regulation of nitrate in flux by barley seedlings using 13NO3–[J]. Plant Physiology, 1989, 90(3): 806–813. DOI:10.1104/pp.90.3.806 |
| [31] | Lainé P, Ourry A, Boucaud J. Shoot control of nitrate uptake rates by roots of Brassica napus L.: Effects of localized nitrate supply [J]. Planta, 1995, 196(1): 77–83. |
| [32] |
郑冬超. 调节转运蛋白AtNRT1.1、AtNRT2.1及PdAMT1.1基因表达对拟南芥和杨树氮素吸收的影响研究[D]. 北京: 北京林业大学博士学位论文, 2013.
Zheng D C. Mediating the expression of AtNRTl.1, AtNRT2.1 and PdAMT1.l genes affects nitrogen absorption in Arabidopsis and Popla [D]. Beijing: PhD Dissertation of Beijing Forestry University, 2013. |
| [33] | Kovács B, Puskás-Preszner A, Huzsvai L, et al. Effect of molybdenum treatment on molybdenum concentration and nitrate reduction in maize seedlings[J]. Plant Physiology and Biochemistry, 2015, 96: 38–44. DOI:10.1016/j.plaphy.2015.07.013 |
| [34] |
王雨, 唐晓清, 施晟璐, 等. 不同施氮水平对盐胁迫下苗期菘蓝生理特性及根中(R, S)-告依春含量的影响[J].
核农学报, 2017, 31(2): 394–401.
Wang Y, Tang X Q, Shi S L, et al. Effects of different nitrogen levels on physiological characteristics and epigoitrin content in root of Isatis indigotica Fort. at seedling stage under salt stress [J]. Journal of Nuclear Agricultural Sciences, 2017, 31(2): 394–401. DOI:10.11869/j.issn.100-8551.2017.02.0394 |
 2018, Vol. 24
2018, Vol. 24  doi:
doi: 

