近年来,生物炭因具有促进土壤有机碳固定[1–3]、改善土壤养分有效性、提高持水量及孔隙度[4–6]、促进作物生长和产量提升[7–8]等功能而被广泛研究和应用。大量研究报道了不同生物炭施用量 (0.5~135 t/hm2) 对作物生长和产量的影响,其中不乏为正面影响、负面影响或没有明显效果的报道,研究结果与生物炭的种类、施用量和土壤类型等因素有关[9–10]。整体而言,当前制备工艺下生产的生物炭以高pH较为普遍[4–6],其施用的负面效应多发生在碱性土壤中[11],而正面效应则多见于风化贫瘠土壤及酸性土壤中[8, 12–13]。尽管低pH的生物炭在碱性土壤中添加后土壤pH有所降低的结果也偶有报道[18–19],但生物炭碱性过高的现象普遍存在,其负面作用已经引起了研究者的广泛关注[8, 20]。
秸秆用作养殖发酵床垫料是消纳和合理利用秸秆、防治养殖污染的有效方式之一,秸秆垫料出圈后用作栽培基质原料是其重要的利用途径。但基于养殖垫料等农业废弃物原料的栽培基质往往存在保水性差、电导率过高、通气透水能力差等缺陷[14],大大限制了其推广应用。添加剂的使用对于改善基质性能至关重要[15]。目前已有学者开始尝试将生物炭作为基质添加剂来调控基质性能及作物生长[16–17],但研究基质类型有限,研究结论不一致,生物炭的效果差异甚大,其中的原因和机理尚不明确。生物炭添加后过高的pH和电导率尤其会对中性和碱性基质中作物的生长产生较大的负面影响[21]。因为大多数温室作物更适宜低电导率和偏微酸性的生长环境,为了促进生物炭在基质调控中的应用,如何抑制pH和电导率的过高增长是关键问题之一。有研究发现,高吸水树脂 (super absorbent polymer,SAP) 可不同程度地降低土壤pH。Bai等[22]报道,所用两种SAP可将沙质土壤pH分别降低11.2%和10.9%。而SAP作为基质添加剂的保水、保肥等优良特性已进行过报道。Dumroese等[16]及Cao等[17]尝试了将生物炭用于改善基质持水性等理化性质并取得了较好的效果。这说明SAP可以与生物炭一起用于基质调控,并有潜力在提升基质物理性状的同时降低生物炭pH和电导率。
前期研究结果已经表明,0.8 g/L的SAP添加可以有效改善基质的保水性能 (数据未发表),因此,本研究旨在研究不同生物炭添加比例对废弃物原料基质的调控效果,并着重对比研究生物炭单独添加和与0.8 g/L的SAP联合添加对基质理化性质及蔬菜生长的效果,以期为促进秸秆废弃物有效利用、改善基质性能和作物高产提供理论依据。
1 材料与方法 1.1 供试材料供试作物:空心菜,品种为泰国柳叶空心菜 (种子产于南京,纯度 > 95.0%、发芽率 > 90.0%)。为消除种子本身质量对出苗率的影响,播种前将种子进行进一步优选,剔除不饱满、过小、颜色或形状异常等易导致发芽困难的种子。
供试基质制备:发酵床垫料堆肥 + 蛭石 + 珍珠岩 + 泥炭 (体积比3∶2∶3∶2),其总氮、磷、钾及速效氮、磷、钾养分含量分别为24.2、8.62、10.1、1.94、0.83和3.72 g/kg。猪圈发酵床垫料为水稻秸秆,在圈内腐解两年,出圈后堆放一个月制成堆肥 (江苏省农科院六合有机肥厂)。蛭石、珍珠岩和泥炭的最大持水量分别为53.9%、31.4%和31.7%。
SAP:江苏省农科院农业设施与装备研究所研制。以改性后的可溶性玉米淀粉为主要原料,丙烯酸和丙烯酰胺为接枝单体,采用水溶液聚合法制备的耐盐性钾型丙烯酸类高吸水树脂,外观为白色粉末,粒度为0.15~0.3 mm,容重在0.6~0.8 g/cm3之间,吸去离子水量为800~1000 g/g,吸水速率小于30 s,pH值在6.9~7.3之间,电导率为4.0~5.0 dS/m。
生物炭:为小麦秸秆在600℃高温下厌氧裂解得到,其容重、持水量、pH及电导率分别为0.31 g/cm3、139%、9.98和1.03 dS/m,颗粒大小均在2 mm以下,碳和氮含量分别为79.3%和0.97%。用扫描电子显微镜 (JSM-5410,JEOL Ltd,Japan) 观察生物炭及SAP的表面微观结构。
1.2 试验设计盆栽试验在温室内进行。设基质中添加生物炭0、2%、4%、6%、8%、10%、12%、14%和16% (v/v),上述基质再等分为两份,一份加0.8 g/L SAP,另一份不加SAP,共18个处理,每个处理重复3次。栽培在60 cm × 50 cm × 20 cm的塑料盆钵中进行,每个盆钵中间用孔径为4 mm的塑料网隔开,一侧填充未加SAP的生物炭基质,依次记为B0、B2、B4、B6、B8、B10、B12和B16;另一侧填充对应生物炭处理添加了0.8 g/L SAP的基质,依次记为SB0、SB2、SB4、SB6、SB8、SB10、SB12和SB16。基质填充深度为18 cm。每侧基质种一行六颗空心菜,用喷壶于塑料盆上方均匀洒水,每10 d浇水一次,首次浇水量为基质最大持水量的80%,即每盆2.5 L,后期补水每次为每盆2.0 L。浇水10天后原位测定盆内不同位置和深度的水分分布。播种60天后收获,测定空心菜株高、茎粗、鲜重、干重、根系特征等生长指标及养分含量。
1.3 测定方法将基质与去离子水以1∶5比例混合搅拌,静置8天后用pH计和电导率仪测定pH和EC;容重、最大持水量、总孔隙度及通气孔隙度等指标测定均参照澳大利亚基质测定标准AS 3743-2003 (2003),具体为:取已知体积和重量的基质浸入去离子水中充分吸水后重力排水,此过程重复3次以确保基质吸水饱和,重力排水30 min,再次测定其体积及重量,然后放入烘箱105℃烘干一周,再次称重。用上述重量及体积计算容重、最大持水量、总孔隙度及通气孔隙度[17]。每个盆钵内有3条种植行与4条行间,在每条种植行和行间均匀取5个点,共计35个点,用电気式水分计 (SK-100,Sankku,Japan) 原位测定5、10、15 cm深处基质水分含量。
1.4 统计分析采用SPSS 12.0软件LSD显著性差异检验对不同生物炭添加比例下基质理化性状及空心菜各项生长指标进行均值比较,用两因素方差分析检测生物炭和SAP添加对所测定指标的影响。采用SigmaPlot12.5 (Systat Software,Inc.,Chicago,IL,USA) 软件进行作图。
2 结果与分析 2.1 生物炭与SAP分子结构特征通过生物炭与SAP的扫描电子显微照片可以看出,该生物炭 (图1a) 为疏松多孔的结构,大部分孔径小于1 μm,起到水分保蓄和离子吸附的作用,但一些孔隙被挥发份覆盖,有待活化。SAP (图1b) 的微观结构为连通的多泡孔状结构,不同大小的泡孔又相互连接形成通道。大泡孔的孔径达几十至100 μm以上,小泡孔则在几微米甚至更小。当这种结构与水充分接触时,不同大小的泡孔都能迅速吸水,使SAP具有吸纳和存储水分的作用。
2.2 添加SAP对不同生物炭添加比例的基质性状的影响由表1可知,随生物炭的添加比例增加,基质持水量变幅为50.3%~61.9%,增加显著;添加SAP后,变幅为67.9%~70.2%,不同处理间差异不显著,显示SAP可大大提高基质的持水稳定性。添加生物炭和SAP处理的基质容重在0.32~0.37 g/cm3之间,是否添加生物炭及SAP影响不显著。总孔隙度及通气孔隙度受SAP添加影响明显,分别提升了5.8%~10.7%和8.9%~17.9%。总孔隙度随生物炭添加比例的增加而显著增大,且在无SAP添加的处理中增大更为明显,表现为高生物炭添加处理 (B10~B16) 孔隙度显著高于低添加处理 (B0~B6)(P < 0.05),但通气孔隙度受生物炭的影响不显著。基质pH随生物炭添加而明显增大,且在无SAP添加处理增大更为明显 (由6.9增至8.0);有SAP处理中pH增大不明显,导致在高生物炭添加比例 (10%~16%) 下pH表现为有SAP处理 (7.2~7.5) 明显低于无SAP处理 (7.5~8.0)。电导率随SAP与生物炭的添加表现出与pH相似的规律。两因素方差分析显示,生物炭添加比例及SAP添加两因素对持水量、pH和EC均有显著的交互作用 ( P < 0.05)。
 |
| 图1 供试秸秆生物炭 (a) 及淀粉基高吸水树脂 (b) 的扫描电镜照片 Fig. 1 Scanning electron micrograph of straw biochar (a) and starch-based SAP (b) used in this study |
| 表1 不同比例生物炭及高吸水性树脂添加下的基质理化性质 Table 1 Basic characteristics of the substrates amended with biochar and super absorbent polymer (SAP) |
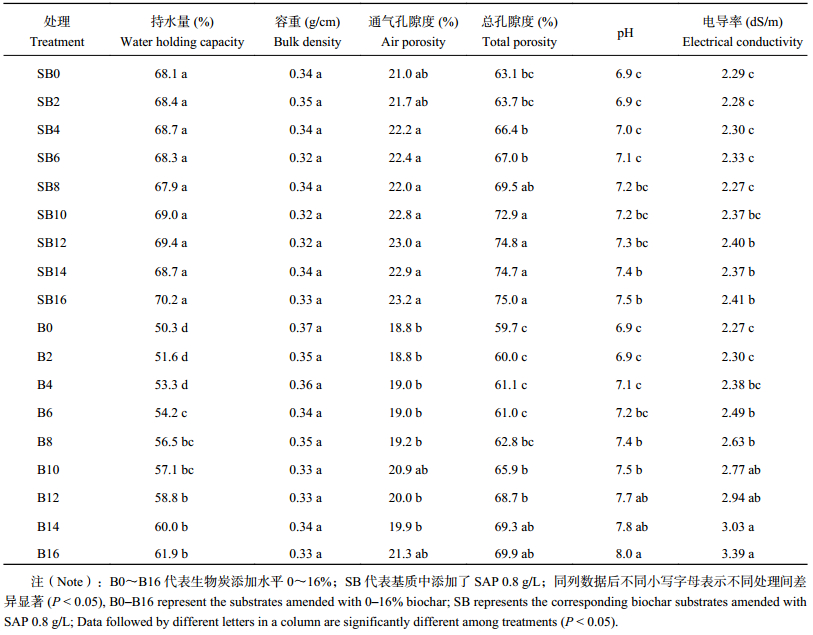 |
生物炭和SAP添加改变了盆钵基质中水分分布的均匀性,图2为浇水后10天时,栽培容器内由上至下基质的水分含量状况。从左到右三个图分别为添加秸秆生物炭0、10%和16%的基质,每个图左半部为无SAP添加处理,右半部为SAP与生物炭同时添加处理。相同生物炭添加量下,同时添加SAP的基质 (右侧) 含水量明显高于无SAP添加基质 (左侧),生物炭的增加也明显提高了盆钵不同深度和不同区域的基质含水量。植株种植的行与行间水分存在差异,除盆钵中线位置的P4行外,其他种植行位置的水分含量均低于行间位置。与无SAP添加处理相比,添加SAP处理基质5 cm以下各层含水量较为均匀,各生物炭添加水平下均呈现此趋势。其中生物炭0、10%和16%水平下,无SAP添加时15 cm比5 cm深度水分增加量分别为46.2%、37.3%和41.4%,而有SAP添加下则仅分别为19.7%、17.3%和14.5%。
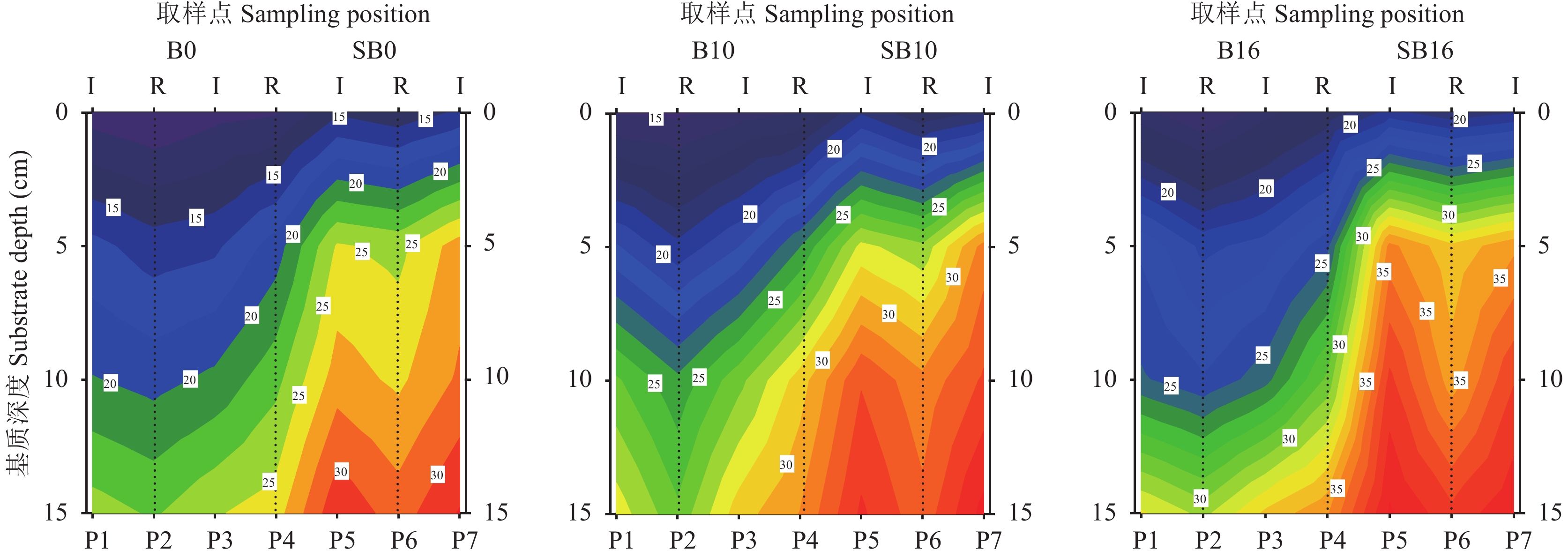 |
| 图2 浇水后第10天不同处理基质不同深度含水量 (%) Fig. 2 Moisture content in substrates in different treatments at the 10th day after watering [注(Note):图中数字表示基质水分含量 (%);R—空心菜种植行,三条虚线位置依次为P2、P4、P6;I为行间,对应P1、P3、P5、P7四条行间位置;P4为盆钵中间种植行 Data inside the contour chart are moisture content (%); R refers to water spinach growing rows, corresponding to the three dotted lines of P2, P4 and P6; I refers to lines between growing rows, corresponding to P1, P3, P5 and P7; P4 represent the middle growing line.] |
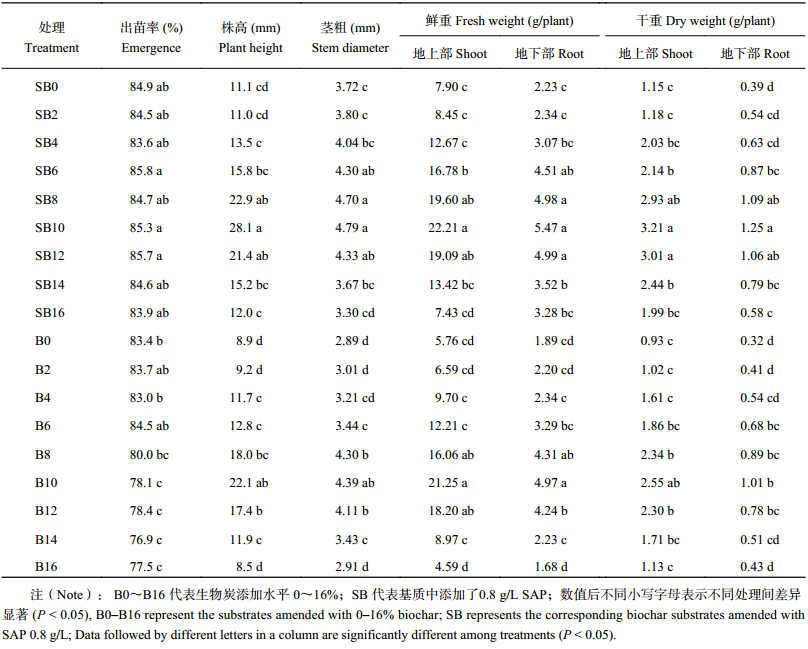
由表2可知,在无SAP添加基质中,空心菜出苗率随生物炭添加比例的增加呈逐渐降低趋势,高生物炭添加处理B10~B16出苗率 (平均77.7%) 显著低于低添加处理B0~B6 (平均83.7%)(P < 0.05)。基质添加0.8 g/L SAP后,空心菜出苗率各生物炭比例间无明显差异。添加SAP的处理空心菜株高、茎粗、地上部及地下部生物量鲜重和干重均显著高于对应的未添加处理。无论添加SAP与否,随生物炭比例的增加,各项指标先提升后下降,在B10时达到最高 ( 表2)。由二因素方差分析可知,SAP添加是影响空心菜地上部分生长的首要因素,而生物炭添加是影响空心菜根部生长的首要因素。生物炭和SAP对株高及鲜重有显著的交互影响 (P < 0.05)。
| 表2 不同生物炭及SAP处理基质下生长60天的空心菜生长指标 Table 2 Growth parameters of water spinach in the substrates under different biochar and SAP treatments at 60 days after sowing |
 |
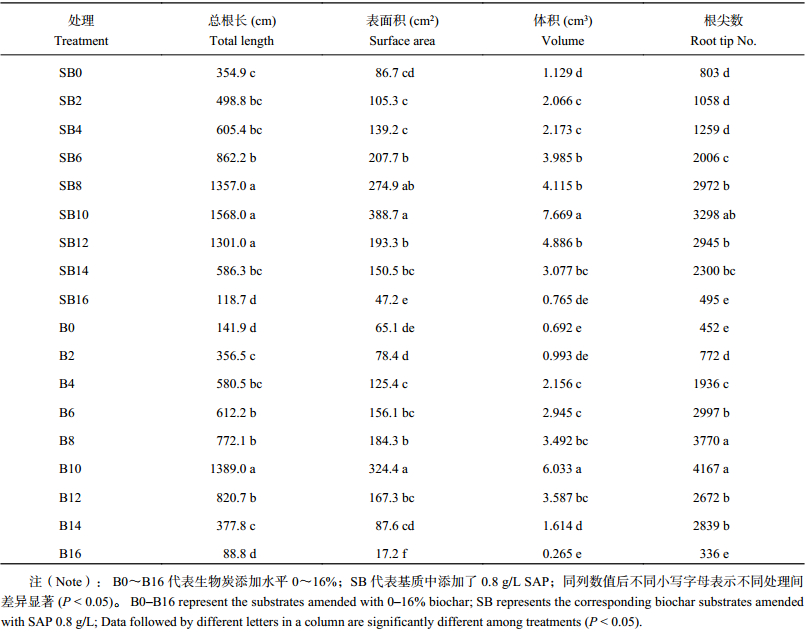
由表3可知,相同生物炭添加比例下,添加SAP处理的空心菜根系特征,包括总根长、根表面积、体积、根尖数均显著高于无SAP处理,且均随生物炭添加比例的增加而呈现先上升、后下降的趋势,在生物炭添加10%处理达最高值。
| 表3 不同比例生物炭及SAP添加处理空心菜根系特征 Table 3 Root characteristics of water spinach grown in substrates amended with different proportions of biochar with and without SAP |
 |
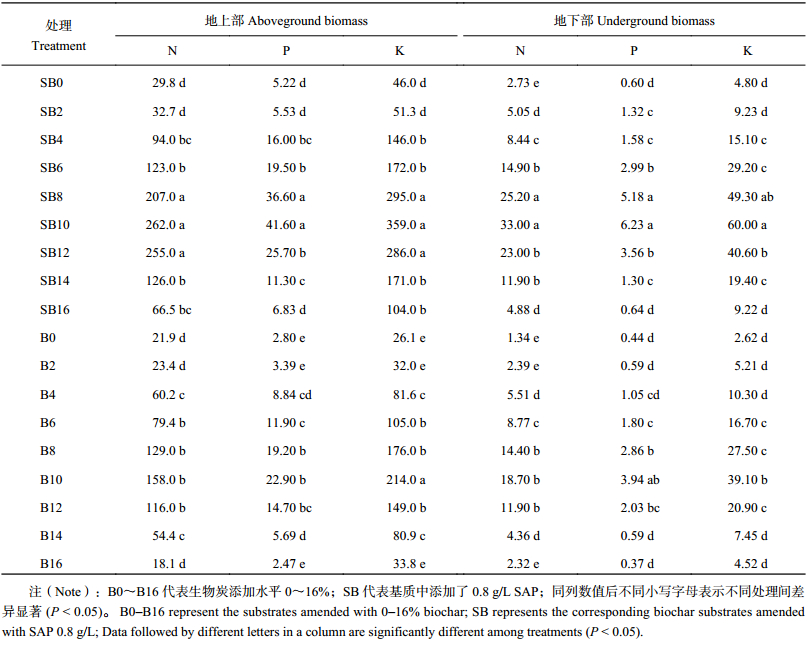
基质生物炭添加比例在0~10%范围内时,空心菜茎叶及根部养分 (N、P、K) 含量随其比例的增加而增加,当添加比例超过10%后养分含量逐渐降低 (表4)。添加0.8 g/L SAP后,不同生物炭添加比例基质中空心菜养分含量均明显增加。生物炭比例是影响空心菜吸收N和P的首要因素,而SAP对K吸收的影响则高于生物炭,两个因素对根部及茎叶养分含量的影响有显著的交互作用 (P > 0.05)。
| 表4 生长60天后不同处理基质中空心菜地上及地下部氮磷钾吸收量 (mg/plant) Table 4 NPK absorptions in aboveground and underground parts of water spinach grown in different substrates for 60 d |
 |
已有大量报道指出,生物炭可引起土壤化学及生物学性质的明显变化,但生物炭对土壤物理性状的影响报道较少[23–24]。与文献报道结果不同,本研究中生物炭对降低基质容重效果不明显,这可能是因为本研究中基质的容重 (0.37 g/cm3) 较所报道的土壤及基质容重小[17, 25]。本研究基质总孔隙度远低于国际标准基质理想值 (> 85%)[26],但随生物炭添加比例的增加而明显增大,这可能是因为生物炭自身具有较大的孔隙的原因[27],也证明了生物炭在改善基质孔隙性状方面的有效作用。这些结果与Belyaeva等[28]所报道结果一致。
另一方面,因生物炭本身的碱性、较大的比表面积和较大的电荷密度[8, 29–30],基质pH及电导率随生物炭添加比例的增加而增加,因为理想基质pH和电导率范围分别为5.3~6.5和 < 0.5 dS/m,所以高生物炭添加比例会带来基质pH和电导率过高的弊端。Jayasinghe等 [21]提出,大部分温室作物更适宜微酸性基质环境以增加养分的可利用性。同时,大量研究已经证明,低电导率基质更适宜作物生长[31]。因此本研究中较高的pH和电导率可能是空心菜生长的限制因素,同时这也是限制生物炭在基质中应用的重要限制因素。但是,基质中同时添加0.8 g/L的SAP后,pH和电导率随生物炭增加而迅速增加的趋势被抑制。同时,生物炭添加带来的高孔隙度和持水量等优势随SAP添加而进一步加强。两种添加剂相互作用的机制尚不明确,但其原因之一可能是因为SAP的保水作用可改变生物炭稳定性及分子特征[24, 32],进而影响了生物炭对基质性质的改善效果。另外,与无SAP添加基质相比,SAP添加后,盆钵内5 cm以下深度含水量趋于均匀,这大大克服了基质保水性差、浇水后水分滞留于盆底而导致上部缺水的缺陷。
3.2 生物炭与SAP添加对基质栽培空心菜养分吸收与生长的影响当生物炭与SAP联合添加时,空心菜出苗率明显高于生物炭单独添加,且生物炭单独添加时随着添加比例的增加 (> 10%),出苗率逐渐降低。这是因为联合添加时升高的孔隙度、持水量以及较为合适的pH和电导率创造了适宜种子发芽的基质环境[33]。生物炭单独添加 (无SAP) 时添加比例为10% (B10) 的情况影响到出苗率,但增加了径粗和株高,究其原因,B10处理基质的EC为2.77 dS/m,高于生物炭添加少于10%的处理。作物幼苗期对盐分较为敏感,本研究较高的EC和较低的出苗率显示了作物出苗对盐分的敏感性,而随作物生长期的延长,耐盐性也随之增强,高EC的危害相对减弱,而高养分含量对作物生长指标则起了促进作用,故收获期植株的株高和茎粗明显高于其他处理。B12~B16处理的出苗率与B10相当甚至更低,但其株高和茎粗等生长指标并没有高于其他处理,可能是因为B12~B16处理的EC值 (2.94~3.39 dS/m2) 过高,严重影响了植物后期的生长。添加SAP后作物生长状况得到改善,养分吸收增加,这些与改善的基质水分供应关系十分密切,因为所用废弃物基质存在水分保蓄能力差的缺点且水分不足是限制基质栽培作物生长的重要因素[24, 34]。同时,SAP的添加也有可能改变了生物炭表面挥发份覆盖的情况[35],进一步提高了生物炭的孔隙度和保水作用。本研究养分含量及养分吸收率在低生物炭添加比例时均随着添加量的增加而提高,并在10%添加量时达最高值 (表4)。养分吸收直接关系到作物的生长,因此空心菜株高、茎粗及生物量等生长指标也呈此趋势。大量其他研究也报道了生物炭添加后土壤或基质理化性状改善进而促进作物养分吸收和生长的结果[4–6, 36]。然而,随着生物炭的继续添加 (10%~16%),由于高生物炭比例带来的过高pH及过高电导率等负面影响,空心菜生长及养分吸收等并未进一步改善,尤其在生物炭单独添加 (没有SAP同时添加) 的情况下负面效应更为明显,导致高生物炭添加比例 (10%~16%),尤其是生物炭单独添加情况下空心菜各项生长指标显著降低,这说明过量的生物炭添加并不会促进作物养分吸收和生长,生物炭添加比例应控制在合适的范围之内,这与Zheng等[37]在土壤中的研究结果一致。
4 结论秸秆原料生物炭添加比例为10%时可有效改善废弃物基质的性能,尽管该生物炭的石灰效应和高电导率对基质pH及电导率有一定的负面影响。高吸水性树脂SAP添加不仅加强了生物炭的正面效应 (增大基质孔隙度、持水量等),同时抑制了高生物炭添加带来的基质pH和电导率的过度升高,最终有效改善了基质栽培空心菜的生长和养分吸收。本研究结果对生物炭在农业废弃物基质中的应用具有一定的参考价值和指导意义。但SAP与生物炭交互作用的机理尚不明确,需进一步研究。
| [1] | Wang J Y, Zhang M, Xiong Z Q, et al. Effects of biochar addition on N2O and CO2 emissions from two paddy soils [J]. Biology and Fertility of Soils, 2011, 47: 887–896. DOI:10.1007/s00374-011-0595-8 |
| [2] |
宋大利, 习向银, 黄绍敏, 等. 秸秆生物炭配施氮肥对潮土土壤碳氮含量及作物产量的影响[J].
植物营养与肥力学报, 2017, 23(2): 369–379.
Song D L, Xi X Y, Huang S M, et al. Effects of combined application of straw biochar and nitrogen on soil carbon and nitrogen contents and crop yields in a fluvo-aquic soil[J]. Journal of Plant Nutrition and Fertilizer, 2017, 23(2): 369–379. |
| [3] | El-mahrouky M, El-naggar A H, Usman A R, et al. Dynamics of CO2 emission and biochemical properties of a sandy calcareous soil amended with Conocarpus waste and biochar [J]. Pedosphere, 2015, 25: 46–56. DOI:10.1016/S1002-0160(14)60075-8 |
| [4] | Busscher W J, Novak J M, Evans D E, et al. Influence of pecan biochar on physical properties of a Norfolk loamy sand[J]. Soil Science, 2010, 175: 10–14. DOI:10.1097/SS.0b013e3181cb7f46 |
| [5] | Novak J M, Busscher W J, Watts D W, et al. Biochars impact on soil moisture storage in an Ultisol and two Aridisols[J]. Soil Science, 2012, 177: 310–320. |
| [6] | Rogovska N, Laird D A, Rathke S J, et al. Biochar impact on Midwestern Mollisols and maize nutrient availability[J]. Geoderma, 2014, 230-231: 340–347. DOI:10.1016/j.geoderma.2014.04.009 |
| [7] |
王耀锋, 刘玉学, 吕豪豪, 等. 水洗生物炭配施化肥对水稻产量及养分吸收的影响[J].
植物营养与肥料学报, 2015, 21(4): 1049–1055.
Wang Y F, Liu Y X, Lü H H, et al. Effect of washing biochar and chemical fertilizers on rice yield and nutrient uptake[J]. Journal of Plant Nutrition and Fertilizer, 2015, 21(4): 1049–1055. DOI:10.11674/zwyf.2015.0425 |
| [8] | Zhu Q H, Peng X H, Huang T Q, et al. Effect of biochar addition on maize growth and nitrogen use efficiency in acidic red soils[J]. Pedosphere, 2014, 24: 699–708. DOI:10.1016/S1002-0160(14)60057-6 |
| [9] | Glaser B, Lehmann J, Zech W. Ameliorating physical and chemical properties of highly weathered soils in the tropics with charcoal-a review[J]. Biology and Fertility of Soils, 2002, 35: 219–230. DOI:10.1007/s00374-002-0466-4 |
| [10] | Solaiman Z M, Murphy D V, Abbott L K. Biochars influence seed germination and early growth of seedlings[J]. Plant and Soil, 2012, 353: 273–287. DOI:10.1007/s11104-011-1031-4 |
| [11] | Deenik J L, McClellan T, Uehara G, et al. Charcoal volatile matter content influences plant growth and soil nitrogen transformations[J]. Soil Science Society of America Journal, 2010, 74: 1259–1270. DOI:10.2136/sssaj2009.0115 |
| [12] | Clough T J, Condron L M. Biochar and the nitrogen cycle: Introduction[J]. Journal of Environmental Quality, 2010, 39: 1218–1223. DOI:10.2134/jeq2010.0204 |
| [13] | Major J, Rondon M, Molina D, et al. Maize yield and nutrition during 4 years after biochar application to a Colombian savanna oxisol[J]. Plant and Soil, 2010, 333: 117–128. DOI:10.1007/s11104-010-0327-0 |
| [14] |
范如芹, 罗佳, 高岩, 等. 农业废弃物的基质化利用研究进展[J].
江苏农业学报, 2014, 30(2): 442–448.
Fan R Q, Luo J, Gao Y, et al. Advances in utilization of agricultural wastes in soilless growing medium production[J]. Jiangsu Journal of Agricultural Science, 2014, 30(2): 442–448. |
| [15] | Tian Y, Sun X Y, Li S Y, et al. Biochar made from green waste as peat substitute in growth media for Calathea rotundifola cv. Fasciata [J]. Scientia Horticulturae, 2012, 43: 15–18. |
| [16] | Dumroese R K, Heiskanen J, Englund K, et al. Pelleted biochar: chemical and physical properties show potential use as a substrate in container nurseries[J]. Biomass and Bioenergy, 2011, 35: 2018–2027. DOI:10.1016/j.biombioe.2011.01.053 |
| [17] | Cao C T N, Farrell C, Kristiansen P E, et al. Biochar makes green roof substrates lighter and improves water supply to plants[J]. Ecological Engineering, 2014, 71: 368–374. DOI:10.1016/j.ecoleng.2014.06.017 |
| [18] | Lehmann J. Bio-energy in the black[J]. Frontiers in Ecology and the Environment, 2007, 5: 381–387. DOI:10.1890/1540-9295(2007)5[381:BITB]2.0.CO;2 |
| [19] | Lehmann J, Rillig M C, Thies J, et al. Biochar effects on soil biota-a review[J]. Soil Biology and Biochemistry, 2011, 43: 1812–1836. DOI:10.1016/j.soilbio.2011.04.022 |
| [20] |
张晗芝, 黄云, 刘钢, 等. 生物炭对玉米苗期生长、养分吸收及土壤化学性状的影响[J].
生态环境学报, 2010, 19(11): 2713–2717.
Zhang H Z, Huang Y, Liu G, et al. Effects of biochar on corn growth, nutrient uptake and soil chemical properties in seedling stage[J]. Ecology and Environmental Sciences, 2010, 19(11): 2713–2717. DOI:10.3969/j.issn.1674-5906.2010.11.034 |
| [21] | Jayasinghe G Y, Arachchi I D L, Tokashiki Y. Evaluation of containerized substrates developed from cattle manure compost and synthetic aggregates for ornamental plant production as a peat alternative[J]. Recycling & Resource Conservation, 2010, 54: 1412–1418. |
| [22] | Bai W, Zhang H, Liu B, et al. Effects of super-absorbent polymers on the physical and chemical properties of soil following different wetting and drying cycles[J]. Soil Use Management, 2010, 26: 253–260. DOI:10.1111/j.1475-2743.2010.00271.x |
| [23] | Hammes K, Schmidt M W I. Changes in biochar in soil [A]. Lehmann J, Joseph S. Biochar for environmental management science and technology [M]. London: Earthscan, 2009.169–182. |
| [24] | Atkinson C J, Fitzgerald J D, Hipps N A. Potential mechanisms for achieving agricultural benefits from biochar application to temperate soils: a review[J]. Plant and Soil, 2010, 337: 1–18. DOI:10.1007/s11104-010-0464-5 |
| [25] | Huang M, Yang L, Qin H D, et al. Quantifying the effect of biochar amendment on soil quality and crop productivity in Chinese rice paddies[J]. Field Crop Research, 2013, 154: 172–177. DOI:10.1016/j.fcr.2013.08.010 |
| [26] | Abad M, Noguera P, Burés S. National inventory of organic wastes for use as growing media for ornamental potted plant production: case study in Spain[J]. Bioresource Technology, 2001, 77: 197–200. DOI:10.1016/S0960-8524(00)00152-8 |
| [27] | Petersona S C, Jackson M A. Simplifying pyrolysis: Using gasification to produce corn stover and wheat straw biochar for sorptive and horticultural media[J]. Industrial Crops and Products, 2014, 53: 228–235. DOI:10.1016/j.indcrop.2013.12.028 |
| [28] | Belyaeva O N, Haynes R J. Comparison of the effects of conventional organic amendments and biochar on the chemical, physical and microbial properties of coal fly ash as a plant growth medium[J]. Environmental Earth Sciences, 2012, 66: 1987–1997. DOI:10.1007/s12665-011-1424-y |
| [29] | Liang B, Lehmann J, Solomon D, et al. Black carbon increases cation exchange capacity in soils[J]. Soil Science Society of America Journal, 2006, 70: 1719–1730. DOI:10.2136/sssaj2005.0383 |
| [30] |
袁帅, 赵立欣, 孟海波, 等. 生物炭主要类型、理化性质及其研究展望[J].
植物营养与肥料学报, 2016, 22(5): 1402–1417.
Yuan S, Zhao L X, Meng H B, et al. The main types of biochar and their properties and expectative researches[J]. Journal of Plant Nutrition and Fertilizer, 2016, 22(5): 1402–1417. DOI:10.11674/zwyf.14539 |
| [31] | Luo J, Fan R Q, Wang T, et al. Evaluation of spent pig litter compost as a peat substitute in soilless growth media[J]. Biological Agriculture & Horticulture, 2015, 31(4): 219–229. |
| [32] | Nguyen B T, Lehmann J. Black carbon decomposition under varying water regimes[J]. Organic Geochemistry, 2009, 40: 846–853. DOI:10.1016/j.orggeochem.2009.05.004 |
| [33] | Medina E, Paredes C, Pérez-Murcia M D, et al. Spent mushroom substrates as component of growing media for germination and growth of horticultural plants[J]. Bioresource Technology, 2009, 100: 4227–4232. DOI:10.1016/j.biortech.2009.03.055 |
| [34] | Rodionov A, Nii-Annang S, Bens O, et al. Impacts of soil additives on crop yield and C-sequestration in post mine substrates of Lusatia, Germany[J]. Pedosphere, 2012, 22: 343–350. DOI:10.1016/S1002-0160(12)60021-6 |
| [35] |
谢祖彬, 刘琦, 许燕萍, 等. 生物炭研究进展及其研究方向[J].
土壤, 2011, 43(6): 857–861.
Xie Z B, Liu Q, Xu Y P, et al. Advances and perspectives of biochar research[J]. Soils, 2011, 43(6): 857–861. |
| [36] | Vaccari F P, Baronti S, Lugato E, et al. Biochar as a strategy to sequester carbon and increase yield in durum wheat[J]. European Journal of Agronomy, 2011, 34: 231–238. DOI:10.1016/j.eja.2011.01.006 |
| [37] | Zheng H, Wang Z Y, Deng X, et al. Impacts of adding biochar on nitrogen retention and bioavailability in agricultural soil[J]. Geoderma, 2013, 206: 32–39. |
 2018, Vol. 24
2018, Vol. 24  doi:
doi: 

