稻田典型的淹水—排干的干湿交替管理措施为土壤中变价元素的氧化还原提供了有利条件。水稻土淹水后,随着土壤氧化还原电位逐渐下降,微生物利用有机物作为电子供体,NO3–、Mn (IV)、Fe (Ⅲ)、SO42–、CO2逐渐取代O2作为电子受体而发生一系列的氧化还原反应[1–3]。Fe (Ⅲ) 的还原耦联着淹水稻田中的碳、氮、磷、硫等元素的生物地球化学循环,进一步影响着营养元素的生物有效性。一方面NO3– 还原、SO42– 还原与Fe (Ⅲ) 还原之间存在电子竞争关系[4],同时NO3– 的还原耦联了厌氧环境下Fe (II) 的氧化[5],且部分SO42– 还原菌也可能兼具Fe (Ⅲ) 还原的功能[6];另一方面,Fe (Ⅲ) 还原可以释放出部分被铁氧化物结合的磷,从而提高稻田中磷的生物可利用性且满足水稻生长对Fe作为微量元素的需求[7–8]。此外,Fe (Ⅲ) 还原过程在有机污染物的降解、金属元素的迁移转化及抑制产甲烷过程等方面也发挥着重要作用[9]。因此研究淹水稻田中Fe (Ⅲ) 还原过程对农业生产和环境保护两方面兼具重要意义。
土壤有机质 (SOM) 是影响水稻土微生物Fe (Ⅲ) 还原能力最重要的因素之一[10]。水溶性有机碳 (DOC) 是水稻土中最为活跃、最易被利用且移动性最高的组分[11]。研究报道淹水稻田中DOC在连接土壤碳库和水生碳库的碳循环中起到非常重要的作用,一般认为,处于游离态的有机酸、糖类、腐殖酸及氨基酸等是DOC的主要组成部分[12–13]。目前,关于水稻土中DOC与Fe (Ⅲ) 还原过程的关系存在两种假设:一、其中小分子有机酸、糖类、氨基酸等不仅可以为微生物生长提供基质,也可以作为Fe (Ⅲ) 还原的电子供体[14];二、DOC中含有一定量的类腐殖酸、富里酸,有研究发现腐殖酸上的醌基在充当Fe (Ⅲ) 还原过程中微生物与铁氧化物间电子穿梭体方面发挥着主要作用[15]。Bi等采用库伦安培法测定土壤DOM的电化学特性时,也验证了DOM具有电子转移能力[16]。然而,不同水稻土DOC的电子转移能力可能因其含量和组分之间的差异而不同,这一差异是否与不同水稻土Fe (Ⅲ) 还原能力的差异存在一定的关系?目前有关这方面的研究却鲜见报道。因此本研究采集我国不同植稻区的典型水稻土,比较分析不同水稻土DOC的含量和荧光特性及不同水稻土的Fe (Ⅲ) 还原特征,依据相关分析和冗余分析明确水稻土DOC与Fe (Ⅲ) 还原过程的关系,以期阐明水稻土有机质对Fe (Ⅲ) 还原的贡献,为深入理解Fe (Ⅲ) 还原过程的作用机理及DOC在元素循环中的意义提供科学依据。
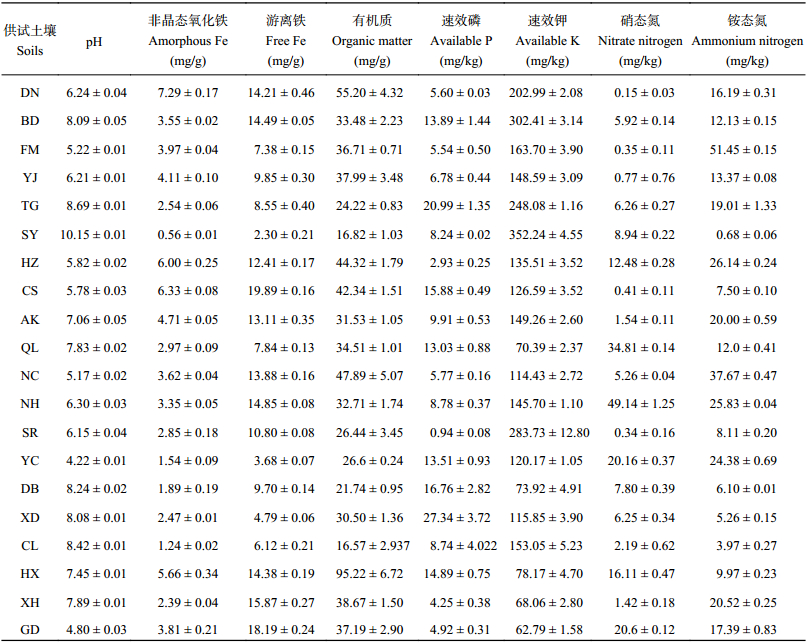
1 材料与方法 1.1 供试土壤采集供试的20个水稻土分别采自我国六大稻作区的不同省份 (图1)。其中YJ、SY、FM、DN属于东北早熟单季稻稻作区;BD、TG属于华北单季稻稻作区;DB、XD、CL属于西北干燥区单季稻稻作区;NH、SR、NC、YC、CS、QL、HZ、AK属于我国最大的植稻区—华中单双季稻稻作区;HX、XH属于西南高原单双季稻稻作区;GD属于华南双季稻稻作区。在水稻收割后,分别采集不同稻田0—20 cm耕层土壤样品,去除植物残体后自然风干、磨细、过筛备用。采用标准方法[17]测定的各土壤基本理化性质见表1。
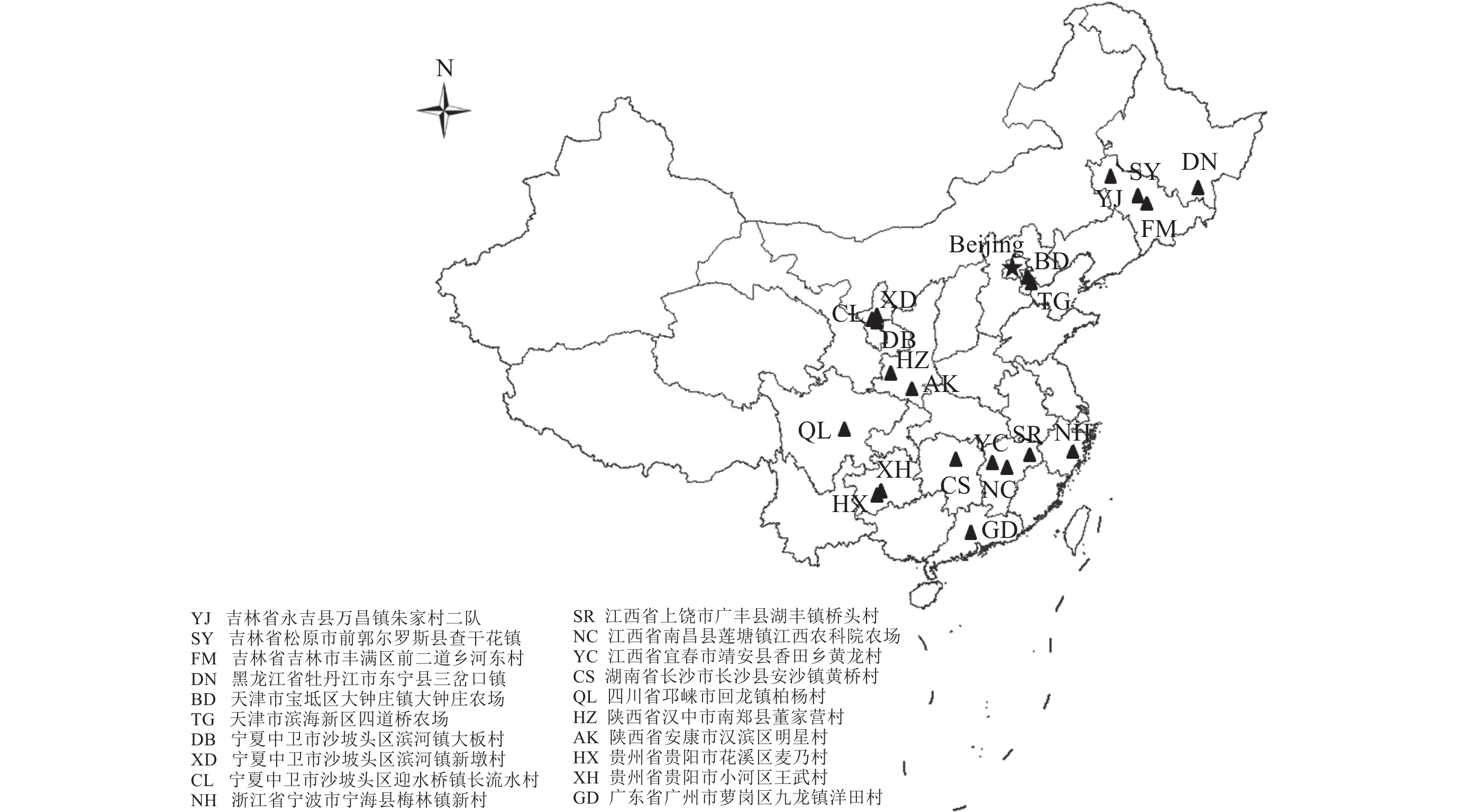 |
| 图1 供试水稻土采样点图示 Fig. 1 Soil sampling site |
DOC含量采用总有机碳测定仪测定。分别称取3.000 g过0.15 mm筛的各水稻土于50 mL带盖离心管中,以1∶10的土水比添加30 mL蒸馏水后于恒温 (60℃) 摇床200 r/min振荡30 min,随后将离心管于10000 r/min离心6 min,并取上清液用真空泵经0.45 μm滤膜过滤,收集滤液上机测定。
1.3 土壤水溶性有机碳三维荧光光谱扫描及光谱特征表征吸取1.2中获得的滤液,对其中DOC的荧光激发–发射矩阵光谱 (EEM) 采用荧光光谱仪进行扫描。测定前将比色皿用5% HNO3溶液进行清洗。测定时激发波长范围为200~550 nm,激发采样间隔为5 nm,发射波长范围为250~600 nm,发射采样间隔为2 nm,扫描速度为1200 nm/min。
以激发波长为370 nm时,发射波长在470 nm和520 nm两处荧光发射强度的比值计算荧光系数 (FI);当激发波长为254 nm时,以发射波长在435~480 nm范围内的积分值与在300~345 nm范围内的积分值的比值来计算腐殖化系数 (HIX);当激发波长为310 nm时,以发射波长在380 nm时的荧光强度与发射波长在420~435 nm范围内的最大荧光强度的比值计算新旧碳比 (β∶α);当激发波长为310 nm时,以发射波长在380 nm和430 nm时荧光发射强度的比值计算得自生源指数 (BIX)。
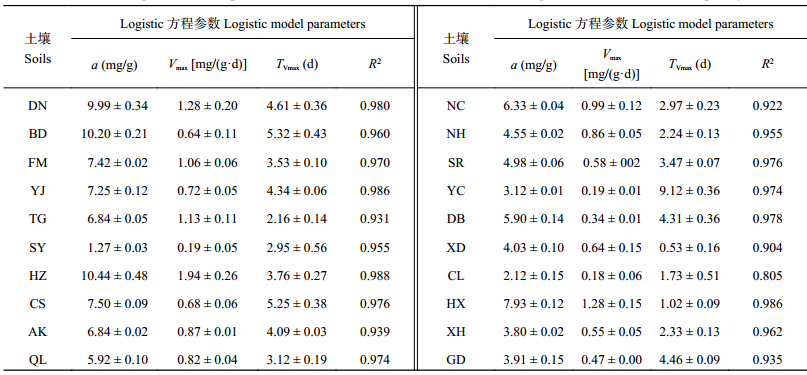
1.4 不同水稻土Fe (Ⅲ) 还原特征表征分别称取3.000 g过1 mm土壤筛的各水稻土样品若干份于10 mL的血清瓶中,以1∶1的土水比添加3 mL去离子水,充N2除O2,并用橡胶塞和铝盖密封,置于30℃恒温培养箱中暗光培养。分别于厌氧培养的第0、1、3、5、7、10、13、16、20、25、30、35、40天用邻菲啰啉比色法测定样品中Fe (Ⅱ) 浓度。通过Origin 8.0软件中Logistics模型y = a/(1 + be–cx),表征由微生物介导的Fe (Ⅲ) 还原过程。其中:x为培养时间;y为培养时间为x时体系中的Fe (Ⅱ) 浓度;a为体系中铁还原最大潜势;b为模型参数;c为反应速率常数。以0.25ac计算最大反应速率 (Vmax);以lnb/c计算最大反应速率对应的时间 (TVmax)。
|
表1 供试水稻土基本化学性质 (
|
 |
加载MATLAB 7.0中DOM Fluor工具箱对DOC的荧光光谱进行平行因子分析,使复杂的荧光光谱分解为单个物质组分,剪掉受散射峰影响的光谱区域,并用空白缺省值代替,采用残差分析及分半信度检验鉴定DOC的主要组分组成[18–19]。采用SPSS16.0进行方差分析及Pearson相关分析。依据冗余分析 (redundancy analysis,RDA),采用CANOCO4.5描述DOC各组分与Fe (Ⅲ) 还原过程的关系。排序中因变量包含不同水稻土的Fe (Ⅲ) 还原能力的特征参数a、Vmax、TVmax,自变量包含描述DOC的荧光光谱特征参数HIX、FI、β∶α、BIX及各组分的荧光强度值。
2 结果与分析 2.1 不同水稻土中水溶性有机碳含量及荧光特性 2.1.1 不同水稻土中水溶性有机碳含量从图2看出,不同水稻土DOC含量在0.250~1.082 g/kg的范围内变化,平均值为0.656 g/kg,且不同水稻土间DOC含量差异明显,变异系数为29.5%,其中SY水稻土中DOC含量最高,而CL水稻土中含量最低,不同水稻土间并没有因植稻区不同而呈现一定趋势,表明人为管理措施对水稻土DOC含量影响较为显著。DOC是SOC中最易被利用的组分,在不同水稻土的SOC中,DOC所占比例仅为2.06%~6.86%,变异系数高达1.558,然而DOC与SOC的相关关系并未达到显著水平,可能与不同水稻土有机质的组分和来源有关。
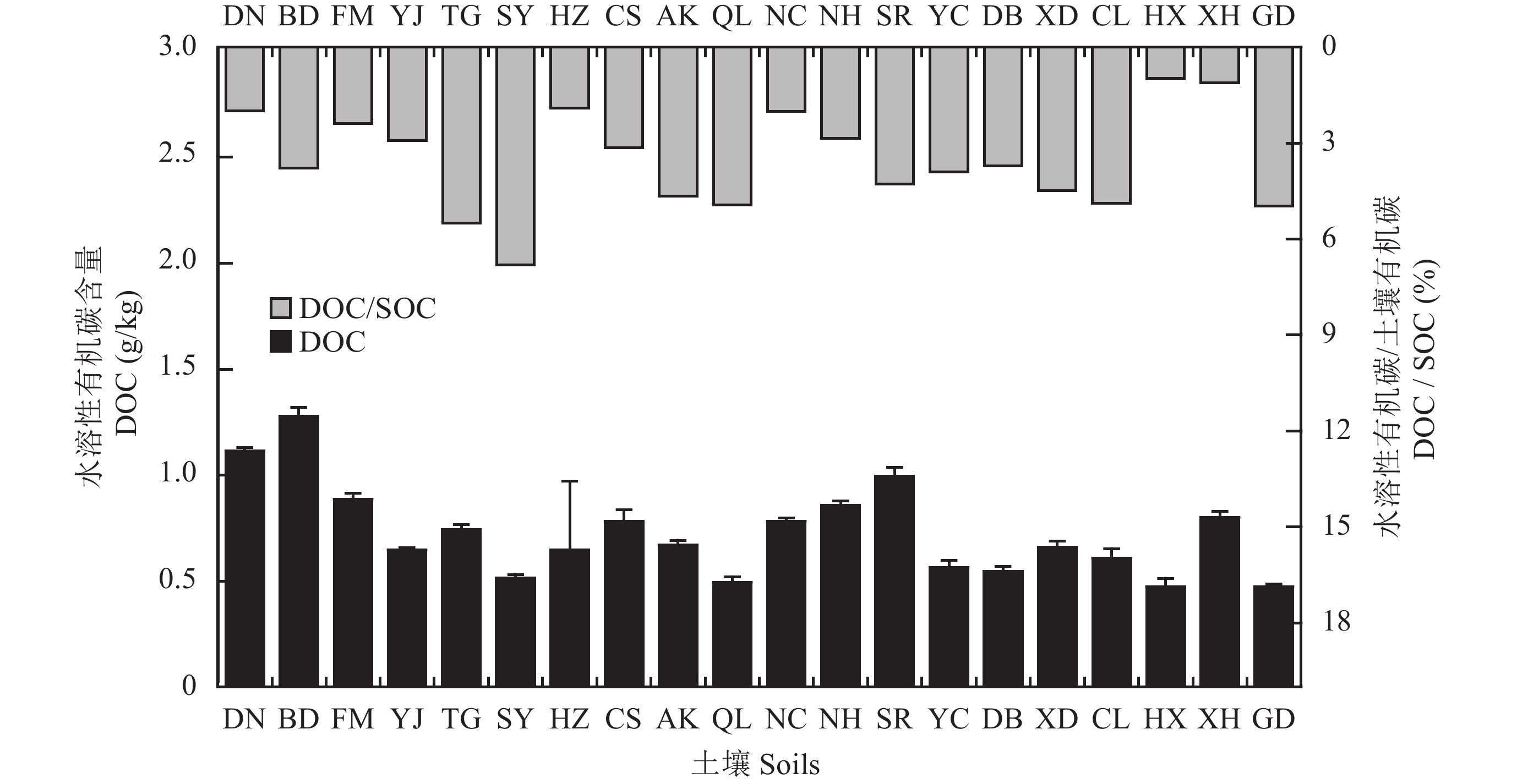 |
| 图2 不同水稻土中水溶性有机碳含量及其占土壤有机碳的比例 Fig. 2 Content of water dissolved organic carbon (DOC) and ratio of DOC to soil organic carbon (DOC/SOC) in paddy soils |
采用PARAFAC分析方法对DOC荧光光谱和组分特征进行分析,共鉴定出4个荧光组分,其激发–发射光谱特征及荧光强度的结果分别如图3、图4所示。依据文献,从图3中可以初步确定4种荧光物质均属于腐殖酸类组分[20]。C1 (330/420 nm) 属于普遍存在于环境中的UVC类腐殖酸,具有高分子量、高芳香性的特征,通常在湿地、森林土壤等环境中具有较高含量。其在不同水稻土DOC中含量最高,荧光强度为0.799~4.570,不同水稻土间差异明显,变异系数为36.82%。C2 (275和370/448 nm) 为代表陆源的类腐殖酸,在不同水稻土DOC中荧光强度与C1组分基本相当,为0.830~5.273,占4种组分总荧光强度的31.15%~41.72%。C3 (335和410/476 nm) 属于可见光区类腐殖酸,常见于淡水湖泊等环境中,可能与不同水稻土淹水时通过灌溉水引入DOC这一途径相关。其在不同水稻土DOC中荧光强度为0.465~3.164,变异系数为53.82%。C4 (290/414 nm) 属于低分子量的UVA水源腐殖酸,多见于水生环境中,通常与生物活性相关,但在废水、湿地及农田环境中也可以检测到。其荧光强度在不同水稻土DOC中的相对较低 (0.0531~0.730),为四种组分总荧光强度的1.07%~13.97%。在水稻土DOC 4种腐殖酸的组分中C1和C2为陆源组分,C3和C4代表水源组分。
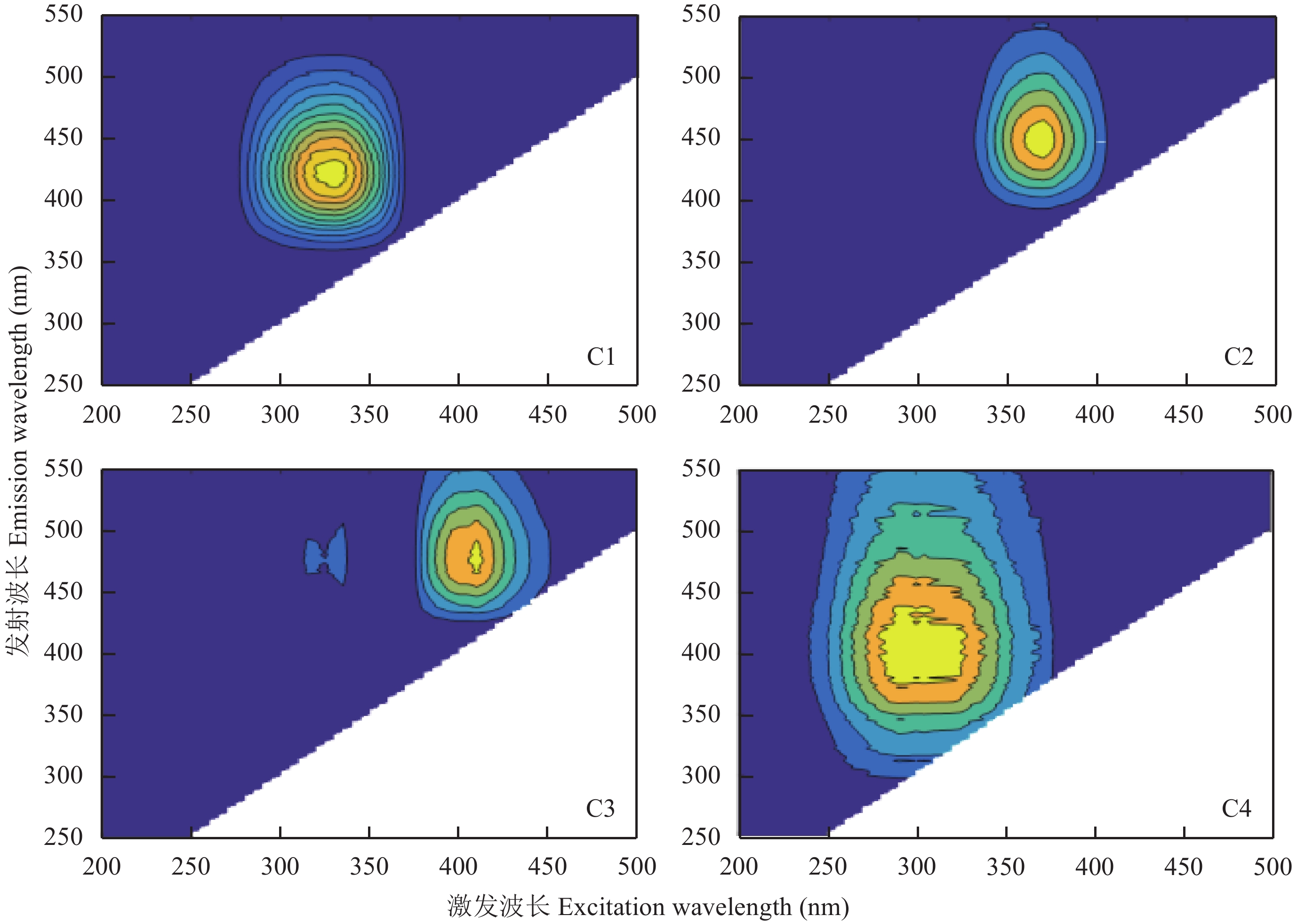 |
| 图3 水稻土水溶性有机碳中4种组分荧光光谱等值线 Fig. 3 Contour plots of the four fluorescent components obtained by PARAFAC in paddy soils |
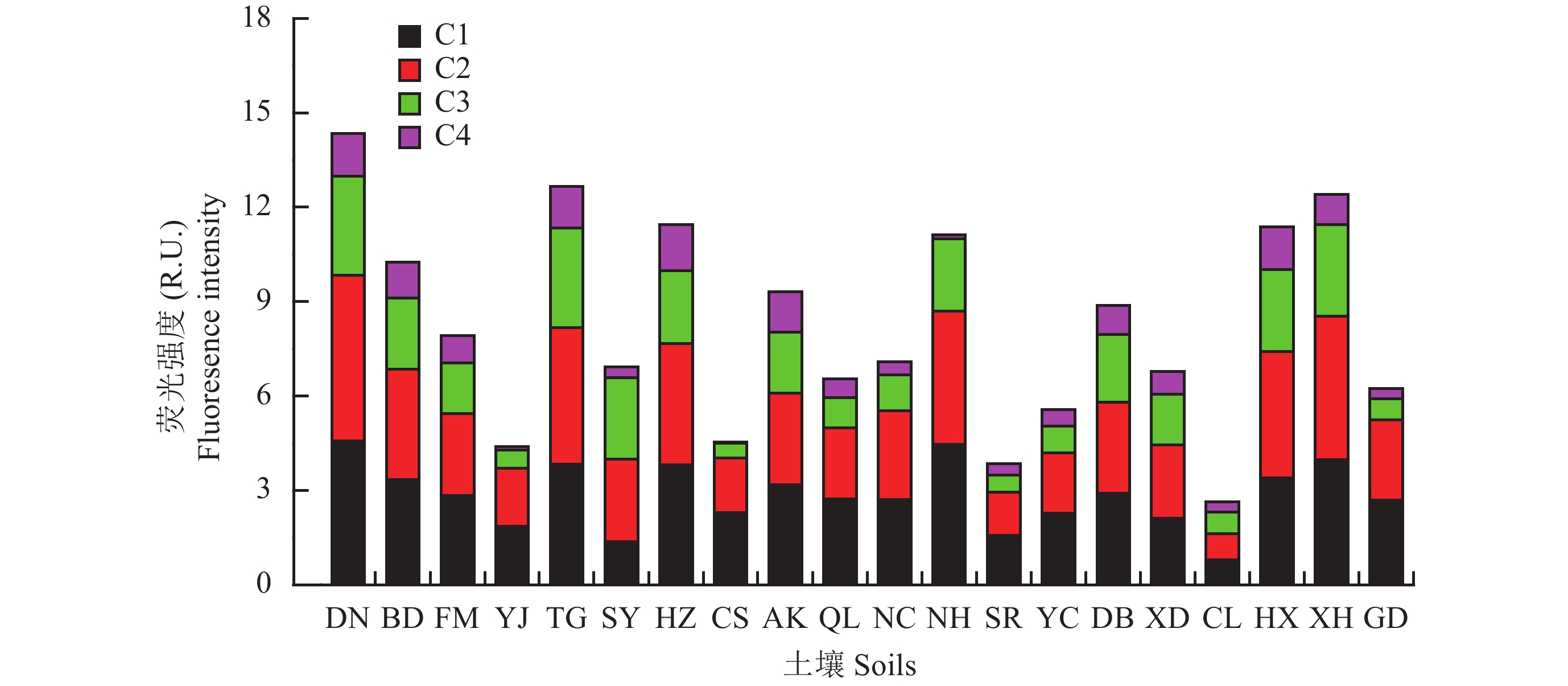 |
| 图4 不同水稻土水溶性有机碳中4种组分荧光强度 Fig. 4 Fluorescence intensity of four components identified with DOC Fluor-PARAFAC model in paddy soils |
从图5a看出,供试的20个水稻土DOC的FI值均低于1.5,除SY、SR和CL水稻土DOC的FI低于1.2外,其余水稻土的FI值均在1.2~1.5的范围内变化,表明风干的水稻土DOC的来源主要以外部输入为主,这与2.1.2中分析得到DOC中荧光特性较强的组分为陆源类腐殖酸 (C1、C2) 这一结果相一致。同时相关分析 (表2) 也表明,FI指数与组分C1的荧光强度呈显著正相关。从图5b看出,不同水稻土的腐殖化系数 (HIX) 在1.02~1.14的范围内变化,表明不同水稻土DOC的腐殖化程度较低,主要以自生源为主。HIX指数与组分C1、C2和C3荧光强度也均呈现出极显著或显著的正相关关系,表明不同水稻土DOC中C1、C2及C3组分的含量决定了DOC的腐殖化程度。图5c和5d中显示,不同水稻土DOC的β∶α值为0.680~0.812,BIX指数为0.680~0.811,表明水稻土的DOC较容易被利用,且微生物活动产生的新鲜有机碳对不同水稻土DOC的贡献相对较低,结合FI指数的结果,可以进一步说明不同水稻土DOC的来源以外源输入为主,微生物内源输入为辅。
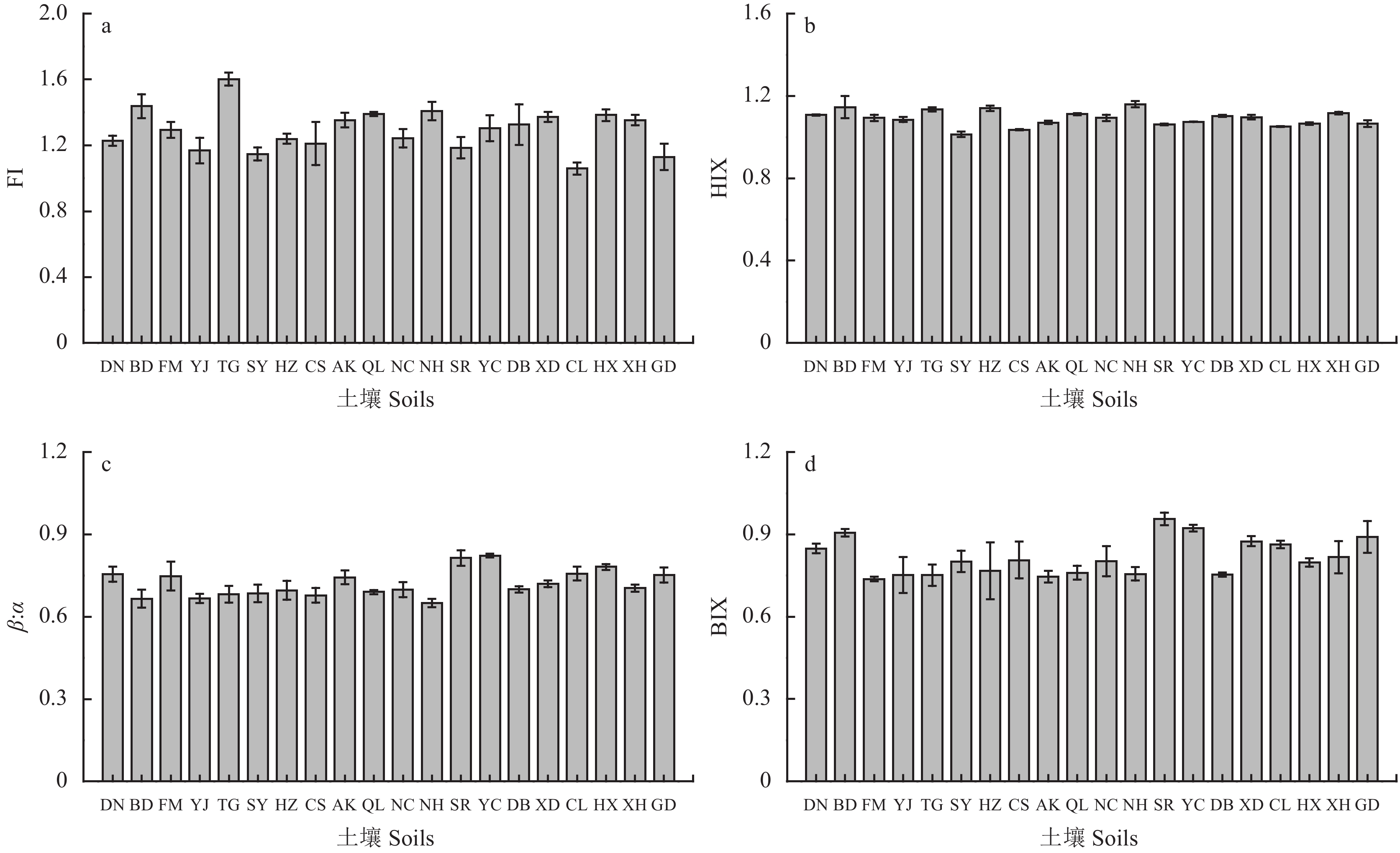 |
| 图5 不同水稻土水溶性有机碳光谱扫描参数 Fig. 5 Indices of the fluorescence properties of soil dissolved organic carbon |
不同水稻土厌氧培养过程中Fe (Ⅱ) 浓度随着淹水时间延长而快速增加,而后于厌氧培养的第10 d后逐渐趋于稳定或缓慢增加 (图6)。从图6看出,于厌氧培养5 d时,YC、CS、AK和DN水稻土中Fe (Ⅱ) 浓度为0.91~6.15 mg/g,为对应非晶态氧化铁含量的59.17%~93.10%,而其余16个水稻土中Fe (Ⅱ) 浓度均已超过对应水稻土中非晶态氧化铁的含量,为对应无定形氧化铁含量的104.76%~222.41%,表明淹水5 d时水稻土中易被还原的非晶态氧化铁已基本被还原。于厌氧培养第40 d时,各水稻土Fe (Ⅲ) 还原量为非晶态氧化铁和游离氧化铁总量的16.65%~69.00%。
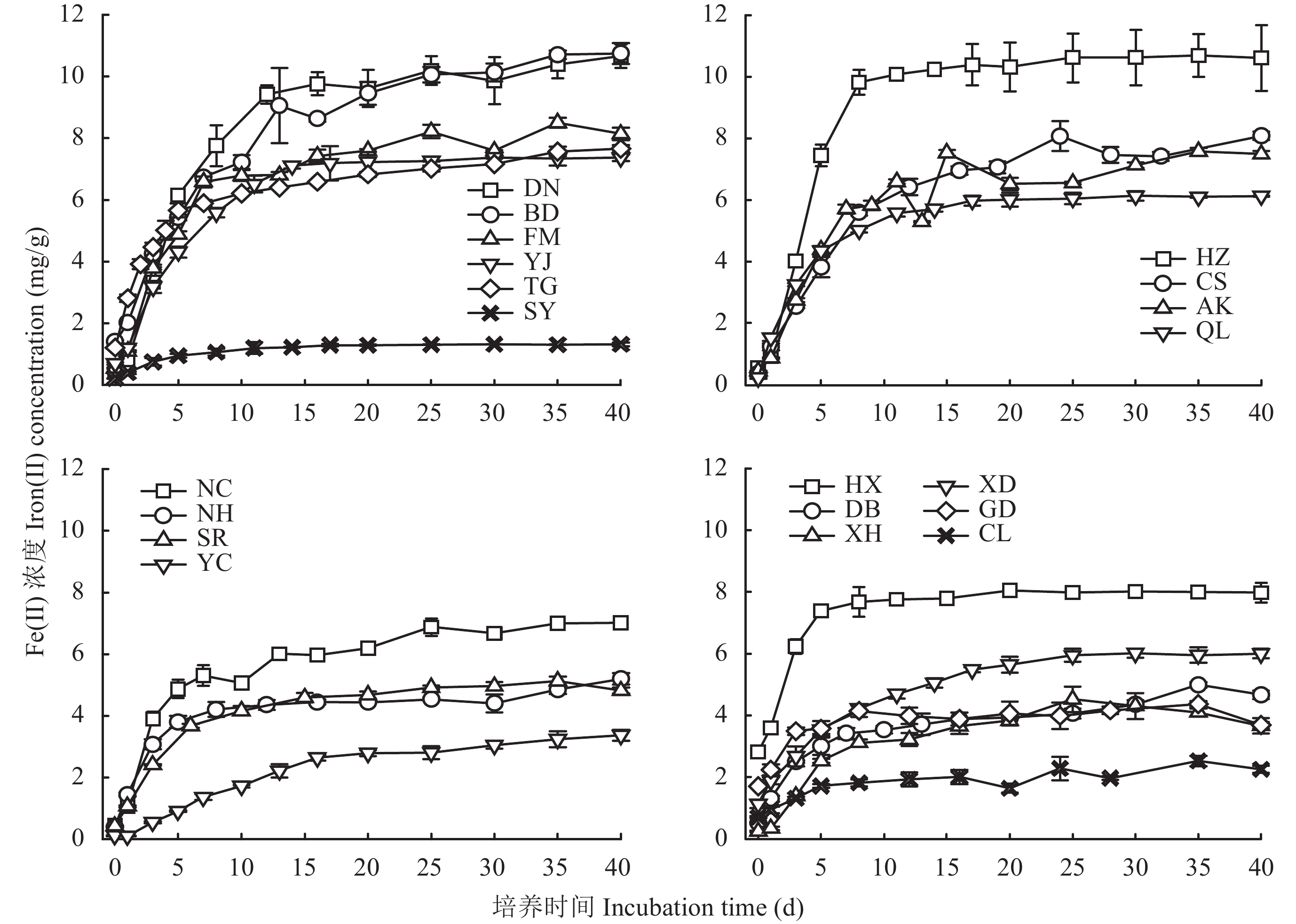 |
| 图6 不同水稻土厌氧培养过程中Fe (Ⅱ) 浓度的变化 Fig. 6 Variations in Fe (Ⅱ) concentrations in submerged paddy soils during anaerobic incubation |
比较不同水稻土厌氧培养过程中Fe (Ⅱ) 浓度随着淹水时间变化的Logistic模型参数发现 (表3),不同水稻土铁还原潜势a、最大Fe (Ⅲ) 还原速率 (Vmax) 及达到最大Fe (Ⅲ) 还原速率对应的时间 (TVmax) 差异明显,变异系数分别达42.48%、57.55%和50.87%。采自华中单双季稻稻作区的HZ水稻土a值最高为10.44 mg/g,并于厌氧培养的第3.76 d时达到Vmax1.94 mg/(g·d)。YC水稻土达到Vmax 0.19 mg/(g·d) 所需的时间最长,为9.21 d。采自东北单季稻稻作区的SY水稻土,因铁氧化含量较低,其a值为所有水稻土中的最低值,仅为1.27 mg/g,并于厌氧培养的第2.95 d时达到最低的Vmax 0.19 mg/(g·d)。另外,尽管在同一稻作区内,土壤采样点接近,但可能由于土壤性质之间的差异,不同土壤之间铁还原特征参数存在显著的差异,这一现象在采自华北单季稻稻作区的TG和BD水稻土之间,西北干燥单季稻稻作区的DB、XD和CL水稻土之间,以及西南单双季稻稻作区的HX和XH水稻土之间表现尤为明显。
| 表2 不同水稻土Fe (Ⅲ) 还原特征参数、水溶性有机碳特征参数及其各组分间的Pearson相关分析 Table 2 Pearson correlation among Logistic kinetics parameters of Fe (Ⅲ) reduction, indices of fluorescence properties and scores of four components identified with DOM Fluor-PARAFAC model in paddy soils |
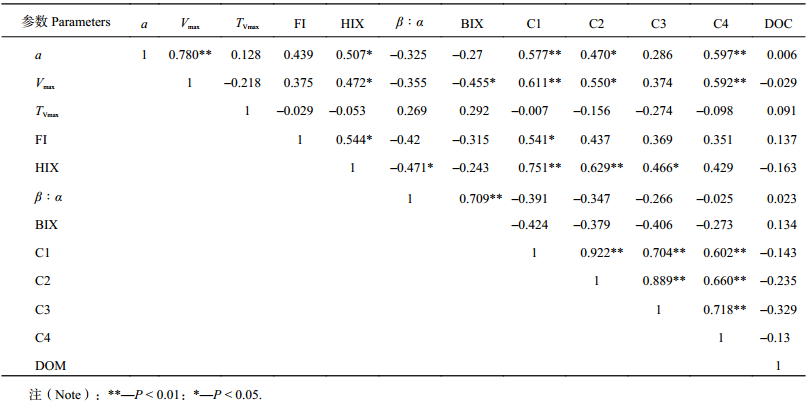 |
将不同水稻土DOC的光谱扫描参数与Fe (Ⅲ) 动力学参数进行关联分析 (表2) 发现,水稻土中DOC腐殖化系数HIX与Fe (Ⅲ) 还原最大反应速率Vmax呈显著正相关关系,与Fe (Ⅲ) 还原潜势a的相关性达到极显著正相关水平,表明水稻土DOC中腐殖酸含量越多、腐殖化程度越高,Fe (Ⅲ) 还原潜势和反应速率越高。同时还发现不同水稻土DOC中4个组分中C1、C2、C4组分各自的荧光强度与a和Vmax的相关性均达到显著或极显著水平。然而水稻土DOC的含量与Fe (Ⅲ) 还原特征参数间的相关关系不显著,可能是由于水稻土DOC中含有一定量的除腐殖质外的其他组分 (如糖类、丙酮酸、丁酸、柠檬酸小分子有机酸等)。另外,水稻土DOC的含量与荧光特性与达到Fe (Ⅲ) 还原最大反应速率对应时间 (TVmax) 的关系均未达到显著水平。
| 表3 水稻土厌氧培养过程中铁还原特征动力学拟合参数 Table 3 The Logistic kinetics parameters of microbial Fe (Ⅲ) reduction during anaerobic incubation of paddy soils |
 |
进一步对所研究的20个水稻土的Fe (Ⅲ) 还原特征参数和DOC的荧光特性参数及组分进行冗余分析 (图7),发现前两个排序轴共解释了变量的58.3%,其中第一排序轴解释了46.7%,表明与第一排序轴相关的DOC因子是主要的影响因素。从图中可以看出,与第一排序轴关系最为密切的是组分C2 (–0.597)、C1 (–0.579) 的荧光强度及腐殖化系数HIX (–0.507)。此外,组分C4和荧光指数FI也与第一排序轴关系较为密切,结合相关分析的结果,进一步表明了不同水稻土DOC中腐殖酸组分在决定Fe (Ⅲ) 还原潜势与铁还原最大反应速率时的作用。
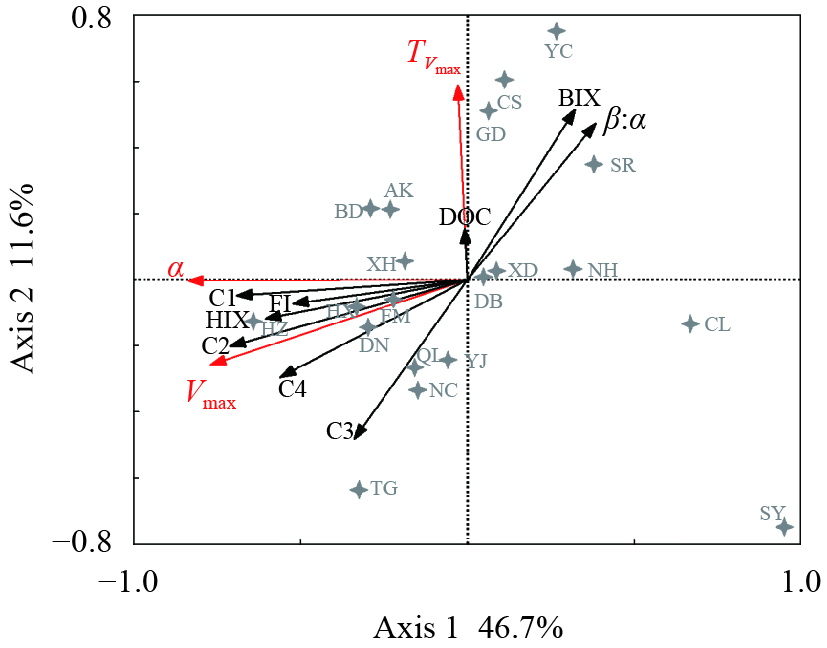 |
| 图7 不同水稻土Fe (Ⅲ) 还原特征与土壤环境因子冗余分析的二维排序图 Fig. 7 Bioplot of RDA ordinations for microbial Fe (Ⅲ) reduction characteristics of paddy soils and indices of fluorescence properties and scores of fours components |
淹水稻田中有机质是水稻土中进行兼性共代谢还原的前提,不仅为微生物生长提供能源,也为Fe (Ⅲ) 还原微生物提供电子。有研究表明,经历反复干湿交替的稻田中微生物兼性共代谢还原可能是Fe (Ⅲ) 还原的主要途径[10]。水溶性有机碳是土壤有机质中最易被微生物分解利用的组分。然而,易维洁等[21]证实在水稻土微生物利用其中含有的水溶性有机碳为唯一能源时微生物活动基本处于“钝化”状态,对Fe (Ⅲ) 的还原效率较低,至多能引起0.12 mmol Fe (Ⅲ) 被还原为Fe (II)。本研究中经测定不同水稻土水溶性有机碳含量为0.250~1.082 g/kg,占土壤总有机碳的比例仅为2.06%~6.86%,不同水稻土铁还原潜势达1.27~10.441 mg/g,且DOC的含量与Fe (Ⅲ) 还原特征参数间的相关关系不显著。此外,经测定本研究供试水稻土DOC中还原糖的含量为94~715 μg/g (以葡萄糖为单位表征),若以1 mol葡萄糖全部氧化可提供24 mol电子计算,DOC中能够提供给Fe (Ⅲ) 还原的电子为水稻土中Fe (Ⅲ) 微生物还原所需电子的11.9%~136.5% (均值为42.4%),其中85%的水稻土样品电子供给能力低于平均值。综上所述,大多数水稻土水溶性有机碳为Fe (Ⅲ) 还原提供电子的能力是有限的。
3.2 水溶性有机碳作为电子穿梭体对Fe (Ⅲ) 还原的作用Lovley早在1996年就证明了腐殖酸可以为包括Fe (Ⅲ) 还原在内的微生物呼吸过程传递电子[22]。众多研究报道,酚醌类基团是水溶性有机碳中具有电子传递能力的核心结构,其腐殖化程度较高,且经常被用作研究Fe (Ⅲ) 还原过程中电子穿梭体的模式物质[23–24]。陶亚等报道了水稻根际土中水溶性有机碳的电子接受能力为635.6 μmol/(g·C)、电子供给能力为34.1 μmol/(g·C),进一步证实了类腐殖酸物质荧光峰强度可作为自然环境中DOC电子转移活性表征的重要指标[25]。同时水稻土水溶性有机碳可经历多次的电子接受和电子供给循环而实现连续且可逆的电子转移[16, 26]。本研究中C1、C2、C4类腐殖酸组分荧光峰强度分别与Fe (Ⅲ) 还原潜势和Fe (Ⅲ) 还原最大反应速率呈显著或极显著正相关关系,这表明水稻土水溶性有机碳主要作为电子穿梭体在Fe (Ⅲ) 还原过程中起作用。
然而,并不是所有具有电子转移能力的组分可以参与到下一次的氧化–还原循环中,Bi等[16]发现森林土壤水溶性有机碳的电子循环率为48.15%~67.73%,而水稻土水溶性有机碳的电子循环率仅为36.7%,表明水溶性有机碳中可能含有具有不可逆电子转移能力的组分。本试验条件下,不同水稻土的腐殖化程度相对较低,容易被利用,且不同水稻土水溶性有机碳的HIX指数与β∶α指数显著负相关 (Pearson相关系数为–0.471)。因此,可以推断水稻土水溶性有机碳中具有不可逆电子转移能力的非醌类物质 (腐殖化程度相对较低) 含量较高。另外,在厌氧铁氧化物富集的土壤中,微生物介导的Fe (Ⅲ) 还原是除产甲烷外耦联有机质矿化的最重要的生物化学过程,水溶性有机碳中具有电活性的醌类基团参与到电子传递链中可能对铁循环耦联的碳循环具有重要的贡献[27]。
3.3 水稻土水溶性有机碳各腐殖酸类荧光组分的贡献研究发现污泥堆肥材料中水溶性有机碳的电子转移能力取决于其分子量的大小,表现为高分子量 (> 14000 Da) > 中等分子量 (3500~14000) > 低分子量 (< 3500) 的趋势,并且不同分子量大小的水溶性有机碳作为电子穿梭体从Fe (Ⅲ) 还原菌Shewanella putrefaciens 200和Klebsiella pneumoniae L17传递电子到铁氧化物的能力也呈现相似的趋势[28]。本试验条件下,经分析鉴定组分C1 (UVC陆源腐殖酸) 是高度芳香化的高分子量类腐殖酸,为水稻土水溶性有机碳中最主要的荧光组分之一,而组分C4为小分子量的UVA水源类腐殖酸,其荧光强度相对较低,因此可以推断组分C1较C4的电子传递能力强。Yuan等[28]还通过红外光谱 (FT-IR) 扫描发现高分子量水溶性有机碳中醌类结构显著高于中等分子量和低分子量水溶性有机碳。本研究中RDA分析结果显示,组分C1较组分C4对不同水稻土Fe (Ⅲ) 还原潜势的贡献强,与Yuan等[28]的结果相佐证。此外,在RDA分析的结果中,C2 (UVC + UVA陆源类腐殖酸) 组分对Fe (Ⅲ) 还原反应速率和Fe (Ⅲ) 还原潜势的作用与C1组分基本相当,而C3组分的贡献最小,说明不同水稻土水溶性有机碳的腐殖化程度和其中陆源的腐殖酸类组分的荧光强度与水稻土铁还原能力正相关。
4 结论不同水稻土水溶性有机碳含量为0.250~1.082 g/kg,并没有因植稻区不同而呈现出一定趋势,人为管理措施对水稻土水溶性有机碳含量影响较为显著。由DOC荧光光谱特征鉴定出2个陆源和2个水源类腐殖酸荧光组分,其来源以外源输入为主,内源输入为辅,且腐殖化程度较低,较易被微生物利用。水稻土中水溶性有机碳除了作为Fe (Ⅲ) 还原过程的电子供体外,其还以电子穿梭体的形式在Fe (Ⅲ) 还原过程中起重要作用。水溶性有机碳的腐殖化程度和其中各UVA和UVC腐殖酸类物质的荧光强度均与Fe (Ⅲ) 还原潜势、Fe (Ⅲ) 还原最大反应速率的相关关系达到显著或极显著水平;结合RDA的结果说明水溶性有机碳的腐殖化程度和其中陆源腐殖酸类组分的荧光强度与水稻土铁还原能力正相关。
| [1] | Lovley D K. Dissimilatory Fe (III)- and Mn(IV)-reducing prokaryotes[M]. New York: Springer, 2006. 635–658. |
| [2] | Kögel-Knabner I, Amelung W, Cao Z, et al. Biogeochemistry of paddy soils[J]. Geoderma, 2010, 157(1-2): 1–14. DOI:10.1016/j.geoderma.2010.03.009 |
| [3] | Weber K A, Achenbach L A, Coates J D. Microorganisms pumping iron: Anaerobic microbial iron oxidation and reduction[J]. Nature Reviews Microbiology, 2006, 4(10): 752–764. DOI:10.1038/nrmicro1490 |
| [4] | Achtnich C, Bak F, Conrad R. Competition for electron donors among nitrate reducers, ferric iron reducers, sulfate reducers, and methanogens in anoxic paddy soil[J]. Biology and Fertility of Soils, 1995, 19(1): 65–72. DOI:10.1007/BF00336349 |
| [5] | Li X, Zhang W, Liu T, et al. Changes in the composition and diversity of microbial communities during anaerobic nitrate reduction and Fe (II) oxidation at circumneutral pH in paddy soil[J]. Soil Biology and Biochemistry, 2016, 94: 70–79. DOI:10.1016/j.soilbio.2015.11.013 |
| [6] | Zhang J, Zhang Y, Chang J, et al. Biological sulfate reduction in the acidogenic phase of anaerobic digestion under dissimilatory Fe(III)-reducing conditions[J]. Water Reseach, 2013, 47(6): 2033–2040. DOI:10.1016/j.watres.2013.01.034 |
| [7] | Li Y, Yu S, Strong J, et al. Are the biogeochemical cycles of carbon, nitrogen, sulfur, and phosphorus driven by the " FeIII-FeII redox wheel” in dynamic redox environments? [J]. Journal of Soils and Sediments, 2012, 12(5): 683–693. DOI:10.1007/s11368-012-0507-z |
| [8] | Colombo C, Palumbo G, He J Z, et al. Review on iron availability in soil: Interaction of Fe minerals, plants, and microbes[J]. Journal of Soils and Sediments, 2013, 14(3): 538–548. |
| [9] |
李红岩, 高峰, 杨敏. 微生物异化Fe(III)还原及其作用机制研究[J].
环境科学与技术, 2011, 34(10): 100–105.
Li H Y, Gao F, Yang M. Review on microbial dissimilatory reduction of Fe(III) and its mechanism[J]. Envirnmental Science & Technology, 2011, 34(10): 100–105. DOI:10.3969/j.issn.1003-6504.2011.10.022 |
| [10] |
贾蓉. 水稻土中微生物发酵过程对氧化铁还原的贡献[D]. 陕西杨凌: 西北农林科技大学博士学位论文, 2017.
Jia R. Contribution of microbial fermentation to iron (III) reduction in submerged paddy soils [D]. Yangling, Shaanxi: PhD Dissertation of Northwest A&F University, 2017. |
| [11] | Ponnamperuma F N. The chemistry of submerged soils [A]. Brady N C. Advances in agronomy [M]. Waltham: Academic Press, Inc., 1972. 29–96. |
| [12] | Guggenberger G, Kaiser K. Dissolved organic matter in soil: Challenging the paradigm of sorptive preservation[J]. Geoderma, 2003, 113(3-4): 293–310. DOI:10.1016/S0016-7061(02)00366-X |
| [13] | Kaiser K, Guggenberger G, Haumaier L, et al. The composition of dissolved organic matter in forest soil solutions: Changes induced by seasons and passage through the mineral soil[J]. Organic Geochemistry, 2002, 33(3): 307–318. DOI:10.1016/S0146-6380(01)00162-0 |
| [14] | Lovley D R, Phillips E J. Organic matter mineralization with reduction of ferric iron in anaerobic sediments[J]. Applied & Environmental Microbiology, 1986, 51(4): 683–689. |
| [15] | Vurgos W D, Fang Y, Royer R A, et al. Reaction-based modeling of quinone-mediated bacterial iron (III) reduction[J]. Geochimica et Cosmochimica Acta, 2003, 67(15): 2735–2748. DOI:10.1016/S0016-7037(03)00105-4 |
| [16] | Bi R, Lu Q, Yu W, et al. Electron transfer capacity of soil dissolved organic matter and its potential impact on soil respiration[J]. Journal of Soils and Sediments, 2013, 13(9): 1553–1560. DOI:10.1007/s11368-013-0748-5 |
| [17] |
鲍士旦. 土壤农化分析(第三版)[M]. 北京: 中国农业出版社, 2007.
Bao S D. Soil and agricutural chemistry analysis (3rd Ed.) [M]. Beijing: China Agriculture Press, 2007. |
| [18] | Stedmon C A, Bro R. Characterizing dissolved organic matter fluorescence with parallel factor analysis: a tutorial[J]. Limnology and Oceanography, 2008, 6: 572–579. |
| [19] | Zhu T B, Duan P F, He J G, et al. Sources, composition, and spectroscopic characteristics of dissolved organic matter extracted from sediments in an anthropogenic-impacted river in Southeastern China[J]. Environmental Science and Pollution Research, 2017, 24(32): 25431–25440. DOI:10.1007/s11356-017-0224-7 |
| [20] | Chen J, Gu B, Leboeuf E J, et al. Spectroscopic characterization of the structural and functional properties of natural organic matter fractions[J]. Chemosphere, 2002, 48(1): 59–68. DOI:10.1016/S0045-6535(02)00041-3 |
| [21] |
易维洁, 曲东, 黄婉玉. 淹水培养时间对水稻土中Fe(III)还原能力的影响[J].
农业环境科学学报, 2010, 29(9): 1723–1729.
Yi W J, Qu D, Huang W Y, et al. Effect of flooding time on dissimilatory iron (III) reduction in different paddy soils[J]. Journal of Agro- Environment Science, 2010, 29(9): 1723–1729. |
| [22] | Lovley D R, Coates D. Humic substances as electron acceptors for microbial respiration[J]. Nature, 1996, 382: 445–448. DOI:10.1038/382445a0 |
| [23] | Watanabe K, Manefield M, Lee M, et al. Electron shuttles in biotechnology[J]. Current Opinion in Biotechnology, 2009, 20(6): 633–641. DOI:10.1016/j.copbio.2009.09.006 |
| [24] | Cory R M, McKnight D M. Fluorescence spectroscopy reveals ubiquitous presence of oxidized and reduced quinones in dissolved organic matter[J]. Environmental Science & Technology, 2005, 39(21): 8142–8149. |
| [25] |
陶亚, 袁田, 周顺桂, 等. 水溶性有机物电子转移能力与荧光峰强度的关系研究[J].
环境科学, 2012, 33(6): 1871–1877.
Tao Y, Yuan T, Zhou S G, et al. Relationship between electron transfer capacity and fluorescence characteristics of dissolved organic matter[J]. Environmental Science, 2012, 33(6): 1871–1877. |
| [26] | Yuan T, Yuan Y, Zhou S G, et al. A rapid and simple electrochemical method for evaluating the electron transfer capacities of dissolved organic matter[J]. Journal of Soils and Sediments, 2011, 11(3): 467–473. DOI:10.1007/s11368-010-0332-1 |
| [27] | Huang D Y, Zhuang L, Cao W D, et al. Comparison of dissolved organic matter from sewage sludge and sludge compost as electron shuttles for enhancing Fe (III) bioreduction[J]. Journal of Soils and Sediments, 2009, 10(4): 722–729. |
| [28] | Yuan Y, Zhou S G, Yuan T, et al. Molecular weight-dependent electron transfer capacities of dissolved organic matter derived from sewage sludge compost[J]. Journal of Soils and Sediments, 2012, 13(1): 56–63. |
 2018, Vol. 24
2018, Vol. 24  doi:
doi: 

