锌是动、植物必需的微量元素,因其参与代谢过程,故缺锌不利于动、植物的生长和发育[1–2],从根本上说人类摄取的所有营养元素都来自土壤–作物体系,而全球主要的农业生产体系中均存在不同程度的微量元素缺乏问题,其中土壤有效锌缺乏现象尤为突出,全球超过50%的耕地存在不同程度的缺锌[3–4]。众所周知,锌、磷之间存在显著的拮抗作用,磷肥的大量施用及其在土壤中的富集是影响作物锌营养的关键因素[5],而且由于高产品种的引入、化肥纯度的增加、有机肥投入减少,特别是近一二十年持续的磷肥投入使得局部地区土壤耕层有效磷大量累积,这在中国的中东部地区尤为明显[6]。研究表明,我国耕地中平均土壤有效磷含量 (Olsen-P) 30年间从原来的7.4 mg/kg已经增加至现在的24.7 mg/kg[7],造成土壤和作物锌等微量元素营养缺乏有加剧的趋势。
因此,如何缓解锌、磷元素之间的拮抗作用,促进作物对土壤中锌养分资源的吸收利用,建立锌营养强化的农业措施已经成为研究热点。
丛枝菌根 (arbuscular mycorrhizal,AM) 真菌是一类可与大多数陆地植物的根系形成共生体的真菌[8],可在土壤中形成大量纤细的菌丝,增大根际吸收范围和增强宿主植物对养分的吸收[9]。研究显示,AM真菌也能显著改善宿主植物的锌营养状况[10]。最近有研究发现,在低锌土壤中,植株体内高达24%的锌是通过菌丝途径进入的[11]。宿主植物与AM真菌形成共生体后,其对锌的吸收运转能力会加强,减缓高磷对锌的抑制作用[12]。因此,本试验设置不同的锌、磷浓度水平,探究接种AM真菌对锌、磷拮抗作用的影响,以期为揭示AM真菌缓解磷对锌拮抗作用的机理提供理论依据。
1 材料与方法 1.1 试验材料供试植物玉米 (Zea mays L.) 品种为‘精科糯2000’。种子用10% H2O2表面消毒10 min,随后用蒸馏水冲洗,在25℃恒温培养箱中催芽,种子露白1 cm左右进行播种。
供试AM真菌为(Glomus versiforme),是含有宿主植物根段、AM真菌孢子及根外菌丝体根际土壤 (北京市农林科学院植物营养与资源研究所微生物室提供)。接种剂是以河砂和土壤的混合物作为扩繁基质,以玉米、三叶草盆栽将原种扩大繁殖获得试验所需接种剂,孢子密度为每克20~30个。
供试土壤为重庆市江津区低磷酸性土。江津区位于重庆市西南部,地处北纬28°3l′~29°27′,东经105°49′~106°21′,距重庆市主城约50 km。土壤的基本性状为pH 4.9、有机质18.51 g/kg、有效磷8.73 mg/kg、有效锌1.59 mg/kg。
1.2 试验设计盆栽试验在西南大学资源环境学院网室中进行,每盆装土1.5 kg,接种处理每盆施菌剂100 g,对照处理施加同等质量的灭活菌剂。试验处理:3个施磷水平 (0、200、400 mg/kg,以P2O5计),2个施锌水平 (0、5 mg/kg),2个接菌水平[接菌 (+AM) 和不接菌 (–AM)],共12个处理,每个处理4次重复。所有处理控制氮肥水平为150 mg/kg,控制钾肥水平为100 mg/kg (以K2O计)。磷肥用普钙,锌肥用硫酸锌,氮肥用硝酸铵,钾肥用硫酸钾。试验在人工光照植物培养室内进行,生物镝灯补充光照 。
1.3 测定项目与方法植株生长50 d后收获,地上部和根系分开收获。根系用去离子水洗净,剪成1 cm左右的根段,混匀后随机取约1 g测定AM真菌侵染率,剩余样品105℃ 杀青30 min后70℃烘干,用于生物量与锌磷含量测定。AM真菌侵染率按照方格交叉法测定[13–14];植株锌磷含量的测定参照《土壤农业化学分析方法》[15]。
1.4 数据分析运用SPSS 18.0对试验数据进行三因素或单因素统计分析,5%水平下LSD多重比较检验各处理平均值之间的差异显著性。
2 结果与分析 2.1 接种AM真菌对玉米生长的影响表1结果表明,玉米生长受到施磷和接菌的显著影响,但施锌的影响不显著。不施锌条件下,与不施磷处理相比,施磷200、400 mg/kg时植株地上部生物量分别增加6.17、9.30倍,地下部生物量分别增加5.86、6.67倍;施锌5 mg/kg条件下,施磷对玉米植株生物量的影响也有相同趋势。
不施磷条件下,施锌0、5 mg/kg时,接种AM真菌处理植株地下部生物量分别提高2.05、1.46倍;但随着施磷水平增加,接菌的促生效应逐渐降低,施磷400 mg/kg时,接菌影响已不显著。接菌对植株地上部生长的影响有相同的趋势,同时也受到供磷水平的影响。
| 表1 不同处理下玉米植株生物量、侵染率、根冠比 Table 1 Dry biomass, root colonized percentage and root/shoot ratio of maize under different treatments |
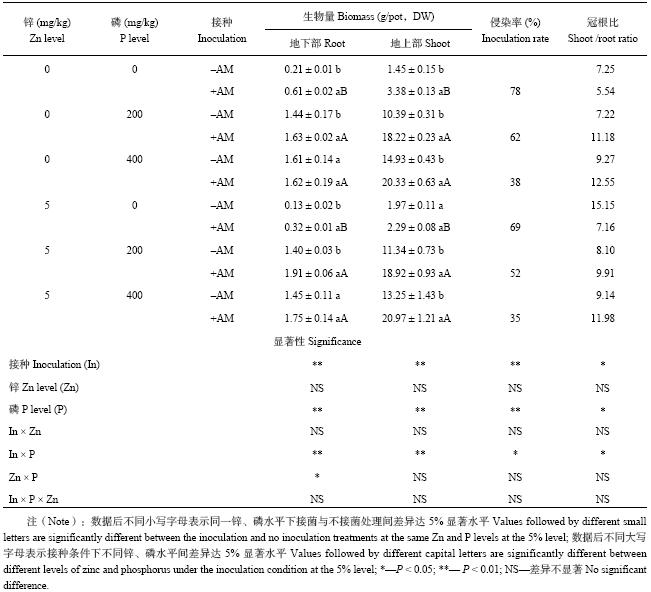 |
表2结果表明,玉米植株的锌营养状况受到施锌、施磷与接菌的显著影响。施锌显著增加玉米植株地上部、地下部的锌含量与地上部锌吸收量,而地下部的增加幅度要高于地上部。随着施磷水平的增加,地上部锌含量有下降趋势:施锌5 mg/kg条件下,施磷200 mg/kg、400 mg/kg处理与不施磷处理相比,锌含量分别降低了24%、29%。但地上部吸锌量随着供磷水平的增加有增加趋势,这是由于植株地上部生物量随着供磷水平增加而增加造成的;供磷水平对地下部锌含量的影响不显著,吸锌量随供磷水平呈增加的趋势也主要与生物量增加有关。不施锌条件下,供磷0、200 mg/kg时,接种AM真菌处理的植株地上部锌含量分别是未接菌对照的3.90倍与5.94倍,而提高施锌水平后,接菌对植株地上部锌含量的影响不显著,说明AM对宿主植物锌营养状况的影响受到土壤锌含量的影响。值得注意的是,整体上AM真菌对植株地下部锌含量的影响趋势与地上部相反,施锌条件下,三种施磷水平接种AM真菌均显著增加地下部锌含量;而不施锌条件下,接种AM与否差异不显著。这说明接种AM真菌对作物锌营养状况的作用除受土壤锌营养状况的影响外,也受其他因素影响。与不接菌处理相比,接种AM真菌提高了植株地上部、地下部的锌吸收量,这主要与植株生物量的提高有关。
| 表2 不同锌磷水平下接种菌根真菌对玉米植株锌吸收量和锌含量的影响 Table 2 Effects of the AM inoculation on Zn uptakes and Zn contents of maize under different Zn and P levels |
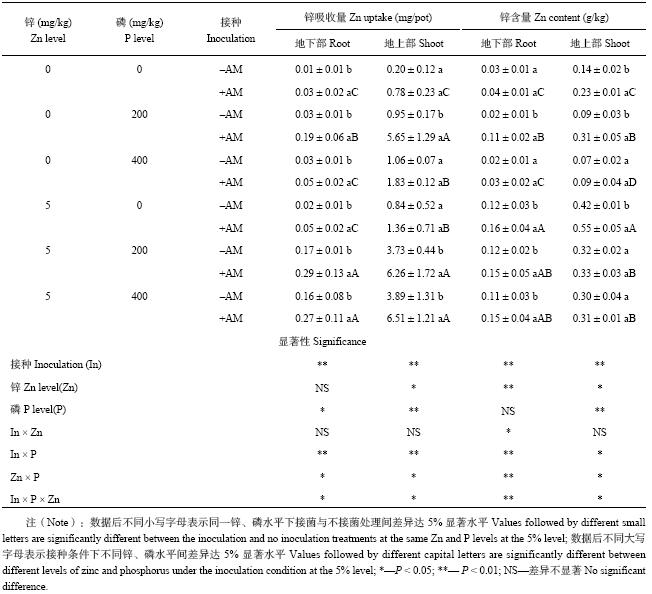 |
由表3可知,施锌对玉米植株地上部、地下部磷含量的影响均不显著,但显著影响植株的磷吸收量。不施磷条件下,施锌处理植株地上部与地下部的磷吸收量较不施锌处理分别降低了23%与5%。整体上,玉米植株地上部的磷含量随施磷水平的增加有升高的趋势,地上部与地下部的磷吸收量也均随施磷水平的增加而升高。
接种AM真菌显著提高玉米植株地上部的磷吸收量与含量,即便是施磷400 mg/kg条件下,植株地上部磷吸收量和含量在不施锌时较不接菌处理分别提高了75%、28%,在施锌为5 mg/kg时分别提高了200%、92%。植株地下部磷含量与吸收量也呈相同的增加趋势。
| 表3 不同处理对玉米植株磷吸收量和磷含量的影响 Table 3 Effects of different treatments on P uptakes and P contents of maize plants |
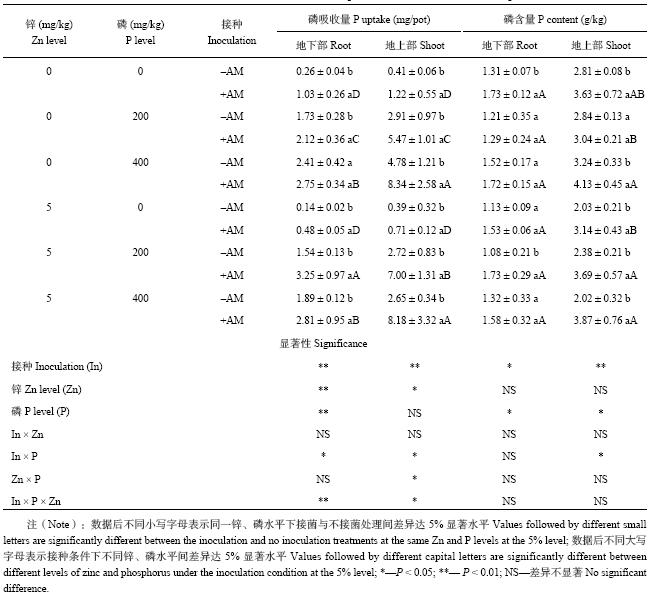 |
由于供试土壤的有效磷含量较低,且锌、磷拮抗作用会随着供磷水平的提高而增强[16],故本试验设置了较高的磷水平。试验结果表明,接种AM真菌显著促进了宿主植物玉米的生长,即便是高磷 (400 mg/kg) 条件下,也能显著增加玉米地上部生物量 (表1),这与其他研究呈现类似的结果[17],也显示了AM真菌在集约化高投入农业生产中的利用潜力[18]。众所周知,接种AM真菌能够改善宿主植物的磷营养状况[19]。本试验中,在供磷 200 mg/kg的条件下,接种AM真菌显著提高了玉米的磷吸收量和含量,但在高磷 (400 mg/kg) 条件下,接菌对地下部的磷吸收量和含量影响均不显著,这可能是因为土壤中磷含量过高会抑制AM真菌的发育,进而降低AM真菌对植物根系的侵染[20]。
随着施磷水平的不断提高,玉米植株的锌含量会逐渐下降,且地上部尤为显著 (表2)。玉米植株锌吸收量和含量的降低,表明磷对锌有拮抗作用,即土壤中磷含量的增加会影响作物对锌的吸收和转运[21–23]。在同等锌、磷条件下,接种AM真菌处理玉米植株锌含量和吸收量会显著提高,这与前人的研究结果相似[19]。在不施锌条件下,施磷200 mg/kg玉米植株地上部锌含量比不施磷时降低36%,与之相反,接种AM真菌后地上部锌含量增加35%,这说明AM真菌可以缓解锌、磷拮抗作用,提高植株对锌的吸收。这可能是由于AM真菌与作物根系形成的共生体增加了额外的运输介质[24],增加了植株对锌磷的吸收运转位点[21]。接种AM真菌后植物整体生理活性提高[25],根系吸收能力的整体提高使得宿主植物能够吸收更多的锌[26],这也说明当前条件下接菌缓解锌磷拮抗作用主要源于能增加吸收土壤中锌营养成分,对于是否能提高土壤中锌的有效性则有待于进一步的探究。值得注意的是,接种AM真菌虽然在施磷为0、200 mg/kg的条件下显著提高了玉米植株地上部锌吸收量,但在施磷400 mg/kg时影响不显著,说明AM真菌对锌磷拮抗作用的减缓还受到土壤供磷水平的影响。
综上所述,接种AM真菌能促进玉米植株的生长,且在一定条件下能有效缓解锌、磷之间的拮抗作用,改善植株的锌磷营养状况。但对AM真菌影响锌磷拮抗作用的机理还需要进一步的研究,随着分子生物学、生物化学等学科的发展与交叉,可为我们探求其机理提供一些新的研究思路。
| [1] | Alloway B J, Baumgarten A, Steinnes E, et al. Soil factors associated with zinc deficiency in crops and humans[J]. Environmental Geochemistry and Health, 2009, 31(5): 537–548. DOI:10.1007/s10653-009-9255-4 |
| [2] | Prasad R. Zinc biofortification of food grains in relation to food security and alleviation of zinc malnutrition[J]. Current Science, 2010, 98(10): 1300–1304. |
| [3] | Sadeghzadeh B, Rengel Z. Zinc in soils and crop nutrition [M]. Wiley-Blackwell, 2011. 335–375. |
| [4] | Cakmak I. Enrichment of cereal grains with zinc: Agronomic or genetic biofortification?[J]. Plant and Soil, 2008, 302(1): 1–17. |
| [5] | Gao X P, Akhter F, Tenuta M, et al. Mycorrhizal colonization and grain Cd concentration of field-grown durum wheat in response to tillage, preceding crop and phosphorus fertilization[J]. Journal of the Science of Food and Agriculture, 2010, 90(5): 750–758. |
| [6] | Macdonald G K, Bennett E M, Potter P A, et al. Agronomic phosphorus imbalances across the world's croplands[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(7): 3086–3091. DOI:10.1073/pnas.1010808108 |
| [7] | Li H, Huang G, Meng Q, et al. Erratum to: Integrated soil and plant phosphorus management for crop and environment in China. A review[J]. Plant and Soil, 2013, 349(1): 157–167. |
| [8] | Abbott L K, Robson A D. Factors influencing the occurrence of vesicular-arbuscular mycorrhizas[J]. Agriculture Ecosystems and Environment, 1991, 35(2-3): 121–150. DOI:10.1016/0167-8809(91)90048-3 |
| [9] | Jansa J, Mozafar A, Frossard E. Long-distance transport of P and Zn through the hyphae of an arbuscular mycorrhizal fungus in symbiosis with maize[J]. Agronomie, 2003, 23(5-6): 481–488. DOI:10.1051/agro:2003013 |
| [10] | Lehmann A, Veresoglou S D, Leifheit E F, et al. Arbuscular mycorrhizal influence on zinc nutrition in crop plants—A meta-analysis[J]. Soil Biology & Biochemistry, 2014, 69: 123–131. |
| [11] | Watts-Williams S J, Smith F A, Mclaughlin M J, et al. How important is the mycorrhizal pathway for plant Zn uptake?[J]. Plant and Soil, 2015, 390(1-2): 157–166. DOI:10.1007/s11104-014-2374-4 |
| [12] | Marschner H. Mineral nutrition of higher plants[J]. Journal of Ecology, 1995, 76(4): 681–861. |
| [13] | Phillips J M, Hayman D S. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection[J]. Transactions of the British Mycological Society, 1970, 55: 158–163. DOI:10.1016/S0007-1536(70)80110-3 |
| [14] | Giovannetti M, Mosse B. Evaluation of techniques for measuring vesicular arbuscular mycorrhizal infection in roots[J]. New Phytologist, 1980, 84(3): 489–500. DOI:10.1111/j.1469-8137.1980.tb04556.x |
| [15] |
鲁如坤. 土壤农业化学分析方法 [M]. 北京:中国农业科技出版社, 2000. 312–314.
Lu R K. Methods of soil and agro-chemistry analysis [M]. Beijing: China Agricultural Science Technology Press, 2000, 312–314. |
| [16] | Ova E A, Kutman U B, Ozturk L, et al. High phosphorus supply reduced zinc concentration of wheat in native soil but not in autoclaved soil or nutrient solution[J]. Plant and Soil, 2015, 393(1): 147–162. |
| [17] |
陈梅梅, 陈保冬, 王新军, 等. 不同磷水平土壤接种丛枝菌根真菌对植物生长和养分吸收的影响[J].
生态学报, 2009, 29(4): 1980–1986.
Chen M M, Chen B D, Wang X J, et al. Influences of arbuscular mycorrhizal fungi (AMF) on the growth and ecological stoichiometry of clover and ryegrass grown in monoculture or in mixture at different phosphorus (P) levels[J]. Acta Ecologica Sinca, 2009, 29(4): 1980–1986. |
| [18] |
冯固, 张福锁, 李晓林, 等. 丛枝菌根真菌在农业生产中的作用与调控[J].
土壤学报, 2010, 47(5): 995–1004.
Feng G, Zhang F S, Li X L, et al. Functions of arbuscular mycorrhizal fungi in agriculture and their manipulation[J]. Acta Pedologica Sinica, 2010, 47(5): 995–1004. DOI:10.11766/trxb200907220329 |
| [19] | Watts–Williams S J, Cavagnaro T R. Uptake of zinc and phosphorus by plants is affected by zinc fertiliser material and arbuscular mycorrhizas[J]. Plant and Soil, 2014, 376(1): 165–175. |
| [20] | Chen B, Jakobsen I. Mycorrhiza and root hairs in barley enhance acquisition of phosphorus and uranium from phosphate rock but mycorrhiza decreases root to shoot uranium transfer[J]. New Phytologist, 2005, 165(2): 591–598. |
| [21] | Zhu Y G, Smith S E, Smith F A. Zinc (Zn)-phosphorus (P) interactions in two cultivars of spring wheat (Triticum aestivum L.) differing in P uptake efficiency [J]. Annals of Botany, 2001, 88(5): 941–945. DOI:10.1006/anbo.2001.1522 |
| [22] | Verma T S, Minhas R S. Zinc and phosphorus interaction in a wheat-maize cropping system[J]. Nutrient Cycling in Agroecosystems, 1987, 13(1): 77–86. |
| [23] | Cakmak I, Marschner H. Mechanism of phosphorus-induced zinc deficiency in cotton. III. Changes in physiological availability of zinc in plants is mail[J]. Physiologia Plantarum, 1987, 70(1): 13–20. DOI:10.1111/ppl.1987.70.issue-1 |
| [24] | Grønlund M, Albrechtsen M, Johansen I E, et al. The interplay between P uptake pathways in mycorrhizal peas: a combined physiological and gene-silencing approach[J]. Physiologia Plantarum, 2013, 149(2): 234–248. DOI:10.1111/ppl.2013.149.issue-2 |
| [25] | Koch M, Tanami Z, Bodani H, et al. Field application of vesicular-arbuscular mycorrhizal fungi improved garlic yield in disinfected soil[J]. Mycorrhiza, 1997, 7(1): 47–50. DOI:10.1007/s005720050162 |
| [26] | Clark R B, Zeto S K. Mineral acquisition by arbuscular mycorrhizal plants[J]. Journal of Plant Nutrition, 2000, 23(7): 867–902. DOI:10.1080/01904160009382068 |
 2018, Vol. 24
2018, Vol. 24  doi:
doi: 

