2. 山东农业大学化学与材料科学学院,山东泰安 271018
2. College of Chemistry and Material Science, Shandong Agricultural University, Taian, Shandong 271018, China
近年来,随着苹果产业的发展、果园树种的更换和矮化密植栽培的要求,受土地资源稀缺的现状限制,果园进行连作栽培在所难免。但是,在同一块土地连续种植同一种作物或近亲缘作物,即使在正常的栽培管理条件下也会出现树势生长变弱、病虫害加剧、产量降低、品质下降等现象,即连作障碍。苹果连作障碍在世界各苹果主产区普遍发生,已成为各苹果优势产区一个普遍存在、亟需解决的生产问题[1]。越来越多研究认为土壤微生物群落结构的改变,尤其是土壤有害真菌的大量繁殖,是引起苹果连作障碍的主要原因[2–3]。目前生产上克服连作障碍行之有效的方法主要有土壤熏蒸和轮作。常用的土壤熏蒸剂如溴甲烷,具有化学性质稳定、穿透力强的特点,能有效防治真菌、细菌、线虫以及啮齿动物等各种土壤有害生物和杂草,且可有效缓解连作障碍,但是溴甲烷会损害臭氧层,因此逐步被淘汰[4],轮作耗时较长,生产中不易推广。因此,寻求安全有效的缓解和克服苹果连作障碍的措施非常重要。
生物炭 (biochar) 是秸杆、稻壳、城市废弃物等生物质在缺氧或低氧条件下热裂解的产物,对土壤理化性质改良、微生物群落调控以及提高农作物产量等方面具有良好的效果[5–6]。顾美英等[7]研究发现施用生物炭,能提高新疆灰漠土和风沙土连作棉田根际土壤养分和微生物多样性,Wang等[8]研究发现单施生物炭能减少连作土壤中有害酚酸类物质的积累,提高连作条件下苹果幼苗的生物量及光合作用,对缓解连作障碍有一定的效果。有机肥可以改善根际土壤微生态环境,减轻作物的自毒作用,进而缓解连作障碍[4, 9]。目前土壤中使用生物炭和有机肥促进作物生长发育的文献较多,但关于二者同时使用是否可以更显著地改善苹果连作土壤环境、促进幼苗生长,以及缓解连作障碍现象未见报道。因此,本试验以苹果连作土壤经溴甲烷熏蒸灭菌后作为高标准对照,以平邑甜茶为试材,在盆栽条件下,研究生物炭复合有机肥这种综合措施对连作条件下平邑甜茶幼苗生物量以及土壤真菌群落结构的影响,探索防治连作障碍效果能替代溴甲烷的措施[4],以期为苹果连作障碍的防控提供理论依据。
1 材料与方法 1.1 试验材料与设计试验于2015年在山东农业大学南校区国家苹果工程中心实验站进行。试验用土取自山东省泰安市岱岳区夏张镇王小庄村25年生红富士苹果园,砧木为八棱海棠 (Malus micromalus),土壤类型为棕壤土,土壤pH为6.20,速效钾含量141.33 mg/kg,速效磷含量43.68 mg/kg,土壤硝态氮含量13.42 mg/kg,铵态氮含量3.56 mg/kg,有机质含量6.45 g/kg。连作土收集距树干1 m、深5—40 cm范围内的土壤,多点取样混匀使用。
生物炭采用炭化稻壳,购自安徽宣城家乐米业有限公司。有机肥由烟台市绿源有机肥有限公司提供,其中有机质含量 > 50%,N、P 2O5和K2O含量大于6%。
平邑甜茶 (Malus hupehensis Rehd.) 种子于4℃层积处理30 d左右,待种子露白后,于2015年3月2日播种于育苗基质中。
参照本课题组前期关于生物炭和有机肥的试验结果,设计本试验有机肥和生物炭的用量[10–11]。本试验共设5个处理:连作土壤 (CK);连作土用溴甲烷熏蒸处理 (F);连作土 + 2%有机肥 (OF);连作土 + 2%生物炭 (B);连作土 + 2%有机肥 + 2%生物炭 (BOF)。待幼苗长至6片真叶时,选取长势一致、无病虫害的幼苗移栽到装有7.0 kg不同处理土壤的泥盆 (直径24 cm、高18 cm) 中,每个处理7盆,每个处理重复3次,共计21盆,每盆栽植2株幼苗,采用滴灌浇水,试验期内不再添加无机肥料。
1.2 测定方法连作土壤处理后,栽植幼苗生长115 d取样测定植株生物量及根系指标。同时取土壤样品,每处理样品随机取5盆,等量混匀,分别制成3个平行样本。土样过2 mm筛,分2部分保存,一部分风干,用于土壤酶活的测定;另一部分带回实验室–20℃冰箱保存,用于提取DNA,分析土壤中微生物多样性。
生物量:用直尺和游标卡尺分别测定平邑甜茶幼苗的株高和地径,干鲜重使用电子天平进行测定。随机测定每个处理的5株幼苗,重复3次。
根呼吸速率的测定:采用Oxy-Lab氧电极自动测定系统进行测定,将0.05 g的幼苗根系切成大小均匀的小段 (1.0 mm),放入氧电极 (Hansatech Qxytherm System) 反应杯中,加入1.5 mL反应介质,启动磁转子后开始测定。3~5 min后停止测定,根据记录曲线得到单位时间内氧的变化量,根据根的质量和反应介质体积计算出样品的呼吸速率[12]。每处理重复3次。
根系指标测定:用水小心洗净根系,将根系平铺于透明硬塑料板上,在水中将根系展开,用专业版WinRHIZO (2007年版) 根系分析系统获取根系扫描图形,记录总根长、平均根直径、根尖数以及总表面积,重复3次。
土壤脲酶活性测定采用比色法,以24 h后1 g土壤中NH3-N的质量表示脲酶活性;磷酸酶活性测定采用磷酸苯二钠比色法,以1 g土壤的酚毫克数表示磷酸酶活性;蔗糖酶活性测定采用比色法,以24 h后1 g土壤中葡萄糖的质量表示蔗糖酶活性[13]。
土壤真菌多样性测定:准确称取0.1 g土样,按照E.Z.N.A.TM Soil DNA Kit (Omega,美国) 试剂盒的方法提取土壤微生物总DNA,利用1.2%琼脂糖凝胶电泳检测提取基因组DNA的完整性,并用Nanodrop 2000 (美国) 检测DNA浓度。利用真菌的通用引物:ITS1F 5′-CTTGGTCATTTAGAGGAAGTAA-3′和ITS1R 5′-GCTGCGTTCTTCATCGATGC-3′进行PCR扩增,并用1.2%琼脂糖凝胶电泳检测,检测效果较好的样本于2%琼脂糖凝胶电泳切胶回收纯化,定量均一化后完成文库构建,用Illumina MiSeq 2 x 300 bp平台进行测序,该工作在微基生物科技 (上海) 有限公司完成。将相似性等于或大于97%的序列 (3% cutoff) 归为同一分类单元OUT,利用Mothur (Version 1.33.2) 进行Alpha多样性分析,包括Chao、Ace等物种丰富度统计和Shannon、Simpson等物种多样性统计[5]。
土壤中尖孢镰刀菌数量:根据苹果尖孢镰刀菌菌株测序结果,在GenBank进行BLast同源比对,根据NCBI基因库中尖孢镰刀菌保守序列用Premer Premier5.0软件设计PCR引物,正向引物序列:GTG AAC ATA CCA CTT GTT GCC TC,反向引物序列:GAG TCC CAA CAC CAA GCT GTG,送上海生工生物工程技术服务有限公司合成。按照赵永坡等[14]方法测定不同处理土壤中尖孢镰刀菌的基因拷贝数。
1.3 统计分析通过SPSS 19.0进行方差分析,采用Duncan′s新复极差法进行差异显著性检测,用Microsoft Excel 2003完成对试验数据的制图。
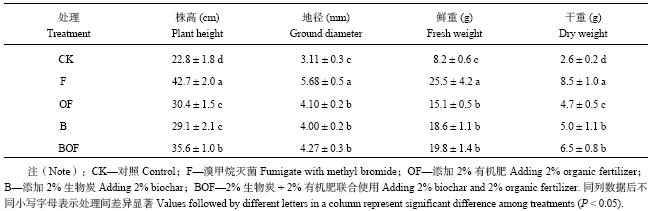
2 结果与分析 2.1 不同处理对平邑甜茶幼苗生物量的影响由表1可以看出,连作土壤经过溴甲烷灭菌后,幼苗的株高、地径、鲜重和干重均远远高于连作土,分别是连作土中幼苗的1.9倍、1.8倍,3.1倍和3.3倍。经生物炭、有机肥或者二者复合处理后,幼苗生物量虽然不如F处理的效果好,但是也明显高于连作土对照。其中,BOF这种复合措施处理连作土后,幼苗生长效果比单一施加效果显著。
| 表1 生物炭配施有机肥对平邑甜茶幼苗生长的影响 Table 1 Effects of biochar combined with organic fertilizer on Malus hupehensis Rehd. seedling growth |
 |
由图1可以看出,灭菌处理后,根系呼吸速率依然是最高的,为对照的1.8倍,而单施有机肥和生物炭也可以提高幼苗根系呼吸速率,分别为对照的1.2和1.3倍,当两者复合施用,则可使根系呼吸速率提高至对照的1.5倍。
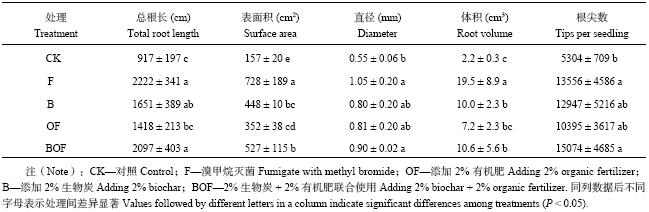
2.3 不同处理对平邑甜茶幼苗根系指标的影响由表2可以看出,各处理均可增加总根长、根系表面积、根体积及根尖数。总根长、根系表面积、根体积、根尖数等在根系吸收和利用土壤养分中至关重要。连作土壤灭菌后,幼苗根系各指标明显增加。经生物炭、有机肥或者二者复合处理后,幼苗总根长、根体积以及表面积虽然不如F处理的效果好,但是也明显高于连作土对照,其中BOF处理效果最好,分别是对照的2.3、4.8和3.4倍。
2.4 不同处理对土壤酶活性的影响由图2可以看出,经过熏蒸灭菌后,土壤酶活性在测定的生长期内与对照相比呈下降趋势,而加入生物炭、有机肥以及二者复合使用,均提高了土壤酶活性。生物炭复合有机肥同时施用,更能明显地提高土壤酶活性,与对照相比,脲酶、蔗糖酶和磷酸酶活性分别提高了1.1倍、1.3倍和1.9倍。溴甲烷灭菌后土壤酶活性最低。
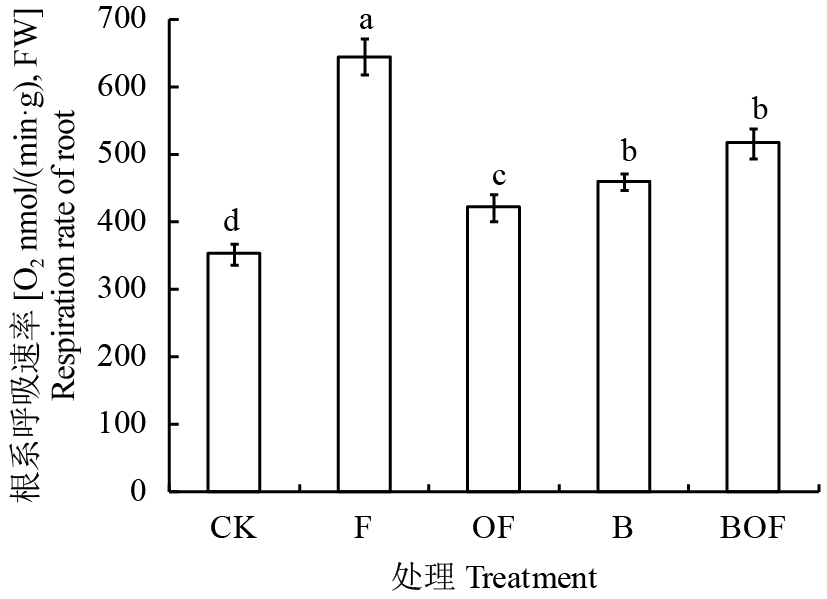 |
| 图1 生物炭配施有机肥对平邑甜茶幼苗根系呼吸速率的影响 Fig. 1 Effects of biochar combined with organic fertilizer on the respiration of seedling roots [注(Note):CK—对照Control;F—溴甲烷灭菌Fumigate with methyl bromide;OF—添加2%有机肥Adding 2% organic fertilizer;B—添加2%生物炭Adding 2% biochar;BOF—2%生物炭 + 2%有机肥联合使用Adding 2% biochar and 2% organic fertilizer.方柱上不同字母表示处理间差异显著 (P < 0.05) Different letters above the bars indicate significant differences among treatments (P < 0.05)] |
| 表2 生物炭配施有机肥对幼苗根系指标的影响 Table 2 Root indexes as affected by combined application of biochar and organic fertilizer |
 |
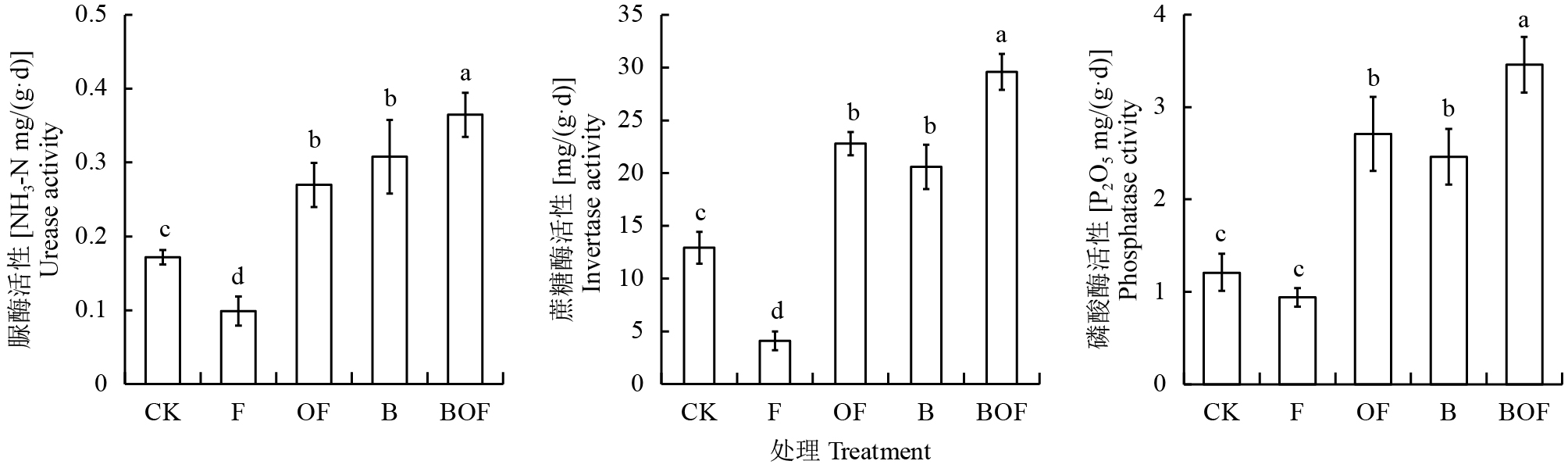 |
| 图2 生物炭配施有机肥对土壤酶活性的影响 Fig. 2 Effects of biochar combined with organic fertilizer on the soil enzyme activities [注(Note):方柱上不同字母表示处理间差异显著 (P < 0.05) Different letters above the bars indicate significant differences among treatments (P < 0.05).] |
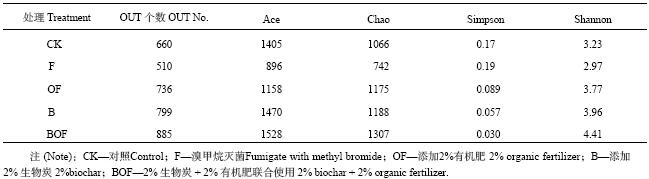
在97%的相似度下,得到了每个处理样品真菌的OUT数 (表3)。连作土、灭菌土、生物炭、有机肥以及生物炭复合有机肥处理的土壤分别获得660、510、799、736和885个真菌OUT。Ace指数、Chao指数、Simpson指数和Shannon指数可反映土壤微生物群落丰富度和多样性。由表3可以看出,添加生物炭或者有机肥之后,土壤中的真菌群落丰富度和多样性均明显增加,生物炭复合有机肥对土壤真菌丰富度和多样性的提高效果最为显著。
连作土壤经过溴甲烷熏蒸处理后,其真菌呈现一个单独的群落 (图3);生物炭、有机肥处理后,土壤中的真菌群落也明显与连作对照土壤中不同,二者共同施用,土壤真菌群落明显与其他处理分开,形成一个单独群落,这表明该真菌的群落结构与对照差异越大 (图3)。
| 表3 生物炭复合有机肥处理的土壤真菌群落丰富度和多样性指数 Table 3 Soil fungal OUTs’ abundance and diversity indexes under biochar combined with organic fertilizer |
 |
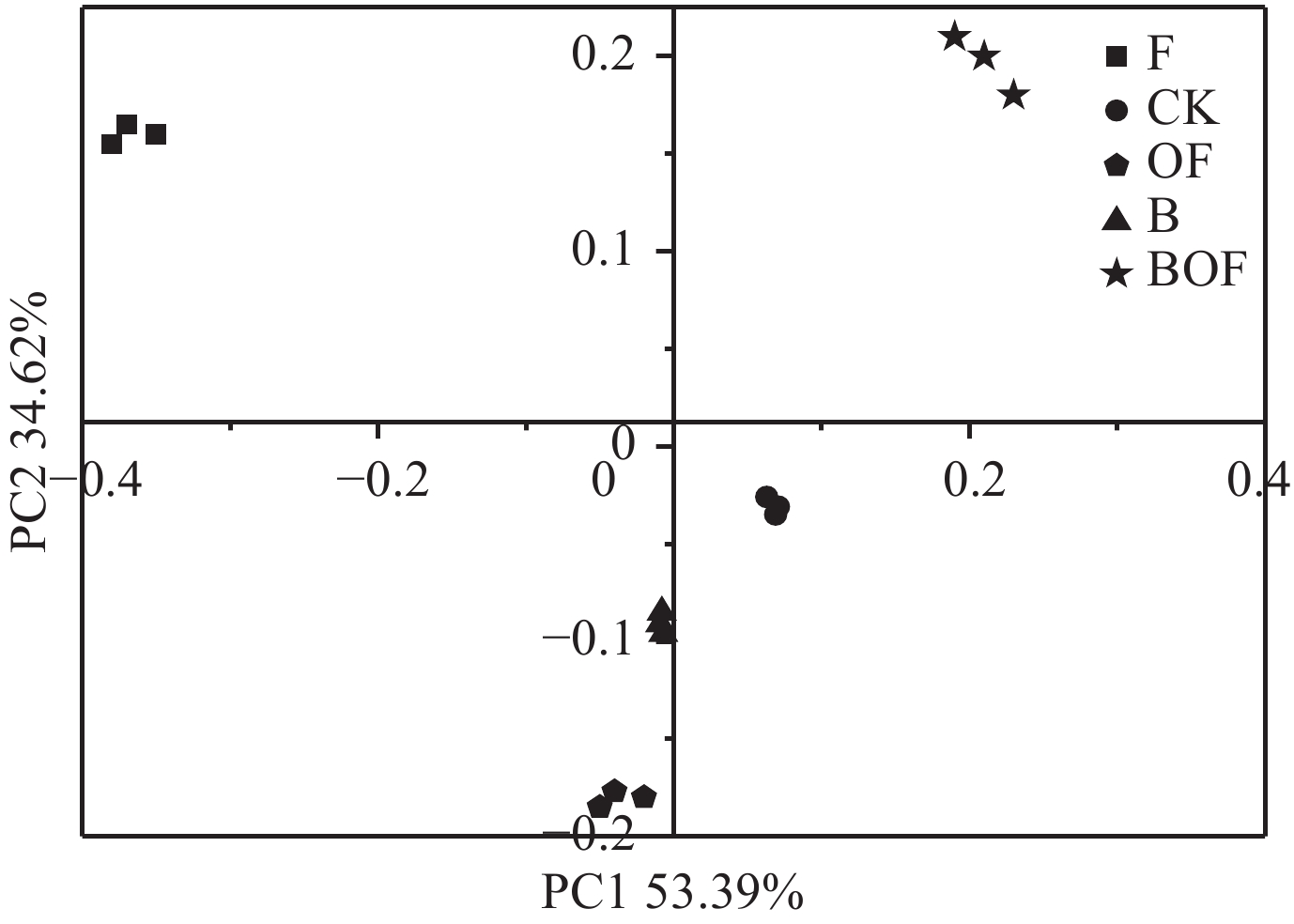 |
| 图3 生物炭配施有机肥处理后土壤真菌主成分 Fig. 3 PCA of the soil fungal OTUs of different treatments |
采用实时荧光定量PCR技术对不同处理下尖孢镰刀菌基因拷贝数进行测定 (图4),结果表明,溴甲烷灭菌、生物炭配施有机肥处理土壤中尖孢镰刀菌基因拷贝数均显著低于连作土,说明连作土壤中以尖孢镰刀菌为主的有害真菌数量明显减少。
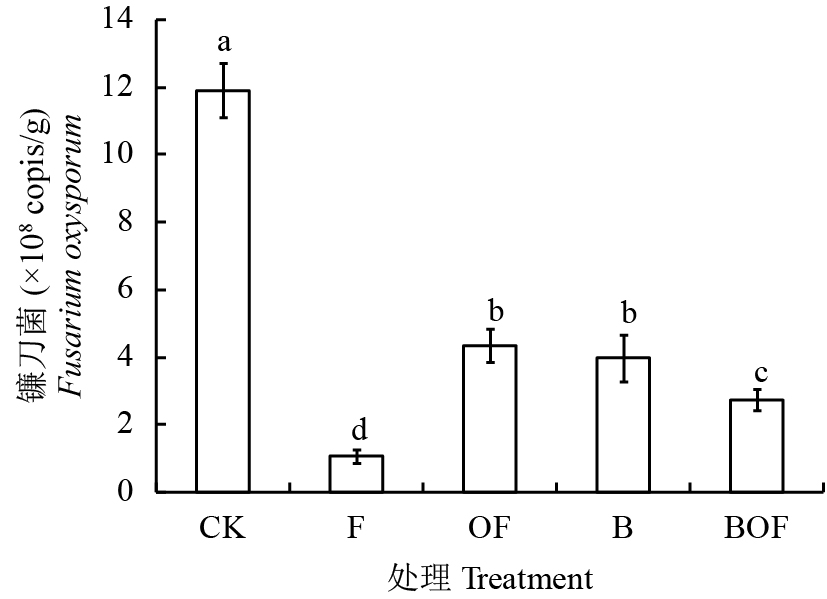 |
| 图4 不同处理对土壤尖孢镰刀菌基因拷贝数的影响 Fig. 4 Effects of different treatments on the copies of Fusarium oxysporum [注(Note):方柱上不同字母表示处理间差异显著 (P < 0.05) Different letters above the bars indicate significant differences among treatments (P < 0.05).] |
苹果连作障碍是全世界主要苹果产区普遍存在的问题。长期连作可以改变土壤的理化和生物特性,同时也会进一步影响作物的生长及产量。Mazzola[15]研究结果表明,土壤微生物是引起连作障碍的重要因素,调整土壤微生物群落结构,可减轻苹果连作障碍。在发生连作障碍的果园土壤中加入有机物料、生物炭、秸秆以及芥菜籽粉等土壤添加剂,可调整土壤微生物数量及群落结构[9, 11, 16–17],进而促进幼苗的生长发育。本研究中,苹果连作土壤经过溴甲烷灭菌,平邑甜茶幼苗的株高和干鲜重显著增加,这和前人研究结果一致[18],即土壤熏蒸是缓解消除连作障碍的有效措施,目前还没有找到与这种方式相媲美的更好措施,因此,本试验中,将经过溴甲烷熏蒸灭菌处理的连作土壤作为高标对照,其余处理措施,一方面与未做任何处理的连作对照相比较,研究缓解连作障碍的效果,另一方面与溴甲烷灭菌处理相比,探讨该措施能否取代或赶超对环境有污染的灭菌处理。生物炭复合有机肥相较于二者单独使用,对连作条件下苹果幼苗生物量的促进作用更加明显。根系的呼吸作用对根系吸收养分及植株的生长发育具有重要意义,在本试验中,生物炭复合有机肥联合处理的苹果幼苗根系呼吸速率仅次于溴甲烷熏蒸处理,远远高于对照。这可能是由于生物炭具有特殊的结构,能提高土壤pH、电导率、养分持留能力及保水能力等[5],而有机肥含有丰富的营养与活性物质,因此可直接或间接促进幼苗植株的生长发育。
土壤酶是一种具有生物活性的催化剂,主要来源于土壤微生物分泌、植物根系分泌及残体分解等,土壤酶活性是土壤微生物活性的综合体现,因此可指示土壤环境中微生物活性,反映土壤养分转化的强弱[19]。土壤酶活性与土壤肥力状况以及微生物活力密切相关。本研究中,连作土壤中不论单独加入生物炭、有机肥还是二者复合加入,都能提高土壤脲酶、蔗糖酶和磷酸酶的活性,生物炭复合有机肥这种综合措施对土壤酶活性的促进作用最好,这可能是由于有机肥弥补了生物炭养分低的缺点,而生物炭则赋予有机肥养分缓释的功能,二者互补,协同作用,大幅度改善了土壤质量,这个研究结果与陈伟等[20]、刘建国等[16]的研究结果相吻合。有研究报道溴甲烷、氯化苦、二氯丙烯等化学试剂熏蒸土壤后,土壤酶活性会受到抑制[21],这表明这些化学试剂在一定程度上能降低土壤微生物活性,具有一定的生态毒理效应,抑制根系有机氮、碳、磷营养元素的矿化[22]。本研究中溴甲烷灭菌处理却对土壤脲酶、磷酸酶和蔗糖酶活性也有抑制作用,这可能是由于溴甲烷可以灭杀连作土壤中固有的微生物,显著降低了土壤有害微生物的活性,因此溴甲烷灭菌处理的苹果幼苗生物量、根系呼吸速率以及根长度均为最大值,并且,对有害病原菌尖孢镰刀菌进行实时荧光定量检测,发现溴甲烷灭菌后,尖孢镰刀菌基因拷贝数显著降低,这进一步证明了土壤有害微生物是引起连作障碍的主要因素[23]。
由于连作障碍问题导致的土壤微生物多样性下降,土传病害加重,已影响了苹果产业的健康发展。研究表明,柱孢菌属 (Cylindrocarpon spp.) 根内生真菌是德国、澳大利亚和意大利三个国家的主要病原菌,腐霉菌在德国的连作果园也起到毒害作用[24];Kelderer等[25]研究发现镰刀菌属 (Fusarium spp.) 和双核丝核菌 (binucleate Rhizoctonia sp.) 是意大利南蒂罗尔地区连作果园的主要病原菌。土壤中施入生物炭[20]和有机肥[4, 9]可明显提高土壤中微生物数量,尤其是细菌的数量。有机肥不仅能改善土壤理化性质,同时也为土壤微生物的生长提供了良好的生长条件及能源,张国栋等[26]研究表明,连作土壤中添加有机肥,土壤微生物群落结构逐渐从“真菌型”向适宜作物生长的“细菌型”转化。生物炭对土壤中微生物种群的影响显著,施用苹果枝生物炭,可抑制某类微生物生长,同时也会促进另一些微生物生长,这就导致微生物群落结构发生变化,最终导致微生物物种的均匀度、丰富度及多样性发生变化[5]。本研究发现,生物炭、有机肥尤其是二者联合使用,能明显增加连作土壤中真菌OUT数目,改变真菌类群的组成,并且增加真菌的Ace指数、Chao指数、Simpson指数和Shannon指数,试验选取尖孢镰刀菌进行实时荧光定量检测,发现加入生物炭复合有机肥可以降低连作土壤中尖孢镰刀菌,这表明,生物炭和有机肥的添加,使得连作土壤环境发生了明显的改变,增加了土壤微生物群落丰富度和多样性,降低了病原菌的数量。主成分分析也可以看出,生物炭配施有机肥这种综合措施明显改变了土壤真菌群落结构,这种改变有利于幼苗的生长发育。除此之外,生物炭还可以通过吸附作用缓解连作土壤中的有害化合物来缓解连作障碍对作物的伤害。
4 结论生物炭与有机肥配合施用可显著提高连作条件下平邑甜茶幼苗的生物量和根系呼吸速率,提高土壤酶活性,增加土壤中真菌的多样性和丰富度,改善连作土壤环境。因此,生物炭与有机肥复合施用缓解苹果连作障碍的效果明显高于单施生物炭或者有机肥,接近于溴甲烷熏蒸处理,且具有环保绿色无污染的特点。因此,在老果园更新建立连作果园时,可考虑用生物炭与有机肥配合施用替代溴甲烷熏蒸技术。
| [1] | Mazzola M, Manici L M. Apple replant disease: role of microbial ecology in cause and control[J]. Annual Review of Phytopathology, 2012, 50: 45–65. DOI:10.1146/annurev-phyto-081211-173005 |
| [2] | Tewoldemedhin Y T, Mazzola M, Labuschagne I, Mcleod A. A multi-phasic approach reveals that apple replant disease is caused by multiple biological agents, with some agents acting synergistically[J]. Soil Biology and Biochemistry, 2011, 43(9): 1917–1927. DOI:10.1016/j.soilbio.2011.05.014 |
| [3] | Caputo F, Nicoletti F, Picione F D L, Manici L M. Rhizospheric changes of fungal and bacterial communities in relation to soil health of multi-generation apple orchards[J]. Biological Control, 2015, 88: 8–17. DOI:10.1016/j.biocontrol.2015.04.019 |
| [4] |
付风云, 相立, 徐少卓, 等. 多菌灵与微生物有机肥复合对连作平邑甜茶幼苗及土壤的影响[J].
园艺学报, 2016, 43(8): 1452–1462.
Fu F Y, Xiang L, Xu S Z, et al. Effects of carbendazim and bio-organic fertilizer on Malus hupehensis seedlings and soil under replant condition [J]. Acta Horticulturae Sinica, 2016, 43(8): 1452–1462. |
| [5] |
曹辉, 李燕歌, 周春然, 等. 炭化苹果枝对苹果根区土壤细菌和真菌多样性的影响[J].
中国农业科学, 2016, 49(17): 3413–3424.
Cao H, Li Y G, Zhou C R, et al. Effect of carbonized apple branches on bacterial and fungal diversities in apple root-zone soil[J]. Scientia Agricultura Sinica, 2016, 49(17): 3413–3424. DOI:10.3864/j.issn.0578-1752.2016.17.014 |
| [6] | Gomez J D, Denef K, Stewart C E, et al. Biochar addition rate influences soil microbial abundance and activity in temperate soils[J]. European Journal of Soil Science, 2014, 65(1): 28–39. DOI:10.1111/ejss.12097 |
| [7] |
顾美英, 刘洪亮, 李志强, 等. 新疆连作棉田施用生物炭对土壤养分及微生物群落多样性的影响[J].
中国农业科学, 2014, 47(20): 4128–4138.
Gu M Y, Liu H L, Li Z Q, et al. Impact of biochar application on soil nutrients and microbial diversities in continuous cultivated cotton fields in Xinjiang[J]. Scientia Agricultura Sinica, 2014, 47(20): 4128–4138. DOI:10.3864/j.issn.0578-1752.2014.20.021 |
| [8] | Wang Y, Pan F, Wang G, et al. Effects of biochar on photosynthesis and antioxidative system of Malus hupehensis Rehd. seedlings under replant conditions [J]. Scientia Horticulturae, 2014, 175(1): 9–15. |
| [9] | Zhang Z, Chen Q, Yin C, et al. The effects of organic matter on the physiological features of Malus hupehensis seedlings and soil properties under replant conditions [J]. Scientia Horticulturae, 2012, 146(3): 52–58. |
| [10] |
尹承苗, 陈学森, 沈向, 等. 不同浓度有机物料发酵液对连作苹果幼树生物量及土壤环境的影响[J].
植物营养与肥料学报, 2013, 19(6): 1450–1458.
Yin C M, Chen X S, Shen X, et al. Effect of different irrigating concentrations of fermented organic fluid on the young apple tree biomass and the soil properties in replant soil[J]. Journal of Plant Nutrition and Fertilizer, 2013, 19(6): 1450–1458. DOI:10.11674/zwyf.2013.0620 |
| [11] | Wang Y, Fu F, Li J, et al. Effects of seaweed fertilizer on the growth of Malus hupehensis Rehd. seedlings, soil enzyme activities and fungal communities under replant condition [J]. European Journal of Soil Biology, 2016, 75: 1–7. DOI:10.1016/j.ejsobi.2016.04.003 |
| [12] |
赵世杰, 史国安, 董新纯. 植物生理学试验指导[M]. 北京: 中国农业科学技术出版社, 2002.
Zhao S J, Shi G A, Dong C X. Techniques of plant physiological experiment[M]. Beijing: China Agricultural Science and Technology Press, 2002. |
| [13] |
关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986. 274–340.
Guan S Y. Soil enzymes and its research methods [M]. Beijing: China Agriculture Press, 1986. 274–340. |
| [14] |
赵永坡, 初雷霞, 岳开华, 等. 太子参根际尖孢镰刀菌绝对荧光定量检测方法的建立及其应用[J].
江西农业大学学报, 2014, 36(5): 1127–1131.
Zhao Y P, Chu L X, Yue K H, et al. Establishment and application of qRT-PCR method for quantification of Fusarium oxysporum f.sp. in Pseudostellaria heterophylla rhizosphere [J]. Acta Agriculturae Universitatis Jiangxiensis, 2014, 36(5): 1127–1131. |
| [15] | Mazzola M. Elucidation of the microbial complex having a causal role in the development of apple replant disease in Washington[J]. Phytopathology, 1998, 88(9): 930–938. DOI:10.1094/PHYTO.1998.88.9.930 |
| [16] |
刘建国, 卞新民, 李彦斌, 等. 长期连作和秸秆还田对棉田土壤生物活性的影响[J].
应用生态学报, 2008, 19(5): 1027–1032.
Liu J G, Bian X M, Li Y B, et al. Effects of long-term continuous cropping of cotton and returning cotton stalk into field on soil biological activities[J]. Chinese Journal of Applied Ecology, 2008, 19(5): 1027–1032. |
| [17] | Yim B, Hanschen F S, Wrede A, et al. Effects of biofumigation using Brassica juncea and Raphanus sativus in comparison to disinfection using Basamid on apple plant growth and soil microbial communities at three field sites with replant disease [J]. Plant and Soil, 2016, 406(1): 389–408. |
| [18] | Jensen P, Buszard D. The effects of chemical fumigants, nitrogen, plastic mulch and metalaxyl on the establishment of young apple trees in apple replant disease soil[J]. Canadian Journal of Plant Science:Revue canadienne de phytotechnie, 1988, 68(1): 255–260. DOI:10.4141/cjps88-031 |
| [19] |
刘善江, 夏雪, 陈桂梅, 等. 土壤酶的研究进展[J].
中国农学通报, 2011, 27(21): 1–7.
Liu S J, Xia X, Chen G M, et al. Study progress on functions and affecting factors of soil enzymes[J]. Chinese Agricultural Science Bulletin, 2011, 27(21): 1–7. |
| [20] |
陈伟, 周波, 束怀瑞. 生物炭和有机肥处理对平邑甜茶根系和土壤微生物群落功能多样性的影响[J].
中国农业科学, 2013, 46(18): 3850–3856.
Chen W, Zhou B, Shu H R. Effects of organic fertilizer and biochar on root system and microbial functional diversity of Malus hupehensis Rehd [J]. Scientia Agricultura Sinica, 2013, 46(18): 3850–3856. DOI:10.3864/j.issn.0578-1752.2013.18.014 |
| [21] | Klose S, Acosta-Martínez V, Ajwa H A. Microbial community composition and enzyme activities in a sandy loam soil after fumigation with methyl bromide or alternative biocides[J]. Soil Biology and Biochemistry, 2006, 38(6): 1243–1254. DOI:10.1016/j.soilbio.2005.09.025 |
| [22] |
姚建华, 牛德奎, 李兆君, 等. 抗生素土霉素对小麦根际土壤酶活性和微生物生物量的影响[J].
中国农业科学, 2010, 43(4): 721–728.
Yao J H, Niu D K, Li Z J, et al. Effects of antibiotics oxytetracycline on soil enzyme activities and microbial biomass in wheat rhizosphere[J]. Scientia Agricultura Sinica, 2010, 43(4): 721–728. |
| [23] | Tewoldemedhin Y T, Mazzola M, Mostert L, Mcleod A. Cylindrocarpon species associated with apple tree roots in South Africa and their quantification using real-time PCR [J]. European Journal of Plant Pathology, 2011, 129(4): 637–651. DOI:10.1007/s10658-010-9728-4 |
| [24] | Manici L, Kelderer M, Franke-Whittle I, et al. Relationship between root-endophytic microbial communities and replant disease in specialized apple growing areas in Europe[J]. Applied Soil Ecology, 2013, 72(5): 207–214. |
| [25] | Kelderer M, Manici L M, Caputo F, Thalheimer M. Planting in the ‘inter-row’ to overcome replant disease in apple orchards: a study on the effectiveness of the practice based on microbial indicators[J]. Plant and Soil, 2012, 357(1): 381–393. |
| [26] |
张国栋, 展星, 李园园, 等. 有机物料发酵流体和堆肥对苹果连作土壤环境及平邑甜茶幼苗生物量的影响[J].
生态学报, 2015, 35(11): 3663–3673.
Zhang G D, Zhan X, Li Y Y, et al. Effects of anaerobic and aerobic fermentation of organic materials on continuous cropping soil environment and Malus hupehensis seedling biomass [J]. Acta Ecologica Sinica, 2015, 35(11): 3663–3673. |
 2018, Vol. 24
2018, Vol. 24  doi:
doi: 

