2. 华南农业大学资源与环境学院/广东高校环境友好型肥料工程技术研究中心,广东广州 510642
2. College of Natural Resource and Environment Sciences, South China Agricultural University/Environment Friendly Fertilizer Engineering Technology Research Center, Guangzhou 510642, China
香蕉是我国南亚热带地区的大宗水果。改革开放以来,我国香蕉产业发展迅猛,已成为我国南亚热带地区农业的支柱产业之一[1]。但是,近年来我国各香蕉主产区由于香蕉枯萎病4号生理小种 (FOC) 的爆发,导致主产区香蕉枯萎病愈演愈烈,严重影响香蕉生产,我国香蕉产量从2011年的1039.81万t迅速下降到2014年的908万t,因此香蕉枯萎病已经威胁到我国香蕉产业发展。
香蕉枯萎病又称黄叶病、巴拿马病,是由尖孢镰刀菌古巴专化型侵染引起的维管束病害[2],属于真菌类土传病害,容易在土壤pH 6以下、肥力低的砂质、砂壤酸性土壤中发作[3],其致病力强、孢子存活时间长,一旦发病即有毁灭性危害。目前我国蕉园由于长期大量施用铵态氮、氯化钾等酸性或生理酸性常规化肥而加剧土壤酸化[4]。研究表明土壤酸化会抑制细菌和放线菌等土壤有益微生物的生长,而有利于喜酸性土壤的真菌类有害微生物,如香蕉枯萎病尖孢镰刀菌的生存和繁殖[5];同时,常规化肥的施用也会引起某些土壤微生物的富集和另一些微生物物种的丧失,会在发病初期加重香蕉枯萎病的病情[6]。因此,解决香蕉园长期大量施用化肥所引起的土壤酸化是防止香蕉枯萎病危害及蔓延的关键。已有大量研究表明,利用石灰调节香蕉园土壤酸度,同时配合施用化学肥料可以有效防控香蕉枯萎病[7–8]。但在生产实践中果农认识到,石灰虽能有效调节酸度,但不能连年施用,否则就会因为产生碳酸钙和硫酸钙沉淀而导致土壤板结。为此,本研究室研发了既可调节土壤酸度,又可供给香蕉生长所需养分的碱性肥料,该肥料不会产生碳酸钙和硫酸钙沉淀,同时具有治酸改土和营养作物的功能。前期有关碱性肥料调节香蕉园土壤酸度及防控香蕉枯萎病效果和机理的研究结果表明:碱性肥料相比常规化肥可以有效地提高香蕉园土壤pH值,并降低香蕉枯萎病发病率及病情指数[9];施用碱性肥料提高土壤pH值后,土壤中细菌和放线菌的数量增加,而包括香蕉尖孢镰刀菌在内的真菌数量减少[10];碱性肥料改变了病区土壤中原有微生物的种群数量和结构后,将可能引起土壤微生物总体活性和多样性的变化。也有研究表明丰富的土壤微生物多样性可降低土传植物病害的发生[11],提高土壤微生物活性有利于形成高肥力的土壤[12]。然而迄今尚没有关于肥料酸碱性对土壤微生物多样性影响的深入研究。为进一步探究碱性肥料防控香蕉枯萎病以及提高香蕉产量的机理,本文采用Biolog-ECO技术研究了不同pH值肥料对土壤微生物种群数量和活性以及功能多样性的影响,为施用碱性肥料防治香蕉枯萎病、恢复病区蕉园土地生产力和提高香蕉产量提供理论依据。
1 材料与方法 1.1 供试材料供试基质:供试基质为土壤和椰糠按1∶1比例混合而成的混合基质土。供试土壤采自华南农业大学农场赤红壤发育的稻田,供试椰糠为从印度进口的无病椰糠。供试混合基质土的pH值为5.59,有机质为17.09 g/kg,速效氮56.59 mg/kg,有效磷59.57 mg/kg,速效钾315.4 mg/kg。供试容器是130 mm × 120 mm × 120 mm的黑色营养钵,每钵装混合基质土0.5 kg。
供试作物:巴西蕉 (Musa AAA Giant Cavendish cv. Baxi) 组培袋装香蕉苗。移栽前在温室培养至6叶期,然后选取生长相对一致的香蕉苗进行试验处理。
供试香蕉枯萎病病原菌:由华南农业大学资源与环境学院植物病理研究室自行筛选,属于尖孢镰刀菌古巴专化型4号生理小种[Fusarium oxysporum f. sp. cubensce (E. F. Smith) Snyder et Hasen]。接种悬浮液香蕉枯萎病菌孢子液的浓度为1 × 107 cfu/mL。
供试肥料:由广东省高校环境友好型肥料工程技术研究中心研发的pH为5.5、7.0、8.0的三种NPK复合肥 (22–8–15)。其中pH 5.5的为酸性常规肥料,pH 7.0的是中性常规肥料,pH 8.0的则是碱性复合肥料。
1.2 试验设计试验于2013年9月,在广州华南农业大学资源环境学院温室 (E113°21′28″,N23°09′40″) 中进行,采用两因素裂区设计。主处理为3个pH值的氮磷钾复合肥 (22–8–15),pH值分别为5.5、7.0、8.0,每个处理的施肥量相等,即每盆按照处理要求分别浇灌pH值不等的氮磷钾复合肥水溶液50 mL,溶液的肥料浓度为0.6% (用水将复合肥稀释至0.6%),移栽后每周浇灌一次,每次每盆浇灌量相等;副处理为香蕉枯萎病尖孢镰刀菌,包括不接种FOC、接种FOC (× 106 cfu/g) 2个水平。共设6个处理,每个处理重复12次,单株为一个重复,总计72株香蕉。
1.3 试验方法 1.3.1 病菌接种方法2013年10月18日,将事先准备好的孢子浓度为 × 107 cfu/mL的香蕉枯萎病病菌原液用注射器吸取50 mL直接注入接种处理香蕉假茎周围的基质土中 (每克干土接种1 × 106 cfu/g的FOC),不接种处理的香蕉则用50 mL的清水代替。
1.3.2 土壤理化性质的测定土壤有机质用重铬酸钾容量法,土壤速效氮采用0.01 mol/L的CaCl2浸提—连续流动分析仪 (AA3) 测定铵态氮和硝态氮;土壤速效磷采用NH4F–HCl浸提—钼锑抗比色法测定;土壤速效钾用1 mol/L的NH4OAC浸提—火焰光度法测定[13–14]。
1.3.3 香蕉病情统计及生物量测定香蕉苗于2013年10月4日移栽至营养钵中,移苗后65天,即第8次浇灌肥后,接种FOC处理的香蕉明显发病。此时调查统计香蕉染病率及病情指数;并收获香蕉植株样品,观察球茎危害程度,分离验证其为香蕉枯萎病病征[15],测定植株生物量。
香蕉生物量的测定:收获香蕉时将其地上部和根分开采样,叶片用湿纱布轻轻擦拭,根用去离子水洗净后用吸水纸吸干,先测定鲜重,杀青 (105℃,30 min) 后75℃烘干至恒重,再测定干重。
香蕉枯萎病发病率 (%)[16] = 染病植株总数/(染病植株总数+健康植株总数) × 100;
病情指数 (%) = ∑(各级病株数 × 该级级数值)/(总株数 × 最高级级数值) × 100。
1.3.4 土壤微生物数种群数量的测定在2013年12月8日收获香蕉时,同时采集土壤样品,每个处理12个重复中的基质土混合保存在无菌塑封袋中,快速带回实验室,去除石块和植物根系,过2 mm筛后混合均匀,用四分法将其分成3份,放入4℃冰箱保存,用于测定土壤微生物种群数量及功能多样性。
测定土壤微生物的数量采用微生物平板计数法。香蕉尖孢镰刀菌选择性培养基的配制参考文献[17]。细菌、真菌、放线菌分别采用LB、孟加拉红、高氏培养基[18–19]。
1.3.5 土壤微生物群落多样性的测定1) Biolog-ECO实验方法:Biolog技术通过分布于96孔中的碳源底物来分析评价土壤微生物生理代谢特征。本研究采用有31种碳源的生态板 (Biolog-ECO) 分析微生物群落的代谢特征,即功能多样性[20]。ECO板接种液的制备采用Classen等的方法[21]。
2) 数据测定分析:土壤微生物利用碳源的整体能力和活性,用孔的平均颜色变化率 (average well color development,AWCD) 表示[22]。
AWCD = ∑ (Ci – R)/n
式中: Ci为每个有培养基孔的光密度值; R 为对照孔的光密度值; n为培养基碳源种类,本研究为31。
丰富度 (Richness) 是指被利用碳源的总数目,为每孔中 (C-R) 值大于0.25的孔数[23]。
Shannon-Wiener指数又称多样性指数 (H')。
H' = –∑ (Pi·lnPi)
式中:Pi为有培养基的孔和对照孔的光密度值差与整板总差的比值,即Pi = (Ci – R)/∑ (Ci-R) [24]。
1.3.6 数据处理用Excel 2007和SPSS 15. 0软件进行数据处理。
2 结果与分析 2.1 肥料对香蕉枯萎病发生的影响接种香蕉尖孢镰刀菌51天后,不接种处理的香蕉没有发现染病情况,接种处理的香蕉明显发病,表明接种香蕉枯萎病尖孢镰刀菌是导致香蕉染病的根本原因。图1为在接种尖孢镰刀菌下,三个肥料处理的香蕉枯萎病发病统计结果。由图1可见,香蕉的染病率、病情指数随着肥料pH的升高而明显降低,与酸性肥料处理相比,中性肥料处理的香蕉染病率和病情指数分别降低了21和6个百分点,碱性肥料分别降低了38和16个百分点。碱性肥料与酸性肥料的香蕉染病率和病情指数差异均达显著水平。
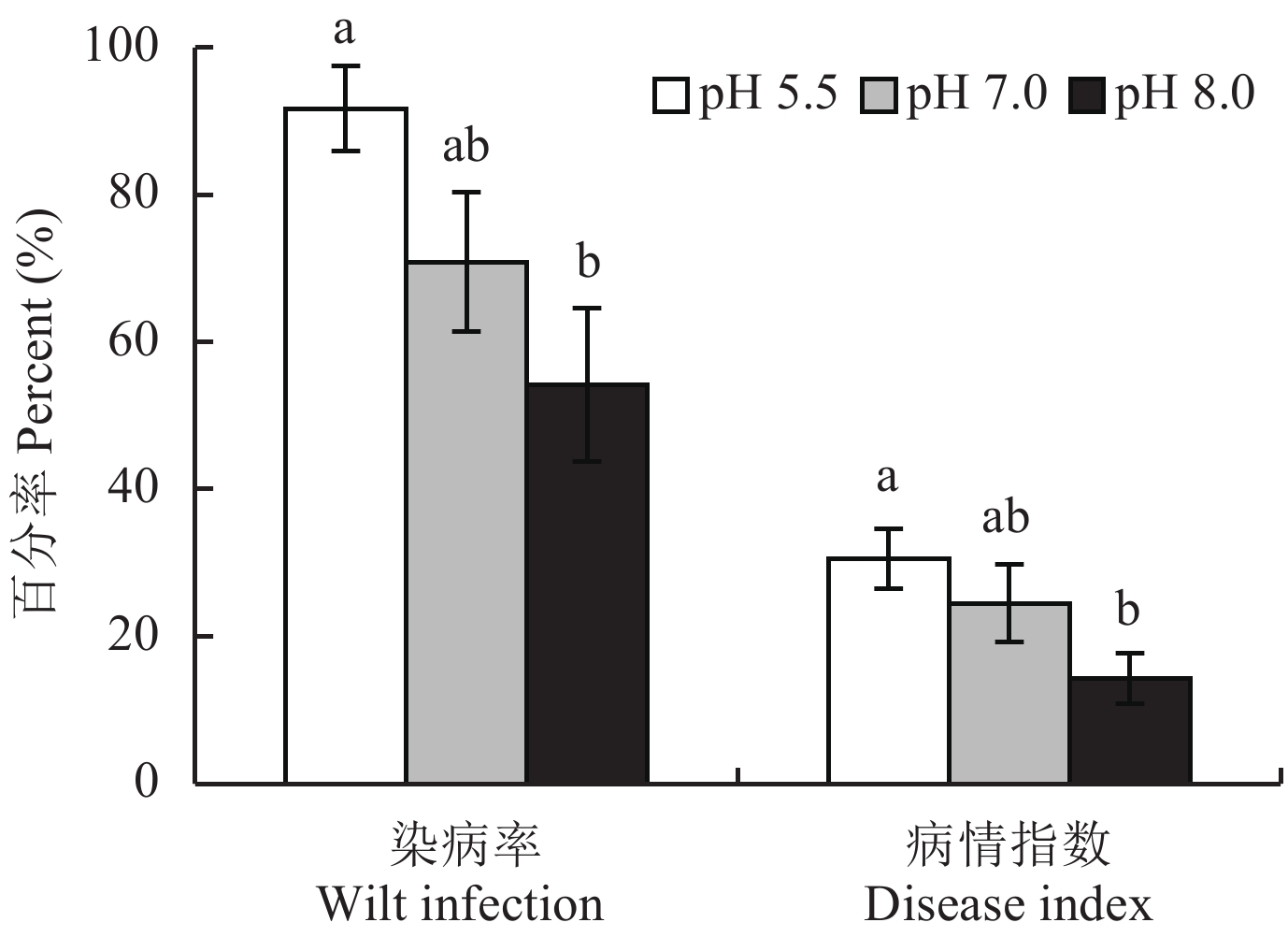 |
| 图1 施用pH不同的肥料对香蕉枯萎病发生的影响 Fig. 1 Effect of fertilizers with different pH values on wilt infection and disease index of Fusarium wilt in banana plants [注(Note):柱上不同小写字母表示同一指标处理间差异显著 (DMRT,P = 0.05,n = 12) Different small letters indicate significant difference among treatments for the same index (DMRT, P = 0.05, n = 12).] |
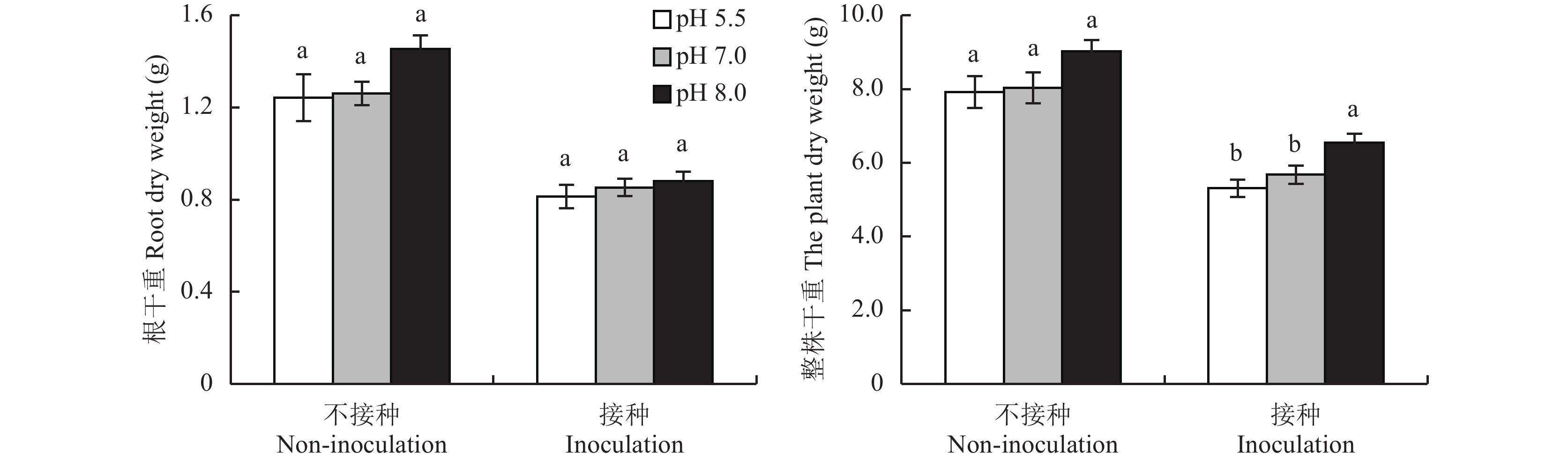
所有香蕉整株干重、根部干重的统计结果如图2所示。不接种尖孢镰刀菌处理的香蕉根部和整株干重均明显大于接种处理的,说明FOC是导致香蕉染病、严重影响香蕉正常生长的重要原因。图2结果还表明,不接种尖孢镰刀菌,三种肥料对香蕉根部和整株生物量影响不显著。在接种尖孢镰刀菌条件下,碱性肥料处理的香蕉地上部整株干重分别比中性和酸性肥料处理显著增加15%和23%,香蕉根部干重在三种肥料处理间差异不显著。可见在不接种FOC情况下,三种pH值的肥料不会明显影响香蕉生物量的积累;当接种FOC时,碱性肥料相比中性和酸性肥料能显著增加香蕉地上部生物量的积累,而对香蕉根部生物量积累影响不显著。
 |
|
图2
接种和不接种尖孢镰刀菌香蕉施用三种肥料的生物量
Fig. 2
Biomass of banana applied with the three fertilizers under inoculated or without inoculated FOC
[注(Note):柱上不同小写字母表示相同条件下不同肥料处理间差异显著 (DMRT, P = 0.05, n = 12) Different small letters indicate significant difference among fertilizer treatments for the same condition (DMRT, P = 0.05, n = 12).] |
由表1可见,随着肥料pH的升高,土壤中FOC和真菌种群数量减少,放线菌数量没有显著变化。在接种条件下,碱性肥料处理的FOC和真菌数量显著小于中性肥料和酸性肥料处理的,中性肥料显著小于酸性肥料处理的。碱性肥料处理的土壤FOC和真菌种群数量分别比酸性肥料处理的减少了60%和51%。在不接种FOC条件下,随着肥料pH值的升高,FOC和真菌数量没有明显变化。结果还表明,施用碱性肥料相比酸性肥料土壤中细菌和放线菌的数量明显增多。不接种FOC,碱性肥料处理的土壤放线菌和细菌数量显著大于酸性和中性肥料处理的,其放线菌和细菌数量分别是酸性肥料的1.42和1.69倍。接种FOC后,碱性肥料和中性肥料处理的细菌数量显著大于酸性肥料处理的,碱性肥料处理的细菌数量是酸性肥料的2.25倍。
| 表1 肥料和FOC对土壤微生物数量的影响 (× 103 cfu/g) Table 1 Effects of the fertilizers and FOC on the soil microbial population |
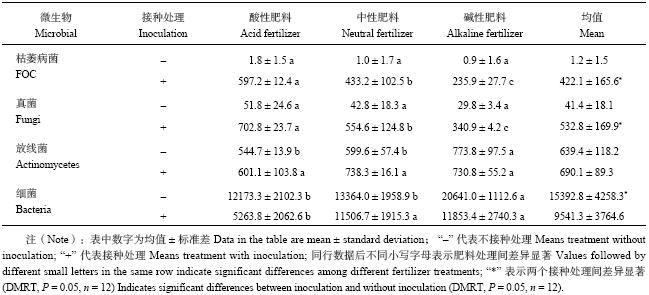 |
表1结果还表明,接种和不接种FOC,土壤中FOC、真菌和细菌数量差异显著,放线菌数量则没有显著差异。接种处理,土壤FOC和真菌数量显著大于不接种处理的,细菌数量则显著小于不接种处理的。
2.4 肥料对土壤微生物活性及多样性的影响 2.4.1 肥料对土壤微生物总体活性的影响AWCD可以反映土壤微生物群落的总体活性及对碳源的利用程度。培养期内AWCD随培养时间的延长呈“S”型曲线 (图3),24 h以内土壤微生物活性较低,且增加缓慢,之后AWCD随着培养时间延长迅速增大。24~72 h时AWCD值增加最快,72 h到96 h时3种肥料处理的AWCD值差异达到最大。从96 h开始,3种肥料处理利用总碳源趋于平稳。从整个增长曲线分析发现,不接种FOC,碱性和中性肥料处理的微生物总活性大于酸性肥料处理,在72 h和96 h时差异显著。接种FOC,碱性肥料的微生物利用碳源程度大于中性和酸性肥料,在72h时碱性肥料与酸性肥料间差异显著,在96 h时碱性肥料与中性和酸性肥料差异均达显著水平。此结果说明碱性肥料在接种和不接种情况下,较酸性肥料有利于提高土壤微生物的总碳源利用率及活性。
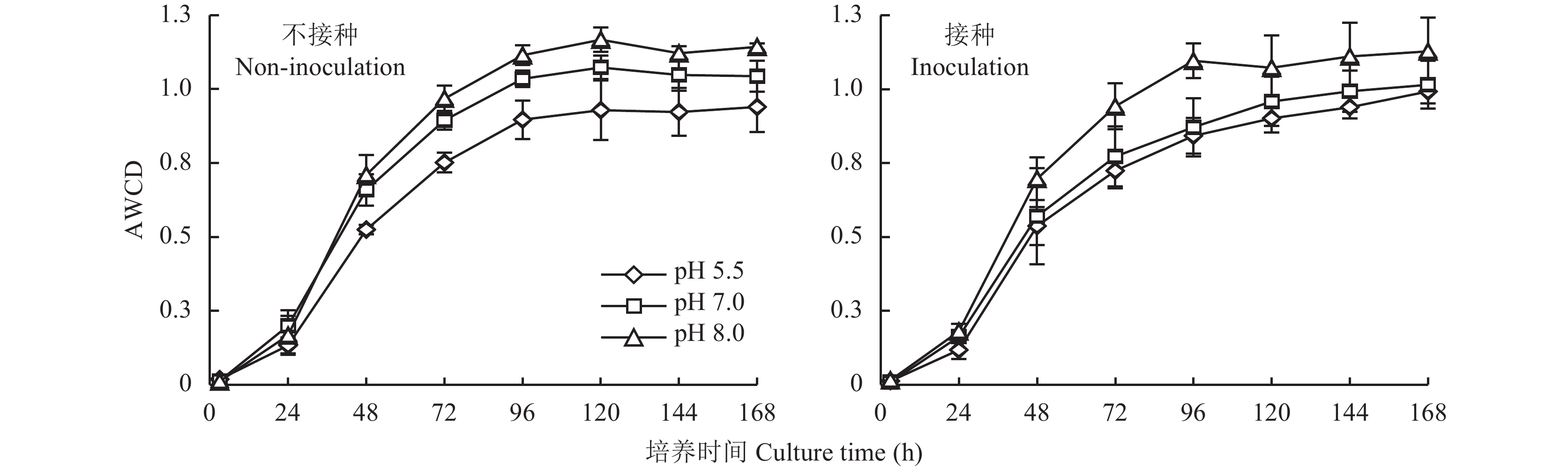 |
| 图3 各处理AWCD值随培养时间的变化 Fig. 3 AWCD variation of total carbon sources with cultivation time prolonged |
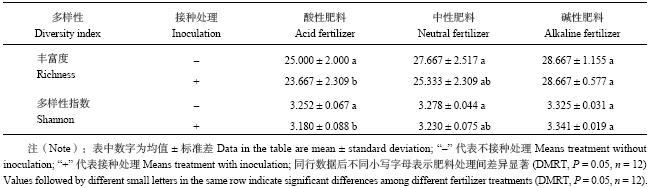
由图3结果可以看出,当培养到72 h时,三种肥料处理间微生物对碳源的利用差异达到最大,因此本文计算分析72 h时三种肥料处理微生物的丰富度 (Richness) 和多样性指数 (Shannon)。如表2所示,不接种FOC处理,三种肥料处理间的Richness和Shannon-Wiener指数没有显著差异。接种FOC处理,随着肥料pH值的升高,不同处理的Richness和Shannon-Wiener指数增大,碱性肥料和酸性肥料间差异达显著水平。此试验结果说明,在不接种情况下,不同pH的肥料对土壤微生物多样性影响不明显,而在接种FOC情况下,肥料的pH值对微生物的多样性影响显著,碱性肥料较酸性肥料可以显著地提高土壤微生物多样性。
| 表2 肥料对土壤微生物多样性的影响 Table 2 Effect of the fertilizers on diversity of soil microbial communities |
 |
本研究是在长期大量施用化肥导致土壤酸化、香蕉枯萎病加剧,而利用石灰调节发病蕉园土壤酸度并配合化肥防控香蕉枯萎病研究成果的基础上[25],针对农田不宜连年施用石灰以及长期施用石灰导致土壤板结、耕性变差等问题,提出了碱性肥料的研究思路,研发了碱性氮磷钾复合肥,并以此为供试肥料研究其对土壤微生物多样性及香蕉枯萎病发生的影响。
3.1 肥料对土壤微生物种群数量的影响 3.2 肥料对土壤微生物活性和多样性的影响 3.3 肥料对香蕉枯萎病发生和生物量积累的影响试验结果表明,接种时,施用碱性肥料相比酸性肥料可以有效防控香蕉枯萎病的发生。一方面原因是施用碱性肥料后,土壤酸碱环境的变化抑制了FOC的生长,且其数量显著减少,FOC数量的多少直接影响香蕉枯萎病的危害程度[33];一方面是因为土壤中细菌等有益微生物的数量显著增加,有研究表明某些香蕉枯萎病拮抗细菌和放线菌可以抑制FOC的生长,有助于防控香蕉枯萎病的发生[34];另一方面是因为施用碱性肥料可以有效地提高土壤微生物多样性,丰富的微生物多样性则可以有效地抑制香蕉枯萎病的发生[35]。
碱性肥料较酸性肥料可以更有效地促进香蕉健康生长,积累更多的生物量。主要原因是因为土壤微生物在土壤养分转化、有机质的分解等方面起着重要的作用,土壤生态系统中各微生物群落数量与活性的提高有助于高肥力土壤的形成[12]。本试验在接种FOC的土壤中施用碱性肥料后,土壤微生物的数量和活性提高,土壤的肥力也随之提高,有助于香蕉吸收养分及生物量的积累。另一方面,改良土壤酸性环境是提高土壤土著微生物数量和活性的有效方法,也是防控香蕉枯萎病发生的有效方法[36]。施用碱性肥料后,香蕉枯萎病得到有效防控,减轻了FOC对香蕉的危害程度,促进了香蕉的健康生长,积累更多生物量。
土壤微生物种群数量的变化,必然会影响土壤微生物的总活性和多样性[29]。处理间的AWCD结果表明,碱性肥料处理的AWCD增长曲线大于酸性肥料处理,即碱性肥料处理微生物的总活性大于酸性肥料处理。这是因为碱性肥料施用于酸性土壤后,改变了土壤原有微生物的酸碱环境,土壤中数量最多的放线菌和细菌数量增大,微生物总数增大,微生物对碳源的利用率随之增大,因此土壤微生物的总体活性增大[30]。微生物多样性的分析结果表明,接种时,碱性肥料处理的Richness和Shannon-Wiener显著大于酸性肥料处理的。而不接种时,三种肥料处理间的Richness和Shannon-Wienerr指数没有显著差异。此结果可能是因为在接种条件下,FOC为主要优势种群,其必然会和其它种群微生物竞争生长所需的碳源等养分生境,从而引起其它微生物生长所需养分及空间不足。也可能是因为FOC的大量存在产生了某种物质抑制其它微生物的生长[31]。土壤中施用碱性肥料时,土壤微生物所处的酸碱环境改变抑制了FOC的生长和繁殖,同时也更有利于放线菌和细菌的活动和生长[10],因此施用不同pH的肥料,在接种条件下,比不接种条件下对微生物种群数量的影响更明显。微生物数量的变化,尤其是施用碱性肥料后放线菌和细菌数量的显著增加,是土壤微生物多样性显著提高的主要原因[32]。
引起香蕉枯萎病的是一种真菌类土传病菌即尖孢镰刀菌 (FOC),和多数微生物一样,其生命活动的生理生化反应与体内外微环境的pH值有密切联系[26]。试验结果表明,接种时,随着肥料pH的升高,土壤中FOC和真菌种群数量明显减少。其原因在于FOC和其它真菌一样喜好在酸性条件下生长,易在 pH 值6以下的酸性砂质或砂壤土中发作[27]。定期施用碱性肥料,土壤中的碱性环境对FOC的生长和萌发产生了抑制作用,因此其数量显著减少[10];而不接种时,随着肥料pH值的升高,FOC和真菌数量并没有明显变化。这是因为不接种的土壤中存在极少量的 FOC,因此其 FOC 和真菌数量显著小于接种处理,当 FOC 和真菌数量越小,不同 pH 值肥料处理间的 FOC 和真菌数量差异越不显著。结果还表明,碱性肥料相比酸性肥料能提高土壤中细菌和放线菌的数量。这是因为放线菌和细菌是喜碱性环境生长的微生物,定期施用碱性肥料后,土壤中的微碱性环境更有利于细菌和放线菌的活动和繁殖[28],因此其数量增大。
4 结论1) 肥料酸碱度 (pH值) 显著影响土壤微生物种群数量。接种FOC条件下,随着肥料pH值的升高,土壤中FOC和真菌数量显著减少,细菌数量显著增加。
2) pH值为8.0的碱性肥料能有效地提高土壤微生物总活性及多样性。接种FOC条件下,碱性肥料处理的土壤微生物总活性和多样性显著大于酸性肥料处理。
3) 施用碱性肥料可以有效防控香蕉枯萎病的发生,降低香蕉的染病率和病情指数的主要原因是碱性肥料可以抑制FOC和真菌的生长和繁殖,而有利于细菌和放线菌等有益微生物的繁殖,有效地提高了土壤微生物的多样性。
4) 在接种FOC条件下,相比酸性肥料,pH为8.0的碱性肥料可以有效促进香蕉的健康生长及生物量的积累。
| [1] | Wang Y, Liu Z S. China agricultural yearbook (General surveys) [M]. Beijing: China Agriculture Press, 2011. 25–26. |
| [2] | Tushemereirwe W K, Kangire A, Kubiriba J, et al. Fusarium wilt resistant bananas considered appropriate replacements for cultivars susceptible to the disease in Uganda [J]. Trends in Glycoscience and Glycotechnology, 2016, 15: 1–14. |
| [3] | Barbiéri R, Santoslima E P, et al. Fusarium oxysporum f. sp. cubense [J]. Ciência E Agrotecnologia, 2006, 30(3): 64–71. |
| [4] | Guo J H, Zhang F S. Significant acidification in major Chinese croplands[J]. Science, 2010, 327(5968): 1008–1010. DOI:10.1126/science.1182570 |
| [5] |
冯海萍, 张丽娟, 曲继松, 等. 绿肥与化肥配施对日光温室土壤养分、微生物及芹菜产量的影响[J].
甘肃农业大学学报, 2015, (2): 66–70.
Feng H P, Zhang L J, Qu J S, et al. Effects of soil nutrients, microbial and yield of celery in facilities soil under green manure and fertilizer reduction[J]. Journal of Gansu Agricultural University, 2015, (2): 66–70. |
| [6] |
张丽娟, 缑武龙, 赵兰凤, 等. 香蕉枯萎病与不同施肥处理对土壤微生物多样性的影响[A]. 第四次全国土壤生物和生物化学学术研讨会论文集[C]. 广州: 第四次全国土壤生物与生物化学学术研讨会, 2007.
Zhang L J, Gou W L, Zhao L F, et al. Effectiveness of fusarium oxysporum f. sp. cubense and applying different fertilizer on soil microbial community functional diversity [A]. Proceedings of the Fourth National Symposium on Soil Biology and Biochemistry[C]. Guangzhou, China: The Fourth National Symposium on Soil Biology and Biochemistry, 2007. |
| [7] | Su H J, Hwang S C, Ko W H. Fusarial wilt of Cavendish bananas in Taiwan[J]. Plant Disease, 1986, 70(9): 814–818. DOI:10.1094/PD-70-814 |
| [8] | Höper H, Steinberg C, Alabouvette C. Involvement of clay type and pH in the mechanisms of soil suppressiveness to fusarium wilt of flax[J]. Soil Biology and Biochemistry, 1995, 27(7): 955–967. DOI:10.1016/0038-0717(94)00238-V |
| [9] |
樊小林, 李进. 碱性肥料调节香蕉园土壤酸度及防控香蕉枯萎病的效果[J].
植物营养与肥料学报, 2014, 20(4): 938–946.
Fan X L, Li J. Effectiveness of alkaline fertilizer on the control of banana Fusarium wilt and regulation of soil acidity in banana orchard [J]. Journal of Plant Nutrition and Fertilizer, 2014, 20(4): 938–946. DOI:10.11674/zwyf.2014.0416 |
| [10] |
李进, 张立丹, 刘芳, 等. 碱性肥料对香蕉枯萎病发生及土壤微生物群落的影响[J].
植物营养与肥料学报, 2016, 22(2): 429–436.
Li J, Zhang L D, Liu F, et al. Effects of alkaline fertilizer on occurrence of banana wilt disease and soil microbial community[J]. Journal of Plant Nutrition and Fertilizer, 2016, 22(2): 429–436. DOI:10.11674/zwyf.14460 |
| [11] | Deng X, Li Q F, Hou X W, et al. Soil microbial functional diversity from different infection grades of banana Fusarium wilt (Fusarium oxysporum f. sp. Cubense) [J]. Applied Mechanics and Materials, 2013, 295-298: 2274–2280. DOI:10.4028/www.scientific.net/AMM.295-298 |
| [12] | Nirukshan S, Herath H M I K, Wijebandara D M D I, et al. Soil microbial population and activity affected by fertilizer and manure addition in a coconut growing sandy regosol [A]. 6th Symposium on Plantation Crop Research[C]. Colombo, Sri Lanka, 2016. |
| [13] |
鲍士旦. 土壤农化分析 (第三版)[M]. 北京: 中国农业出版社, 2000. 138.
Bao S D. Soil and agro-chemistry analysis (Third edition) [M]. Beijing: China Agricultural Press, 2000. 138. |
| [14] |
鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 1999. 167.
Lu R K. Analytical methods of soil and agricultural chemistry [M]. Beijing: China Agricultural Science and Technology Press, 1999. 167. |
| [15] |
方中达. 植病研究方法 (第三版)[M]. 北京: 中国农业出版社, 1998. 125.
Fang Z D. Research methods of plant disease (Third edition) [M]. Beijing: China Agricultural Press, 1998. 125. |
| [16] | Carlier J, De Waele D, Escalant J V. Global evaluation of Musa germplasm for resistance to fusarium wilt, Mycosphaerella leaf spot diseases and nematodes: in-depth evaluation [M]. International Network for the Improvement of Banana and Plantain, 2003. 67. |
| [17] | Sun E J, Su H J, Ko W H. Identification of Fusarium oxysporum f. sp. cubense race 4 from soil or host tissue by cultural characters [J]. Phytopathology, 1978, 68(11): 1672–1673. DOI:10.1094/Phyto-68-1672 |
| [18] | Wang B, Yuan J, Zhang J, et al. Effects of novel bioorganic fertilizer produced by Bacillus amyloliquefaciens W19 on antagonism of Fusarium wilt of banana [J]. Biology and Fertility of Soils, 2013, 49(4): 435–446. DOI:10.1007/s00374-012-0739-5 |
| [19] | Shen Z, Zhong S, Wang Y, et al. Induced soil microbial suppression of banana Fusarium wilt disease using compost and biofertilizers to improve yield and quality [J]. European Journal of Soil Biology, 2013, 57(4): 1–8. |
| [20] | Preston-Mafham J, Boddy L, Randerson P F. Analysis of microbial community functional diversity using sole-carbon-source utilization profiles-a critique[J]. FEMS Microbiology Ecology, 2002, 42(1): 1–14. |
| [21] | Classen A T, Boyle S I, Haskins K E, et al. Community-level physiological profiles of bacteria and fungi: plate type and incubation temperature influences on contrasting soils[J]. FEMS Microbiology Ecology, 2003, 44(3): 319–328. DOI:10.1016/S0168-6496(03)00068-0 |
| [22] | Kurten G L, Barkoh A. Evaluation of community-level physiological profiling for monitoring microbial community function in aquaculture ponds[J]. North American Journal of Aquaculture, 2016, 78(1): 34–44. DOI:10.1080/15222055.2015.1079580 |
| [23] | Janniche G S, Spliid H, Albrechtsen H J. Microbial community-level physiological profiles (CLPP) and herbicide mineralization potential in groundwater affected by agricultural land use[J]. Journal of Contaminant Hydrology, 2012, 140-141: 45–55. DOI:10.1016/j.jconhyd.2012.08.008 |
| [24] | Dobranic J K, Zak J C. A microtiter plate procedure for evaluating fungal functional diversity[J]. Mycologia, 1999, 91(5): 756–765. DOI:10.2307/3761529 |
| [25] | Peng H X, Sivasithamparam K, Turner D W. Chlamydospore germination and fusarium wilt of banana plantlets in suppressive and conducive soils are affected by physical and chemical factors[J]. Soil Biology and Biochemistry, 1999, 31(10): 1363–1374. DOI:10.1016/S0038-0717(99)00045-0 |
| [26] | Tasaki M, Kojima K, Takayanagi H, et al. Effect of soil amelioration water content and pH neutralization on indigenous microbes[J]. Proceedings of Environmental and Sanitary Engineering Research, 2015, 71(3): 73–81. |
| [27] | Ploetz R C. Fusarium wilt of banana[J]. Phytopathology, 2015, 105(12): 1512. DOI:10.1094/PHYTO-04-15-0101-RVW |
| [28] |
苏琴, 杜晨, 郑安妮, 等. 三裂叶蟛蜞菌入侵对土壤微生物和 pH 的影响[J].
湖北农业科学, 2013, 52(11): 2543–2546.
Su Q, Du C, Zheng A N, et al. Effects of Wedelia trilobata invasion on soil microorganisms and soil pH [J]. Hubei Agricultural Sciences, 2013, 52(11): 2543–2546. DOI:10.3969/j.issn.0439-8114.2013.11.018 |
| [29] | Tardy V, Mathieu O, Lévêque J, et al. Stability of soil microbial structure and activity depends on microbial diversity[J]. Environmental Microbiology Reports, 2014, 6(6): 173–183. |
| [30] | Ferreira E P D B, Stone L F, Stone L F. Population and microbial activity of the soil under an agro-ecological production system[J]. Rev.ciênc.agron, 2017, 48(1): 22–31. |
| [31] | Huang X, Liu L, Wen T, et al. Illumina MiSeq investigations on the changes of microbial community in the Fusarium oxysporum f.sp. cubense infected soil during and after reductive soil disinfestation [J]. Microbiological Research, 2015, 181: 33–42. DOI:10.1016/j.micres.2015.08.004 |
| [32] |
罗建华. 枣园生草对土壤微生物多样性的影响[J].
防护林科技, 2016, (8): 19–21.
Luo J H. Effects of grass in Ziziphus jujube orchard on microbial diversity in soil [J]. Protection Forest Science and Technology, 2016, (8): 19–21. |
| [33] | Garcíabastidas F, Ordóñez N, Konkol J, et al. First report of Fusarium oxysporum f. sp. cubense tropical race 4 associated with Panama disease of banana outside Southeast Asia [J]. Plant Disease, 2014, 98(5): 694. |
| [34] | Jalaluldeen A M, Sijam K, Othman R, et al. Isolation and characterization of actinomycetes with in-vitro antagonistic activity against Fusarium oxysporum from rhizosphere of chilli [J]. Methodology, 2014, 3: 45–51. |
| [35] |
邓晓, 李勤奋, 武春媛, 等. 健康香蕉 (Musa paradisiaca) 植株与枯萎病患病植株根区土壤细菌多样性的比较研究
[J].
生态环境学报, 2015, (3): 402–408.
Deng X, Li Q F, Wu C Y, et al. Comparison of soil bacterial genetic diversity in root zone of banana (Musa paradisiaca) infected with Fusarium wilt and non-infected plants [J]. Ecology and Environmental Sciences, 2015, (3): 402–408. |
| [36] | Senechkin I V, van Overbeek L S, van Bruggen A H C. Greater fusarium wilt suppression after complex than after simple organic amendments as affected by soil pH, total carbon and ammonia-oxidizing bacteria[J]. Applied Soil Ecology, 2014, 73: 148–155. DOI:10.1016/j.apsoil.2013.09.003 |
 2018, Vol. 24
2018, Vol. 24  doi:
doi: 

