2. 中华人民共和国农业部华北都市农业重点实验室,北京 102206;
3. 中国农业科学院农业资源与农业区划研究所/农业部植物营养与肥料重点实验室,北京 100081
2. Key Laboratory of Urban Agriculture (North China), Beijing 102206, China;
3. Institute of Agricultural Resources and Regional Planning, Chinese Academy of Agricultural Sciences/Ministry of Agriculture Key Laboratory of Plant Nutrition and Fertilizer, Beijing 100081, China
氟磺胺草醚为5-(2-氯-4-三氟甲基苯氧基)-N-甲磺酰-2-硝基苯甲酰胺,是一种二苯醚类选择性除草剂,广泛用于大豆、花生等农田除草。其作用机理是通过抑制靶标植物原卟啉原氧化酶,破坏植物细胞膜,导致细胞死亡[1],从而达到防治田间杂草的目的。随着氟磺胺草醚的用量增多,再加上氟磺胺草醚不易降解、半衰期长 (100~240 d) 等特性,导致其在土壤环境中不断积累[2–3]。据报道,残留在土壤中的氟磺胺草醚极易对大豆和后茬敏感作物造成药害,使作物减产、甚至绝产[4]。此外,氟磺胺草醚可能会杀死土壤中的细菌、真菌和放线菌,破坏微生物多样性,对土壤生态系统健康造成危害[5–7]。Zhang等[5]对添加了氟磺胺草醚的土壤生物指标进行了测定,证明土壤酶活性、微生物数量的变化均不同程度受到除草剂的影响。吴小虎等[8]研究了氟磺胺草醚对不同土壤微生物群落结构和功能多样性的影响,结果表明高浓度氟磺胺草醚改变了土壤微生物群落结构和功能多样性,对细菌、真菌影响显著。
植物根际具有丰富的微生物群落和根系分泌物[9–10],在根系活动的影响下,除草剂的降解及其微生态效应更加复杂[11]。虞云龙等[12]测定了小麦、棉花、水稻和玉米根际土壤和非根际土壤中丁草胺的降解特征及其降解菌的变化动态,结果表明根际土壤中丰富的微生物对丁草胺的降解具有显著的促进作用。Arthur等[13]研究表明,阿特拉津在植物根区土壤中的半衰期较无植物对照土壤缩短约75%,且根区土壤中阿特拉津的降解菌数量比对照土壤多9倍。Souto等[14]研究证实,除草剂甲咪唑烟酸在植物根际土壤中有更高的降解速率。由此可见,根际环境、微生物和除草剂三者之间存在一定程度的相互作用,除草剂在作物根际的生态效应与根际环境密切相关,研究根际环境中除草剂的微生态效应及其降解规律,对于了解除草剂、作物和土壤之间的相互关系,揭示除草剂在作物根际的降解机理具有重要的指导意义。
目前对氟磺胺草醚的研究多集中于其对土壤中微生物数量、群落结构和土壤酶活性的影响,关于氟磺胺草醚在植物根际环境的微生态效应及其降解尚未见报道。本文通过室内根箱模拟栽培试验,在土壤中添加不同浓度氟磺胺草醚后种植大豆,研究了根际土壤中微生物数量和土壤酶活性的变化以及氟磺胺草醚在大豆根际的降解动态。旨在为探明氟磺胺草醚在大豆根际的微生态效应及其降解机理提供必要的理论依据。
1 材料与方法 1.1 供试材料 1.1.1 土壤供试土壤为黑土 (Mollisols),采自吉林省公主岭市城西玉米田0—20 cm耕层土壤,5年内未曾使用过氟磺胺草醚除草剂。采集后的土壤在室温下风干,过5 mm筛,其中一部分供根箱栽培试验用,另一部分供土壤基本理化性质分析用。土壤基本理化性质为pH6.15、EC158.37 μS/cm、有机质22.91 g/kg、全氮1.2 g/kg、有效磷34.52 mg/kg、速效钾163.40 mg/kg。
1.1.2 仪器与试剂Agilent 1200高效液相色谱仪。氟磺胺草醚 (fomesafen),纯度96%,由山东省青岛瀚生生物科技有限公司提供原药。试验过程中所用的其它试剂都是分析纯。
1.1.3 供试大豆试验所用大豆品种为中黄13号,由中国农业科学院作物科学研究所提供。
1.1.4 根箱试验所用根箱为亚克力板所制,长30 cm、宽15 cm、高20 cm,根箱内用0.5 mm (300目) 尼龙网分隔出根际区。每个根箱装相当于8.0 kg风干土的试验处理土壤。
1.2 试验设计大豆盆栽试验于人工气候室内进行,室温 (28 ± 3)℃。根据田间推荐剂量试验设4个处理,分别为:不添加氟磺胺草醚 (CK);添加氟磺胺草醚浓度为3.75 mg/kg,为田间使用推荐剂量 (T1);添加氟磺胺草醚浓度为7.5 mg/kg,为田间使用推荐剂量的2倍 (T2);添加氟磺胺草醚浓度为18.75 mg/kg,为田间使用推荐剂量的5倍 (T5)。每个处理设置3次重复。
氟磺胺草醚溶解于甲醇后,均匀加入到一定量的试验土壤中,充分搅拌、混匀制成含有氟磺胺草醚的母土。根据3种处理浓度设置,分别称取氟磺胺草醚母土和未处理的土壤,充分混匀,得到初始浓度为3.75 mg/kg、7.50 mg/kg和18.75 mg/kg的试验土壤。将各处理试验土壤移至根箱中 (图1),同时在每个根箱中加入尿素和磷酸二氢钾作为基肥,使得N、P均为0.2 g/kg土。60%田间持水量下平衡3 d后,待用。对照 (CK) 添加同样比例的甲醇,不添加氟磺胺草醚。大豆育苗至第1片复叶期移栽到根箱的根区内,每个根箱种植6株,株间距设置为4 cm。试验期间,所有农艺管理措施都按照常规盆栽试验进行。于移栽后的7 d、14 d、28 d、42 d、56 d采用破坏性取样法取根际土样,并对土壤中微生物数量、土壤酶活性和氟磺胺草醚含量进行测定分析。
 |
| 图1 根箱结构示意图 Fig. 1 Diagram of rhizobox |
土壤微生物采用稀释平板法测定[15–16]。细菌采用牛肉膏蛋白胨琼脂培养基 (pH 7.0~7.2),在28℃~30℃恒温培养箱中保湿培养,36~48 h后观察计数。放线菌采用改良高氏一号培养基 (pH 7.2~7.4),其中,每300 mL培养基中加入3%的重铬酸钾1 mL,以抑制细菌和霉菌的生长,在30℃~32℃恒温箱中保湿培养,7~10 d内观察计数。真菌采用马丁氏培养基 (链霉素在培养基灭菌之后加入),在24℃~26℃恒温箱中保湿培养,4 d后观察计数。
1.3.2 土壤酶活性的测定方法土壤过氧化氢酶采用高锰酸钾滴定法测定,其活性用20 min后1 g土消耗0.1 mol/L KMnO4的mL数表示。土壤磷酸酶采用磷酸苯二钠比色法测定,其活性以24 h后100 g土光密度值对应标准曲线上酚的mg数表示。土壤脲酶采用靛酚蓝比色法测定,其活性用38℃培养3 h后单位土重释放的NH4+-N的μg数表示。土壤蔗糖酶采用3,5-二硝基水杨酸比色法测定,其活性以24 h后1 g土壤中葡糖糖的质量 (mg) 表示[17]。
1.3.3 土壤中氟磺胺草醚含量的测定方法样品提取和净化方法:称取相当于10 g干土的过筛土样于50 mL离心管中,加入15 mL丙酮/正己烷 (1∶2,V/V) 提取液,涡旋提取3 min,置于超声波清洗器中超声提取30 min,在8000 rpm离心10 min,将上清液移至50 mL旋蒸瓶中。重复上述提取步骤3次,合并上清液于旋蒸瓶中,35℃旋蒸近干,将残留物溶于5 mL氯仿。过层析柱 (无水硫酸钠和弗罗里硅土柱) 净化[18],先用10 mL氯仿淋洗层析柱,将淋洗液收集弃去,待净化样品移入层析柱中,用10 mL氯仿再次淋洗层析柱,淋洗液收集弃去。再用40 mL甲醇/氯仿 (3∶1,V/V) 洗脱,收集洗脱液。于35℃下旋转蒸发近干,用甲醇定容至5 mL,过0.22 μm有机滤膜,供HPLC检测。
色谱分析条件:具备自动进样器和紫外检测器 (G1314B);色谱柱Eclipse XDB-C18,5 μm,4.6 × 250 mm;流动相为乙腈∶水 (50∶50),水中含有0.1%磷酸;流速1.0 mL/min,柱温40℃,检测波长290 nm,进样量20 μL,保留时间11 min。
以样品保留时间定性,外标法定量,计算公式:
| ${A} = {\rm{a}}c + {\rm{b}};\quad\quad\quad\quad\,$ | (1) |
| ${R} = \frac{{\left( {\displaystyle\frac{{{{A}_\text{样}} - {\rm{b}}}}{{\rm{a}}}} \right) \times {{V}_\text{终}}}}{{{W}}}$ | (2) |
公式 (1) 为标准品浓度与峰面积之间的拟合关系,c为标准品浓度,a、b为拟合曲线的常数值,A为不同标准品浓度对应的峰面积;公式 (2) 中A样为样品对应的峰面积,V终为样品溶液的最终定容体积 (mL),W为样品质量 (g),R为样品中农药残留量 (mg/kg)。
添加回收率试验表明,该方法添加氟磺胺草醚浓度在1~10 mg/kg (1、5、10 mg/kg),回收率为75%~86%,变异系数为1.2%~9.8%,满足试验分析要求。
1.4 数据处理所有试验数据均为3次重复的平均值。采用Microsoft Excel 2010进行基本计算和作图,采用SPSS 21.0软件进行统计分析,各项测定指标在不同处理之间的差异显著性采用Tukey honestly significant difference (HSD) 法进行检验分析,差异显著水平设置为P = 0.05。
2 结果与分析 2.1 土壤微生物数量在整个试验过程中,低浓度 (T1) 和中浓度 (T2) 氟磺胺草醚处理的大豆根际土壤细菌数量均低于对照 (CK) 处理,并且低浓度处理在第7 d、42 d和56 d与对照差异达到显著水平 (P < 0.05)。高浓度 (T5) 氟磺胺草醚处理的大豆根际土壤细菌数量只有在28 d时显著大于对照 (CK),其它各时期与对照差异均不显著。在整个试验过程中,同一采样时期3种浓度氟磺胺草醚处理的大豆根际土壤细菌数量与氟磺胺草醚浓度呈现正相关,细菌数量均为T1 < T2 < T5。并且在28 d时,高浓度 (T5) 处理的细菌数量显著大于低浓度和中浓度 ( P < 0.05)。在42 d时,高浓度 (T5) 和中浓度 (T2) 处理的细菌数量显著大于低浓度 (T1)( 图2)。
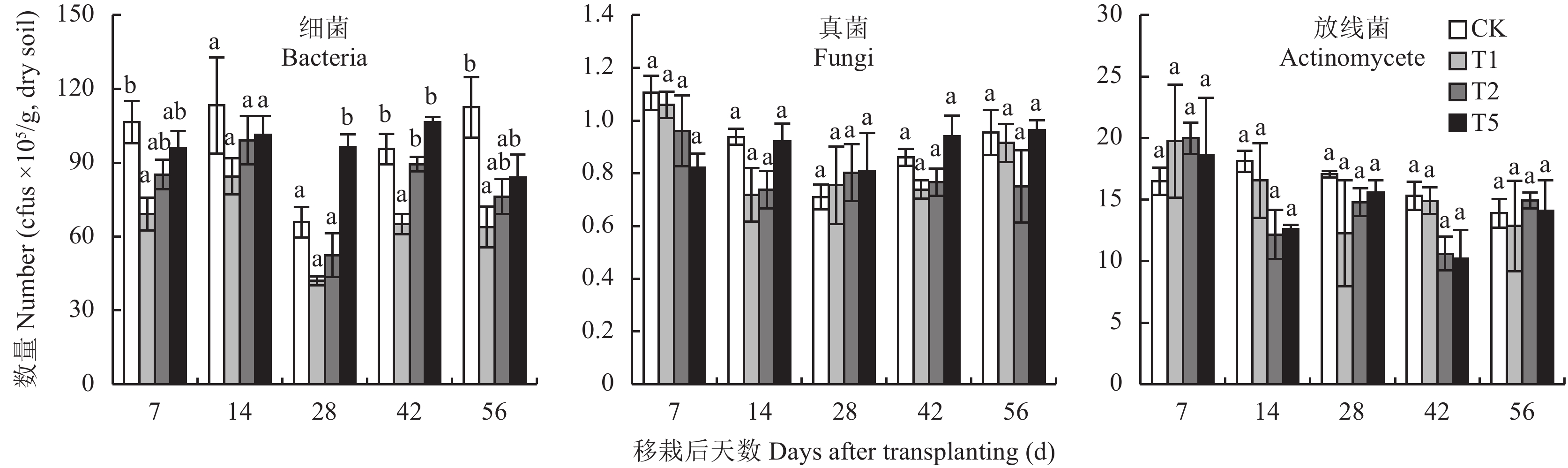 |
| 图2 施用不同浓度氟磺胺草醚后不同时期大豆根际土壤细菌、真菌和放线菌数量 Fig. 2 Numbers of bacteria, fungi and actinomycete in the soybean rhizosphere with different concentrations of fomesafen [注(Note):T1—氟磺胺草醚Fomesafen 3.75 mg/kg;T2—氟磺胺草醚Fomesafen 7.5 mg/kg;T5—氟磺胺草醚Fomesafen 18.75 mg/kg;误差线代表标准偏差 Bars donate S.D., 柱上不同字母表示同一采样日期不同处理间差异达到5%显著水平 Different letters above the bars indicate significant differences among different treatments at the same sample date at P<0.05.] |
在整个试验过程中,高浓度 (T5) 氟磺胺草醚处理的大豆根际土壤真菌数量与对照 (CK) 相比表现出先减少后增加的趋势;低浓度 (T1) 和中浓度 (T2) 则表现为先减少后增加再减少。而低浓度 (T1) 氟磺胺草醚处理的大豆根际土壤放线菌数量与对照 (CK) 相比呈现先增加后减少的趋势;中浓度 (T2) 和高浓度 (T5) 则表现为先增加后减少再增加。但是根际土壤真菌和放线菌数量在各处理之间的差异均未达到显著水平 (图3)。
2.2 土壤酶活性由图可知,在整个培养过程中,低浓度 (T1) 氟磺胺草醚处理的大豆根际土壤过氧化氢酶活性与对照 (CK) 相比表现出先减少后增加的趋势,7 d、14 d和28 d时过氧化氢酶活性均低于对照 (CK),42 d以后均高于对照 (CK)。中浓度 (T2) 氟磺胺草醚处理的大豆根际土壤过氧化氢酶活性与对照 (CK) 相比同样表现出先减少后增加的趋势,只有在56 d时略高于对照 (CK)。高浓度 (T5) 氟磺胺草醚处理的大豆根际土壤过氧化氢酶活性的变化趋势与低浓度和中浓度一致,在培养7 d和14 d时低于对照,28 d以后均略高于对照 (CK)。但是,大豆根际土壤过氧化氢酶活性在各处理之间的差异并未达到显著水平。
低浓度 (T1) 氟磺胺草醚处理的大豆根际土壤磷酸酶活性只有在14 d时显著低于对照 (CK)(P < 0.05),其余各时期与对照差异均不显著。中浓度 (T2) 氟磺胺草醚处理的大豆根际土壤磷酸酶活性在整个试验过程中与对照 (CK) 均无显著差异。高浓度 (T5) 氟磺胺草醚处理的大豆根际土壤磷酸酶活性在7 d和28 d时与对照 (CK) 差异达到显著水平 ( P < 0.05),7 d时低于对照,28 d时高于对照。
在整个培养过程中,高浓度 (T5) 氟磺胺草醚处理的大豆根际土壤脲酶活性与对照 (CK) 相比表现出先增加后减少的趋势,培养7 d时高浓度 (T5) 氟磺胺草醚处理的大豆根际土壤脲酶活性大于对照 (CK),14 d以后均小于对照,并且在培养14 d、28 d、42 d时差异达到显著水平 (P < 0.05)。中浓度 (T2) 氟磺胺草醚处理的大豆根际土壤脲酶活性在7 d时显著大于对照 (CK),而14 d到42 d均显著小于对照 ( P < 0.05)。低浓度 (T1) 氟磺胺草醚处理的大豆根际土壤脲酶活性在14 d和28 d时显著低于对照 ( P < 0.05),其余时间两者差异不显著。
在整个试验过程中,低浓度 (T1) 和中浓度 (T2) 氟磺胺草醚处理的大豆根际土壤蔗糖酶活性与对照相比均没有显著差异。高浓度 (T5) 氟磺胺草醚处理的大豆根际土壤蔗糖酶活性在试验前期与对照 (CK) 差异不显著,只有在42 d和56 d时显著低于对照 (CK)(P < 0.05)。在整个试验过程中,高浓度 (T5) 处理的大豆根际土壤蔗糖酶活性均低于低浓度 (T1) 和中浓度 (T2),并且在42 d时差异达到显著水平 ( P < 0.05)。
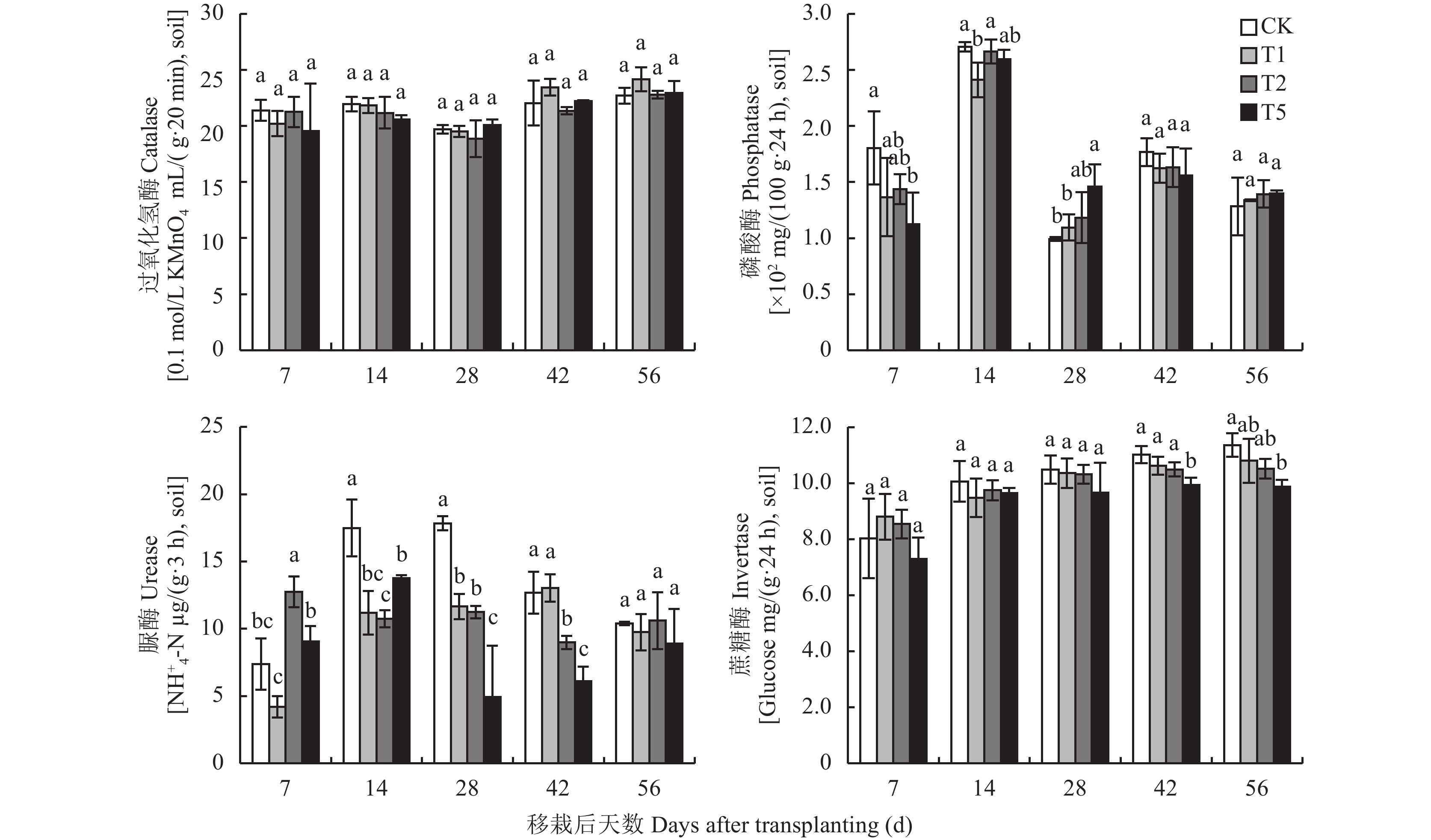 |
| 图3 施用不同浓度氟磺胺草醚后不同时期大豆根际土壤酶活性 Fig. 3 Soil enzyme activities in the soybean rhizosphere under different concentrations of fomesafen [注(Note):T1—氟磺胺草醚Fomesafen 3.75 mg/kg;T2—氟磺胺草醚Fomesafen 7.5 mg/kg;T5—氟磺胺草醚Fomesafen 18.75 mg/kg;误差线代表标准偏差 Bars donate S.D., 柱上不同字母表示同一采样日期不同处理间差异达到5%显著水平 Different letters above the bars indicate significant differences among different treatments at the same sample date at P<0.05.] |
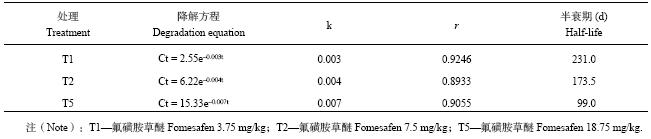
低浓度 (T1) 和中浓度 (T2) 氟磺胺草醚在整个56 d的试验过程中降解非常缓慢,浓度分别从起始的2.55 mg/kg和6.22 mg/kg减少到56 d后的2.16 mg/kg和4.76 mg/kg。高浓度 (T5) 氟磺胺草醚在整个试验过程中降解很明显,从起始的15.33 mg/kg减少到56 d后的9.44 mg/kg,并且在最初的1周内降解速率最快,以后随着农药浓度的降低降解逐渐变慢 (图4)。
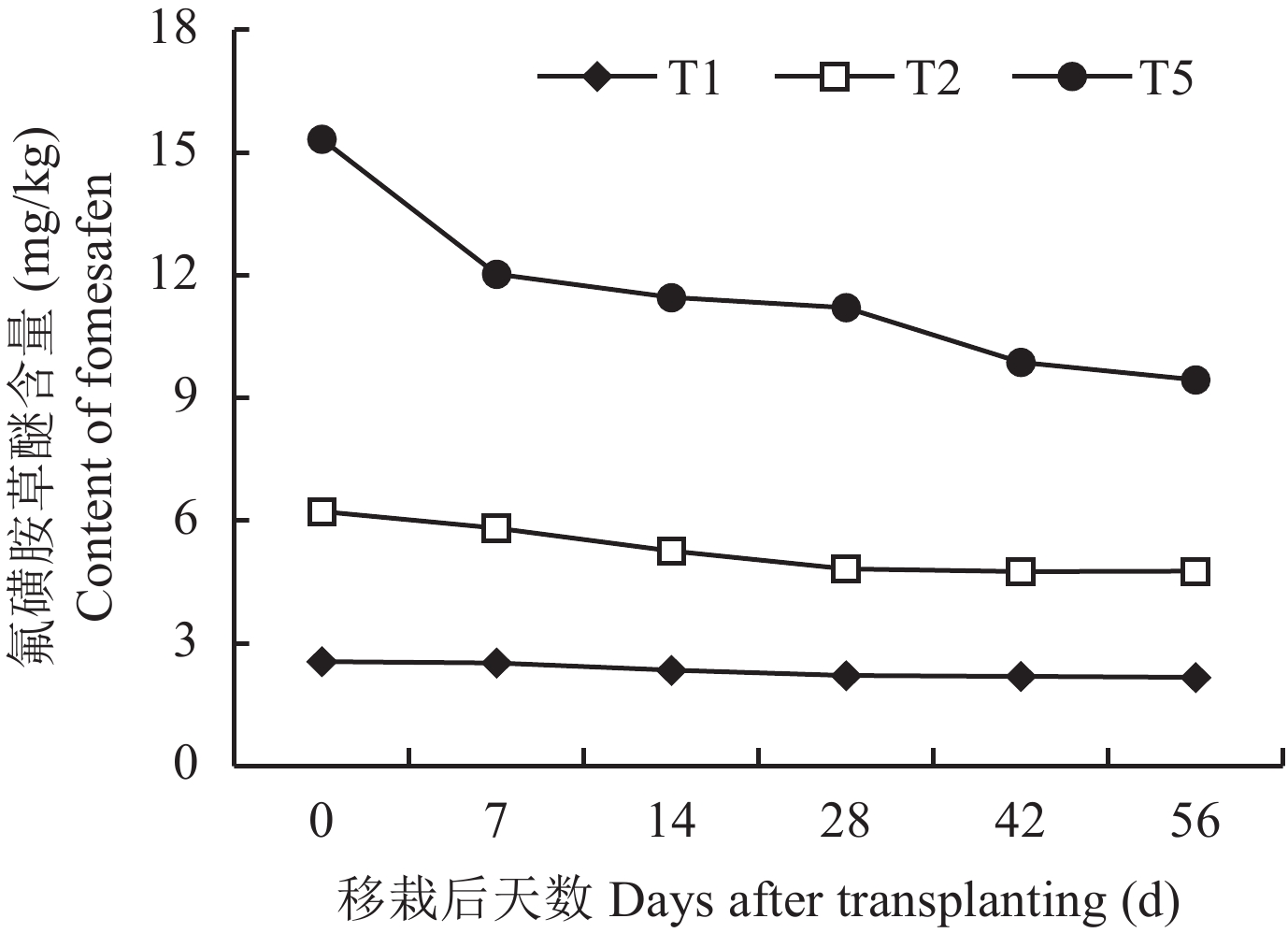 |
| 图4 不同浓度的氟磺胺草醚在大豆根际的降解动态 Fig. 4 Degradation of different concentrations of fomesafen in the soybean rhizosphere [注(Note):T1—氟磺胺草醚Fomesafen 3.75 mg/kg;T2—氟磺胺草醚Fomesafen 7.5 mg/kg;T5—氟磺胺草醚Fomesafen 18.75 mg/kg.] |
3种浓度的氟磺胺草醚在大豆根际土壤中的降解均符合一级动力学方程:
| ${ {C_{\rm t}}} = { {C_0}}{e}^{-{\rm {k}}t}$ | (3) |
式中:Ct为氟磺胺草醚t时刻在土壤中的残留浓度;C0为氟磺胺草醚的初始浓度;k为降解速率常数;t为时间。据此求得不同浓度氟磺胺草醚在大豆根际土壤中的降解动力学参数。
由表1可以看出,不同浓度的氟磺胺草醚在大豆根际土壤中的半衰期差异明显,T1、T2和T5的半衰期分别为231 d、173.5 d和99 d,由低浓度到高浓度半衰期逐渐变短。土壤中氟磺胺草醚初始浓度越高,降解速率越快,半衰期越短。
| 表1 氟磺胺草醚在大豆根际土壤中的降解动力学特征 Table 1 Degradation kinetics of fomesafen in the soybean rhizosphere |
 |
土壤微生物能够促进土壤生态系统的物质循环和能量流动,是土壤健康、土壤污染和生态恢复等指示生物,有很好的环境指示作用[19–20]。众多研究[21–22, 30]结果表明,除草剂氟磺胺草醚对土壤中的微生物产生不同程度的刺激或抑制等作用。本研究发现T5浓度的氟磺胺草醚处理的大豆根际土壤细菌数量在28 d和42 d时表现出一定程度的“激增效应”[22],据推测细菌的增长可能是由于氟磺胺草醚的添加为微生物提供更多能源,导致某种适应的细菌数量有所增加。而T1和T2浓度氟磺胺草醚处理的大豆根际土壤细菌数量在整个培养时期均低于CK,可能是由于除草剂添加量并未达到某类可以利用它的细菌生长所需的浓度,而却对大量的微生物产生了毒性,具体还需进一步设计实验进行分析验证。据统计分析,大豆根际土壤真菌和放线菌数量在对照和各浓度氟磺胺草醚处理之间,以及不同浓度氟磺胺草醚处理之间差异并不显著,这可能是因为大豆根际土壤中真菌和放线菌对氟磺胺草醚具有一定的抗性,并未受到氟磺胺草醚添加的影响。土壤微生物群落结构与植物根系活力有密切关系,在植物生长过程中,根系分泌物由于受到除草剂的影响而产生变化,从而对根际土壤微生物产生一定的影响。因此,今后可通过测定除草剂胁迫下植物根系分泌物的成分,以及根际微生物的群落结构来进一步探索除草剂、根系分泌物以及根际微生物之间的相互关系。
3.2 土壤酶活性土壤酶是反映土壤对环境变化响应的重要指标之一,它在土壤的物质循环和能量流动以及污染物的降解方面有十分重要的作用[23],然而大量的研究证明土壤酶活性明显会受到包括杀虫剂、除草剂等农药的影响[24]。Kuchaeski等[25]研究表明,除草剂对土壤中的过氧化氢酶和磷酸酶活性有刺激作用。孙约兵等[26]研究了硝磺草酮对土壤酶活性的影响,其结果表明,土壤过氧化氢酶活性和蔗糖酶活性随硝磺草酮浓度增加呈现出“先升高后降低”的趋势,在最大浓度50 mg/kg处理下与对照相比增加最大,而添加了硝磺草酮的脲酶活性反而降低。张清明等[5]研究表明添加氟磺胺草醚30 d后,土壤脲酶活性受到抑制,随着培养时间延长转而受到刺激,而酸性磷酸酶活性随着添加氟磺胺草醚浓度的增加而升高。
本研究结果表明高浓度 (T5) 氟磺胺草醚处理的大豆根际土壤酶活性与对照相比,比低浓度 (T1) 和中浓度 (T2) 响应更为强烈,这说明土壤酶活性与氟磺胺草醚浓度存在一定的剂量关系[27]。土壤过氧化氢酶活性在试验初期受到氟磺胺草醚一定程度的抑制,试验后期与对照相比略有升高,但统计分析表明各浓度处理与对照之间并没有显著性差异,这与郑景瑶等[22]研究获得的氟磺胺草醚对过氧化氢酶活性呈先抑制后刺激的结果一致,这个结果可能是因为土壤微生物虽然在氟磺胺草醚的作用下受到一定程度的损害,但还不足以激发酶活性响应机制[28]。大豆根际土壤中的磷酸酶活性在不同时期的响应比较敏感,表明其易受到氟磺胺草醚的影响,试验初期表现出的抑制作用,说明氟磺胺草醚对微生物产生了一定的毒害,降低了土壤中有机磷的转化速度。此后磷酸酶活性表现出的增长,可能是由于氟磺胺草醚的渗透和融入,为微生物生长提供了能量来源,表现出激活作用[29]。不同浓度氟磺胺草醚对大豆根际土壤脲酶活性影响不同,表现先抑制后轻微刺激的趋势,这与张清明等报道的氟磺胺草醚对脲酶活性影响的结果相似,说明氟磺胺草醚在初期会对脲酶表现出一定的毒性,不利于有效氮的充分利用[30],而T2和T5处理则在后期表现出较长的抑制作用。蔗糖酶活性在短时期内并未受到氟磺胺草醚的显著影响,高浓度氟磺胺草醚处理的大豆根际土壤蔗糖酶活性显著受到抑制,这可能是因为随着氟磺胺草醚的渗透融入,逐渐对土壤微生物表现出一定的毒性。本研究结果发现脲酶活性和磷酸酶活性对氟磺胺草醚的响应较为敏感,建议其可作为衡量氟磺胺草醚对土壤生态影响的环境指标。
不同除草剂对同一种酶的影响不同,本研究中氟磺胺草醚对不同酶活性的影响也有所不同。目前有解释认为这与除草剂对土壤酶的作用机制有关[31],除草剂与酶分子之间产生作用[8],同一底物表现出对不同酶的不同作用,除草剂分子可能是某种酶的最适底物,也可能是另外一种酶的天然抑制剂[32]。然而酶活性同样也受到根系活动的影响,根系越发达,根系分泌物越多,能够在一定程度上促进细菌、真菌等微生物繁殖,从而酶活性有所增加[33]。有研究发现农药处理水稻后,水稻根系对营养液中氮、磷、钾等元素的吸收能力受到一定程度的影响[34],根系活力有所下降。还有学者[35]认为,除草剂对植物吸收的影响主要表现在植物根系,用高浓度除草剂容易对根系产生毒害现象,而植物根系活力与酶活性相互影响。一般认为,使用高剂量化学农药后会对作物造成药害,影响到植物的正常生长发育,从而对植物根系产生消极作用。本试验研究过程中高浓度剂量处理对大豆外部形态有明显的抑制效果,但关于氟磺胺草醚对大豆根系活力造成的影响与酶活性之间的相互关系还需进一步研究。本研究结果仅仅在推荐剂量基础上和盆栽条件下得出的,与田间广阔的根系生长环境不同,而除草剂与土壤酶活性的相互作用十分复杂,需要进一步结合大豆根系分泌物、微生物和复杂的微生态环境探索其机理。
3.3 氟磺胺草醚在大豆根际土壤中的降解除草剂在土壤中的降解受土壤pH值、土壤类型、有机质等不同因素的影响[36–37],但研究证明土壤微生物对除草剂的降解起促进作用。殷春涛等[38]研究灭菌与非灭菌土,观察到甲基磺草酮在非灭菌土中降解更迅速,说明微生物对甲基磺草酮的降解有一定的促进作用。郭华等[39]研究草萘胺在土壤中的降解,结果证明草萘胺在灭菌土中降解的半衰期是非灭菌土的3倍,土壤微生物是影响草萘胺降解的主要因素。吴小虎等[8]研究氟磺胺草醚在黑土中的降解动态,结果表明氟磺胺草醚的降解呈现先快后慢的趋势,分析认为这与微生物对其利用方式有关。本试验结果表明3种浓度的氟磺胺草醚在大豆根际土壤中的降解均符合一级动力学方程,半衰期为99~231 d,高浓度 (T5) 氟磺胺草醚降解速率明显高于低浓度 (T1) 和中浓度 (T2),降解趋势与吴小虎等所得研究结果相似,呈现先快后慢的趋势。与高浓度相比,中浓度 (T2) 和低浓度 (T1) 氟磺胺草醚降解缓慢。分析认为可能是因为在农药浓度较低的情况下,微生物倾向于利用其它有机物维持自身生长,对农药的利用效率较低[40–42],随着农药浓度降低,降解趋于缓慢,从而导致低浓度氟磺胺草醚在土壤中残留时间较长。
4 结论总体而言,氟磺胺草醚只在施用浓度较低时会降低大豆根际土壤细菌数量,而对大豆根际土壤真菌和放线菌的数量均没有显著影响。氟磺胺草醚对大豆根际土壤过氧化氢酶活性没有显著影响,在短期内对根际土壤磷酸酶活性有一定程度的抑制作用;低浓度氟磺胺草醚可以显著降低大豆根际土壤脲酶活性,中浓度和高浓度对脲酶活性表现为先刺激后抑制的作用;高浓度氟磺胺草醚在试验后期可以显著抑制大豆根际土壤蔗糖酶活性。氟磺胺草醚降解半衰期由低浓度到高浓度逐渐变短,即大豆根际土壤中氟磺胺草醚初始浓度越高,降解速率越快,半衰期越短。
| [1] |
战徊旭, 任洪雷, 蒋凌雪, 等. 氟磺胺草醚降解菌的分离鉴定及生长特性研究[J].
作物杂志, 2011, (2): 40–44.
Zhan H X, Ren H L, Jiang L X, et al. Separation, identification and growth characters of herbicide fomesafen degrading-fungi[J]. Crops, 2011, (2): 40–44. |
| [2] | Kizilkaya R, Izzet Akca, Askin T, et al. Effect of soil contamination with azadirachtin on dehydrogenase and catalase activity of soil[J]. Eurasian Journal of Soil Science, 2012, 1(2): 98–103. |
| [3] | Guo J F, Zhu G N, Shi J J, et al. Adsorption, desorption and mobility of formesafen in Chinese soils[J]. Water Air & Soil Pollution, 2003, 148(1-4): 77–85. |
| [4] | Rauch B J, Bellinder R R, Brainard D C, et al. Dissipation of fomesafen in New York State soils and potential to cause carryover injury to sweet corn[J]. Weed Technology, 2007, 21(1): 206–212. DOI:10.1614/WT-05-168.1 |
| [5] | Zhang Q M, Zhu L S, Wang J, et al. Effects of fomesafen on soil enzyme activity, microbial population, and bacterial community composition[J]. Environmental Monitoring & Assessment, 2014, 186(5): 2801–2812. |
| [6] | MariAc Z, Jayl G, Marisaa G. An integrated approach to evaluate the impacts of the herbicides glyphosate, 2,4-D and metsulfuron-methyl on soil microbial communities in the Pampas region, Argentina[J]. Applied Soil Ecology, 2008, 40(1): 1–12. |
| [7] | Kalia A, Gupta R P. Disruption of foodweb by pesticides[J]. Indian Journal of Ecology, 2004, 31(2): 85–92. |
| [8] | Wu X H, Xu J, Dong F S, et al. Responses of soil microbial community to different concentration of fomesafen[J]. Journal of Hazardous Materials, 2014, 273(3): 155–164. |
| [9] | Zobiole L H S, Kremer R J, Oliveira R S, et al. Glyphosate affects micro-organisms in rhizosphere of glyphosate-resistant soybeans[J]. Journal of Applied Microbiology, 2011, 110(1): 118–127. DOI:10.1111/jam.2010.110.issue-1 |
| [10] | Zhang X L, Li X, Zhang C G, et al. Ecological risk of long-term chlorimuron-ethyl application to soil microbial community: an in situ investigation in a continuously cropped soybean field in Northeast China[J]. Environmental Science & Pollution Research International, 2011, 18(3): 407–415. |
| [11] |
何艳, 徐建民, 李兆君. 有机污染物根际胁迫及根际修复研究进展[J].
土壤通报, 2004, 35(5): 658–662.
He Y, Xu J M, Li Z J. Rhizosphere stress effect and rhizoid-remediation of organic pollutants in soil[J]. Chinese Journal of Soil Science, 2004, 35(5): 658–662. |
| [12] |
虞云龙, 杨基峰, 潘学冬, 等. 作物种类对根际土壤中丁草胺降解的影响[J].
农药学学报, 2004, 6(1): 46–52.
Yu Y L, Y J F, Pan X D, et al. Effect of plant species on degradation of butachlor on rhizosphere soils collected from agricultural field[J]. Chinese Journal of Pesticide Science, 2004, 6(1): 46–52. |
| [13] | Arthur E L, Perkovieh B S, Anderson T A, et al. Degradation of an atrazine and metolaehlor herbicide mixture in pesticide-contaminated soils from two agrochemical dealerships in Lowa[J]. Water Air & Soil Pollution, 2000, 119(1–4): 75–90. |
| [14] | Souto K M, Jacques R J S, Avilal A D, et al. Biodegradation of the herbicides imazethapyr and imazapic in rhizosphere soil of six plant species[J]. Ciência Rural, 2013, 43(10): 1790–1796. DOI:10.1590/S0103-84782013001000010 |
| [15] |
许光辉, 郑洪元. 土壤微生物分析方法手册[M]. 北京: 中国农业出版社, 1986.
Xu G H, Zheng H Y. Handbook of analytical method on soil microorganism [M]. Beijing: China Agriculture Press, 1986. |
| [16] |
李阜棣, 喻子牛, 何绍江. 农业微生物学实验技术[M]. 北京: 中国农业出版社, 1996.
Li F D, Yu Z N, He S J. Experimental techniques in agricultural microbiology[M]. Beijing: China Agriculture Press, 1996. |
| [17] |
关松荫, 等. 土壤酶及其研究法[M]. 北京: 中国农业出版社, 1986.
Guan S Y, et al. Soil enzyme and its research methods [M]. Beijing: China Agriculture Press, 1986. |
| [18] |
郭江峰, 陆怡通, 孙锦荷. 氟磺胺草醚在花生和大豆田中的残留动态[J].
农业环境保护, 2000, 19(2): 82–84.
Guo J F, Lu Y T, Sun J H. Residue dynamics of fomesafen in peanut and soybean fields[J]. Agroenvironmental Protection, 2000, 19(2): 82–84. |
| [19] |
吴雪楠, 孙菁菁, 罗园园, 等. 草甘磷对土壤微生物能量代谢的影响[J].
化学与生物工程, 2016, 33(4): 18–21.
Wu X N, Sun J J, Luo Y Y, et al. Effect of glyphosate on energy metabolism of soil micro-organisms[J]. Chemistry and Bioengineering, 2016, 33(4): 18–21. |
| [20] |
刘贝贝, 陈冬, 康秋玉, 等. 土壤微生物对农药场地土壤环境的生物指示作用[J].
土壤通报, 2013, 44(5): 1210–1217.
Liu B B, Chen D, Kang Q Y, et al. The biological indication of soil organisms to soil environment of insecticide factory[J]. Chinese Journal of Soil Science, 2013, 44(5): 1210–1217. |
| [21] |
杨会青, 孔祥清, 王智慧, 等. 四种除草剂对根瘤菌、AMF等土壤微生物的影响[J].
微生物学通报, 2009, 36(4): 511–514.
Yang H Q, Kong X Q, Wang Z H, et al. The effect of four herbicides on rhizobium, AMF and other soil microbe[J]. Microbiology, 2009, 36(4): 511–514. |
| [22] |
郑景瑶, 王百惠, 岳忠辉, 等. 氟磺胺草醚对黑土微生物数量及酶活性的影响[J].
植物保护学报, 2013, 40(5): 468–472.
Zheng J Y, Wang B H, Yue Z H, et al. Effect of fomesafen on microorganism quantity and enzyme activities in black soil[J]. Acta Phytophylacica Sinica, 2013, 40(5): 468–472. |
| [23] | Ge G F, Li Z J, Zhang J, et al. Geographical and climatic differences in long-term effect of organic and inorganic amendments on soil enzymatic activities and respiration in field experimental stations of China[J]. Ecological Complexity, 2009, 6(4): 421–431. DOI:10.1016/j.ecocom.2009.02.001 |
| [24] | Kucharski J, Wyszkowska J. Biological properties of soil contaminated with the herbicide Apyros 75 WG[J]. Journal of Elementology, 2008, 13(3): 357–371. |
| [25] | Kucharski J, Tomkiel M, Bacmaga M, et al. Enzyme activity and microorganisms diversity in soil contaminated with the Boreal 58 WG herbicide[J]. Journal of Environmental Science and Health Part B, 2016, 51(7): 446. DOI:10.1080/03601234.2016.1159456 |
| [26] |
孙约兵, 王润珑, 徐应明, 等. 除草剂硝磺草酮对土壤微生物生态效应研究[J].
中国环境科学, 2016, 36(1): 190–196.
Sun Y B, Wang R L, Xu Y M, et al. Ecological effect of herbicide mesotrione on soil microbial communities[J]. China Environmental Science, 2016, 36(1): 190–196. |
| [27] |
宋福强, 范晓旭, 常伟, 等. 苜蓿菌根对土壤中阿特拉津降解及酶活性影响[J].
中国农学通报, 2016, 32(30): 182–187.
Song F Q, Fan X X, Chang W, et al. Effect of alfalfa mycorrhiza on atrazine degradation and enzyme activities in soil[J]. Chinese Agricultural Science Bulletin, 2016, 32(30): 182–187. DOI:10.11924/j.issn.1000-6850.casb16040027 |
| [28] |
吕林兰, 杨家新, 董学兴, 等. 马拉硫磷对双齿围沙蚕乙酰胆碱酯酶和过氧化氢酶的影响[J].
农业环境科学学报, 2010, 29(3): 431–436.
Lü L L, Yang J X, Dong X X, et al. Effection of malathion on the activity of acetycholinesterase and catalase of polychaete Perinereis aibuhitensis [J]. Journal of Agro-Environment Science, 2010, 29(3): 431–436. |
| [29] |
傅丽君, 杨文金. 四种农药对枇杷园土壤磷酸酶活性及微生物呼吸的影响[J].
中国生态农业学报, 2007, 15(6): 113–116.
Fu L J, Yang W J. Effect of pesticides on soil phosphatase activity and respiration of soil microorganisms in loquat orchard[J]. Chinese Journal of Eco-Agriculture, 2007, 15(6): 113–116. |
| [30] |
张清明. 除草剂氟磺胺草醚对土壤酶、微生物与蚯蚓的生态毒理研究[D]. 山东: 山东农业大学博士学位论文, 2012.
Zhang Q M. Ecological toxicology studies of herbicide fomesafen on soil enzyme, microorganism and earthworm(Eisenia fetida)[D]. Tai’an, Shandong: PhD Dissertation of Shandong Agricultural University, 2012. |
| [31] |
严岩, 文波龙, 徐惠风, 等. 除草剂苄嘧磺隆对盐碱化沼泽芦苇生长及土壤酶活性影响的实验研究[J].
湿地科学, 2016, 14(1): 117–120.
Yan Y, Wen B L, Xu H F, et al. Effects of herbicide bensulfuron-methyl on growth of reed and activities of enzymes in soil in salinized marshes[J]. Wetland Science, 2016, 14(1): 117–120. |
| [32] |
杜慧玲, 吴济南, 王丽玲, 等. 苯磺隆对土壤酶活性的影响[J].
核农学报, 2010, 24(3): 585–588.
Du H L, Wu J N, Wang L L, et al. Effect of tribenuron-methyl application on activity of soil enzyme[J]. Journal of Nuclear Agricultural Science, 2010, 24(3): 585–588. DOI:10.11869/hnxb.2010.03.0585 |
| [33] |
李晓慧, 韩晓增, 王树起, 等. 小麦不同施肥方式对黑土微生物数量和酶活性的影响[J].
生态学杂志, 2010, 29(6): 1143–1148.
Li X H, Han X Z, Wang S Q, et al. Effects of wheat root activity and fertilization mode on the microbial amount and enzyme activities in black soil[J]. Chinese Journal of Ecology, 2010, 29(6): 1143–1148. |
| [34] |
刘井兰, 于建飞, 印建莉, 等. 化学农药对植物生理生化影响的研究进展[J].
农药, 2006, 45(8): 511–514.
Liu J L, Yu J F, Yin J L, et al. Research progress on the effect of chemical pesticides on the plant physiology and biochemistry[J]. Agrochemicals, 2006, 45(8): 511–514. |
| [35] |
赵艺, 赵保卫. 土壤污染对植物根系生长影响的研究进展[J].
环境科学与管理, 2008, 33(6): 13–15.
Zhao Y, Zhao B W. Advances in the research of the impact of soil pollution on the growth of plant roots[J]. Environmental Science and Management, 2008, 33(6): 13–15. |
| [36] | Lehmann R G, Miller J R, Fontaine D D, et al. Degradation of a sulfonamide herbicide as a function of soil sorption[J]. Weed Research, 2010, 32(3): 197–205. |
| [37] | Beynon K I, Roberts T R, Wright A N. The degradation of the herbicide benzoylprop-ethyl following its application to wheat[J]. Pesticide Management Science, 2010, 5(4): 429–442. |
| [38] |
殷春涛, 陈天明, 崔立强, 等. 典型土壤中除草剂甲基磺草酮降解特性研究[J].
江苏农业科学, 2014, 42(5): 253–255.
Yin C T, Chen T M, Cui L Q, et al. Study on degradation characteristics of herbicide mesotrione in typical soil[J]. Jiangsu Agriculture Science, 2014, 42(5): 253–255. |
| [39] |
郭华, 朱红梅, 杨红. 除草剂草萘胺在土壤中的降解与吸附行为[J].
环境科学, 2008, 29(6): 1729–1736.
Guo H, Zhu H M, Yang H. Degradation and adsorption behavior of napropamide in soils[J]. Environmental Science, 2008, 29(6): 1729–1736. |
| [40] | Nannipieri P, Giagnoni L, Landi L, et al. Role of phosphatase enzymes in soil/phosphorus in action [M]. Berlin Heidelberg: Springer, 2011(26): 215–243. |
| [41] |
向月琴, 高春明, 庞国辉, 等. 土壤中多菌灵的降解动态及其对土壤微生物群落多样性的影响[J].
土壤学报, 2008, 45(4): 699–704.
Xiang Y Q, Gao C M, Pang G H, et al. Degradation dynamics of carbendazim in soil and its effects on soil microbial community diversity[J]. Acta Pedologica Sinica, 2008, 45(4): 699–704. |
| [42] |
谢慧, 朱鲁生, 谭梅英. 哌虫啶在土壤中的降解动态及对土壤微生物的影响[J].
土壤学报, 2016, 53(1): 232–240.
Xie H, Zhu L S, Tan M Y. Degradation dynamics of IPP in soil and its effects on soil microorganisms[J]. Acta Pedologica Sinica, 2016, 53(1): 232–240. DOI:10.11766/trxb201501170575 |
 2018, Vol. 24
2018, Vol. 24  doi:
doi: 

