2. 沈阳农业大学土地与环境学院/土肥资源高效利用国家工程实验室,辽宁沈阳 110866
2. College of Land and Environment, Shenyang Agricultural University/National Engineering Laboratory for Efficient Utilization of Soil and Fertilizer, Shenyang 110866, China
番茄 (Solanum lycopersicum L.) 为茄科番茄属草本植物,原产拉丁美洲,自16世纪初引种至欧洲后逐渐发展成为世界上种植面积最广的蔬菜作物之一。中国是世界番茄主要生产国,2012年播种面积 (100万hm2) 和总产量 (5000万t) 均已越居世界首位[1]。番茄露地或设施栽培生产中经常会遭遇盐渍逆境,致使其光合生产潜力难以充分发挥,最终导致产量降低,商品性变差,给生产造成严重的经济损失。因此,研究番茄在盐渍逆境下的生理生态变化及其机制,对其高产、优质栽培及耐盐品种选育鉴定具有极其重要的意义。
利用外源物质对栽培作物进行诱抗处理是目前提高植物对逆境耐性的简便、有效、可行的方法之一[2]。水杨酸 (salicylic acid,SA) 和一氧化氮 (nitric oxide,NO) 是普遍存在于植物体内的两种生物活性信号分子,二者均能参与植物应答生物和非生物逆境的信号转导过程。研究发现,在复杂的细胞信号转导网络中SA和NO并非孤立存在,它们“cross talk”,在诸多生理代谢[3]、基因表达[4]和抗逆反应[5]中均能表现出交互 (协同) 作用。受此启发,以外源SA和NO供体硝普钠 (sodium nitropprusside,SNP) 协同诱导植物提高抗性的研究正愈来愈受关注。
目前,在对植物抵御重金属[6]、耐低温[7]、适应缺铁[8]、缓解UV-B辐射[9]和抗盐[10–13]等的研究中虽已证实了SA、SNP复配诱抗处理的协同效应,但相关研究仍主要局限于对生长发育、抗氧化系统活性、渗透调节和离子组成等方面的探讨。有关利用叶绿素荧光动力学技术系统研究SA、SNP协同调控植物抗 (耐) 盐的研究鲜见报道。本研究以番茄为试材,研究SA和SNP对NaCl胁迫下番茄幼苗叶片PSⅡ光化学效率、激发能分配和天线色素吸收光能利用的影响,旨在探明盐胁迫下外源SA、NO对番茄叶片光合功能的调控作用及其相互关系,为高效利用化学诱抗剂缓解盐渍逆境障碍提供理论依据和技术参考。
1 材料与方法 1.1 材料培养与试验设计供试材料为番茄品种‘秦丰保冠’,由西安市秦丰蔬菜研究所提供。将温汤浸种出芽 (55℃温水中浸泡3~4 h后放在铺有湿润纱布的培养皿内,于29℃恒温箱中催芽) 的种子播于营养钵中,以蛭石作基质,待真叶展开后每2 d浇1/8 Hoagland营养液1次,每株浇50 mL,当幼苗具有4~5真叶时,挑选长势一致的植株定植于水培箱内,定植前用蒸馏水洗净根部的育苗基质。水培箱大小为60 cm × 40 cm × 20 cm,每个水培箱加1/4 Hoagland营养液35 L,定植6株,株行距均为15 cm。定植后恢复生长10 d,开始进行试验处理。每个水培箱24 h进行充气泵充气,每2 d更换1次营养液。
试验设如下处理:1) 对照 (CK0),1/4 Hoagland营养液;2) 盐胁迫处理 (CK1),含100 mmol/L NaCl的1/4 Hoagland营养液;3) 水杨酸处理 (SA),在盐胁迫溶液中加入0.2 mmol/L SA;4) 硝普钠处理 (SNP),在盐胁迫溶液中加入0.1 mmol/LSNP;5) SA+SNP处理,在盐胁迫溶液中同时加入0.2 mmol/L SA和0.1 mmol/L SNP。NaCl胁迫处理浓度、SA和SNP浓度及试验处理天数均根据预备试验确定。为防止盐激,先将营养液含有的NaCl浓度增加到50 mmol/L,2 d后浓度增至100 mmol/L,此时定为胁迫处理的开始时间。在进行SA+SNP处理的同时,前4个处理补充加入适量体积的去离子水,以保持处理体积一致。处理期间每天更换处理营养液,每处理3次重复 (3个水培槽),水培槽随机排列。处理的第3、5和7 d分别测定幼苗上数第2片完全展开叶的相关指标,测定时每处理随机测定6株,每株重复测定2次。
1.2 测定项目与方法 1.2.1 气体交换参数使用LI-6400XT光合作用测定系统 (Li-Cor Inc.,Lincoln,NE,USA) 测定净光合速率 (Pn)、气孔导度 (Gs) 和胞间CO2浓度 (Ci) 等参数。测定时,仪器使用开放式气路、内置LED红/蓝光源 (6400-02B),光强设置为800 μmol/(m2·s),叶室温度为 (28 ± 2)℃、CO2浓度为 (360 ± 20) μL/L。
1.2.2 叶绿素荧光参数采用JUNIOR-PAM脉冲调制叶绿素荧光仪 (Heinz Walz GmbH,Effeltrich,Germany) 测定叶绿素荧光参数。测定前先对叶片进行30 min暗适应,然后照射 < 0.1 μmol/(m 2·s)的检测光测得最小荧光 (Fo),之后照射8000 μmol/(m2·s) 的饱和脉冲光测得最大荧光 (Fm)。接着照射800 μmol/(m2·s) 的内源光化光,10 min后获得稳态荧光 (Fs),再次照射饱和脉冲光以获得光下最大荧光 (Fm′),最后关闭光化光,打开远红光的同时测定光下的最小荧光 (Fo′)。PSⅡ最大光化学效率 (Fv/Fm)、光化学荧光猝灭系数 (qP)、非光化学荧光猝灭系数 (NPQ) 和实际光化学效率 (ΦPSⅡ) 均由仪器自动给出。直接计算PSⅡ潜在光化学活性 (Fv/Fo),反应中心激发能捕获效率 (Fv′/Fm′) 和PSⅡ激发能压力 (1-qP),其中,Fv = Fm – Fo,Fv′ = Fm′ – Fo′。根据孙骏威等[14]的方法计算光合功能相对限制值 (LPFD) = 1 – (qP × ΦPSⅡ)/0.83。按Babani和Lichtenthaler的公式[15]计算用于表征CO2潜在同化活性的叶绿素荧光衰减率 (Rfd) = (Fm – Fs)/Fs。两个光系统之间的激发能分配系数按Braun和Malkin的公式[16]计算,PSⅠ激发能分配系数α = ƒ/(1 + ƒ),PSⅡ激发能分配系数β = 1/(1 + ƒ),ƒ = (Fm′ – Fs)/(Fm′ – Fo′);PSⅠ和PSⅡ间激发能分配的不平衡性用β/α-1表示。参照Demmig-Adams等[17]的方法计算吸收光能用于进行光化学反应的份额,P = (Fv′/Fm′) × qP;非光化学耗散的份额,Ex = (1–qP) × (Fv′/Fm′);天线热耗散的份额,D = 1 – (Fv′/Fm′)。
1.3 数据统计分析试验数据用IBM SPSS 19.0统计软件进行单因素方差分析 (One-way ANOVA),采用LSD法进行差异显著性比较,使用ORIGIN PRO 8.5软件绘图。
2 结果与分析 2.1 SA和SNP对NaCl胁迫下番茄幼苗叶片气体交换参数的影响番茄幼苗在100 mmol/L NaCl胁迫处理 (CK1) 的3~7 d,叶片净光合速率 (Pn) 和气孔导度 (Gs) 分别持续显著下降了28.8%~59.7%和40.7%~59.0%,胞间CO2浓度 (Ci) 先于第3 d显著下降了6.9%,后在5~7 d显著升高了13.9%~20.2% (图1)。与CK1相比,SA、SNP单独和复配处理均能使NaCl胁迫下幼苗叶片Pn、Gs和Ci的变化得到显著抑制,其中以SA+SNP处理的综合效果最明显,在3~7 d,其Pn和Gs分别比CK1显著提高了25.5%~94.9%和43.2%~50.0%;Ci在第3 d比CK1显著提高了7.5%,在5~7 d比CK1显著降低10.2%~13.8%。试验期间,SA和SNP处理间的上述各参数均无显著差异。
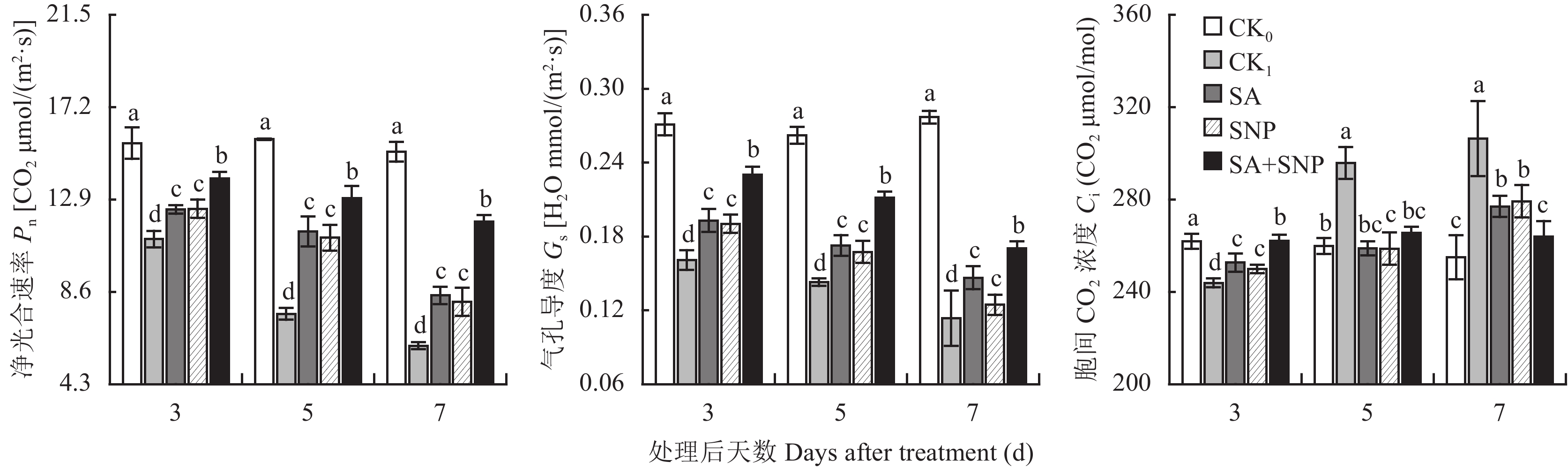 |
| 图1 水杨酸和硝普钠对NaCl胁迫下番茄幼苗叶片气体交换参数的影响 Fig. 1 Effects of salicylic acid and sodium nitroprusside on gas exchange parameters in leaves of tomato seedlings under NaCl stress [注(Note):柱上不同小写字母表示处理间差异达0.05显著水平Different small letters above the bars mean significant difference among treatments at 0.05 level.] |
如图2所示,与对照 (CK0) 相比,100 mmol/L NaCl胁迫处理 (CK1) 番茄幼苗的3~7 d,叶片初始荧光 (Fo) 显著升高了28.6%~32.7%,最大荧光 (Fm)、PSⅡ潜在光化学活性 (Fv /Fo) 和最大光化学效率 (Fv /Fm) 分别显著降低了14.2%~24.4%、40.1%~52.4%和10.2%~16.5%。与CK1相比,SA、SNP单独和复配处理均能显著抑制Fo的升高,不同程度延缓Fm、Fv/Fo和Fv/Fm的降低,其中以SA+SNP处理效果最明显,在3~7 d,其Fo比CK1显著降低了19.8%~23.5%;Fm、Fv/Fo和Fv/Fm分别比CK1显著提高了11.2%~14.6%、51.7%~72.4%和9.5%~15.3%。除第5 d Fv/Fm SA处理显著高于SNP处理外,试验期间两处理间的上述各参数均无显著差异。
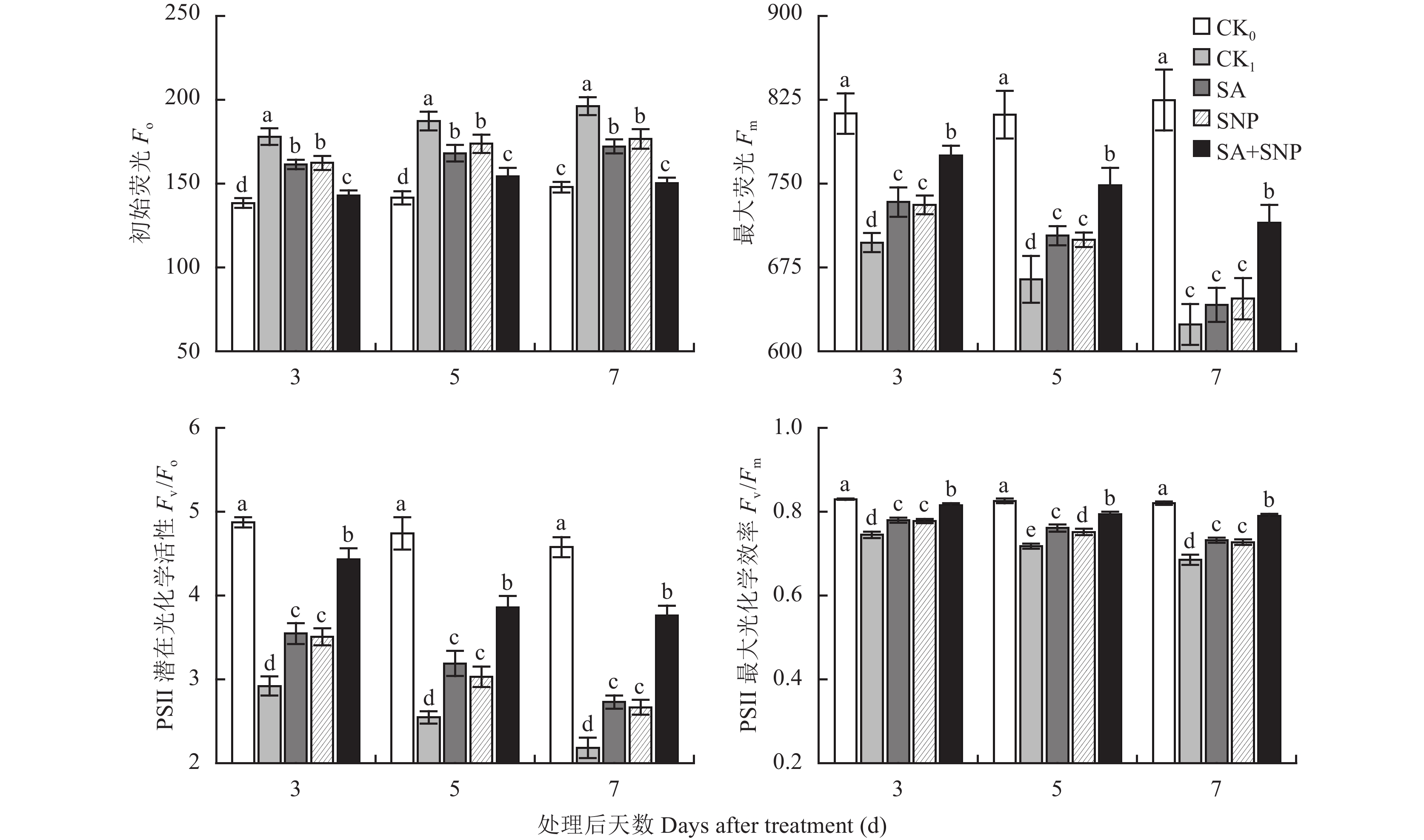 |
| 图2 水杨酸和硝普钠对NaCl胁迫下番茄幼苗叶片暗适应荧光参数的影响 Fig. 2 Effect of salicylic acid and sodium nitroprusside on dark adaptation fluorescence parameters in leaves of tomato seedlings under NaCl stress [注(Note):柱上不同小写字母表示处理间差异达0.05显著水平Different small letters above the bars mean significant difference among treatments at 0.05 level.] |
番茄幼苗在100 mmol/L NaCl胁迫处理 (CK1) 的3~7 d,叶片PSⅡ天线转化效率 (Fv′/Fm′)、实际光化学效率 (ΦPSⅡ) 和光化学荧光淬灭系数 (qP) 分别显著降低了25.2%~36.7%、51.9%~78.8%和35.8%~66.5%,非光化学猝灭系数 (NPQ) 显著升高50.5%~66.9%(图3)。与CK1相比,SA、SNP单独和复配处理均能使NaCl胁迫下幼苗叶片的Fv′/Fm′、ΦPSⅡ和qP显著升高,NPQ显著降低,其中以SA+SNP处理效果最明显,在3~7 d,其Fv′/Fm′、ΦPSⅡ和qP分别比CK1提高了25.7%~34.6%、74.2%~198.6%和38.8%~121.9%,NPQ比CK1显著降低了22.8%~23.4%。试验期间,SA和SNP处理间的上述各参数均无显著差异。
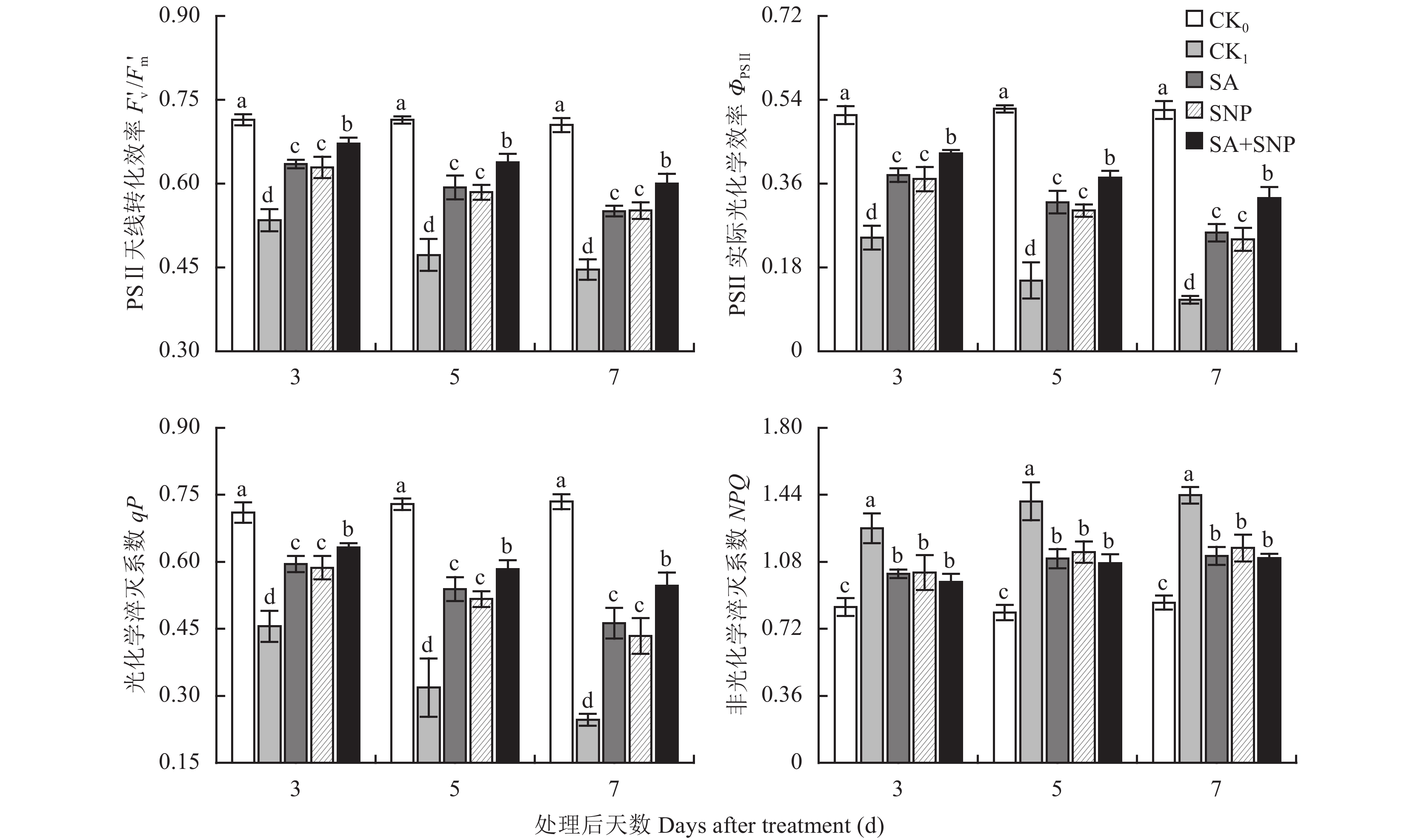 |
| 图3 水杨酸和硝普钠对NaCl胁迫下番茄幼苗叶片光适应荧光参数的影响 Fig. 3 Effects of salicylic acid and sodium nitroprusside on light adaptation fluorescence parameters in leaves of tomato seedlings under NaCl stress [注(Note):柱上不同小写字母表示处理间差异达0.05显著水平Different small letters in the figure mean significant difference among treatments at 0.05 level.] |
如图4所示,与对照 (CK0) 相比,100 mmol/L NaCl胁迫处理 (CK1) 3~7 d,番茄幼苗叶片光合功能相对限制值 (LPFD) 显著升高了53.4%~84.6%,叶绿素荧光衰减率 (Rfd) 显著降低了27.2%~39.3%。与CK1相比,SA、SNP单独和复配处理均能显著抑制LPFD的升高、不同程度延缓Rfd的降低,其中以SA+SNP处理效果最好,在3~7 d,其LPFD比CK1显著降低了23.9%~26.0%,Rfd比CK1显著提高了22.2%~25.5%。试验期间,SA和SNP处理间的LPFD和Rfd值均无显著差异。
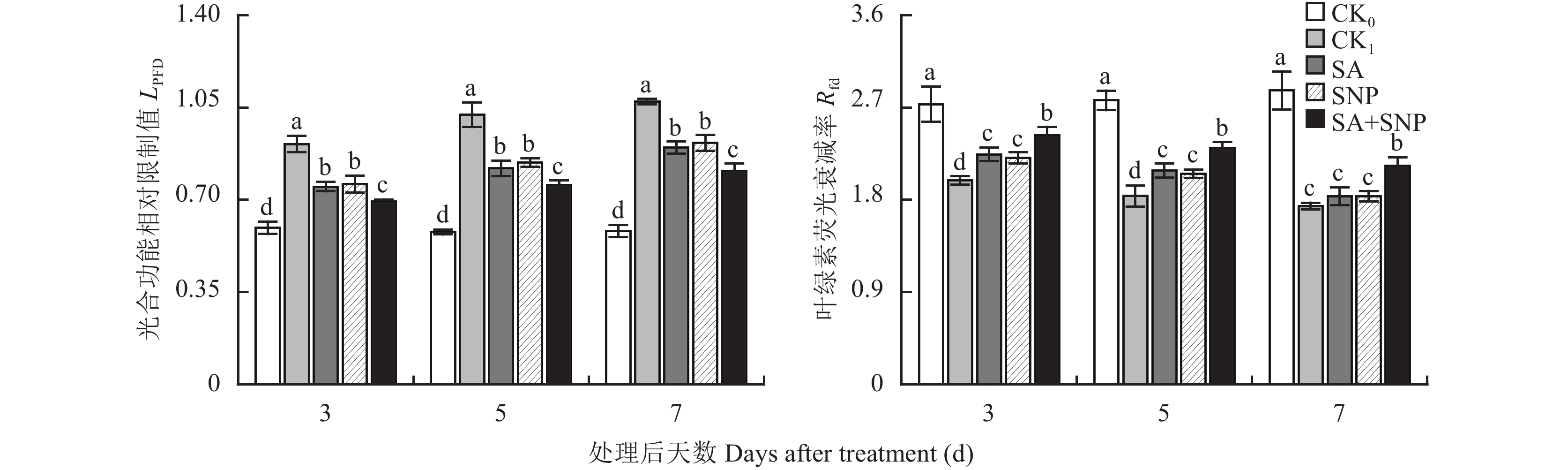 |
| 图4 水杨酸和硝普钠对NaCl胁迫下番茄幼苗叶片光合功能相对限制值和叶绿素荧光衰减率的影响 Fig. 4 Effects of salicylic acid and sodium nitroprusside on photosynthetic function relative limit value and chlorophyll fluorescence decay rate in leaves of tomato seedlings under NaCl stress [注(Note):柱上不同小写字母表示处理间差异达0.05显著水平Different small letters above the bars mean significant difference among treatments at 0.05 level.] |
番茄幼苗在100 mmol/L NaCl胁迫处理 (CK1) 的3~7 d,叶片PSⅠ激发能分配系数 (α) 显著降低了24.7%~53.3%、PSⅡ激发能分配系数 (β)、两个光系统间激发能分配不平衡偏离系数 (β/α–1) 和PSⅡ激发能压力 (1–qP) 分别显著升高了17.5%~39.2%、194.4%~748.0%和87.9%~184.0%(图5)。与CK1相比,SA、SNP单独和复配 (SA+SNP) 处理均能显著减缓α的下降和抑制β、β/α-1和1-qP的上升,并以SA+SNP处理效果最明显,在3~7 d,其α比CK1显著提高了23.9%~78.8%,β、β/α–1和1–qP分别比CK1显著降低了10.9%~19.4%、51.7%~72.8%和32.5%~39.9%。试验期间,SA和SNP处理间的上述各参数均无显著差异。
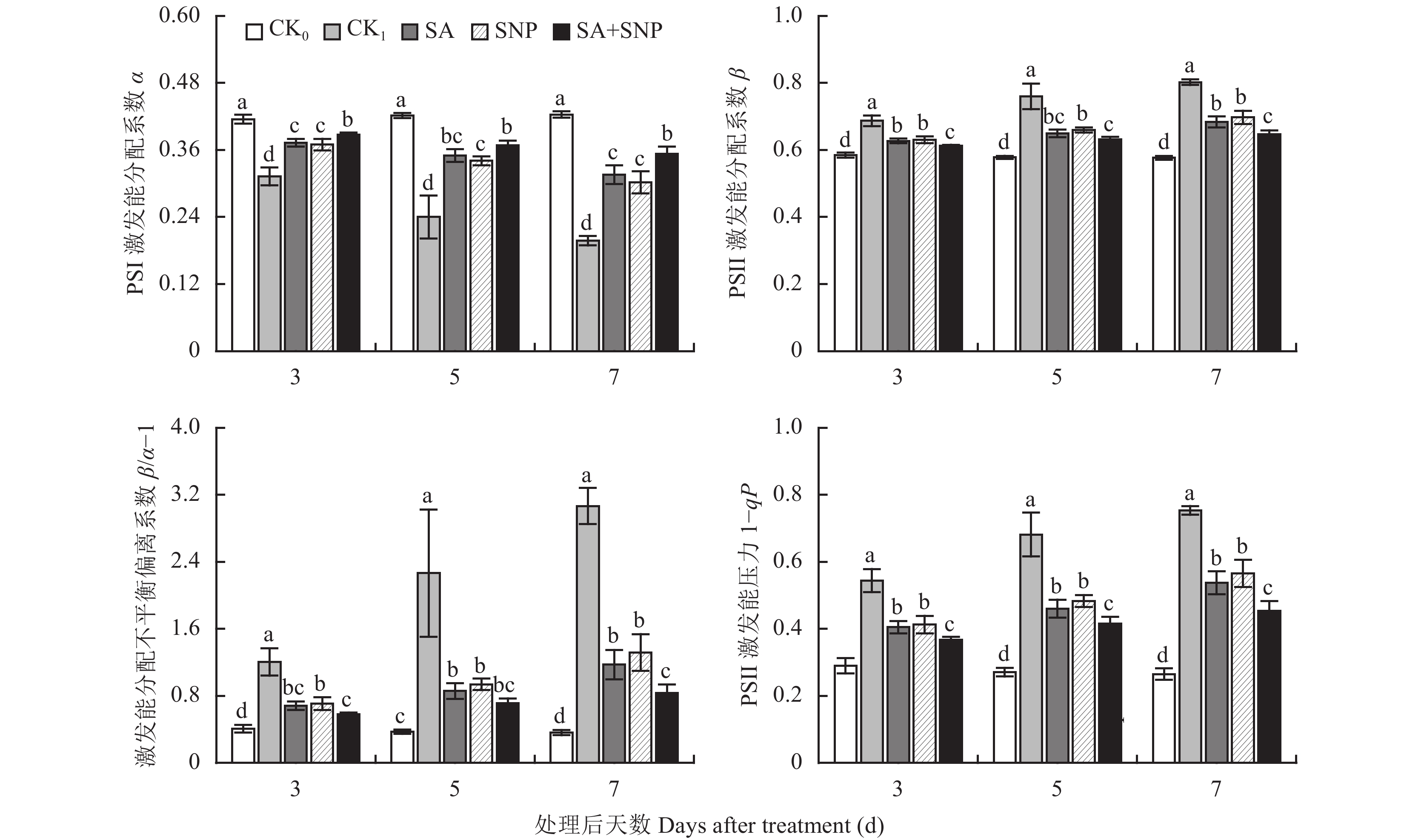 |
| 图5 水杨酸和硝普钠对NaCl胁迫下番茄幼苗叶片双光系统间激发能分配和PSⅡ激发能压力的影响 Fig. 5 Effects of salicylic acid and sodium nitroprusside on distribution of excitation energy between two photosystems and PSⅡexcitation pressure in leaves of tomato seedlings under NaCl stress [注(Note):柱上不同小写字母表示处理间差异达0.05显著水平Different small letters above the bars mean significant difference among treatments at 0.05 level.] |
PSⅡ捕获的光能除了用于光化学反应外,剩余部分分别通过反应中心和天线色素进行耗散[17–18]。如图6所示,与对照 (CK0) 相比,100 mmol/L NaCl胁迫处理 (CK1) 番茄幼苗的3~7 d,叶片捕获光能用于进行光化学反应的份额 (P) 显著降低了51.9%~78.8%,用于反应中心非光化学耗散的份额 (Ex) 和天线热耗散的份额 (D) 分别显著升高40.4%~79.8%和62.9%~87.6%。与CK1相比,SA、SNP单独和复配 (SA+SNP) 处理均能使NaCl胁迫下幼苗叶片的P值显著提高,Ex和D值显著降低,其中以SA+SNP处理效果最好,在3~7 d,其P值比CK1提高了74.2%~198.6%,Ex和D值分别比CK1降低了15.1%~19.1%和27.8%~31.4%。试验期间,SA和SNP处理间的 P、Ex和D值均无显著差异。
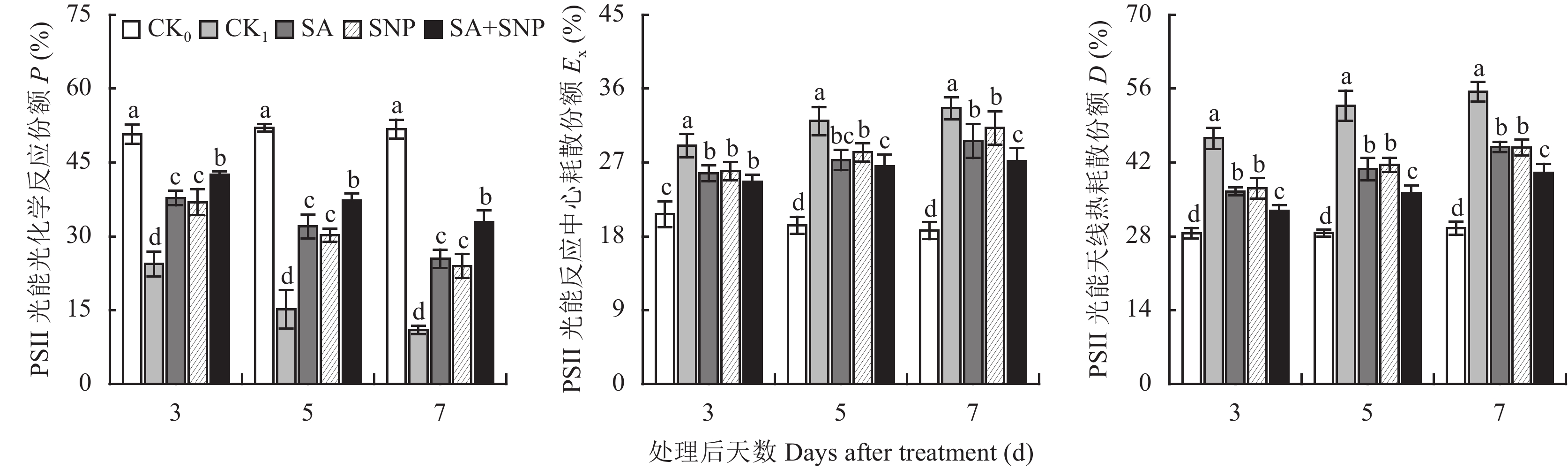 |
| 图6 水杨酸和硝普钠对NaCl胁迫下番茄幼苗叶片PSⅡ吸收光能分配利用的影响 Fig. 6 Effects of salicylic acid and nitric oxide on the distribution and utilization of luminous energy of PSⅡin leaves of tomato seedlings under stress of NaCl [注(Note):柱上不同小写字母表示处理间差异达0.05显著水平Different small letters above the bars mean significant difference among treatments at 0.05 level.] |
番茄幼苗在NaCl胁迫下叶片Gs下降趋稳的同时Ci持续上升,按Farquhar和Sharkey[19]的气体交换模型理论可以明确叶肉细胞光合活性降低是引起幼苗Pn下降的主导因素。众所周知,叶绿体内光合过程的各步骤密切偶联,任何一步受阻均可导致光抑制的发生,而光抑制并非意味着PSⅡ的破坏,要判断盐胁迫是否损伤了PSⅡ,还需借助对Fo、Fm和Fv/Fo的综合分析。Baker[20]认为,Fv /Fm降低的同时若伴随有Fo的升高,则可明确PSⅡ反应中心已经遭到破坏。Fv /Fo作为Fv /Fm的另一种敏感表达方式,与有活性的PSⅡ反应中心数量成正比[21],反映了光能从捕光色素蛋白复合体 (LHCⅡ) 到PSⅡ的传递能力[22]。试验中,NaCl胁迫处理的幼苗叶片Fo显著升高,Fm、Fv /Fo和Fv /Fm显著降低,表明盐胁迫引起的光抑制损伤了PSⅡ(破坏反应中心,LHCⅡ可逆脱离PSⅡ),致使光合原初反应受阻,通过PSⅡ的电子传递能力 (Fm) 下降。SA、SNP单独或复配处理均能使胁迫下的Fo显著降低,Fm、Fv /Fo和Fv /Fm显著升高,并以复配处理效果最好,说明在缓解盐胁迫损伤PSⅡ反应中心、维持光能从LHCⅡ到PSⅡ的传递方面SA和SNP复配处理具有协调增效作用。这与Liu等[11]对棉苗的研究结果部分一致。
PSⅡ实际光化学效率 (ΦPSⅡ) 的大小除受反应中心激发能捕获效率 (Fv′/Fm′) 制约外,还与反映PSⅡ反应中心开放程度和初级醌电子受体 (QA) 下游电子传递通畅性的光化学淬灭系数 (qP) 有关。由于光合CO2同化 (暗反应) 对ATP和NADPH需求的多寡也可反馈调控ΦPSⅡ的变化[23],因此基于ΦPSⅡ计算的LPFD可以反映某一特定光强下光合机构整体功能的相对受限程度。非光化学淬灭 (NPQ) 代表了叶片依赖叶黄素循环的非辐射能量耗散的强弱,是植物长期适应环境形成的一种光合机构自我保护机制[24]。本研究结果显示,NaCl胁迫在显著降低幼苗叶片Fv′/Fm′、ΦPSⅡ、qP和Rfd的同时,使NPQ和LPFD显著升高,表明盐胁迫对光合机构的损伤抑制了PSⅡ的光化学效率,进而迫使植株启动依赖叶黄素循环保护机制的运行来耗散过剩激发能。SA、SNP单独或复配处理均能使盐胁迫下的ΦPSⅡ、Fv′/Fm′、qP和Rfd显著升高,NPQ和LPFD显著降低,并以复配处理效果最好,说明增强非辐射能量耗散并不是盐胁迫下SA或/和SNP保护光合机构的主要机制,对PSⅡ及其QA下游电子传递受体的保护,以及对光合暗反应活性 (Rfd) 的改善才是外源SA或/和SNP减轻过剩光能损伤PSⅡ、增强番茄幼苗耐盐能力的真正原因,而其中表现出复配处理的协同增效作用也类似于Liu等[11]对棉苗的研究。
状态转换参与调节的激发能均衡分配是PSⅡ和PSⅠ高效运转、协调完成线性电子传递的前提[25–27]。状态转换是指植物光合机构两种存在状态 (状态Ⅰ和状态Ⅱ) 间的相互转换。状态Ⅰ使激发能较多地分配至PSⅡ,结果使PSⅡ被过度激发,从而加重了PSⅡ的光抑制;状态Ⅱ与状态Ⅰ的作用过程恰好相反[28–29]。本试验中,番茄幼苗在NaCl胁迫下叶片分配至PSⅠ的激发能 (α) 显著减少,分配至PSⅡ的激发能 (β) 显著增多,致使激发能分配不平衡偏离系数 (β/α–1) 显著增大,这是光合机构状态Ⅰ向状态Ⅱ转换受阻的必然结果,而由此导致过高的PSⅡ激发能压力 (1–qP) 会诱导反应中心发生可逆失活,甚至破坏PSⅡ和类囊体膜的结构,从而使电子“Z”链传递受阻,严重制约光合作用的高效运行[27, 30]。胁迫条件下SA、SNP单独或复配处理的幼苗叶片β、β/α–1和1–qP显著降低,α显著升高,并以复配处理效果更明显,说明在调节状态转换、促进激发能均衡分配 (双光系统间) 方面,SA和SNP复配处理也具有协同增效作用。业已证实,PSⅡ向PSⅠ的激发能“满溢”和磷酸化的LHCⅡ向PSⅠ的移动是植物光合机构实现状态Ⅰ向状态Ⅱ转换的两种可能方式[27, 29–30],而以这两种方式并行调节的激发能均衡分配也已被Tan等[25]在小麦的研究上所证实。NaCl胁迫下,SA或/和SNP改善番茄幼苗叶片激发能双光系统间均衡分配的状态转换调节方式尚不明确,对此仍需深入研究。
盐胁迫下,包括PSⅡ在内的整个光合机构活性的改善是SA或/和SNP减少幼苗叶片吸收光能天线热耗散份额 (D)、增加反应中心光化学分配份额 (P) 的主要原因。Ex指的是因反应中心的关闭 (或失活) 使已传递到反应中心的激发能在不能进行光化学反应时,不得不通过反应中心耗散的份额,该值升高将诱发PSⅡ产生过量的活性氧,并直接构成对反应中心色素和结构蛋白的损伤,进而严重缩减PSⅡ激发能光化学利用的份额 (P)[17–18, 31–32]。本试验中,SA和SNP复配处理在增加P和减少D中表现出的优势未能在减少Ex分配上得以体现,说明通过减少反应中心过剩光能耗散降低活性氧生成并非是SA和SNP协同保护PSⅡ的主要生理机制。据此推测,在调节抗氧化系统活性增强上,二者表现出的协同增效作用才是SA和SNP协同提高反应中心活性的主要原因,而这与本研究前期报道的结果相吻合[13],同时也与Simaei等[12]对大豆,Liu等[11]和Dong等[10]对棉花的研究结果一致。需要指出的是,Cyt-b559介导的环式电子传递[33]和脱去外周天线的PSⅡβ的形成 (缩小了PSⅡ光吸收截面) 与移动 (在类囊体的基粒片层和基质片层区的移动,完成光能由PSⅡ向PSⅠ的分配)[34–35]是反应中心激发能耗散的两种主要方式,而SA或/和SNP究竟以何种方式下调Ex的机制尚不明确,对此还需深入研究。
4 结论水杨酸、硝普钠单独或复配处理均能有效减轻NaCl胁迫对番茄幼苗叶片PSⅡ的损伤,其具体作用机制主要包括参与调节激发能在PSⅡ和PSⅠ间的均衡分配,增强QA下游的线性电子传递效率,以及对光合暗反应同化CO2活性的提升。其中复配处理表现出的显著优势说明外源水杨酸和一氧化氮在保护光合机构、提高番茄幼苗抗 (耐) 盐性上具有协同增效作用。
| [1] | Testa R, Di Trapani A M, Sgroi F, et al. Economic sustainability of Italian greenhouse cherry tomato[J]. Sustainability, 2014, 6(11): 7967–7981. |
| [2] |
陆晓民, 孙锦, 郭世荣, 等. 低氧胁迫下24-表油菜素内酯对黄瓜幼苗叶片光合特性及多胺含量的影响[J].
应用生态学报, 2012, 23(1): 140–146.
Lu X M, Sun J, Guo S R, et al. Effects of exogenous 24-epibrassinolide on the leaf photosynthetic characteristics and polyamines content of cucumber seedlings under hypoxia stress[J]. Chinese Journal of Applied Ecology, 2012, 23(1): 140–146. |
| [3] | Khurana A, Kumar R, Babbar S B. Nitric oxide is involved in salicylic acid-induced flowering of Lemna aequinoctialis Welw [J]. Acta Physiologiae Plantarum, 2014, 36(10): 2827–2833. DOI:10.1007/s11738-014-1600-2 |
| [4] | Klessig D F, Durner J, Noad R, et al. Nitric oxide and salicylic acid signaling in plant defense[J]. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(16): 8849–8855. DOI:10.1073/pnas.97.16.8849 |
| [5] | Asgher M, Per T S, Masood A, et al. Nitric oxide signaling and its crosstalk with other plant growth regulators in plant responses to abiotic stress[J]. Environmental Science and Pollution Research, 2017, 24(3): 2273–2285. DOI:10.1007/s11356-016-7947-8 |
| [6] | Xu L L, Fan Z Y, Dong Y J, et al. Effects of exogenous salicylic acid and nitric oxide on physiological characteristics of two peanut cultivars under cadmium stress[J]. Biologia Plantarum, 2015, 59(1): 171–182. DOI:10.1007/s10535-014-0475-9 |
| [7] | Esim N, Atici Ö. Effects of exogenous nitric oxide and salicylic acid on chilling-induced oxidative stress in wheat (Triticum aestivum) [J]. Frontiers in Life Science, 2015, 8(2): 124–130. DOI:10.1080/21553769.2014.998299 |
| [8] | Dong Y, Chen W, Liu F, et al. Effects of exogenous salicylic acid and nitric oxide on peanut seedlings growth under iron deficiency[J]. Communications in Soil Science and Plant Analysis, 2016, 47(22): 2490–2505. DOI:10.1080/00103624.2016.1254790 |
| [9] | Yan F, Liu Y, Sheng H, et al. Salicylic acid and nitric oxide increase photosynthesis and antioxidant defense in wheat under UV-B stress[J]. Biologia Plantarum, 2016, 60(4): 686–694. DOI:10.1007/s10535-016-0622-6 |
| [10] | Dong Y J, Wang Z L, Zhang J W, et al. Interaction effects of nitric oxide and salicylic acid in alleviating salt stress of Gossypium hirsutum L. [J]. Journal of Soil Science and Plant Nutrition, 2015, 15(3): 561–573. |
| [11] | Liu S, Dong Y J, Xu L L, et al. Effects of foliar applications of nitric oxide and salicylic acid on salt-induced changes in photosynthesis and antioxidative metabolism of cotton seedlings[J]. Plant Growth Regulation, 2014, 73(1): 67–78. DOI:10.1007/s10725-013-9868-6 |
| [12] | Simaei M, Khavari-Nejad R A, Saadatmand S, et al. Effects of salicylic acid and nitric oxide on antioxidant capacity and proline accumulation in Glycine max L. treated with NaCl salinity [J]. African Journal of Agricultural Research, 2011, 6(16): 3775–3782. |
| [13] |
孙德智, 何淑平, 彭靖, 等. 水杨酸和硝普钠对NaCl胁迫下番茄幼苗生长及生理特性的影响[J].
西北植物学报, 2013, 33(3): 541–546.
Sun D Z, He S P, Peng J, et al. Effects of salicylic acid and sodium nitropprusside on tomato seedling growth and physiological characteristics under NaCl stress[J]. Acta Botanica Boreali-Occidentalia Sinica, 2013, 33(3): 541–546. |
| [14] |
孙骏威, 翁晓燕, 李峤, 等. 缺钾对水稻不同品种光合和能量耗散的影响[J].
植物营养与肥料学报, 2007, 13(4): 577–584.
Sun J W, Weng X Y, Li Q, et al. Effects of potassium-deficiency on photosynthesis and energy dissipation in different rice cultivars[J]. Journal of Plant Nutrition and Fertilizer, 2007, 13(4): 577–584. DOI:10.11674/zwyf.2007.0407 |
| [15] | Babani F, Lichtenthaler H K. Light-induced and age-dependent development of chloroplasts in etiolated barley leaves as visualized by determination of photosynthetic pigments, CO2 assimilation rates and different kinds of chlorophyll fluorescence ratios [J]. Journal of Plant Physiology, 1996, 148(5): 555–566. DOI:10.1016/S0176-1617(96)80075-7 |
| [16] | Braun G, Malkin S. Regulation of the imbalance in light excitation between photosystemⅡand photosystemⅠby cations and by the energized state of the thylakoid membrance[J]. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 1990, 1017(1): 79–90. DOI:10.1016/0005-2728(90)90181-3 |
| [17] | Demmig-Adams B, Adams III W W, Barker D H, et al. Using chlorophyll fluorescence to assess the fraction of absorbed light allocated to thermal dissipation of excess excitation[J]. Physiologia Plantarum, 1996, 98: 253–264. |
| [18] | Kato M C, Hikosaka K, Hirotsu N, et al. The excess light energy that is neither utilized in photosynthesis nor dissipated by photoprotective mechanisms determines the rate of photoinactivation in photosystem II[J]. Plant and Cell Physiology, 2003, 44(3): 318–325. DOI:10.1093/pcp/pcg045 |
| [19] | Farquhar G D, Sharkey T D. Stomatal conductance and photosynthesis[J]. Annual Review of Plant Physiology, 1982, 33: 317–345. DOI:10.1146/annurev.pp.33.060182.001533 |
| [20] | Baker N R. Chlorophyll fluorescence: a probe of photosynthesis in vivo[J]. Annual Review of Plant Biology, 2008, 59: 89–113. DOI:10.1146/annurev.arplant.59.032607.092759 |
| [21] | Krause G H, Weis E. Chlorophyll fluorescence and photosynthesis: the basics[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1991, 42: 313–349. DOI:10.1146/annurev.pp.42.060191.001525 |
| [22] |
谢寅峰, 张千千, 刘伟龙, 等. 外源水杨酸对高氯酸盐胁迫下水花生叶绿素荧光特性的影响[J].
环境科学学报, 2010, 30(7): 1457–1465.
Xie Y F, Zhang Q Q, Liu W L, et al. Effects of exogenous salicylic acid on the chlorophyll fluorescence characteristics of Alternanthera philoxeroides under perchlorate stress [J]. Acta Scientiae Circumstantiae, 2010, 30(7): 1457–1465. |
| [23] |
张会慧, 田褀, 刘关君, 等. 转2-Cys Prx基因烟草抗氧化酶和PSII电子传递对盐和光胁迫的响应
[J].
作物学报, 2013, 39(11): 2023–2029.
Zhang H H, Tian Q, Liu G J, et al. Responses of antioxidant enzyme and PSII electron transport in leaf of transgenic tobacco carrying 2-Cys Prx to salt and light stresses [J]. Acta Agronomica Sinica, 2013, 39(11): 2023–2029. |
| [24] | Goss R, Böhme K, Wilhelm C. The xanthophyll cycle of Mantoniella squamata converts violaxanthin into antheraxanthin but not to zeaxanthin: consequences for the mechanism of enhanced non-photochemical energy dissipation [J]. Planta, 1998, 205(4): 613–621. DOI:10.1007/s004250050364 |
| [25] | Tan X X, Xu D Q, Shen Y G. Both spillover and light absorption cross-section changes are involved in the regulation of excitation energy distribution between the two photosystems during state transitions in wheat leaf[J]. Photosynthesis Research, 1998, 56(1): 95–102. DOI:10.1023/A:1005953528191 |
| [26] | Tikkanen M, Aro E M. Thylakoid protein phosphorylation in dynamic regulation of photosystem Ⅱ in higher plants[J]. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 2012, 1817(1): 232–238. DOI:10.1016/j.bbabio.2011.05.005 |
| [27] | Rochaix J D. Regulation and dynamics of the light-harvesting system[J]. Annual Review of Plant Biology, 2014, 65: 287–309. DOI:10.1146/annurev-arplant-050213-040226 |
| [28] | Fork D C, Satoh K. The control by state transitions of the distribution of excitation energy in photosynthesis[J]. Annual Review of Plant Physiology, 1986, 37: 335–361. DOI:10.1146/annurev.pp.37.060186.002003 |
| [29] | Yokono M, Murakami A, Akimoto S. Excitation energy transfer between photosystem Ⅱ and photosystem I in red algae: larger amounts of phycobilisome enhance spillover[J]. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 2011, 1807(7): 847–853. DOI:10.1016/j.bbabio.2011.03.014 |
| [30] | Cui Z H, Wang Y P, Zhang A, et al. Regulation of reversible dissociation of LHCII from PSII by phosphorylation in plants[J]. American Journal of Plant Sciences, 2014, 5(2): 241–249. DOI:10.4236/ajps.2014.52032 |
| [31] | Macpherson A N, Telfer A, Barber J, et al. Direct detection of singlet oxygen from isolated photosystem II reaction centres[J]. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 1993, 1143(3): 301–309. DOI:10.1016/0005-2728(93)90201-P |
| [32] | Nishiyama Y, Allakhverdiev S I, Murata N. Protein synthesis is the primary target of reactive oxygen species in the photoinhibition of photosystem II[J]. Physiologia Plantarum, 2011, 142(1): 35–46. DOI:10.1111/ppl.2011.142.issue-1 |
| [33] | Shinopoulos K E, Brudvig G W. Cytochrome b559 and cyclic electron transfer within photosystem II [J]. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 2012, 1817(1): 66–75. DOI:10.1016/j.bbabio.2011.08.002 |
| [34] | Allen J F. Protein phosphorylation in regulation of photosynthesis[J]. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 1992, 1098(3): 275–335. DOI:10.1016/S0005-2728(09)91014-3 |
| [35] | Wollman F A. State transitions reveal the dynamics and flexibility of the photosynthetic apparatus[J]. EMBO Journal, 2001, 20(14): 3623–3630. DOI:10.1093/emboj/20.14.3623 |
 2018, Vol. 24
2018, Vol. 24  doi:
doi: 
