2. 西安理工大学西北旱区生态水利工程国家重点实验室培育基地,陕西西安 710048;
3. 中国科学院水利部水土保持研究所,陕西杨凌 712100
2. State Key Laboratory Base of Eco-hydraulic Engineering in Arid Area, Xi'an University of Technology, Xi'an 710048, China;
3. Institute of Soil and Water Conservation, Chinese Academy of Science and Ministry of Water Resource, Yangling, Shaanxi 712100, China
植物碳 (C)、氮 (N)、磷 (P) 化学计量特征是了解碳、氮、磷素分配规律和确定植物生长限制性元素类型的重要依据,对于认识生态系统元素生物地球化学循环具有重要意义[1–3]。近年来,随着氮肥的大量生产和使用以及畜牧业迅猛发展等,氮沉降增加带来的生态效应逐渐成为国内外生态学家关注的热点问题[4–5]。随着对全球变化认识的逐渐深入,人们也开始关注多个全球变化因子交互作用对生态系统的影响[2, 6–7]。干旱半干旱地区的生态系统受氮素和水分双重限制,研究氮沉降增加和干旱胁迫对植物生态化学计量特征的影响对于深入了解全球变化下干旱生态系统的响应具有重要意义。
人类活动直接或间接导致生态系统氮沉降量的显著增加[8–9]。氮沉降增加提高了土壤中可利用氮素含量,为植物的生长提供了氮素的来源,导致植物组织中 C∶N 的降低[10–11]。同时,短期氮沉降增加通过提高植物体氮素含量,增大了植物组织的 N∶P[12–14]。但是长期氮沉降研究表明,氮沉降增加对植物体 N∶P 没有显著影响[15–16]。此外,由于植被种类、管理措施、氮添加量和初始土壤养分条件的差异也会造成植物体 N∶P 对氮沉降的响应不同[5, 8, 14–15]。与此同时,随着全球气候变暖,干旱成为世界范围内普遍存在的问题,而且有愈演愈烈的趋势[17–18]。干旱导致土壤中可利用水分含量显著降低,土壤含水量会通过影响枯落物分解[19]和元素的矿化过程[20–21]来改变土壤中营养元素的含量。长期的干旱胁迫会显著抑制土壤中参与氮磷元素循环转化的酶活性[22],导致土壤中可利用性氮磷元素含量降低,尤其是可利用性磷素的含量[23],从而改变植物组织中 C∶P、C∶N 和 N∶P[24–26]。在全球变化的背景下,氮沉降增加和干旱胁迫相互伴生、相互耦合,共同对陆地生态系统产生显著影响[27]。氮沉降的显著增加能否减轻干旱胁迫对植物生长的氮素限制,而磷素限制作用是否会进一步加剧还鲜有研究。
黄土丘陵区地处干旱半干旱地区,水分是限制植物生长的重要因素,研究表明近 50 年来该区降水量逐渐减少,且降水年际间变化大,月际间分配不均匀,干旱将会进一步限制该区的植被恢复过程[28]。该区目前的氮沉降量为 N 2.2 g/(m2·a)[29–30],据预测,未来该区氮沉降量将会持续增加[31]。研究氮沉降量持续增加和干旱胁迫加剧情况下,植物体碳、氮、磷含量及其化学计量特征的响应,对于预测未来气候变化对全球植被的影响具有重要的意义。
1 材料与方法 1.1 试验材料试验材料采用黄土丘陵区地带性草原建群种白羊草 (Bothriochloa ischaemum),种子于 2013 年秋季采自中国科学院安塞水土保持综合试验站 (36°51′30″N、109°19′23″E,海拔 1068~1309 m) 的试验田中。供试土壤为陕北安塞县的黄绵土,其基本理化性质为:田间持水量 20%,土壤有机质 2.58 g/kg,全氮 0.21 g/kg,全磷 0.57 g/kg,速效氮 11.55 mg/kg,pH 为 8.24。采用自制的 PVC 圆筒 (内径 15 cm、高 20 cm) 作为盆栽器皿,每盆装入等量风干的土壤 3.8 kg,以盆栽方式培育白羊草幼苗。播种前,测定白羊草种子的发芽率在 90% 以上。2014 年 6 月 1 日播种,每盆点取三个穴,每穴播 3 粒种子,待种子发芽生长稳定后,每盆每穴留健壮苗 1 株。育苗期间充分供水,保持幼苗正常生长。
1.2 试验设计本试验采用水分和施氮双因素完全随机试验设计。2014 年 8 月 1 日将盆栽移入人工气候室 (AGC-D003N 逆境型,浙江求是人工环境有限公司),设定气候室光照为 500 μmol/(m2·s),空气温度为 28℃/22℃ (昼/夜),湿度为 55%。待盆栽幼苗稳定几天后开始进行干旱胁迫和施氮处理。试验设 3 个水分水平,分别为田间持水量的 75%~80% (WW)、55%~60% (MD) 和 35%~40% (SD),依次代表正常供水、中度干旱胁迫和重度干旱胁迫。每天下午 6 点左右称重,补充消耗的水分,控制在设定的土壤水分水平。设置3个氮素添加水平:0、2.5 和 5 g/(m2·a),以 N0、N2.5、N5 表示。N2.5 和 N5 分别代表低氮和高氮添加水平。将含氮浓度为 18.4 mmol/L 的 NH4NO3 溶液 0、5 和 10 mL 分别均匀的喷洒到 N2.5 和 N5 处理的土壤表面,每两周进行一次,共 6 次。试验共计 6 个处理,每个处理 5 个重复。
2014 年 11 月 15 日,盆栽试验结束。用剪刀将每盆中的 3 株白羊草贴土壤表面取植株的地上部分。将土柱从 PVC 管中取出,分离根系和土壤,用镊子挑取土壤中残留的根系,将获得的根系用蒸馏水冲洗干净。将所采集的植物地上部分和根系在 80℃ 的烘箱中烘至恒重,用粉碎机磨碎后用于植物样品碳、氮、磷元素含量的测定。
1.3 测定项目及方法植物样品碳含量采用重铬酸钾硫酸氧化法测定,氮含量采用半微量开氏法测定,磷含量采用钼锑抗比色法测定。碳氮磷的化学计量比为植物组织中全碳氮磷含量的质量比。
1.4 数据处理试验数据在 Excel 2007 统计软件中进行整理。采用 SPSS 16.0 软件对数据进行统计分析。不同处理间碳氮磷含量及其化学计量比采用单因素 (one-way ANOVA) 和 Duncan 法进行方差分析和多重比较 (P < 0.05)。采用双因素方差分析 (two-way ANOVA) 检验水分水平和施氮水平及其交互作用。采用 SigmaPlot 12.5 软件绘图。
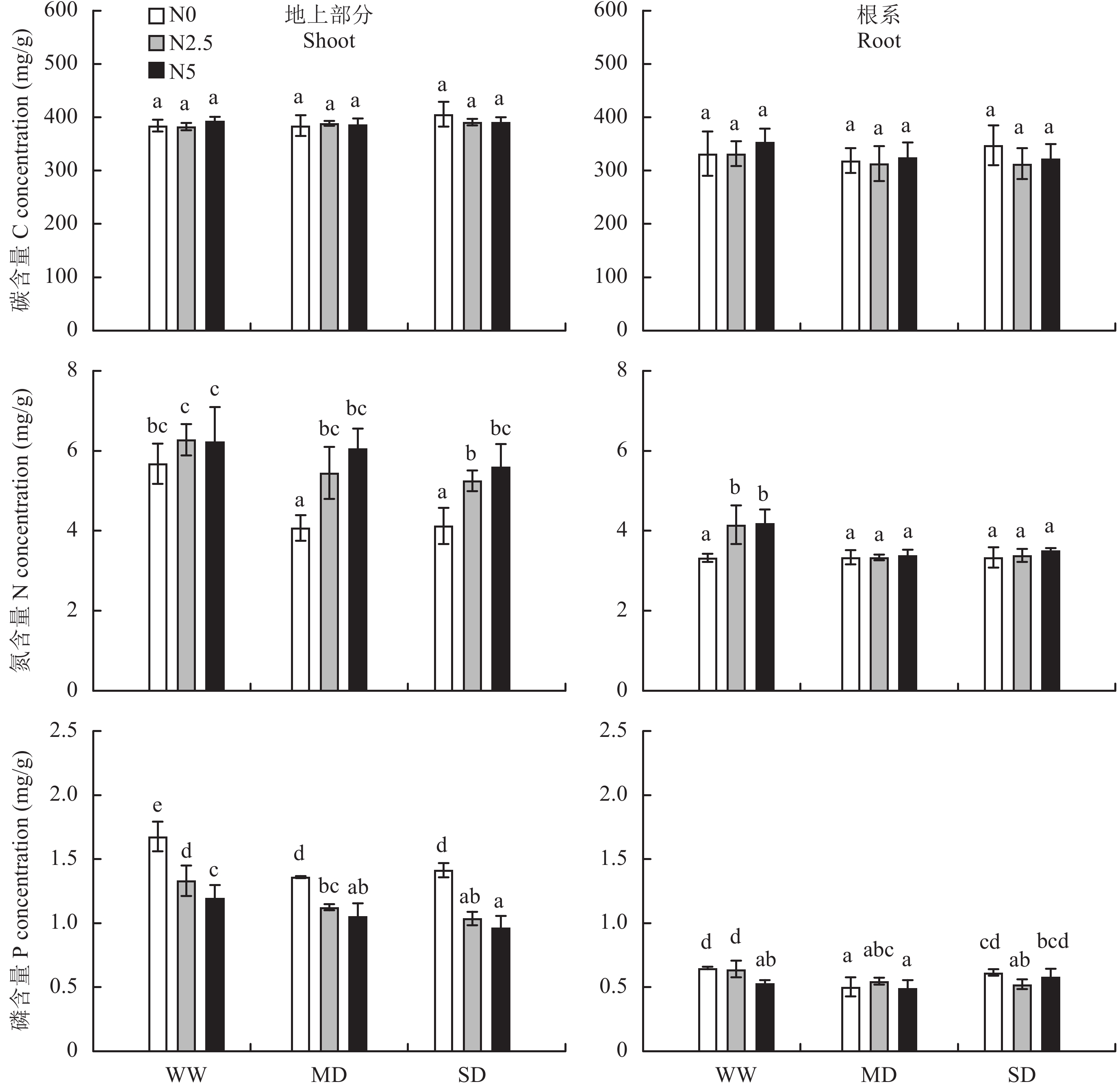
2 结果与分析 2.1 氮素和干旱胁迫对白羊草碳氮磷含量的影响氮素添加和干旱胁迫对白羊草地上部分和根系碳含量无显著影响 (表 1、图 1)。氮素添加使白羊草地上部分氮含量提高 9.7%~48.4% (P < 0.001),干旱胁迫白羊草地上部分氮含量降低 2.8%~28.3% (P < 0.001),两种处理因素对地上氮含量无显著交互作用。氮素添加和干旱胁迫对白羊草根系氮含量的影响具有显著交互作用 (表 1),表现为正常水分条件下氮素添加使根系氮含量提高 25.0%~26.1% (P < 0.01),干旱条件下氮素添加无显著作用 (图 1)。氮素添加和干旱胁迫使白羊草地上部分磷含量分别降低 17.4%~31.8% 和 12.0%~22.1% (P < 0.001)(表 1、图 1),两种处理因素对地上磷含量无显著交互作用。氮素添加和干旱胁迫对白羊草根系磷含量有显著影响,在正常水分条件下,高施氮处理使根系磷含量降低 18.4% (P < 0.05),在重度干旱胁迫下,中等施氮处理使根系磷含量降低 15.0% (P < 0.05)(表 1、图 1)。
| 表1 氮素添加和干旱胁迫对白羊草碳、氮、磷含量及其化学计量比的方差分析结果 Table 1 ANOVA analysis for the effects of nitrogen addition (N), water stress (D) and their interaction (N × D) on C, N, P concentrations and their stoichiometry in B. ischaemum |
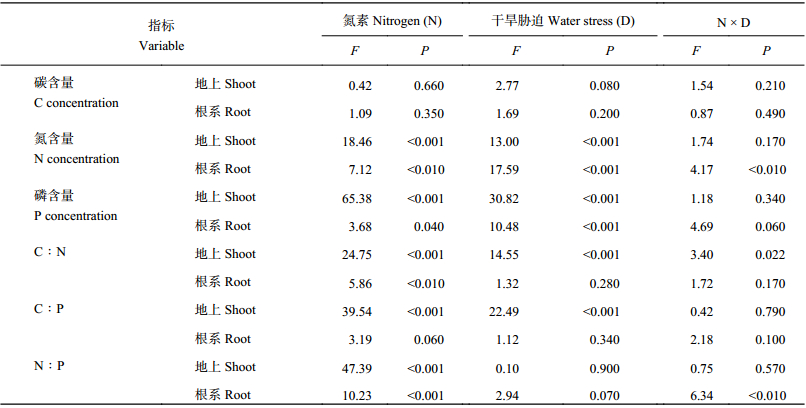 |
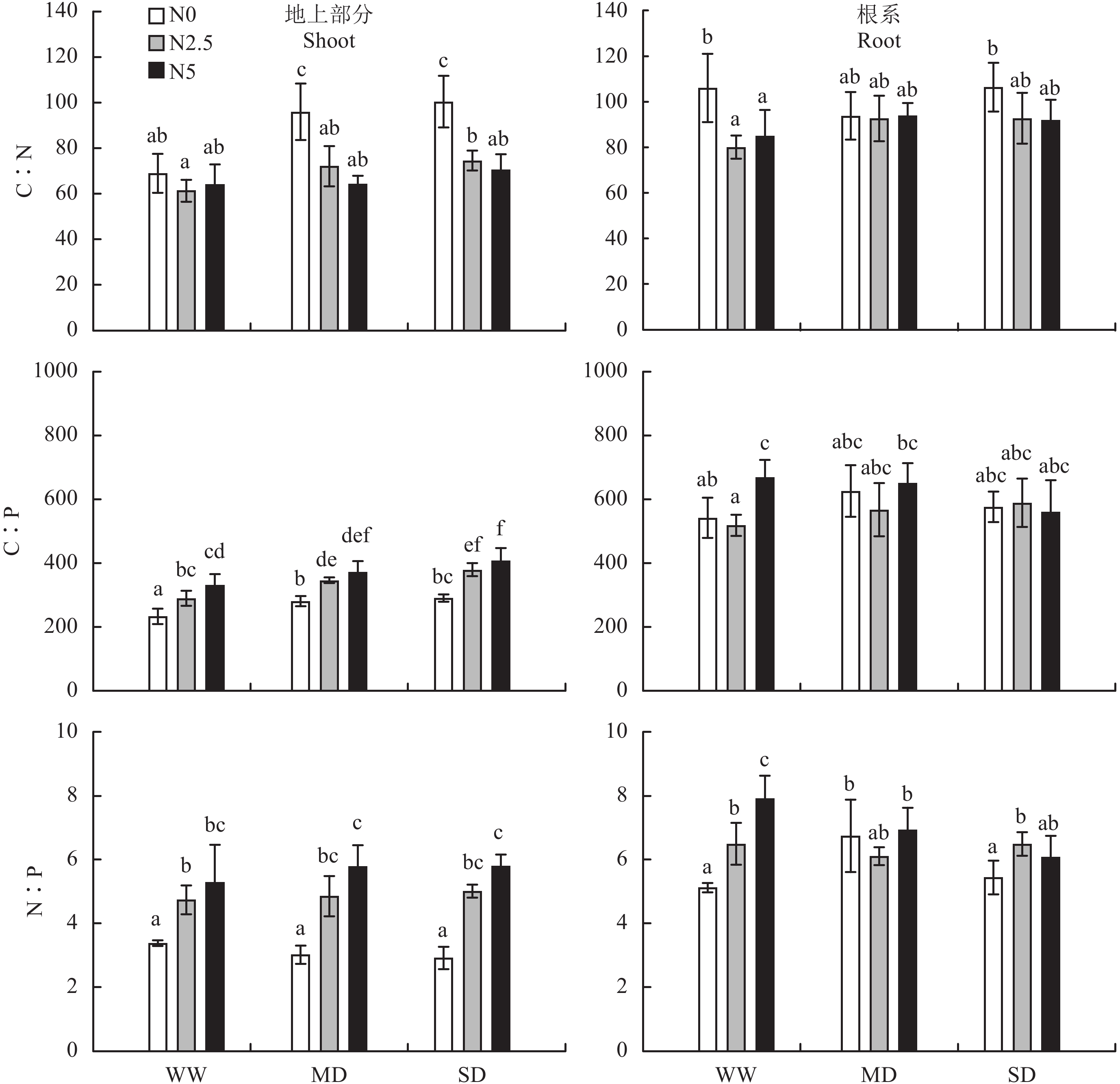
氮素添加和干旱胁迫对白羊草地上部分 C∶N 的影响具有显著交互作用 (表 1),表现为在干旱胁迫条件下氮素添加使地上部分 C∶N 降低 24.9%~32.9% (P < 0.05),在正常供水条件下氮素添加无显著影响 (图 2)。氮素添加对根系部分 C∶N 有显著影响,在正常供水条件下氮素添加使根系部分 C∶N 降低 19.8%~24.5% (P < 0.05)(表 1、图 2)。氮素添加和干旱胁迫使白羊草地上部分 C∶P 分别提高 24.4%~42.3% 和 12.2%~31.0% (P < 0.001),对根系 C∶P 无显著影响 (表 1、图 2)。氮素添加使白羊草地上部分 N∶P 提高 40.0%~99.0% (P < 0.05),干旱胁迫对白羊草地上部分 N∶P 无显著影响 (表 1、图 2)。氮素添加和干旱胁迫对白羊草根系部分 N∶P 具有显著交互作用,表现为在正常供水条件下氮素添加使根系部分 N∶P 提高 26.8%~54.8% (P < 0.05),在干旱胁迫条件下氮素添加无显著影响。
 |
|
图1
不同氮素添加和干旱胁迫白羊草地上部分和根系的碳、氮、磷含量
Fig. 1
C, N and P concentrations in the shoot and root of B. ischaemum under different N addition and drought stress
|
 |
|
图2
不同氮素添加和干旱胁迫白羊草地上部分和根系碳、氮、磷化学计量比
Fig. 2
C, N and P stoichiometry in the shoot and root of B. ischaemum under different N addition and drought stress
|
碳、氮、磷是地球上所有生命化学组成的重要元素,也是植物生长发育所必需的基本营养元素。光合作用同化的碳是植物生理生化过程的底物和能量来源,氮和磷是各种蛋白质和遗传物质的重要组成元素[32]。因此,碳、氮、磷对植物的生长和生理代谢调节起着重要作用。水分和氮素是干旱半干旱区生态系统的主要限制性因素,氮沉降增加 (氮素添加) 直接提高了土壤中有效态氮素含量,土壤水分可以通过影响微生物驱动的枯落物分解和氮磷元素的矿化过程间接影响土壤中有效态氮磷元素含量,进而对植物体氮磷元素含量产生显著影响。本研究中,干旱胁迫显著降低了白羊草体内氮和磷含量,施氮则显著提高了白羊草氮含量,降低了磷含量。安卓等[4]研究表明,氮素添加显著提高了长芒草叶片碳、氮和立枯物氮、磷含量。羊留冬等[33]发现人工施氮显著提高了冷杉幼苗叶片氮和磷含量。张文瑾等[34]研究发现氮素添加对油蒿、披针叶黄华叶片碳、氮和磷含量无显著影响。Ye 等[35]对水稻研究表明干旱胁迫降低了磷含量,对碳和氮含量影响不大,而元分析结果表明干旱胁迫降低了植物体氮和磷含量[25]。造成这种差异的原因可能是不同研究所采用植物种类以及土壤本身特性的差异造成的。黄土高原地处干旱半干旱地区,土壤氮磷俱缺[36],因此水分和氮素都是影响植物生长发育的重要限制因素。大量研究表明,干旱胁迫显著抑制土壤中参与氮磷元素循环转化酶的活性[22, 37],减弱了土壤中氮磷元素的矿化过程,导致土壤中可利用性氮磷元素含量的降低,从而导致白羊草体内氮磷含量的降低。氮素添加直接提高了土壤中可利用性氮素含量,从而提高了白羊草体内氮素含量。说明在黄土丘陵区干旱胁迫进一步加剧情况下,氮沉降增加有助于减轻氮素对白羊草生长的限制作用。
氮和磷是自然陆地生态系统的主要限制性元素,相互独立又相互影响,并对植物碳固定产生影响[38]。土壤养分和水分状况的改变会显著影响植物的光合作用和矿质代谢过程,进而影响植物体化学计量特征。本研究发现,氮素和土壤水分对植物体生态化学计量特征存在显著的交互作用。在正常水分条件下,氮素添加显著降低了 C∶N,提高了 N∶P,而在土壤水分增加条件下,氮素添加对植物 C∶N 无显著影响,而 N∶P 不变或者显著降低[2]。这种变化可能是由于土壤水分条件改善和氮素添加导致的植被的快速生长对氮磷素含量的稀释作用高于植物对氮磷素吸收量的提高。在本研究中,干旱处理和氮素添加对白羊草地上部分 C∶N 和根系部分 N∶P 的影响具有显著交互作用,表现为在正常供水条件下氮素添加对地上部分 C∶N 无显著影响,而根系部分 N∶P 显著提高,在干旱胁迫条件下氮素添加显著降低了地上部分 C∶N,根系部分 N∶P 无显著变化。氮素添加和干旱胁迫对植物体碳含量无显著影响,说明在干旱条件下氮素添加导致植物体将更多的氮素转移至地上部分,将更多的磷素转移至根系部分,这反映了植物对不同环境条件的适应策略[39]。在土壤持续干旱而可利用性氮素含量提高的条件下,植物体将更多的氮素分配至植物叶片提高叶绿体含量,促进植物正常生长,而将磷素更多分配至植物根系,以促进根系生长吸收水分,缓解干旱胁迫对植物生长的限制作用。作为重要的生理指标,C∶N 和 C∶P 反映了植物的生长速度[40],碳作为结构性元素,在植物体中含量普遍较高而且变异小,因此,氮、磷含量是影响 C∶N 和 C∶P 值的主要因素[41]。本研究不同处理条件下,白羊草地上部分和根系 C∶N 均值分别为 74.69 和 92.82,C∶P 均值分别为 325.76 和 588.80,高于全球平均水平 (22.5、232)[42],进一步说明黄土丘陵区植物叶片氮、磷含量较低。同时较高的 C∶N 和 C∶P 值代表植物氮、磷利用率较高,这是植物适应养分贫瘠土壤的一种策略。氮和磷是陆地生态系统的重要的限制性元素,N∶P 可以用来作为环境对植物生长养分供应状况的指标,本研究中白羊草氮磷比在 4.74~7.93 之间,低于全球平均水平 (13.8)[41]。Güsewell[32]认为,植物体氮磷小于 10 时,植物生长主要受氮素限制,氮磷比大于 20 时,植物生长受磷素限制,氮磷比在 10 和 20 之间时,植物生长受氮素和磷素共同限制。本研究结果表明黄土高原地区天然草地群落生长主要受氮素的限制,施氮在一定程度上改善了黄土高原地区氮素的缺乏状况。但是,未来干旱胁迫的进一步加剧,会显著抑制植物体对氮素和磷素的吸收,从而限制该区植物的生长。
4 结论干旱胁迫显著降低了白羊草体内氮、磷含量以及 C∶N 和 C∶P 比,但对 N∶P 影响不大。氮素添加提高了白羊草体内氮含量,降低了磷含量,导致白羊草 C∶N 降低,C∶P 和 N∶P 比提高。施氮在一定程度上改善了黄土高原地区氮素的缺乏状况,减轻了干旱胁迫下白羊草生长的氮素限制作用。但是随着干旱胁迫的持续和大气沉降导致的氮素的不断添加,白羊草的生长将逐渐受到氮素和磷素的限制。
| [1] |
刘超, 王洋, 王楠, 等. 陆地生态系统植被氮磷化学计量研究进展[J].
植物生态学报, 2012, 36(11): 1205–1216.
Liu C, Wang Y, Wang N, et al. Advances research in plant nitrogen, phosphorus and their stoichiometry in terrestrial ecosystems: a review[J]. Chinese Journal of Plant Ecology, 2012, 36(11): 1205–1216. |
| [2] | Lü X T, Kong D L, Pan Q M, et al. Nitrogen and water availability interact to affect leaf stoichiometry in a semi-arid grassland[J]. Oecologia, 2012, 168(2): 301–310. DOI:10.1007/s00442-011-2097-7 |
| [3] |
赵亚芳, 徐福利, 王渭玲, 等. 华北落叶松针叶碳、氮、磷含量及化学计量比的季节变化[J].
植物营养与肥料学报, 2015, 21(5): 1328–1335.
Zhao Y F, Xu F L, Wang W L, et al. Seasonal variations of leaf C, N, P contents and stoichiometry of Larix principis-rupprechtii [J]. Journal of Plant Nutrition and Fertilizer, 2015, 21(5): 1328–1335. DOI:10.11674/zwyf.2015.0528 |
| [4] |
安卓, 牛得草, 文海燕, 等. 氮素添加对黄土高原典型草原长芒草氮磷重吸收率及C∶N∶P化学计量特征的影响[J].
植物生态学报, 2011, 35(8): 801–807.
An Z, Niu D C, Wen H Y, et al. Effects of N addition on nutrient resorption efficiency and C∶N∶P stoichiometric characteristics in Stipa bungeana of steppe grasslands in the Loess Plateau, China [J]. Chinese Journal of Plant Ecology, 2011, 35(8): 801–807. |
| [5] | Song X Z, Gu H H, Wang M, et al. Management practices regulate the response of Moso bamboo foliar stoichiometry to nitrogen deposition[J]. Scientific Reports, 2016, 6: 24107. DOI:10.1038/srep24107 |
| [6] | Gargallo-Garriga A, Sardans J, Perez-Trujillo M, et al. Warming differentially influences the effects of drought on stoichiometry and metabolomics in shoots and roots[J]. New Phytologists, 2015, 207(3): 591–603. DOI:10.1111/nph.13377 |
| [7] | Huang W J, Houlton B Z, Marklein A R, et al. Plant stoichiometric responses to elevated CO2 vary with nitrogen and phosphorus inputs: evidence from a global-scale meta-analysis [J]. Scientific Reports, 2015, 5: 18225. |
| [8] | Liu J X, Huang W J, Zhou G Y, et al. Nitrogen to phosphorus ratios of tree species in responses to elevated CO2 and nitrogen addition in subtropical forests [J]. Global Change Biology, 2013, 19(1): 208–216. DOI:10.1111/gcb.12022 |
| [9] | Kanakidou M, Myriokefalitakis S, Daskalakis N, et al. Past, present, and future atmospheric nitrogen deposition[J]. Journal of the Atmospheric Sciences, 2016, 73(5): 2039–2047. DOI:10.1175/JAS-D-15-0278.1 |
| [10] | Novotny A M, Schade J D, Hobbie S E, et al. Stoichiometric response of nitrogen-fixing and non-fixing dicots to manipulations of CO2, nitrogen, and diversity [J]. Oecologia, 2007, 151(4): 687–696. DOI:10.1007/s00442-006-0599-5 |
| [11] | Han X, Sistla S A, Zhang Y H, et al. Hierarchical responses of plant stoichiometry to nitrogen deposition and mowing in a temperate steppe[J]. Plant and Soil, 2014, 382(1): 175–187. |
| [12] |
石贤萌, 杞金华, 宋亮, 等. 哀牢山中山湿性常绿阔叶林两种优势幼苗 C、N、P 化学计量特征及其对氮沉降增加的响应[J].
植物生态学报, 2015, 39(10): 962–970.
Shi X M, Qi J H, Song L, et al. C, N and P stoichiometry of two dominant seedlings and their responses to nitrogen additions in the montane moist evergreen broad-leaved forest in Ailao Mountains, Yunnan[J]. Chinese Journal of Plant Ecology, 2015, 39(10): 962–970. DOI:10.17521/cjpe.2015.0093 |
| [13] |
王乔姝怡, 郑成洋, 张歆阳, 等. 氮添加对武夷山亚热带常绿阔叶林植物叶片氮磷化学计量特征的影响[J].
植物生态学报, 2016, 40(11): 1124–1135.
Wang Q S Y, Zheng C Y, Zhang X Y, et al. Impacts of nitrogen addition on foliar nitrogen and phosphorus stoichiometry in a subtropical evergreen broad-leaved forest in Mount Wuyi[J]. Chinese Journal of Plant Ecology, 2016, 40(11): 1124–1135. DOI:10.17521/cjpe.2016.0110 |
| [14] |
黄菊莹, 余海龙. 四种荒漠草原植物的生长对不同氮添加水平的响应[J].
植物生态学报, 2016, 40(2): 165–176.
Huang J Y, Yu H L. Responses of growth of four desert species to different N addition levels[J]. Chinese Journal of Plant Ecology, 2016, 40(2): 165–176. DOI:10.17521/cjpe.2015.0210 |
| [15] | Ostertag R. Foliar nitrogen and phosphorus accumulation responses after fertilization: an example from nutrient-limited Hawaiian forests[J]. Plant and Soil, 2010, 334(1-2): 85–98. DOI:10.1007/s11104-010-0281-x |
| [16] | Mayor J R, Wright S J, Turner B L. Species-specific responses of foliar nutrients to long-term nitrogen and phosphorus additions in a lowland tropical forest[J]. Journal of Ecology, 2014, 102(1): 36–44. DOI:10.1111/jec.2013.102.issue-1 |
| [17] | Trenberth K E, Dai A G, van der Schrier G, et al. Global warming and changes in drought[J]. Nature Climate Change, 2014, 4(1): 17–22. |
| [18] | Dai A G. Increasing drought under global warming in observations and models[J]. Nature Climate Change, 2013, 3(1): 52–58. |
| [19] | Liu P, Huang J H, Han X G, et al. Differential responses of litter decomposition to increased soil nutrients and water between two contrasting grassland plant species of Inner Mongolia, China[J]. Applied Soil Ecology, 2006, 34(40212): 266–275. |
| [20] | Wang C H, Wan S Q, Xing X R, et al. Temperature and soil moisture interactively affected soil net N mineralization in temperate grassland in Northern China[J]. Soil Biology and Biochemistry, 2006, 38(5): 1101–1110. DOI:10.1016/j.soilbio.2005.09.009 |
| [21] |
任艳林. 降水变化对樟子松人工林土壤无机氮和净氮矿化速率的影响[J].
北京大学学报(自然科学版), 2012, 48(6): 925–932.
Ren Y L. Effects of precipitation change on inorganic nitrogen and net nitrogen mineralization rate at a plantation of Mongolian Pine[J]. Acta Scientiarum Naturalium Universitatis Pekinensis, 2012, 48(6): 925–932. |
| [22] | Sardans J, Penuelas J. Drought decreases soil enzyme activity in a Mediterranean Quercus ilex L. forest [J]. Soil Biology and Biochemistry, 2005, 37(3): 455–461. DOI:10.1016/j.soilbio.2004.08.004 |
| [23] | Sardans J, Penuelas J. Increasing drought decreases phosphorus availability in an evergreen Mediterranean forest[J]. Plant and Soil, 2004, 267(1): 367–377. |
| [24] | Sardans J, Penuelas J. Drought changes nutrient sources, content and stoichiometry in the bryophyte Hypnum cupressiforme Hedw. growing in a Mediterranean forest [J]. Journal of Bryology, 2008, 30(1): 59–65. DOI:10.1179/174328208X281987 |
| [25] | He M Z, Dijkstra F A. Drought effect on plant nitrogen and phosphorus: a meta-analysis[J]. New Phytologist, 2014, 204(4): 924–931. DOI:10.1111/nph.12952 |
| [26] | Sardans J, Rivas-Ubach A, Penuelas J. The C∶N∶P stoichiometry of organisms and ecosystems in a changing world: a review and perspectives[J]. Perspectives in Plant Ecology and Evolution and Systematics, 2012, 14(1): 33–47. DOI:10.1016/j.ppees.2011.08.002 |
| [27] |
孙良杰, 齐玉春, 董云社, 等. 全球变化对草地土壤微生物群落多样性的影响研究进展[J].
地理科学进展, 2012, 31(12): 1715–1723.
Sun L J, Qi Y C, Dong Y S, et al. Research progresses on the effects of global change on microbial community diversity of grassland soils[J]. Process in Geography, 2012, 31(12): 1715–1723. DOI:10.11820/dlkxjz.2012.12.018 |
| [28] |
姚玉璧, 李耀辉, 王毅荣, 等. 黄土高原气候与气候生产力对全球气候变化的响应[J].
干旱地区农业研究, 2005, 23(2): 202–208.
Yao Y B, Li Y H, Wang Y R, et al. Effects of the climate and climatic productivity in the Loess Plateau of China on global climate change[J]. Agricultural Research in the Arid Areas, 2005, 23(2): 202–208. |
| [29] |
魏样, 同延安, 乔丽, 等. 陕西省不同生态区大气氮沉降量的初步估算[J].
农业环境科学学报, 2010, 29(4): 795–800.
Wei Y, Tong Y A, Qiao L, et al. Preliminary estimate of the atmospheric nitrogen deposition in different ecological regions of Shaanxi Province[J]. Journal of Agro-Environment Science, 2010, 29(4): 795–800. |
| [30] | Han X W, Tsunekawa A, Tsubo M, et al. Responses of plant-soil properties to increasing N deposition and implications for large-scale eco-restoration in the semiarid grassland of the northern Loess Plateau, China[J]. Ecological Engineering, 2013, 60: 1–9. DOI:10.1016/j.ecoleng.2013.07.053 |
| [31] | Galloway J N, Dentener F J, Capone D G, et al. Nitrogen cycles: past, present, and future[J]. Biogeochemistry, 2004, 70(2): 153–226. DOI:10.1007/s10533-004-0370-0 |
| [32] | Güsewell S. N: P ratios in terrestrial plants: variation and functional significance[J]. New Physiologist, 2004, 164(2): 243–266. DOI:10.1111/j.1469-8137.2004.01192.x |
| [33] |
羊留冬, 王根绪, 杨阳, 等. 峨眉冷杉幼苗叶片功能特征及其N、P化学计量比对模拟大气氮沉降的响应[J].
生态学杂志, 2012, 31(1): 44–50.
Yang L D, Wang G X, Yang Y, et al. Responses of leaf functional traits and nitrogen and phosphorus stoichiometry in Abies fabiri seedlings in Gongga Mountain to simulated nitrogen deposition [J]. Chinese Journal of Ecology, 2012, 31(1): 44–50. |
| [34] |
张文瑾, 张宇清, 佘维维, 等. 氮添加对油蒿群植物叶片生态化学计量特征的影响[J].
环境科学研究, 2016, 29(1): 52–58.
Zhang W J, Zhang Y Q, She W W, et al. Effects of nitrogen addition on foliar ecological stoichiometric characteristics of Artemisia ordosica community [J]. Research of Environmental Sciences, 2016, 29(1): 52–58. |
| [35] | Ye Y, Liang X, Chen Y, et al. Carbon, nitrogen and phosphorus accumulation and partitioning, and C∶N∶P stoichiometry in late-season rice under different water and nitrogen managements[J]. PLoS One, 2014, 9: e101776. DOI:10.1371/journal.pone.0101776 |
| [36] | Liu Z P, Shao M A, Wang Y Q. Spatial patterns of soil total nitrogen and soil total phosphorus across the entire Loess Plateau region of China[J]. Geoderma, 2013, 197/198: 67–78. DOI:10.1016/j.geoderma.2012.12.011 |
| [37] | Steinweg J M, Dukes J S, Wallenstein M D. Modeling the effects of temperature and moisture on soil enzyme activity: Linking laboratory assays to continuous field data[J]. Soil Biology and Biochemistry, 2012, 55: 85–92. DOI:10.1016/j.soilbio.2012.06.015 |
| [38] | Yan Z B, Li P, Chen Y H, et al. Nutrient allocation strategies of woody plants: an approach from the scaling of nitrogen and phosphorus between twig stems and leaves[J]. Scientific Reports, 2016, 6: 20099. DOI:10.1038/srep20099 |
| [39] | Kleczewski N M, Herms D A, Bonello P. Nutrient and water availability alter belowground patterns of biomass allocation, carbon partitioning, and ectomycorrhizal abundance in Betula nigra [J]. Trees-Structure and Function, 2012, 26(2): 525–533. DOI:10.1007/s00468-011-0613-3 |
| [40] | Agren G I. The C∶N∶P stoichiometry of autotrophs-theory and observations[J]. Ecology Letters, 2004, 7(3): 185–191. DOI:10.1111/ele.2004.7.issue-3 |
| [41] | Reich P B, Olkesyn J. Global patterns of plant leaf N and P in relation to temperature and latitude[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(30): 11001–11006. DOI:10.1073/pnas.0403588101 |
| [42] | Elser J J, Fagan W F, Denno R F, et al. Nutritional constraints in terrestrial and freshwater food webs[J]. Nature, 2000, 408(6812): 578–580. DOI:10.1038/35046058 |
 2017, Vol. 23
2017, Vol. 23  doi:
doi: 

