在低氮环境中,植物发生一系列形态和生理上的变化来适应外界环境,如根长变长、侧根密度降低等[1–2],同时有较多的光合产物被根系利用,促进根系的生长,从而提高根冠比。曹兰芹等[3]研究表明,与高氮处理相比,油菜在低氮处理下其氮素吸收效率升高,但其机理尚不够明确。根系是油菜吸收养分的主要器官,其活力水平和根表面积对氮的吸收极为重要,氮吸收能力强的植物根系活力和吸收面积往往较大。NO3– 是油菜的主要氮源,土壤中的NO3– 主要通过质流迁移至根系表面,而质流的动力来源于植物的蒸腾作用,因此,油菜的蒸腾速率对NO3– 的吸收具有重要促进作用。油菜吸收NO3– 后,一部分在根系中同化利用,另一部分通过木质部运输到植物的地上部参与同化反应,因此,木质部伤流液中NO3– 含量可反映其体内分配对不同氮水平的适应性。硝酸还原酶 (NR) 和谷氨酰胺合成酶 (GS) 是NO3– 同化的两个关键酶。NR是NO3– 诱导酶,是其参与同化的第一个步骤,即在NR作用下,NO3– 在细胞中还原成NO2–。生成的NO2– 在亚硝酸还原酶的作用下还原成氨,参与下一步的同化反应。由于亚硝酸还原酶的活性远远高于硝酸还原酶,所以植物体内几乎没有NO2– 的积累,故NR是NO3– 还原的限速酶[4]。NO3– 被还原生成的NH4+,在GS酶的作用下,合成谷氨酰胺,参与体内的各种新陈代谢反应。NR和GS对植株的氮效率有显著促进作用,氮效率较高的油菜植株其NR和GS活性往往也较高[5–6]。植物体内氮代谢与碳代谢相互偶联,NO3– 的同化过程利用由光合作用提供的还原剂、能量和碳骨架,因此,植物的光合作用对NO3– 的同化利用具有重要促进作用[7–8]。
油菜是我国主要油料作物,其氮肥利用率较低[9],在农业生产上氮肥施用过量和不足并存[10–12]。为了精确控制油菜生长的营养环境,本研究以水和稀盐酸清洗干净的珍珠岩砂粒作为油菜的生长基质,开展砂培试验,以正常供氮水平为对照,设置中度和重度低氮胁迫处理,在油菜移栽后第40 d采样 (该时期油菜对低氮胁迫的适应性生理变化趋于稳定),测定油菜NO3– 吸收、分配和同化的相关生理指标,对研究油菜在不同低氮胁迫下相关生理变化及其氮素利用效率,对生产实践具有重要指导意义。
1 材料与方法 1.1 试验设计供试油菜品种为814 (常规油菜品种),由国家油料作物改良研究中心湖南分中心提供。
根据氮水平的不同,该试验设3个处理:1) 正常供氮处理 (NO3– 10 mmol/L);2) 中度低氮胁迫处理 (NO3– 3 mmol/L);3) 重度低氮胁迫处理 (NO3– 1 mmol/L)。每处理重复3次。
油菜播种出苗后,长至第4片叶展开后进行移栽,油菜移栽至塑料钵中 (30 cm × 30 cm),每钵一株。塑料钵中盛放用水和稀盐酸清洗干净的珍珠岩砂粒 (无营养液成分) 作为油菜的生长基质。移栽油菜后的塑料钵放置在玻璃大棚中,油菜在自然光照和自然温度下生长,在油菜移栽后的生长期内,每3 d浇一次营养液,一次240 mL。正常供氮处理 (即10 mmol/L处理) 的营养液成分: KNO3 3.3 mmol/L、Ca(NO3)2·4H2O 3.3 mmol/L、Fe-EDTA 1 mmol/L、KH2PO4 1 mmol/L、MgSO4 5 mmol/L、B 0.5 mg/L、Mn 0.5 mg/L、Zn 0.05 mg/L、Cu 0.02 mg/L、Mo 0.01 mg/L,使用HCl和NaOH调节pH至5.8;处理2) 和处理3) 的营养液成分中除KNO3和Ca(NO3)2·4H2O的用量减少为NO3–浓度为3 mmol/L和1 mmol/L外,其他同正常供氮处理,减量的钾和钙以KCl和CaCl2的形式补充。油菜生长的水分全部来源于所浇营养液。
1.2 测定方法在油菜的苗期 (移栽后40 d) 分植株的地上部 (从下往上第4片叶) 和地下部取样。分别测定全氮和NO3– 含量,酶活及干物质量等。并测定植株地下部分的根系活力、根系吸收面积,地上部分的气孔导度、蒸腾速率、光合速率。
样品经研磨浸提后,采用连续流动分析仪 (AA3) 测定NO3– 含量;NR活性采用Fan等[14]方法测定;GS活性采用杨兰[15]所用测定方法测定;植株全氮采用凯氏定氮法测定[16];根系活力采用TTC法测定[13];根系吸收面积采用甲烯蓝法测定[13]。
气孔导度、蒸腾速率、光合速率采用LI-6400便携式光合仪测定。测定参数设置如下:光照为1000 μmol/(m2·s),相对湿度为65%,CO2浓度为400 mg/kg,温度为环境温度。
木质部汁液的收集及其 NO3– 含量的测定:用剪刀将油菜植株从根茎上1 cm处剪断,其根立即转移至营养液中,用预称重的脱脂棉球附在油菜的切割面上并用塑料薄膜包裹,1 h后用注射器挤压棉花,收集棉花的渗出液,即木质部汁液。根据棉花的增重来计算木质部汁液的体积。在连续流动分析仪 (AA3) 上测定渗出液NO3– 浓度。
1.3 数据计算及处理氮素光合效率 = 光合速率/叶片单位面积氮素量;
水分利用效率 (WUE) = 光合速率/蒸腾速率[17];
氮素吸收效率 = 植株总氮量/营养液提供的总氮量;
氮素利用效率 = 生物产量/植株总氮量。
采用SPSS 13.0和Microsoft Excel软件进行数据处理。处理间差异显著性分析采用LSD检验法。
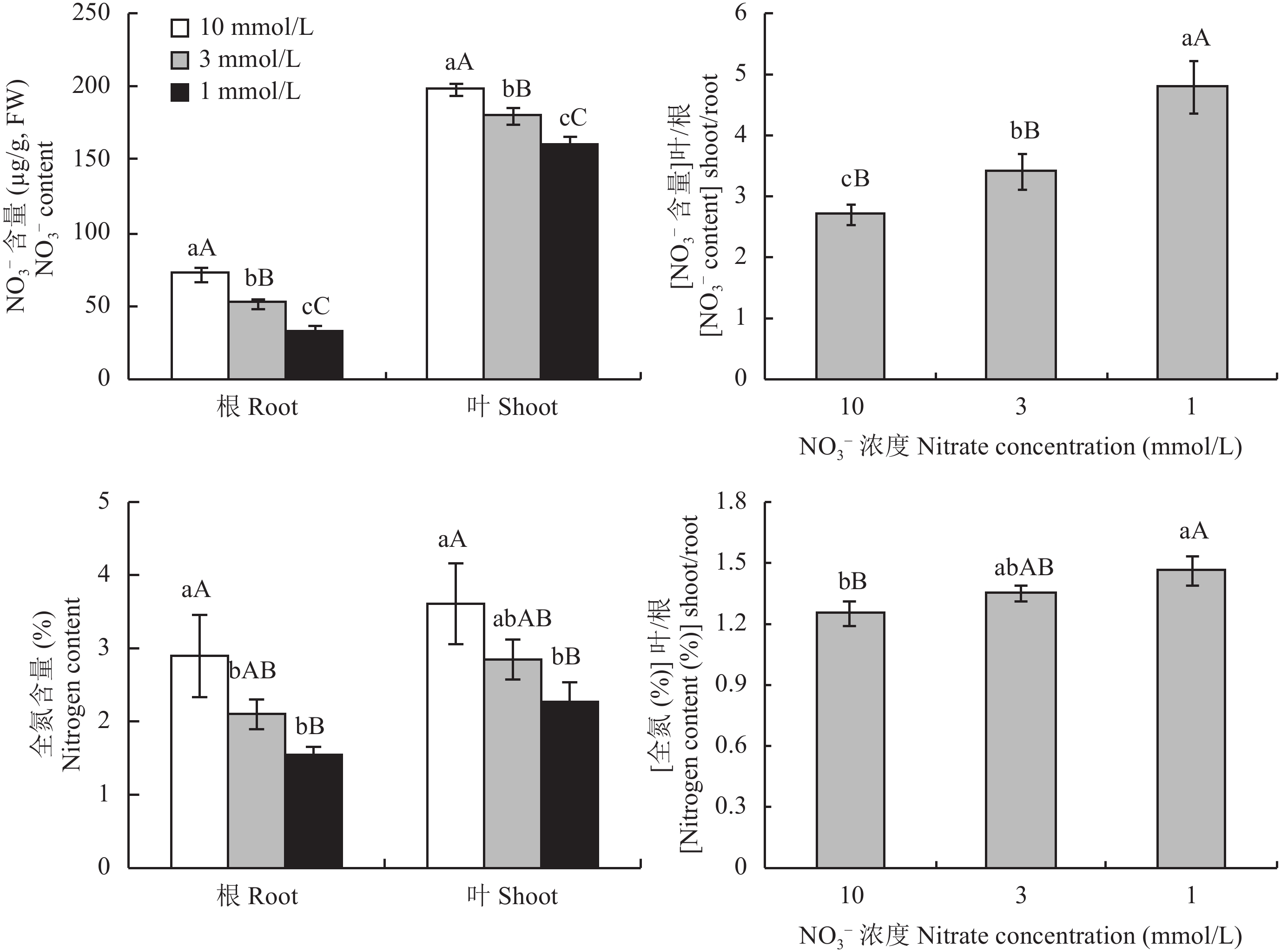
2 结果与分析 2.1 油菜NO3–、全氮含量及体内分布对低氮胁迫的响应与正常供氮处理 (10 mmol/L) 相比,在低氮胁迫下 (3 mmol/L、1 mmol/L) 油菜根和叶中NO3– 含量均显著下降,3个氮处理之间的差异均达到了极显著水平 (图1)。但 (NO3– 含量) 叶/根在低氮胁迫下升高 ,3 mmol/L比10 mmol/L处理高25.99%,两者之间的差异达到了显著水平,1 mmol/L比3 mmol/L处理高40.06%,两者之间的差异达到了极显著水平。
油菜植株根和叶的全氮含量均随供氮水平的降低而降低。[植株全氮 (%)] 叶/根在低氮胁迫下有升高趋势。3 mmol/L与10 mmol/L处理之间的差异不显著,1 mmol/L比10 mmol/L处理高16.88%,两者之间的差异达极显著水平,1 mmol/和3 mmol/L处理之间的差异不显著。
 |
|
图1
不同氮浓度水平下油菜NO3–、全氮含量及其体内分布
Fig. 1
Nitrate nitrogen content, total nitrogen and their distribution of oilseed rape in different nitrate concentration levels
|
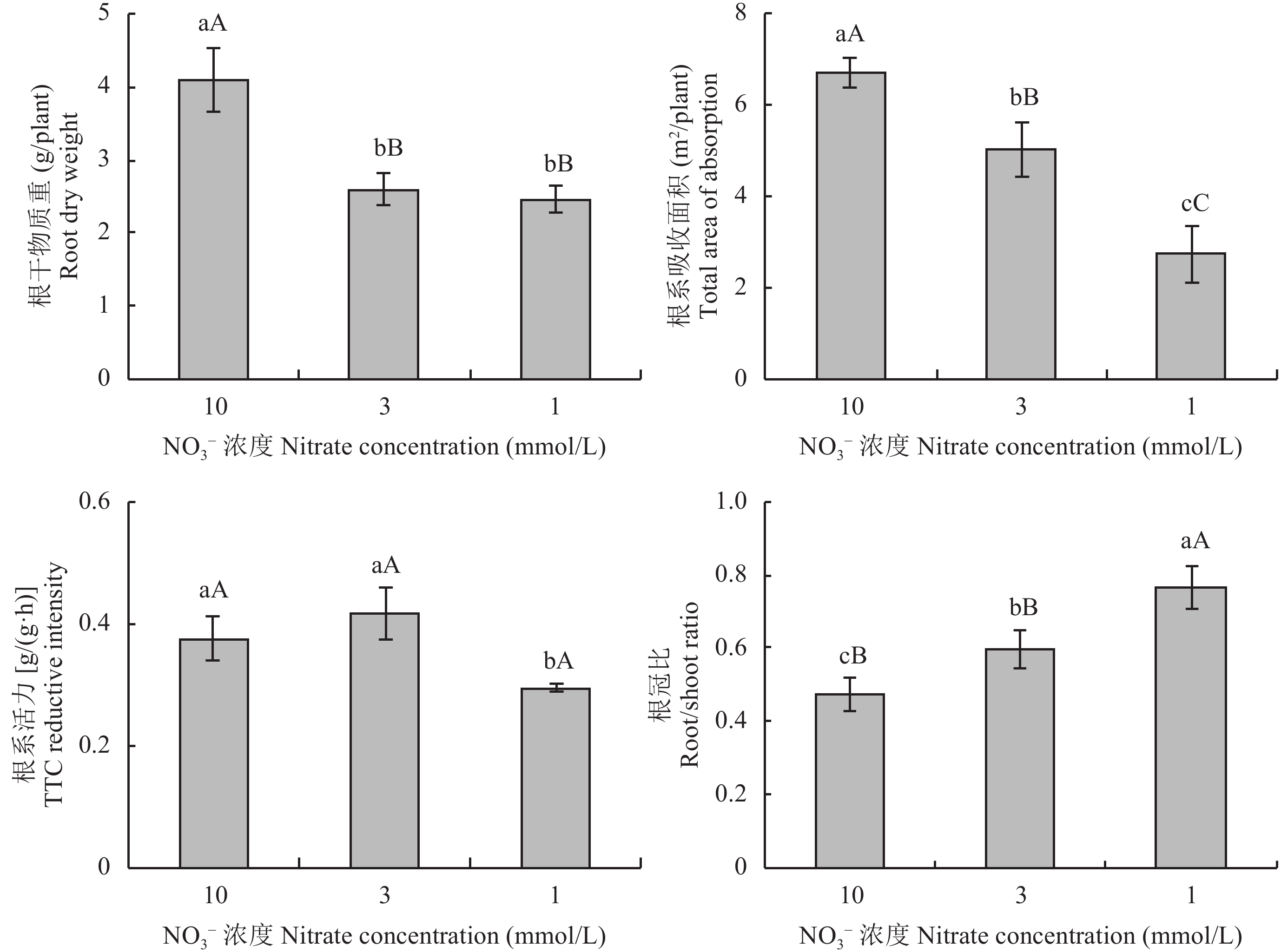
油菜植株的根干物质重随供氮水平的降低而降低 (图2),3 mmol/L比10 mmol/L处理显著降低36.91%,1 mmol/L与3 mmol/L之间的差异不显著。油菜植株的根系吸收面积随供氮水平的降低而减少,3个氮处理之间差异均达到了极显著水平。10 mmol/L和3 mmol/L处理根系活力差异不显著,但均显著高于1 mmol/L处理,分别高出27.69% 和41.25%。油菜植株的根冠比随着供氮水平的降低而升高,3 mmol/L的根冠比比10 mmol/L处理高26.31%,两者之间的差异达到了显著水平,1 mmol/L的根冠比比3 mmol/L高28.23%,两者之间的差异达到了极显著水平,这可能是油菜植株的氮素吸收效率随供氮水平降低而升高的原因之一。
 |
|
图2
不同氮浓度水平下油菜的根系特性
Fig. 2
Root characteristics of oilseed rape in different nitrate concentration levels
|
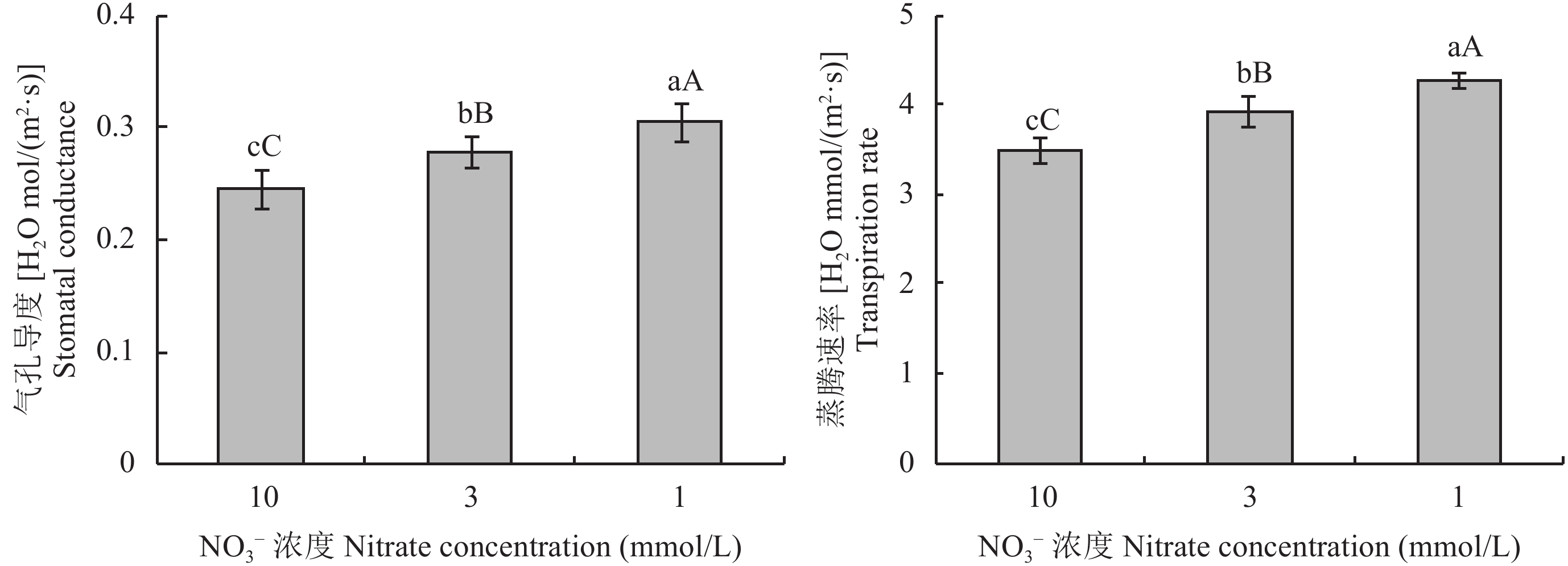
由图3可知,油菜植株的气孔导度、蒸腾速率在低氮胁迫下均显著上升。3个氮处理之间的差异均达到了极显著水平,3 mmol/L和1 mmol/L处理的蒸腾速率比10 mmol/L处理分别高出12.30% 和22.25%。
 |
|
图3
不同氮浓度水平下油菜气孔导度、蒸腾速率
Fig. 3
Stomatal conductance, transpiration of oilseed rape in different nitrate concentration levels
|
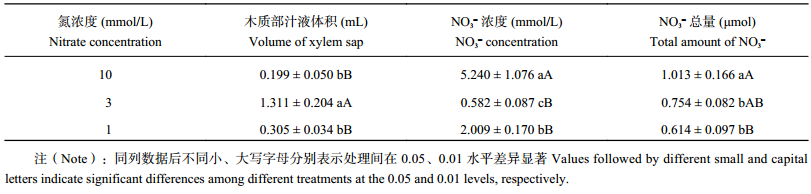
由表1可以看出,3 mmol/L处理的木质部汁液体积极显著高于10 mmol/L和1 mmol/L处理,10 mmol/L和1 mmol/L处理之间的差异不显著。3 mmol/L处理的木质部汁液中NO3– 浓度最低,与10 mmol/L处理之间的差异达到了极显著水平,与1 mmol/L处理之间的差异达到了显著水平。10 mmol/L处理收集到的木质部汁液中NO3– 的总量显著高于 3 mmol/L、1 mmol/L处理,10 mmol/L 处理分别比 3 mmol/L、1 mmol/L 处理高 34.35%、64.98%,而 3 mmol/L 和 1 mmol/L 处理间差异不显著。
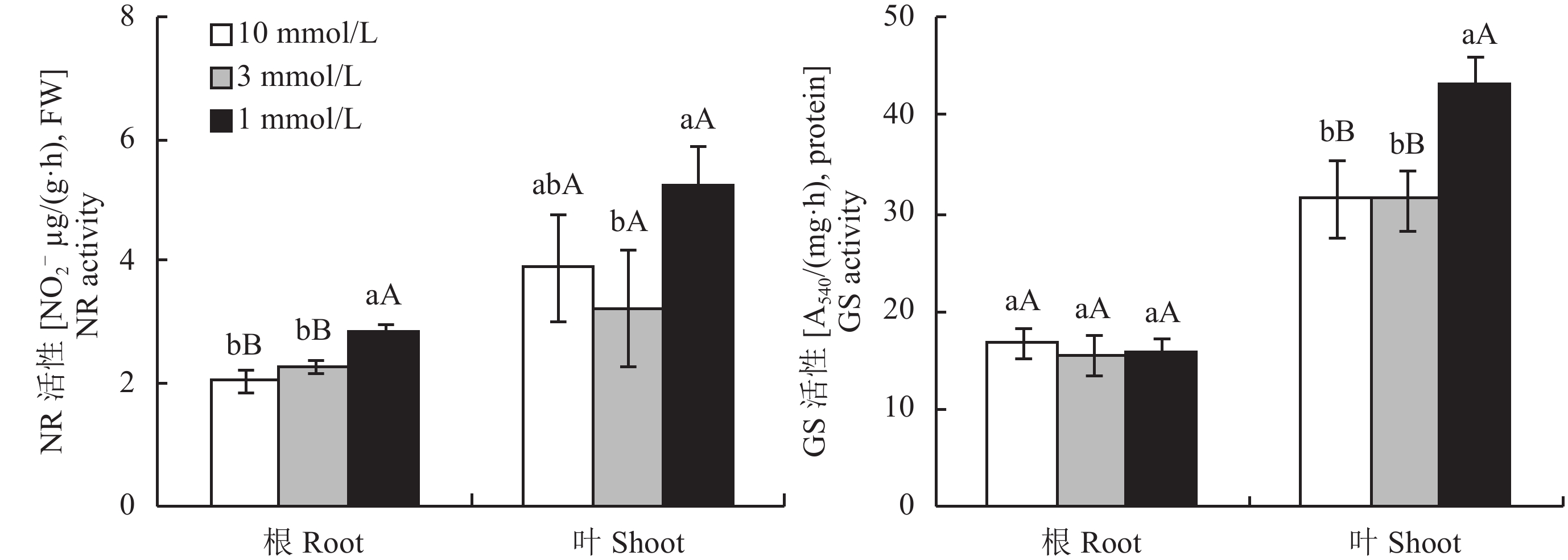
2.5 油菜NO3– 代谢关键酶活性对低氮胁迫的响应由图4可知,10 mmol/L和3 mmol/L处理的油菜根系中NR活性差异不显著,但均极显著低于1mmol/L处理。在叶中,10 mmol/L处理的NR活性与3 mmol/L、1 mmol/L处理之间的差异均不显著。3 mmol/L比1 mmol/L处理低38.39%,两者之间的差异达到了显著水平。
在根中,3个氮处理之间的GS活性差异均不显著;在叶中,10 mmol/L和3 mmol/L处理之间的差异不显著,但均极显著低于1 mmol/L处理。
| 表1 不同氮浓度水平下油菜木质部汁液体积及NO3– 浓度 Table 1 Volume of xylemsap, NO3– concentration of oilseed rape in different nitrate concentration levels |
 |
 |
|
图4
不同氮浓度水平下油菜NR、GS活性
Fig. 4
NR, GS activities of oilseed rape in different concentration nitrate levels
|
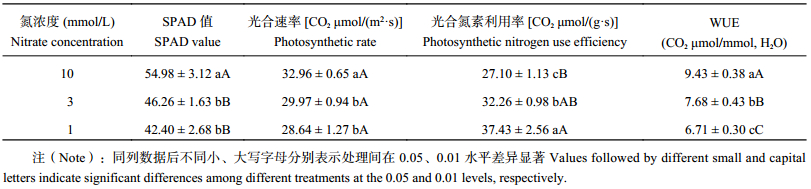
由表2可以看出,植株的叶绿素含量和光合速率在低氮胁迫下均显著下降,但 3 mmol/L与1 mmol/L处理之间的差异不显著。在低氮胁迫下,植株的光合氮素利用率显著升高,3 mmol/L比10 mmol/L处理高19.03%,两者之间的差异达显著水平,1 mmol/L比10 mmol/L处理高38.11%,两者之间的差异达极显著水平,1 mmol/L与3 mmol/L处理之间的差异达显著水平。
油菜植株的水分利用效率在低氮胁迫下显著下降,3 mmol/L比10 mmol/L处理降低18.58%,1 mmol/L比10 mmol/L处理降低28.86%,3个氮处理之间的差异均达到了极显著水平。
| 表2 油菜光合速率、光合氮素利用率及水分利用率对低氮胁迫的响应 Table 2 Photosynthetic nitrogen use efficiency and water use efficiency (WUE) of oilseed rape in different nitrate concentration levels |
 |
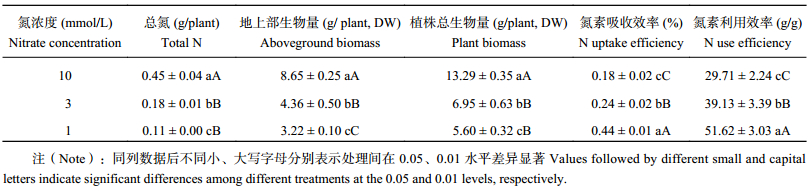
由表3可知,油菜植株的总氮、地上部生物量及总生物量均在低氮胁迫下显著下降。3 mmol/L、1 mmol/L处理的总氮和总生物量与10 mmol/L之间的差异均达到了极显著水平,3 mmol/L与1 mmol/L处理之间的差异达到了显著水平。3个氮处理地上部生物量之间的差异均达到了极显著水平。3 mmol/L处理的总氮比10 mmol/L的降低了60.42%,其地上部生物量比10mmol/L降低了49.61%,其植株总生物量比10 mmol/L降低了47.73%。1 mmol/L处理的总氮比10 mmol/L的降低了75.86%,其地上部生物量降低了62.79%,其植株总生物量降低了57.89%。
植株的氮素吸收效率和氮素利用效率在低氮胁迫下显著升高,3个氮处理之间的差异均达到了极显著水平。3 mmol/L处理的氮素吸收效率比10 mmol/L处理的提高了31.66%,其氮素利用效率提高了31.71%。1 mmol/L的氮素吸收效率比10 mmol/L处理提高了141.20%,其氮素利用效率提高了73.73%。
| 表3 油菜氮素与干物质累积以及氮素吸收利用效率对低氮胁迫的响应 Table 3 Nitrogen and dry matter accumulation, nitrogen uptake and utilize efficiency of oilseed rape in different nitrate concentration levels |
 |
根是植物吸收NO3– 的主要器官,氮素吸收效率高的植物一般都具有根系发达、生物量大、分布密度大等特点。为了更好地吸取养分,根系在不同的生长环境中,进化出一系列形态或生理上的塑性反应。在低氮环境中,植物体通过减少侧根密度,增加根长来减少根系间的竞争和增加根系在土壤中的生长范围[1–2],从而提高NO3– 吸收效率。在本试验中,中度低氮胁迫处理 (3 mmol/L) 和重度低氮胁迫处理 (1 mmol/L) 的油菜植株由于总氮吸收量减少 (表3),蛋白质合成量降低,造成植株生长矮小,生物量下降,但根冠比显著增加 (图2)。1 mmol/L与3 mmol/L的根干物质重差异不显著,但根冠比差异达极显著水平,这是由于1 mmol/L的地上部生物量极显著低于3 mmol/L 所致 (表3)。作物通过增加生物量在根系中的分配来促进植物体对养分离子的吸收,提高其氮素吸收效率 (表3),这可能是植物对低氮环境的适应机制之一。在低氮胁迫下,植物地上部合成的碳水化合物向根系运输加强,根系中出现淀粉累积现象[18–19],根系的生长优于地上部的生长,这可能是导致植物体根冠比变大的主要原因。
本试验表明,油菜在低氮胁迫下,不仅通过改变植物的根系特性来适应低氮环境,而且能够改变植物地上部分的生理状况来加强对氮素的吸收。研究表明,土壤中的氮素能够调控植物的蒸腾作用[17],在缺氮环境中,植物体的气孔导度、蒸腾速率提高,土壤中的质流加强[17, 20–21]。这与本试验的研究结果一致,低氮胁迫下油菜植株的气孔导度、蒸腾速率显著升高 (图3)。质流虽然不能直接促进植物体对NO3– 的吸收,但能够提高根际NO3– 浓度,因此,蒸腾作用对于植物体对NO3– 的捕获具有重要促进作用。在低氮胁迫下,油菜植株通过提高蒸腾作用来加强对NO3– 的吸收,是其适应低氮环境的机制。但在低氮胁迫下,升高的蒸腾作用加剧了植物体水分的散失,导致其水分利用效率 (WUE) 下降 (表2)。因此,油菜植株在低氮胁迫下通过牺牲其水分利用效率来促使其氮素吸收效率的提高。
3.2 NO3– 的运输分配与同化对低氮胁迫的响应及氮素利用效率NO3– 被植物体吸收后,既可以在根系中同化利用,也可以转移到根系液泡中储存起来,被吸收的硝态氮还可以通过木质部运往植物的地上部分,在植物的地上部分同化利用。硝态氮在植物的地上部分与地下部分分配的比例,取决于植物品种、外部NO3– 浓度、温度、光照强度等[22]。NO3– 在植物体内的分配对氮素利用效率有重要影响,研究表明,油菜体内NO3– 被更多的分配在地上部分,能够促进其氮效率的提高[23]。NO3– 在叶片中同化能更有效的利用由光合作用提供的还原剂、能量和碳骨架,因此,NO3– 的还原发生在植物的地上部分比在地下部分更为节能高效[7–8]。在本试验中,低氮胁迫处理油菜体内NO3– 含量显著下降 (图1),但有更高比例的NO3– 被分配在植物的地上部分。且低氮胁迫得越重,向地上部分分配NO3– 的比例越高。NR和GS是NO3– 代谢的两个关键酶,对植株NO3– 的同化有显著促进作用。低氮胁迫处理油菜体内NR、GS活性无明显下降 (图4)。低氮胁迫下的油菜植株叶绿素含量、光合速率降低,但光合氮素利用率显著增加,且低氮胁迫得越重,光合氮素利用率增加越多 (表2)。油菜植株在低氮胁迫下,NO3– 在地上部的分配比例增加 (图1),同时伴随着光合氮素利用率的显著提高,这是植株氮素利用效率显著提高的重要原因 (表3)。
低氮胁迫处理油菜植株蒸腾速率提高 (图3),不仅能够促进植物体对NO3– 的吸收,而且促进了NO3– 从根系向地上部分的运输[24–25]。当供氮水平从10 mmol/L减至3 mmol/L时,木质部汁液中的NO3– 总量仅减少25.57%,供氮水平从3 mmol/L减至1 mmol/L时,木质部汁液中的NO3– 总量仅减少22.80% (表1)。
气孔的开合控制着植物的蒸腾速率和植物体对CO2的吸收,气孔孔径增加,气体交换加强,一方面可以促进植物的光合作用,另一方面,也加剧了水分的散失。随着供氮水平的降低,油菜植株氮含量下降 (图1),叶绿素合成受阻,光合作用受到限制,但蒸腾作用加剧,导致其水分利用效率降低 (表2)。气孔的闭合受保卫细胞中NO3– 的调控,当其浓度降低时,气孔的开合度也随之降低[26]。当外界氮水平降低时,气孔的分布和密度不变[27],但油菜植株的气孔导度增加 (图3)。该研究表明植物的氮代谢对气孔的闭合具有调控作用,但这一调控机理还需要进一步研究。
4 结论1) 在低氮胁迫下,油菜氮素吸收总量降低,但氮素吸收效率和氮素利用效率均显著升高。
2) 油菜植株的根冠比、蒸腾速率均在低氮胁迫下增加,促进了植株对NO3– 的吸收。
3) 低氮胁迫下,油菜蒸腾速率的升高促进了NO3– 向植株地上部分的运输,同时光合氮素利用率显著升高,促进了植株氮素利用效率的提高,但植株水分散失加剧,水分利用效率显著下降。
| [1] | Postma J A, Dathe A, Lynch J P. The optimal lateral root branching density for maize depends on nitrogen and phosphorus availability[J]. Plant Physiology, 2014, 166(2): 590–602. DOI:10.1104/pp.113.233916 |
| [2] |
谢孟林, 李强, 查丽, 等. 低氮胁迫对不同耐低氮性玉米品种幼苗根系形态和生理特征的影响[J].
中国生态农业学报, 2015, 23(8): 946–953.
Xie M L, Li Q, Zha L, et al. Effects of low nitrogen stress on the physiological and morphological traits of roots of different low nitrogen tolerance maize varieties at seedling stage[J]. Chinese Journal of Eco-Agriculture, 2015, 23(8): 946–953. |
| [3] |
曹兰芹, 伍晓明, 杨睿, 等. 不同氮吸收效率品种油菜氮素营养特性的差异[J].
作物学报, 2012, 38(5): 887–895.
Cao L Q, Wu X M, Yang R, et al. Differences of nitrogen status between different N-uptake-efficiency rape-seed (Brassica napus L.) cultivars [J]. Acta Agronomica Sinica, 2012, 38(5): 887–895. |
| [4] |
吴礼树. 土壤肥料学[M]. 北京: 中国农业出版社, 2011.
Wu S L. Soli fertilizer science [M]. Beijing: China Agriculture Press, 2011. |
| [5] | Wang G L, Ding G D, Li L, et al. Identification and characterization of improved nitrogen efficiency in interspecific hybridized new-type Brassica napus [J]. Annals of Botany, 2014, 114(3): 549–559. DOI:10.1093/aob/mcu135 |
| [6] | Ye X, Hong J, Shi L, et al. Adaptability mechanism of nitrogen-efficient germplasm of natural variation to low nitrogen stress in Brassica napus [J]. Journal of Plant Nutrition, 2010, 33(13): 2028–2040. DOI:10.1080/01904167.2010.512211 |
| [7] | Tang Y F, Sun X C, Hu C X, et al. Genotypic differences in nitrate uptake, translocation and assimilation of two Chinese cabbage cultivars [Brassica campestris L. ssp. Chinensis (L.)] [J]. Plant Physiology and Biochemistry, 2013, 70: 14–20. DOI:10.1016/j.plaphy.2013.04.027 |
| [8] | Luo J K, Sun S B, Jia L J, et al. The mechanism of nitrate accumulation in pakchoi [Brassica campestris L.)] [J]. Plant and Soil, 2006, 282: 291–300. DOI:10.1007/s11104-005-6094-7 |
| [9] |
刘强, 宋海星, 荣湘民, 等. 不同品种油菜子粒产量及氮效率差异研究[J].
植物营养与肥料学报, 2009, 15(4): 898–903.
Liu Q, Song H X, Rong X M, et al. Study on oilseed yield and nitrogen efficiency in different cultivars of oilseed rape (Brassica napus) [J]. Plant Nutrition and Fertilizer Science, 2009, 15(4): 898–903. |
| [10] |
李银水, 余常兵, 廖星, 等. 湖北省不同油菜轮作模式下作物施肥现状调查[J].
中国农学通报, 2012, 28(36): 205–211.
Li Y S, Yu C B, Liao X, et al. Investigation of present fertilization on crops by different rapeseed rotation systems in Hubei province[J]. Chinese Agricultural Science Bulletin, 2012, 28(36): 205–211. DOI:10.3969/j.issn.1000-6850.2012.36.035 |
| [11] |
徐华丽, 鲁剑巍, 李小坤, 等. 四川省油菜施肥状况调查[J].
西南农业学报, 2011, 24(4): 1372–1376.
Xu H L, Lu J W, Li X K, et al. Investigation of fertilizer condition of rapeseed in Sichuan province[J]. Southwest China Journal of Agricultural Sciences, 2011, 24(4): 1372–1376. |
| [12] |
王小英, 刘芬, 同延安, 等. 陕南秦巴山区油菜施肥现状评价[J].
中国油料作物学报, 2013, 35(2): 190–195.
Wang X Y, Liu F, Tong Y A, et al. Fertilization evaluation of rapeseed in Qin-Ba mountain area of southern Shanxi province[J]. Chinese Journal of Oil Crop Sciences, 2013, 35(2): 190–195. DOI:10.7505/j.issn.1007-9084.2013.02.013 |
| [13] |
邹琦. 植物生理生化实验指导[M]. 北京: 中国农业出版社, 1995.
Zou Q. Guide of plant physiology and biochemistry experiment[M]. Beijing: China Agriculture Press, 1995. |
| [14] | Fan X R, Jia L J, Li Y L, et al. Comparing nitrate storage and remobilization in two rice cultivars that differ in their nitrogen use efficiency[J]. Journal of Experiment Botany, 2007, 58(7): 1729–1740. DOI:10.1093/jxb/erm033 |
| [15] |
杨兰. 生长调节剂对油菜氮素再利用的影响及其与氮素利用效率的关系研究[D]. 长沙: 湖南农业大学硕士学位论文, 2012.
Yang L. Effect of growth regulators on nitrogen reutilization of oilseed rape and relation to nitrogen utilization efficiency[D]. Changsha: MS Thesis, Hunan Agriculture University, 2012. |
| [16] |
鲍士旦. 土壤农化分析(第三版) [M]. 北京: 中国农业出版社, 1999.
Bao S D. Agricultural chemistry analysis of soil (3rd Ed.)[M]. Beijing: China Agriculture Press, 1999. |
| [17] | Matimati I, Verboom G A, Cramer M D. Nitrogen regulation of transpiration controls mass-flow acquisition of nutrients[J]. Journal of Experimental Botany, 2013, 65(1): 159–168. |
| [18] | Cai J, Chen L, Qu H Y, et al. Alteration of nutrient allocation and transporter genes expression in rice under N, P, K, and Mg deficiencies[J]. Acta Physiologiae Plantarum, 2012, 34(3): 939–946. DOI:10.1007/s11738-011-0890-x |
| [19] |
孙虎威, 王文亮, 刘尚俊, 等. 低氮胁迫下水稻根系的发生及生长素的响应[J].
土壤学报, 2014, 51(5): 1096–1102.
Sun H W, Wang W L, Liu S J, et al. Formation of rice root regulated by nitrogen deficiency[J]. Acta Pedologica Sinica, 2014, 51(5): 1096–1102. |
| [20] | Cramer M D, Hoffmann V, Verboom G A. Nutrient availability moderates transpiration in Erharta calycina [J]. New Phytologist, 2008, 179(4): 1048–1057. DOI:10.1111/nph.2008.179.issue-4 |
| [21] | Kupper P, Rohula G, Saksing L, et al. Does soil nutrient availability influence night-time water flux of aspen saplings?[J]. Environmental and Experimental Botany, 2012, 82: 37–42. DOI:10.1016/j.envexpbot.2012.03.013 |
| [22] | Smirnoff N, Stewart G R. Nitrate assimilation and translocation by higher plants: comparative physiology and ecological consequences[J]. Physiologia Plantarum, 1985, 64(2): 133–140. DOI:10.1111/ppl.1985.64.issue-2 |
| [23] | Han Y L, Song H X, Liao Q, et al. Nitrogen use efficiency is mediated by vacuolar nitrate sequestration capacity in roots of Brassica napus [J]. Plant Physiology, 2016, 170: 1684–1698. |
| [24] | Tanner W, Beevers H. Does transpiration have an essential function in long-distance ion transport in plants?[J]. Plant, Cell and Environment, 1990, 13(8): 745–750. DOI:10.1111/pce.1990.13.issue-8 |
| [25] | Tanner W, Beevers H. Transpiration, a prerequisite for long distance transport of minerals in plants?[J]. Proceedings of the National Academy of Sciences, 2001, 98(16): 9443–9447. DOI:10.1073/pnas.161279898 |
| [26] | Guo F Q, Young J, Crawford N M. The nitrate transporter AtNRT1.1 (CHL1) functions in stomatal opening and contributes to drought susceptibility in Arabidopsis [J]. The Plant Cell, 2003, 15(1): 107–117. DOI:10.1105/tpc.006312 |
| [27] | Broadley M R, Escobar-Gutierrez A J, Burns A, et al. Nitrogen-limited growth of lettuce is associated with lower stomatal conductance[J]. New Phytologist, 2001, 152(1): 97–106. DOI:10.1046/j.0028-646x.2001.00240.x |
 2017, Vol. 23
2017, Vol. 23  doi:
doi: 

