2. 国家级“三峡库区水环境监测与模拟”国际科技合作基地,重庆 400716;
3. 湖南大学生物学院,湖南长沙 410082
2. National Base of International S&T Collaboration on Water Environmental Monitoring and Simulation in TGR Region, Chongqing 400716, China;
3. College of Biology, Hunan University, Changsha 410082, China
酸性土壤在全世界分布广泛,并且有不断恶化的趋势[1–2]。我国的酸性土壤主要分布在长江以南的广大热带、亚热带地区和云贵川等地,面积约为2.04 × 108 hm2,且大部分土壤的pH值小于5.5,其中很大一部分小于5.0,甚至4.5[3]。近年来随着工业的发展和不合理的农田施肥,我国土壤酸化面积和酸化程度还在不断增加[4]。
紫花苜蓿 (Medicago sativa L.) 是营养丰富的优良牧草,根系发达,与根瘤菌共生后具有较强的固氮能力,被用作改土培肥的良好作物,但紫花苜蓿是对酸性土壤条件最为敏感的植物之一[5],限制了苜蓿的北草南引[6–7];豆科葛藤 (Argyreia seguinii Levl.) 根瘤发达、固氮量多,葛藤–根瘤菌共生固氮体系对提高土壤肥力、改善土壤结构和保持水土发挥了重要的作用[8],在我国西南石漠化地区,特别是三峡库区对缓解酸性土壤水土流失具有推广应用价值。接种耐酸根瘤菌可以提高豆科宿主在酸性土壤中的定殖能力,提高产量及品质[9–10]。目前对耐酸根瘤菌的研究集中于耐酸根瘤菌的基因组序列研究[11–13],酸胁迫对耐酸和酸敏感根瘤菌菌株基因和蛋白合成的不同影响[14]以及耐酸根瘤菌菌株对豆科寄主生长的影响[15–18]等方面。已经获得了耐酸根瘤菌菌株LPU83,耐酸苜蓿根瘤菌菌株WSM1115,耐酸伯克氏菌菌株WSM2232全基因组序列;Brigido 等[14]研究发现耐酸根瘤菌的耐酸性能与来源土壤及其微生物菌群直接相关。接种耐酸根瘤菌能显著提高盆栽条件下酸性土壤中葛藤、紫花苜蓿的植株鲜重、地上部鲜重、根鲜重、株高、根瘤菌鲜重以及植株全氮含量[16];在酸性条件下,紫花苜蓿与耐酸性强的根瘤菌株所形成共生体系较与耐酸性弱的菌株的共生体系在固氮量、经济产量和品质方面显著提高[18]。耐酸根瘤菌应用于接种主要集中于接种对缓解酸性土壤对植物的毒害及对土壤理化性质影响的方面[19–21],而对于接种耐酸根瘤菌对豆科植物根际土壤微生态影响的研究较少。为了深入研究接种耐酸根瘤菌对酸性土壤的生物修复机理,本研究对酸性土壤条件下的葛藤和苜蓿分别接种耐酸葛藤、苜蓿根瘤菌,综合测试和分析了土壤养分、土壤中可培养微生物等特征的变化,以及土壤微生物磷脂脂肪酸 (phospholipid fatty acid, PLFA) 的动态等,探讨接种耐酸根瘤菌对根际微生态的综合影响,以阐明耐酸根瘤菌缓解土壤酸胁迫的机制。
1 材料与方法 1.1 试验材料供试土壤为重庆市北碚区缙云山酸性黄壤。基础理化性质:pH 4.8、有机质7.28 g/kg、全氮0.68 g/kg、全磷0.12 g/kg、全钾10.98 g/kg、有效磷5.88 mg/kg、速效钾61.39 mg/kg。耐酸苜蓿根瘤菌菌株91532、91512和91522 (以下简称3、4、5) 为本实验室分离保存,耐酸葛藤根瘤菌菌株PR068、389、390分离自贵州和重庆市,均能在pH 4.8的土壤和YMA固体平板上生长并分别能使苜蓿、葛藤植株结瘤[14, 22]。紫花苜蓿种子购自江苏省连云港草业中心 (发芽率85.4%);葛藤种子购自福建省三明市沙县 (发芽率86.6%)。YMA培养基:10 g/L甘露醇、0.5 g/L K2HPO4、0.2 g/L MgSO4·7H2O、0.1 g/L NaCl、5 g/L酵母粉、15 g/L琼脂粉。
1.2 试验设计室内盆栽试验设置7个处理:1) 不接种根瘤菌 (CK);2) 接种葛藤根瘤菌068;3) 接种葛藤根瘤菌389;4) 接种葛藤根瘤菌390;5) 接种苜蓿根瘤菌3;6) 接种苜蓿根瘤菌4;7) 接种苜蓿根瘤菌5。各处理均重复3次,分5个时期,即30 d、60 d、90 d、120 d、150 d取样。YMA培养基培养耐酸根瘤菌至OD600值约为1.0后,经4000 r/min离心10 min,收集菌体后重悬于新鲜YMA液体培养基中。
种子于50~60℃水中浸泡30 min后捞出,白天放在阳光下暴晒,夜间转至阴凉处,期间加水保持种子湿润,当大部分种子略有膨胀时用根瘤菌拌种,即种子与菌剂 (根瘤菌重∶种子重=1∶10),加入适量1% 羧甲基纤维素纳溶液充分搅拌均匀,阴干后直接用于播种[23]。
每盆装pH为 4.8的酸性黄壤2 kg,分别均匀散播籽粒饱满的葛藤种子20粒和紫花苜蓿种子60粒,表面覆少量湿土。栽培期间保持土壤含水量为田间持水量的60%~70%。收获植株,测定土壤养分、微生物数量,利用磷脂脂肪酸 (PLFAs) 生物标记法分析根际土壤微生物多样性。
1.3 试验方法1.3.1 土壤常规性质及可培养微生物数量测定 根际土壤采用抖根法取样。土壤基本理化性质 (包括pH及有机质) 采用常规方法测定[24]。土壤可培养微生物采用涂布计数法[25],细菌和真菌釆用10–3~10–5的稀释度,放线菌采用10–2~10–4的稀释度。
1.3.2 土壤磷脂脂肪酸测定 按照Bligh等[26]的方法提取土壤微生物磷脂脂肪酸 (PLFAs),经提取和预处理后,用Agilent 6850气相色谱仪 (FID检测器) 分析PLFA成分。色谱条件为:HP-5柱 (25.0 m × 0.20 μm × 0.33 μm),进样量1 μL,分流比10∶1,载气为H2,尾吹气高纯N2,助燃气空气,流速0.8 mL/min,汽化室温度250℃,检测器温度300℃,柱前压10.0 psi。升高柱温:升温程序为170℃起始,5℃/min升至260℃,而后40℃/min升到310℃,维持1.5 min。各成分脂肪酸通过MIDI Sherlock微生物鉴定系统 (Version 6.1, MIDI, Inc., Newark, DE) 进行鉴定, 标准品为购于美国MIDI公司的C9-C20的脂肪酸甲酯,PLFA用C19:0做内标,换算PLFA的绝对含量。表征微生物的PLFAs生物标记参照文献[27]。
1.4 数据处理使用Microsoft Excel 2010对数据进行处理,使用SPSS 19.0软件对试验数据进行统计分析,采用单因素ANOVA分析和LSD法检验各处理间的差异显著性 (P < 0.05)。
2 结果与分析 2.1 接种耐酸葛藤、苜蓿根瘤菌对根际土壤微生物数量的影响接种耐酸根瘤菌处理的根际土壤中可培养细菌、真菌、放线菌和根瘤菌数量显著高于不接种处理的 (表1和表2)(P < 0.05)。自接种至120 d取样,伴随着土壤中根瘤菌数量的增加 (P < 0.05),不论接种葛藤或苜蓿根瘤菌,各处理根际土壤中可培养细菌、真菌、放线菌数量均逐渐升高,在120 d时数量达到最高,与对照相比分别提高61.5%~348.4%、3.4%~441.7%、18.9%~255.2%。但在150 d取样时,上述指标均下降。说明接种耐酸根瘤菌刺激了酸性土壤中土著微生物的繁殖,该作用可以维持4个月。接种葛藤根瘤菌显著提高了根际土壤可培养细菌的数量,接种苜蓿根瘤菌显著提高了可培养细菌及真菌的数量,菌株葛藤068处理各特征微生物类群数量显著高于葛藤389、390的处理 (表1),菌株苜蓿5处理显著高于苜蓿3、4的处理 (表2)。
| 表1 接种耐酸葛藤根瘤菌对葛藤根际土壤微生物数量的影响 Table 1 Effects of inoculating acid-tolerant rhizobium from kudzu on quantity of soil microorganisms |
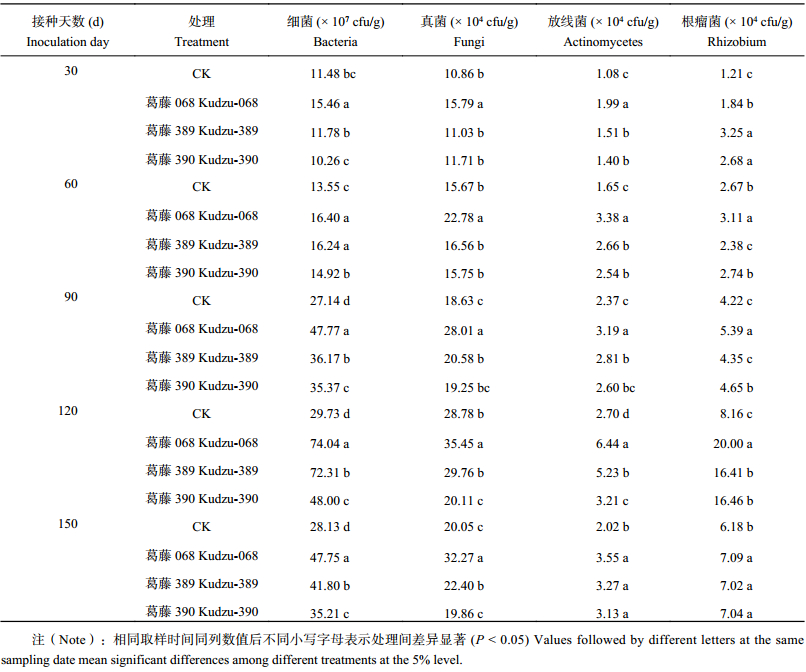 |
| 表2 接种耐酸苜蓿根瘤菌对苜蓿根际土壤微生物数量的影响 Table 2 Effects of inoculating acid-tolerant rhizobium from alfalfa on quantity of soil microorganisms |
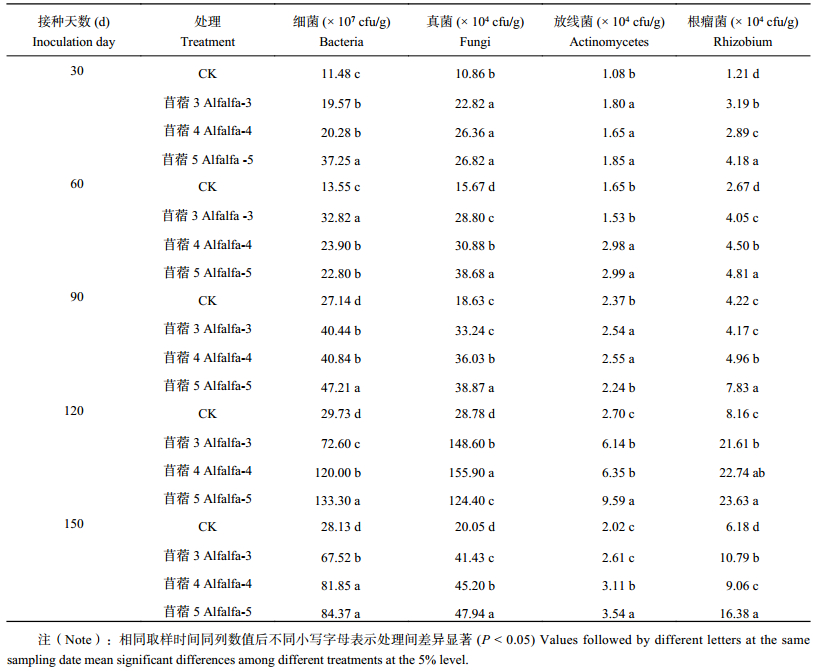 |
表3、表4所示,除第30天取样期,接种耐酸葛藤和苜蓿根瘤菌处理的土壤pH均显著高于每一取样期的对照处理 (P < 0.05),且在整个培养期内稳步上升;除葛藤处理第30 d取样、苜蓿处理第90 d取样,接种处理的土壤有机质含量显著高于未接种处理,且与土壤pH相似,土壤有机质在整个培养过程中持续增加;无论葛藤或苜蓿处理,土壤全氮在30~90 d取样期含量变化不大,但在120 d取样期,包括未接种对照,各处理土壤全氮有明显增加,接种处理的土壤全氮显著高于对照 (P < 0.05)。150 d土壤全氮降低至原有水平。接种耐酸根瘤菌后,土壤有效磷、速效钾显著增加,在120 d达到峰值,其中有效磷含量较CK提高了24.8%~162.4%,120 d之后略有下降。与对照相比,试验组对土壤全氮、铵态氮和硝态氮有显著增加的作用,120 d时铵态氮提高16.6%~56.2%,硝态氮提高145.4%~225.8%,说明接种耐酸根瘤菌处理提高了土壤速效氮的释放。接种葛藤068较其他葛藤耐酸根瘤菌的效果好;苜蓿5的接种效果也好于其他耐酸苜蓿根瘤菌。
| 表3 接种耐酸葛藤根瘤菌对根际土壤养分的影响 Table 3 Effects of inoculating acid-tolerant rhizobium of kudzu on soil nutrients |
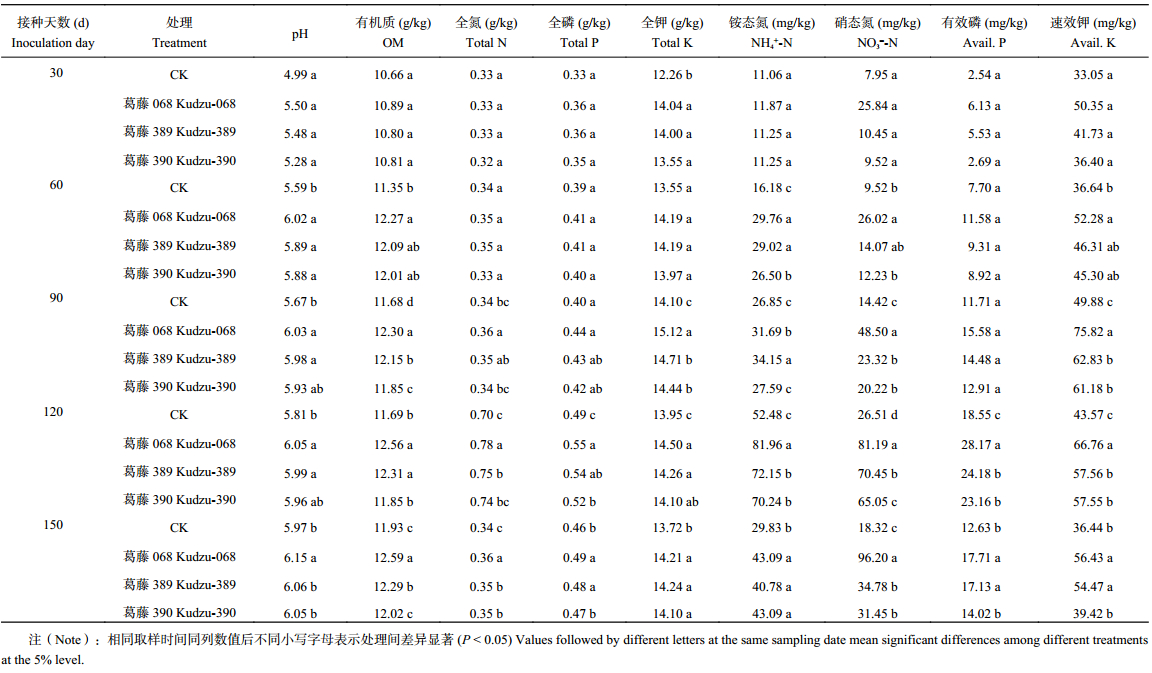 |
| 表4 接种耐酸苜蓿根瘤菌对根际土壤养分的影响 Table 4 Effects of inoculating acid-tolerant rhizobium of alfalfa on soil nutrients |
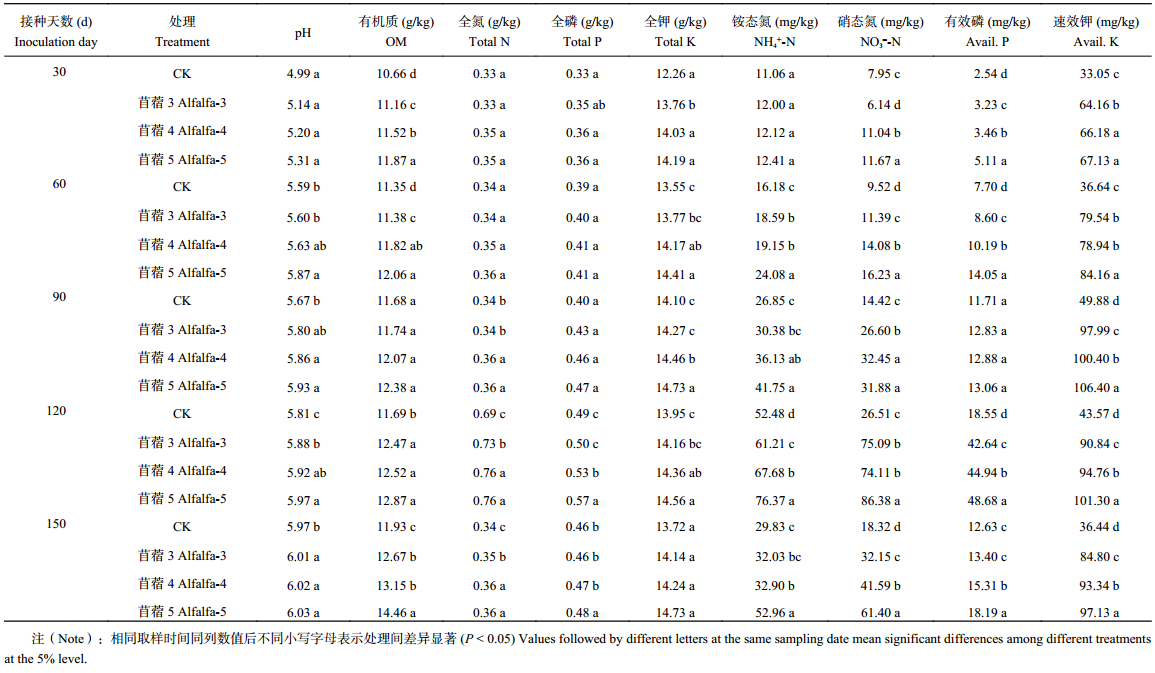 |
2.3.1 接种耐酸葛藤、苜蓿根瘤菌对土壤中PLFA分子种类数的影响 耐酸葛藤根瘤菌施入土壤室内盆栽培养30~150 d后,检测出的PLFA种类如表5所示。随着种植和接种时间的延长,土壤中PLFA种类呈逐渐增加趋势;各处理与对照在PLFA分子的种类数上并无显著差异,尤其是葛藤068、苜蓿5处理,PLFA种类数较稳定。可见施入耐酸根瘤菌对根际土壤微生物种类组成并无大的扰动。
| 表5 接种耐酸根瘤菌对根际土微生物PLFA种类的影响 Table 5 Effect of inoculating acid-tolerant rhizobium on types of microbial PLFAs in soil |
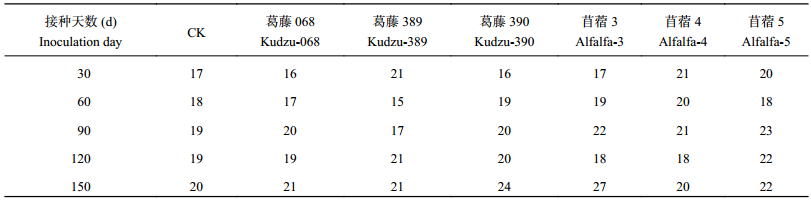 |
2.3.2 接种耐酸葛藤、苜蓿根瘤菌对土壤中PLFA含量和组成的影响 图1显示,接种耐酸根瘤菌后,根际土壤微生物PLFA绝对量随时间逐渐增加,尤以葛藤068、390明显。不同处理对根际土壤PLFA绝对含量的影响程度不同:葛藤389处理在取样中后期的PLFA绝对含量低于CK;而葛藤068、葛藤390的PLFA绝对含量在整个培养期内均高于CK。在培养的大部分时期,苜蓿4、5处理的PLFA含量低于CK的,而苜蓿3处理的PLFA绝对含量高于CK。在整个培养期内,相较于CK,施用葛藤390显著提高了表征细菌的PLFA的含量,葛藤068显著提高表征细菌、真菌、G+、G– 的PLFA含量;苜蓿3、苜蓿5处理显著提高了中后期根际土壤表征细菌、真菌、G+、G– 的PLFA含量。
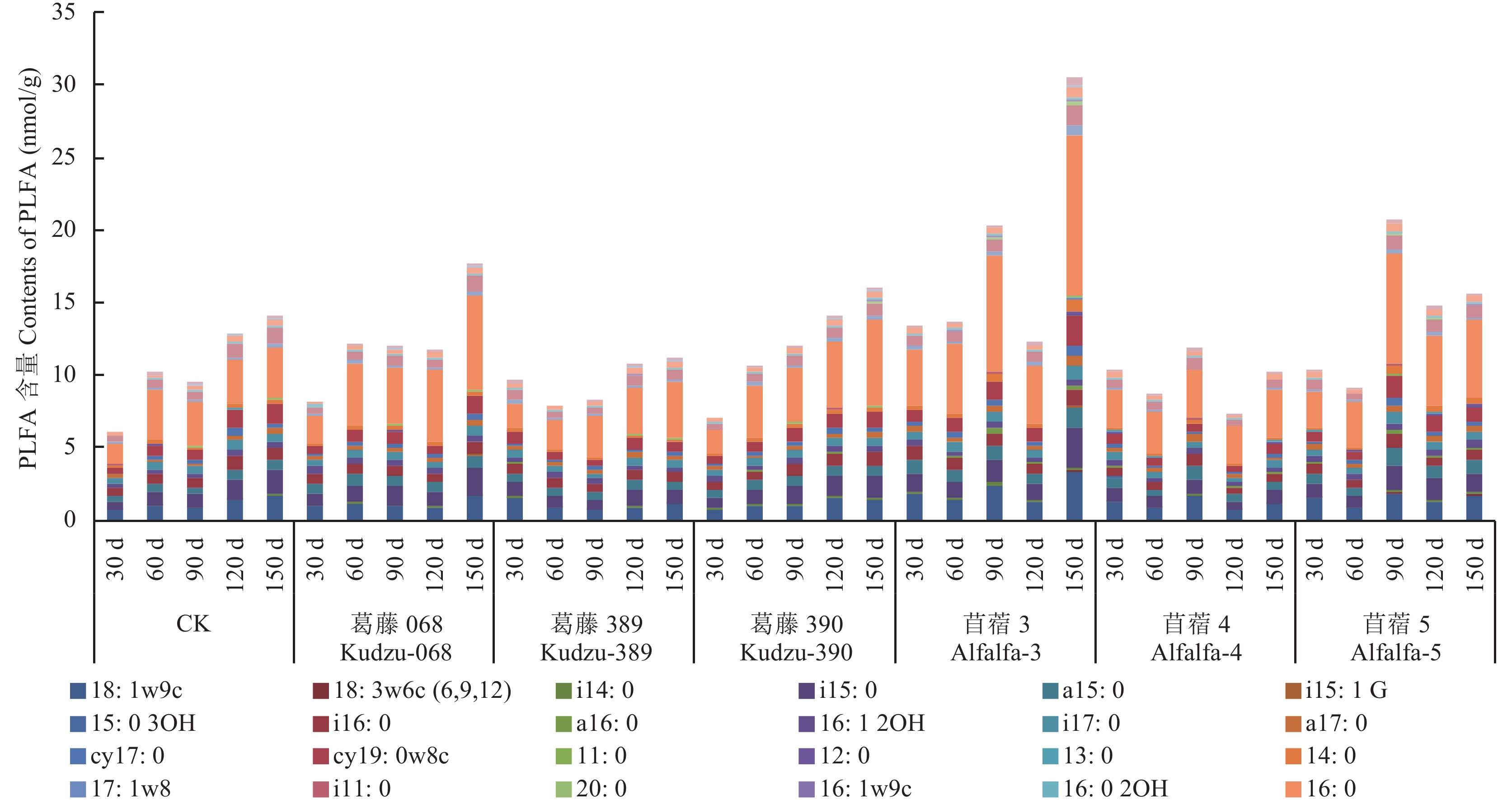 |
| 图1 接种耐酸根瘤菌土壤微生物PLFAs含量及组成 Fig. 1 Contents and composition of microbial PLFAs in soils inoculated with kudzu and alfalfa rhizobium |
不同于根际土壤可培养微生物数量变化,各处理的PLFA绝对含量在120 d取样期均未达到其最高值,耐酸葛藤根瘤菌、苜蓿3处理在150 d达到高峰,苜蓿4、5处理的PLFA含量则以90 d样品最高。施用苜蓿根瘤菌后根际土壤PLFA总含量显著高于施用葛藤根瘤菌处理的。
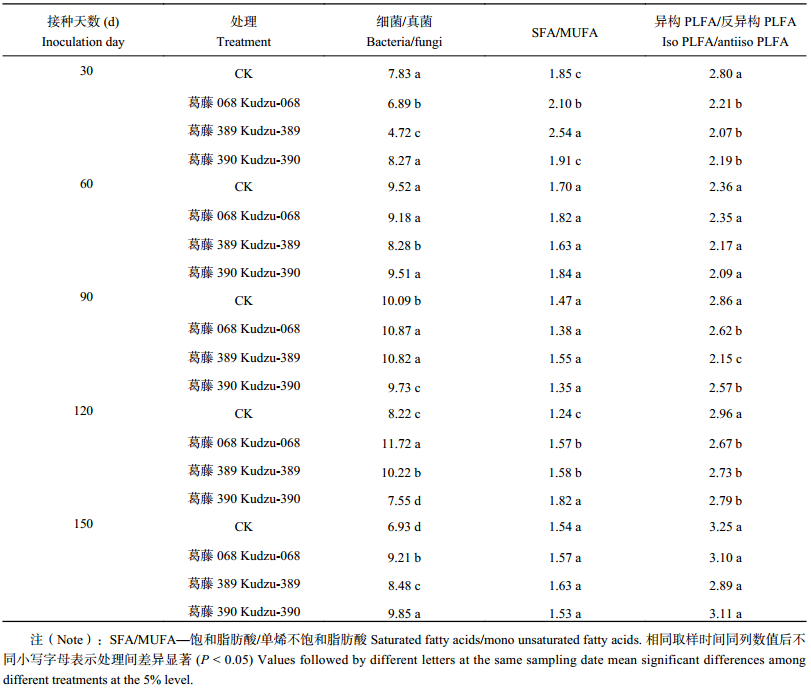
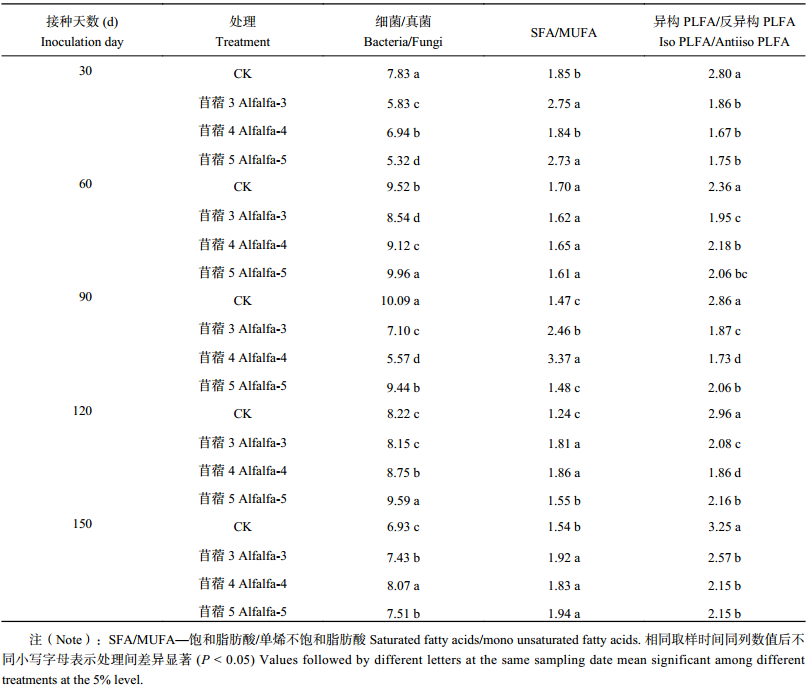
2.4 接种耐酸根瘤菌对PLFA特征比值的影响细菌/真菌常用来表征两个种群相对丰度及土壤生态系统的稳定性,土壤细菌/真菌越低则土壤生态系统越稳定[28]。施用耐酸葛藤根瘤菌068、389和耐酸苜蓿根瘤菌,在培养前期土壤中细菌与真菌的比值显著低于CK,随培养时间的延长,比值显著升高,有的处理甚至高于对照 (表6、表7)。一般饱和脂肪酸/单烯不饱和脂肪酸以及异构PLFA/反异构PLFA反映环境胁迫或营养限制,外界胁迫导致微生物合成更多的单烯不饱和脂肪酸,异构PLFA/反异构PLFA比率也会增大[29]。与CK相比,接种耐酸葛藤根瘤菌提高了一般饱和脂肪酸/单烯不饱和脂肪酸值,尤以30 d、120 d提高显著;接种耐酸苜蓿根瘤菌在培养的中后期一般饱和脂肪酸/单烯不饱和脂肪酸比值显著高于CK。无论接种耐酸葛藤或苜蓿根瘤菌,在整个培养期内显著降低了根际土壤中异构PLFA/反异构PLFA的比值 (P < 0.05)。
| 表6 接种耐酸葛藤根瘤菌后土壤微生物各类群PLFA比值 Table 6 Ratios of different microorganism PLFA contents in soil inoculated with Kudzu |
 |
| 表7 接种耐酸苜蓿根瘤菌后土壤微生物各类群PLFA比值 Table 7 Ratios of different microorganism PLFA contents in soil inoculated with alfalfa |
 |
酸化作用发生后,土壤中盐基饱和度和阳离子交换量降低,加速土壤矿物的风化作用和土壤矿物养分的流失,对作物生长产生极大的负面影响,甚至会导致植物中毒死亡[30]。土壤微生物是生态系统的重要组成部分,土壤微生物区系组成很大程度上影响并决定着土壤的生物活性、有机质分解、腐殖质合成以及土壤养分的转化[31],肖烨等[32]研究发现湿地土壤微生物数量与土壤养分各指标相关性达到极显著水平,而过低的土壤pH限制微生物在土壤中的定殖能力[33]。接种根瘤菌不仅可以改善植株品质,而且对提高土壤肥力也有显著作用[34–35]。已有研究证明在水培条件下,接种耐酸根瘤菌可促进葛藤、苜蓿的结瘤以及生长,接种耐酸苜蓿根瘤菌使营养液pH从酸性环境 (pH 4.8) 升至中性环境 (pH 7.5 左右)[15],接种耐酸葛藤根瘤菌使培养液pH由4.6升至7.0左右[36],有效缓解酸胁迫。朱丹等的研究结果表明,接种耐酸根瘤菌显著提高盆栽条件下酸性土壤中葛藤、紫花苜蓿的植株鲜重、地上部鲜重、根鲜重、株高、根瘤菌鲜重以及植株全氮含量,尤以接种葛藤菌株068及苜蓿菌株5的处理影响最为显著 (P < 0.05),其中接种葛藤菌株068,植株鲜重显著提高29.5%(P < 0.05),接种苜蓿菌株5,植株鲜重提高137.6%(P < 0.05)。本研究在酸性土壤中接种耐酸根瘤菌,随培养时间的延长,土壤pH在整个培养期内显著升高 (P < 0.05),自接种至150 d,根际土壤pH均由4.8提高至6.0左右,其中接种葛藤068及苜蓿5菌株提高的效果最为显著,分别达到6.15及6.03。耐酸葛藤、苜蓿根瘤菌均能在酸性土壤中定殖且数量显著高于不接种处理,可能是由于接种耐酸葛藤、苜蓿根瘤菌提高了土壤pH,缓解酸胁迫,从而促进了根瘤菌的定殖。
根瘤菌的生物固氮作用提高了土壤和植物可利用氮素含量,适宜的土壤氮含量增加了微生物分解有机质的速率[32],促进土壤微生物参与土壤中碳、氮循环及养分转化。本试验中,土壤有机质随培养时间延长稳步上升且显著优于不接种处理 (P < 0.05)。在接种初期土壤有效磷、速效钾、全氮、铵态氮和硝态氮含量显著提高,说明接种耐酸根瘤菌改善了根际生态,增加了土壤根际营养的有效性。而120 d后土壤有效磷、速效钾略有下降,这可能与培养后期葛藤、紫花苜蓿进入生殖生长需要较多磷素、钾素有关;150 d时土壤铵态氮和硝态氮略有降低,应是培养后期根瘤菌活性下降和植物营养需求增大的共同作用结果[16]。
PLFA是活体微生物细胞膜的恒定组分,对环境因素敏感且在体外迅速降解,特定菌群PLFA含量变化可反映原位土壤微生物活体的生物量以及微生物群落结构的变化[37]。本研究结果还表明,接种耐酸根瘤菌并不影响土壤微生物种类组成,但接种葛藤068菌株、葛藤390菌株和苜蓿菌株3使得土壤PLFA绝对含量均高于CK。这说明接种耐酸根瘤菌后,根际土壤pH显著提高,缓解了酸胁迫,促进表征根际土壤细菌、真菌、G+、G–的PLFA绝对含量的升高,即根际土壤微生物数量的提高,因而促进了土壤有机质的分解,以及有效磷和速效钾的释放。营养的供应反过来又继续维持土壤微生物的生长和生物活性。正如本研究结果,接种初期接种处理的细菌与真菌PLFA比值较未接种对照降低,土壤生态系统稳定性增加[38–39]。但随着接种时间的延长,在接种了120 d后,接种耐酸根瘤菌后根际土壤细菌/真菌值显著高于CK,土壤细菌的数量显著增加,可能原因是豆科植物土壤微生物区系中自生固氮菌、氨化细菌、硝化细菌等数量较多,真菌和细菌结构组成受固氮微生物的影响[40]。
低碳源、低氧浓度、低pH和高温情况下,异构PLFA/反异构PLFA比值增大[29]。而本研究中异构PLFA/反异构PLFA值、一般饱和脂肪酸/单烯不饱和脂肪酸值均显著低于CK,表明接种耐酸根瘤菌缓解了土壤微生态原有的胁迫环境。根际土壤生态系统变得活跃,根际土壤养分条件得到改善,促进根际分泌物的形成,显著降低了酸性土壤的环境胁迫及养分胁迫,从而提高豆科宿主产量及品质。Brigido等[14]研究结果表明耐酸根瘤菌的耐酸性能与来源土壤及其微生物菌群有关;本文的研究进一步证明,耐酸根瘤菌在酸性土壤中的定殖还能改善酸性土壤的微生态条件。
4 结论酸性土壤中施用耐酸葛藤、苜蓿根瘤菌显著提高土壤pH,增加根际土壤中全氮、有机质的含量,有效磷、铵态氮、硝态氮、速效钾都呈先升高后略有降低的趋势,在接种120 d时达到峰值且以菌种葛藤068、苜蓿5增加效果最为显著。随培养时间延长,根际土壤可培养微生物数量显著升高,耐酸葛藤、苜蓿根瘤菌均能在酸性土壤中定殖且数量显著高于不接种处理 (P < 0.05)。根际土壤中检测出的特征脂肪酸种类数量与未接种处理无明显差别,葛藤068和390菌株,苜蓿3和5菌株处理显著增加土壤各微生物群落的PLFA含量。由土壤微生物PLFA的相对丰度可知,酸性黄壤中接种耐酸葛藤、苜蓿根瘤菌能显著降低酸性土壤条件对土壤微生物的胁迫。在酸性土壤中接种耐酸根瘤菌,使根际生态得到了改善。
| [1] | Edwards D G, Sharifuddin H A H, Yusoff M N M, et al. The management of soil acidity for sustainable crop production [A]. Wright R J, Baligar V C, Murrmann R P. Plant-soil interaction at low pH [M]. Berlin: Springer Netherlands, 1991. |
| [2] |
陈梅, 陈亚华, 沈振国, 等. 猪粪对红壤铝毒的缓解效应[J].
植物营养与肥料学报, 2002, 8(2): 173–176.
Chen M, Chen Y H, Shen Z G, et al. Amelioration of aluminum toxicity on wheat plants grown in acid red soil by pig manure[J]. Plant Nutrition and Fertilizer Science, 2002, 8(2): 173–176. DOI:10.11674/zwyf.2002.0208 |
| [3] |
赵其国. 中国东部红壤地区土壤退化的时空变化、机制及调控[M]. 北京: 科学出版社, 2002: 70–75.
Zhao Q G. Spatial temporal variation, mechanism and regulation of soil degradation in the red soil region of eastern China [M]. Beijing: Science Press, 2002: 70–75. |
| [4] |
李昂. 四种土壤调理剂对酸性土壤铝毒害改良效果研究[D]. 北京: 中国农业科学院硕士学位论文, 2014.
Li A. Remediate effects on aluminum toxicity by using four soil conditioners in acid soils [D]. Beijing: MS Thesis of Chinese Academy of Agricultural Sciences, 2014. |
| [5] | Tiwari R P, Reeve W G, Gleenn A R. Mutations conferring acid sensitivity in the acid-tolerant strains Rhizobium meliloti WSM419 and Rhizobium leguminosamm biovar viciae WSM710 [J]. EMS Microbiology Letters, 1992, 100: 107–112. DOI:10.1111/fml.1992.100.issue-1-3 |
| [6] | Exley C. Reflections upon and recent insight into the mechanism of formation of hydroxy aluminosilicates and the therapeutic potential of silicic acid[J]. Coordination Chemistry Reviews, 2012, 255(1-2): 82–88. |
| [7] | Xiao K C, Yu L, Xu J M, et al. pH, nitrogen mineralization, and KCl-extractable aluminum as affected by initial soil pH and rate of vetch residue application: results from a laboratory study[J]. Journal of Soils and Sediments, 2014, 14(9): 1513–1525. DOI:10.1007/s11368-014-0909-1 |
| [8] |
吴金平, 丁自立, 郭凤领, 等. 中国葛资源现状及发展对策[J].
湖北农业科学, 2013, 52(24): 6084–6086.
Wu J P, Ding Z L, Guo F L, et al. Situation and developmental strategies of Pueraria DC. resources in China [J]. Hubei Agricultural Sciences, 2013, 52(24): 6084–6086. DOI:10.3969/j.issn.0439-8114.2013.24.038 |
| [9] |
姜华, 赵雅丽, 何承刚, 等. 紫花苜蓿根瘤菌及其共生系统耐酸性的研究[J].
云南农业大学学报, 2013, 28(1): 56–60.
Jiang H, Zhao Y L, He C G, et al. Study on acid tolerance in Rhizobium meliloti and its symbiosis system [J]. Journal of Yunnan Agricultural University, 2013, 28(1): 56–60. |
| [10] |
张媚佳, 徐淑韵, 徐苏凌, 等. 接种耐酸根瘤菌对紫花苜蓿生长的影响[J].
贵州农业科学, 2011, 39(5): 164–166.
Zhang M J, Xu S Y, Xu S L, et al. Effect of acid-tolerant rhizobium on the growth of alfalfa[J]. Guizhou Agricultural Sciences, 2011, 39(5): 164–166. |
| [11] | Wibberg D, Tejerizo G T, Del Papa M F, et al. Genome sequence of the acid-tolerant strain Rhizobium sp. LPU83 [J]. Journal of Biotechnology, 2014, 176: 40–41. DOI:10.1016/j.jbiotec.2014.02.008 |
| [12] | Reeve W, Ballard R, Howieson J, et al. Genome sequence of Ensifer medicae strain WSM1115, an acid-tolerant Medicago-nodulating microsymbiont from Samothraki, Greece [J]. Standards in Genomic Sciences, 2014, 9(3): 514–520. |
| [13] | Walker R, Watkin E, Tian R, et al. Genome sequence of the acid-tolerant Burkholderia sp. strain WSM2232 from Karijini National Park, Australia [J]. Standards in Genomic Sciences, 2014, 9(3): 551–561. |
| [14] | Brigido C, Oliveira S. Most acid-tolerant chickpea Mesorhizobia show induction of major Chaperone genes upon acid shock [J]. Microbial Ecology, 2013, 65(1): 145–153. DOI:10.1007/s00248-012-0098-7 |
| [15] |
张琴, 李艳宾. 六株耐酸苜蓿根瘤菌的筛选及生长特性研究[J].
中国农学通报, 2007, 23(9): 1–10.
Zhang Q, Li Y B. Isolation of six acid-tolerant Rhizobium meliloti and study on its growth characteristics [J]. Chinese Agricultural Science Bulletin, 2007, 23(9): 1–10. |
| [16] |
朱丹. 有益微生物对根际微生态的影响—以耐酸葛藤、苜蓿根瘤菌和青稞菌肥为例[D]. 重庆: 西南大学硕士学位论文, 2014.
Zhu D. Influence of beneficial microorganisms on rhizosphere micro-ecology with aciduric Kudzu, alfalfa rhizobium and highland barley as examples [D]. Chongqing: MS Thesis of Southwest University, 2014. |
| [17] | Bertrand A, Bipfubusa M, Dhont C, et al. Rhizobial strains exert a major effect on the amino acid composition of alfalfa nodules under NaCl stress[J]. Plant Physiology and Biochemistry, 2016, 108: 344–352. DOI:10.1016/j.plaphy.2016.08.002 |
| [18] | Jiang H, Duan X, Shan G, et al. Study on acid tolerance in rhizobium meliloti and its symbiosis system[J]. Animal Husbandry and Feed Science, 2014, 6(3): 104–106, 112. |
| [19] |
刘丽, 马鸣超, 姜昕, 等. 根瘤菌与促生菌双接种对大豆生长和土壤酶活的影响[J].
植物营养与肥料学报, 2015, 21(3): 644–654.
Liu L, Ma M C, Jiang X, et al. Effect of rhizobia and PGPR co-inoculant on soybean characteristics and soil enzyme activities[J]. Journal of Plant Nutrition and Fertilizer, 2015, 21(3): 644–654. DOI:10.11674/zwyf.2015.0311 |
| [20] |
刘亚柏, 王润芳. 氮磷钾对红花草固氮根瘤菌生长及种植后土壤肥力的影响[J].
中国农学通报, 2015, 31(36): 220–225.
Liu Y B, Wang R F. Effect of NPK on clover nitrogen-fixing rhizobia growth and soil fertility after plantation[J]. Chinese Agricultural Science Bulletin, 2015, 31(36): 220–225. DOI:10.11924/j.issn.1000-6850.casb15090098 |
| [21] |
朱宝国, 洪亚南, 张春峰, 等. 根瘤菌及组合菌对大豆叶部性状、干物质积累及产量的影响[J].
中国农学通报, 2015, 31(30): 92–95.
Zhu B G, Hong Y N, Zhang C F, et al. Effects of rhizobial and combination bacteria on leaf character, dry matter accumulation and yield of soybean[J]. Chinese Agricultural Science Bulletin, 2015, 31(30): 92–95. DOI:10.11924/j.issn.1000-6850.casb15040064 |
| [22] |
张学军. 苜蓿根瘤菌耐受酸性胁迫的生理、遗传和共生特性研究[D]. 重庆: 西南大学硕士学位论文, 2008.
Zhang X J. Properties of physiology, genetics and symbiotics of acid-tolerant strains of Rhizobium meliloti under acid stress [D]. Chongqing: MS Thesis of Southwest University, 2008. |
| [23] |
高振生, 马其东, 牛志强, 等. 沿海滩涂地区首稽根瘤菌接种方法和效果的研究[J].
草地学报, 1996, 4(4): 288–292.
Gao Z S, Ma Q D, Niu Z Q, et al. The method and effect of inoculating rhizobium to alfalfa in coastland[J]. Acta Agrestia Sinica, 1996, 4(4): 288–292. DOI:10.11733/j.issn.1007-0435.1996.04.009 |
| [24] |
鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.
Lu R K. Analytical methods for soil and agro-chemistry[M]. Beijing: China Agricultural Science and Technology Press, 2000. |
| [25] |
沈萍, 陈向东. 微生物学实验[M]. 北京: 高等教育出版社, 2007.
Shen P, Chen X D. Microbiology experiment [M]. Beijing: Higher Education Press, 2007. |
| [26] | Bligh E G, Dyer W J. A rapid method of total lipid extraction and purification[J]. Canadian Journal of Biochemistry and Physiology, 1959, 37(8): 911–917. DOI:10.1139/o59-099 |
| [27] |
颜慧, 蔡祖聪, 钟文辉. 磷脂脂肪酸分析方法及其在土壤微生物多样性研究中的应用[J].
土壤学报, 2006, 43(5): 851–859.
Yan H, Cai Z C, Zhong W H. PLFA analysis and its applications in the study of soil microbial diversity[J]. Acta Pedologica Sinica, 2006, 43(5): 851–859. |
| [28] | Vries F T, Hoffland E, Eekeren N V, et al. Fungal/bacterial ratios in grasslands with contrasting nitrogen management[J]. Soil Biology and Biochemistry, 2006, 38(8): 2092–2100. DOI:10.1016/j.soilbio.2006.01.008 |
| [29] |
吴愉萍. 基于磷脂脂肪酸(PLFA)分析技术的土壤微生物群落结构多样性的研究[D]. 杭州: 浙江大学博士学位论文, 2009.
Wu Y P. Studies on soil microbial community structure based on phospholipid fatty acid (PLFA) analysis[D]. Hangzhou: PhD Dissertation of Zhejiang University, 2009. |
| [30] |
朱茂旭, 蒋新, 和文祥, 等. 红壤中质子化及铝的溶解与质子缓冲之间的关系[J].
中国环境科学, 2002, 22(3): 277–281.
Zhu M X, Jiang X, He W X, et al. The relationship of protonation and dissolution of aluminum with proton buffering in red soils[J]. China Environmental Science, 2002, 22(3): 277–281. |
| [31] | Harris J A. Measurements of the soil microbial community for estimating the success of restoration[J]. European Journal of Soil Science, 2003, 54(4): 801–808. DOI:10.1046/j.1351-0754.2003.0559.x |
| [32] |
肖烨, 黄志刚, 武海涛, 等. 三江平原典型湿地类型土壤微生物特征与土壤养分的研究[J].
环境科学, 2015, 36(5): 1842–1848.
Xiao Y, Huang Z G, Wu H T, et al. Soil microorganism characteristics and soil nutrients of different wetlands in Sanjiang Plain, northeast China[J]. Environmental Science, 2015, 36(5): 1842–1848. |
| [33] | Banks M L, Kennedy A C, Kremer R J, et al. Soil microbial community response to surfactants and herbicides in two soils[J]. Applied Soil Ecology, 2014, 74: 12–20. DOI:10.1016/j.apsoil.2013.08.018 |
| [34] |
宁国赞, 刘惠琴, 马晓彤. 中国苜蓿根瘤菌大面积应用研究现状及展望[A]. 首届中国苜蓿发展大会论文集[C]. 北京: 中国草原学会, 2001.
Ning G Z, Liu H Q, Ma X T. Present situation and prospect of application of large area of alfalfa in China[A]. Proceedings of the first China alfalfa development conference[C]. Beijing: Chinese Grassland Society, 2001. |
| [35] |
樊利勤, 庄培亮, 马兰珍, 等. 厚荚相思根瘤菌对盆栽苗木生长及土壤肥力的影响[J].
生态科学, 2004, 23(4): 289–291.
Fan L Q, Zhuang P L, Ma L Z, et al. Responses of Acacia crassicarpa seedlings and soil nutrition to rhizobia isolated from Acacia crassicarpa [J]. Ecologic Science, 2004, 23(4): 289–291. |
| [36] | Zhang L, Gu J P, Wei S Q, et al. Mechanism of acid tolerance in a rhizobium strain isolated from Pueraria lobata (Willd.) Ohwi [J]. Canadian Journal of Microbiology, 2011, 57(6): 514–524. DOI:10.1139/w11-036 |
| [37] | Liu B R, Jia G M, Chen J A, et al. A review of methods for studying microbial diversity in soils[J]. Pedosphere, 2006, 16(1): 18–24. DOI:10.1016/S1002-0160(06)60021-0 |
| [38] | Thiet R K, Frey S D, Six J. Do growth yield efficiencies differ between soil microbial communities differing in fungal: bacterial ratios? Reality check and methodological issues[J]. Soil Biology and Biochemistry, 2006, 38(4): 837–844. DOI:10.1016/j.soilbio.2005.07.010 |
| [39] | De Vries F T, Hoffland E, van Eekeren N, et al. Fungal/ bacterial ratios in grasslands with contrasting nitrogen management[J]. Soil Biology and Biochemistry, 2006, 38(8): 2092–2103. DOI:10.1016/j.soilbio.2006.01.008 |
| [40] |
刘岳燕, 姚槐应, 黄昌勇. 水分条件对水稻土微生物群落多样性及活性的影响[J].
土壤学报, 2006, 43(5): 828–834.
Liu Y Y, Yao H Y, Huang C Y. Influence of soil moisture regime on microbial community diversity and activity in a paddy soil[J]. Acta Pedologica Sinica, 2006, 43(5): 828–834. |
 2017, Vol. 23
2017, Vol. 23  doi:
doi: 

