2. 浙江大学环境与资源学院,浙江杭州 10058
2. College of Environmental and Resource Sciences, Zhejiang University, Hangzhou 310058, China
铵态氮 (NH4+-N) 和硝态氮 (NO3–-N) 均是植物可以直接吸收利用的氮 (N) 源。近年来国内外大量研究表明,无论是喜铵作物还是喜硝作物,铵硝混合营养较单纯的铵营养或硝营养更能获得高产,这已在多种作物中得到证实[1–3]。有研究表明,铵硝混合营养能明显减轻盐分、水分、高温等逆境胁迫的危害,提高作物的抗逆性,进而促进作物的生长,施用不同形态的氮肥,会导致植物组织中矿质离子的含量有明显差异[4–7]。Cao 和 Tibbitts[8]研究表明,铵硝混合营养可以促进马铃薯的氮素吸收,提高氮素利用效率。陈鹏等[9]研究指出,铵硝混合营养比单一的铵或硝营养对香蕉生长具有更优的效果,植物体内 N、P、K 等养分含量也明显得到提高。陈斌等[6]研究表明,提高铵态氮比例能提高水分胁迫条件下茼蒿株高、产量及全氮含量。李良霞等[7]研究表明铵硝混合营养处理高羊茅受氧化胁迫程度小,耐热性最好。铵态氮的吸收与谷氨酰胺合成酶 (GS)、谷氨酸合成酶 (GOGAT) 活性有密切联系;硝态氮的吸收是在硝酸还原酶酶系作用下完成的,包括硝酸还原酶 (NR) 和亚硝酸还原酶 (NiR),外界条件对植株吸收同化硝态氮有很大的影响;同时,作物吸收 NH4+ 或 NO3– 会改变体内电荷平衡从而影响植物对外界其他养分离子的吸收[10]。此外,由于二者的同化过程不同,也影响植物体内碳代谢和激素代谢,进而使植株生长发育和外部形态明显不同[8]。Gashaw 等[11]研究指出,作物在增铵营养时,NR 活性比单一硝营养要高。在营养液中 NH4+-N 和 NO3–-N 不同配比时,随 NH4+-N 比例增加,GS 活性也有所增加[12]。
棉花是新疆重要的经济作物,种植面积在 2014 年已达到 242 万公顷 (新疆统计年鉴 2015),但是,早春的低温冻害严重制约着北疆棉花的产量和品质的提升。因此,如何提高新疆棉花对低温的抗性对于新疆棉花高产、稳产及品质提高具有重要的意义。代建龙等[3]研究指出,盐分差异分布,棉花施用硝态氮较铵态氮促进主要营养元素 (N、P、K、Mg、Fe、Mn) 的吸收及生物量积累,更有利于幼苗生长。在低温胁迫条件下,有关铵硝混合营养对棉花的氮素营养代谢及磷钾养分吸收影响的研究鲜有报道。鉴于此,本试验通过研究不同铵硝配比对低温胁迫下棉苗干物质量、硝态氮含量、棉株全氮含量、氮素吸收量及氮素代谢相关酶活性的影响,探讨增铵营养调控,增强棉株对矿质养分的吸收和积累,明确增铵营养对提高棉花抗冷性的作用,为制定北疆棉花抵抗低温冷害的防御技术提供理论依据。
1 材料与方法 1.1 试验设计供试棉花 (Gossypium hirsutum L.) 品种为新陆早 13 号。种子经消毒后在 (25 ± 1)℃ 的培养箱内催芽,将发芽一致的种子播种于装有蛭石的营养钵中育苗,每钵定苗 2 株。本试验在人工气候室 [黑夜/白天为 10 h /14 h,光照强度 280 μmol/(m2·s),相对湿度为 (65 ± 2)%] 内进行模拟低温,采用蛭石为介质,在 12 cm × 12 cm 的营养钵内育苗,把培养钵置于 45 cm × 33 cm × 20 cm 的保险盒中,每个保险盒中放置 12 个营养钵,保险盒内注入营养液,从棉花播种至出苗 60 d 左右 (苗期) 为主要研究阶段。试验采用两因素五水平,即 2 个温度处理 (15℃、25℃,分别设置在两个其他条件相同的人工气候室内) 和 5 个铵硝态氮配比处理 (0/100、25/75、50/50、75/25 和 100/0)。总氮水平为 5 mmol/L。在所有营养液中均加入占总氮量 3% 的双氰胺 (DCD) 作为硝化抑制剂,每个处理均设置 3 次重复。营养液中大量元素配方遵循 Hoagland 营养液,微量元素参照 Hammer 等[13]的方法配制,营养液每 3 d 更换一次。
1.2 测定项目与方法1.2.1 干物质量的测定 出苗 60 d 后,选取各处理长势均匀的棉株 6 株,将茎秆、叶片等器官分开,洗净,在 105℃ 烘箱中杀青 30 min,然后在 80℃ 条件下烘干至恒重后称重,即为各器官干物质量。
1.2.2 棉株全氮含量的测定 准确称取 0.5000 g 粉碎后的植物干样,H2SO4–H2O2 硝化,采用凯氏定氮法[13]测定棉花植株全氮含量,每次测定均重复 4 次。
1.2.3 硝态氮含量、硝酸还原酶活性测定 参考邹琦[14]的方法测定,每次测定 4 次重复。
1.2.4 谷氨酰胺合成酶 (GS) 和谷氨酸合酶 (GOGAT) 活性的测定 参照 Teixeira 等[15]的方法提取粗酶液用于 GS 和 GOGAT 活性测定。GS 活性单位定义为该反应条件下,每分钟催化形成 1 μmol 的 γ-谷氨酰异羟肟酸 (γ-glutamylhydroxamate) 所需要的酶量。GOGAT 活性以每分钟反应混合液于 30℃ 减少 1 μmol 的 NADH 为一个酶活性单位,总 GOGAT 活性计算以每分钟每毫克酶液催化 NADH 减少多少 μmol 表示。
1.3 数据统计与分析数据分析用 Microsoft Excel 2010 软件,采用 SPSS 19.0 软件进行双因素方差分析和差异显著性检验 (Duncan 法),采用 Sigmaplot 12.5 软件进行绘图。
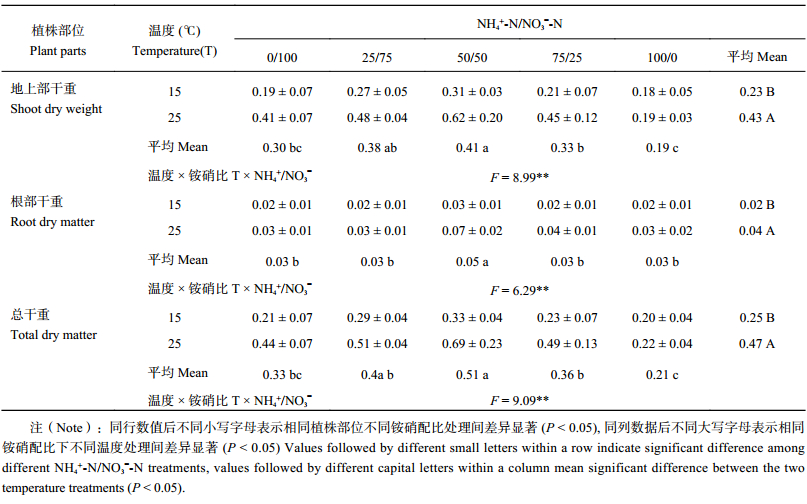
2 结果与分析 2.1 不同铵硝配比对低温胁迫下棉花幼苗生长的影响由表 1 可以看出,25℃ 温度下,铵硝混合营养对棉苗各器官干物质量积累均有显著的影响 (P < 0.05)。相同温度下,均表现为地上部、根系干重在 NH4+-N/NO3–-N 为 50/50 处理时最大,纯铵营养处理最小。对棉苗干物质量的影响效果均表现出铵硝混合营养优于纯铵或纯硝营养处理。低温 (15℃) 胁迫下,NH4+-N/NO3–-N 为 50/50 处理时棉苗各器官干物质量最大,显著高于其他处理,纯硝处理最小。根系干重 NH4+-N/NO3–-N 为 50/50 处理比纯硝处理增加了 45.9%。地上部干重、总干物质量均表现出显著性差异 (P < 0.05)。25℃ 时,纯硝处理棉苗总干物质量比 NH4+/NO3– 为 50/50 处理减少 36.5%,而 15℃ 时减少 37.4%,差异显著。在棉花生长过程中,低温胁迫抑制了棉花地上部和地下部营养器官的生长,而铵硝混合营养有利于棉苗干物质的积累及后期的生长发育。这说明增铵营养 (尤其是 NH4+-N/NO3–-N 为 50/50 处理) 在逆境条件下表现出显著促进植物生长发育的效果。
| 表1 不同 NH4+/NO3– 处理低温胁迫下棉花幼苗生物量 (g/plant) Table 1 Biomass of cotton seedlings under low temperature stress affected by different NH4+/NO3– ratios |
 |
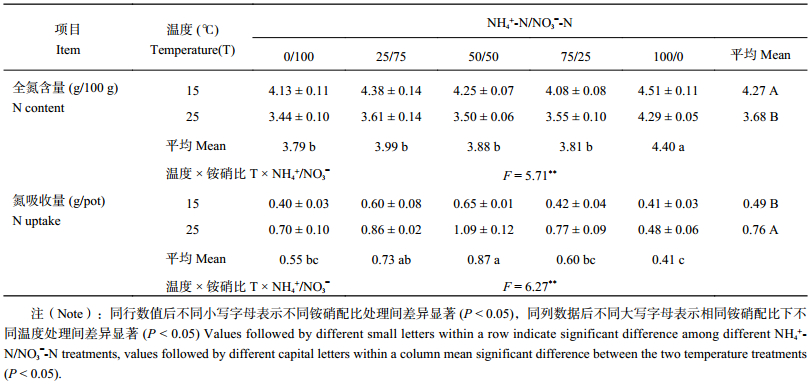
由表 2 可以看出,低温胁迫下,不同铵硝营养配比处理的棉花幼苗地上部全氮含量随着营养液中 NH4+-N 比例增加而极显著递增 (P < 0.01),且低温 (15℃) 处理极显著高于常温 (25℃) 处理 (P < 0.01)。氮素吸收量变化趋势表现为:随着 NH4+-N/NO3–-N 比值的增加,棉苗地上部氮素吸收量先增加后降低,常温处理高于低温处理,不同温度及铵硝配比间差异均达显著水平 (P < 0.05)。如营养液中 NH4+-N/NO3–-N 比为 50/50 处理相对于纯硝处理在低温胁迫条件下的棉花全氮含量增量比常温下两者全氮含量的增量高 50.0%,而氮素吸收量增量则降低 35.9%。说明低温胁迫显著抑制了棉苗对氮素的吸收,而铵硝混合营养 (尤其是 NH4+-N/NO3–-N 为 50/50 处理) 有利于促进棉花低温下对氮的吸收。
| 表2 不同 NH4+/NO3– 对低温胁迫下棉花幼苗地上部氮素吸收的影响 Table 2 Effects of different NH4+/NO3– ratios on nitrogen uptake in shoots of cotton seedlings under low temperature stress |
 |
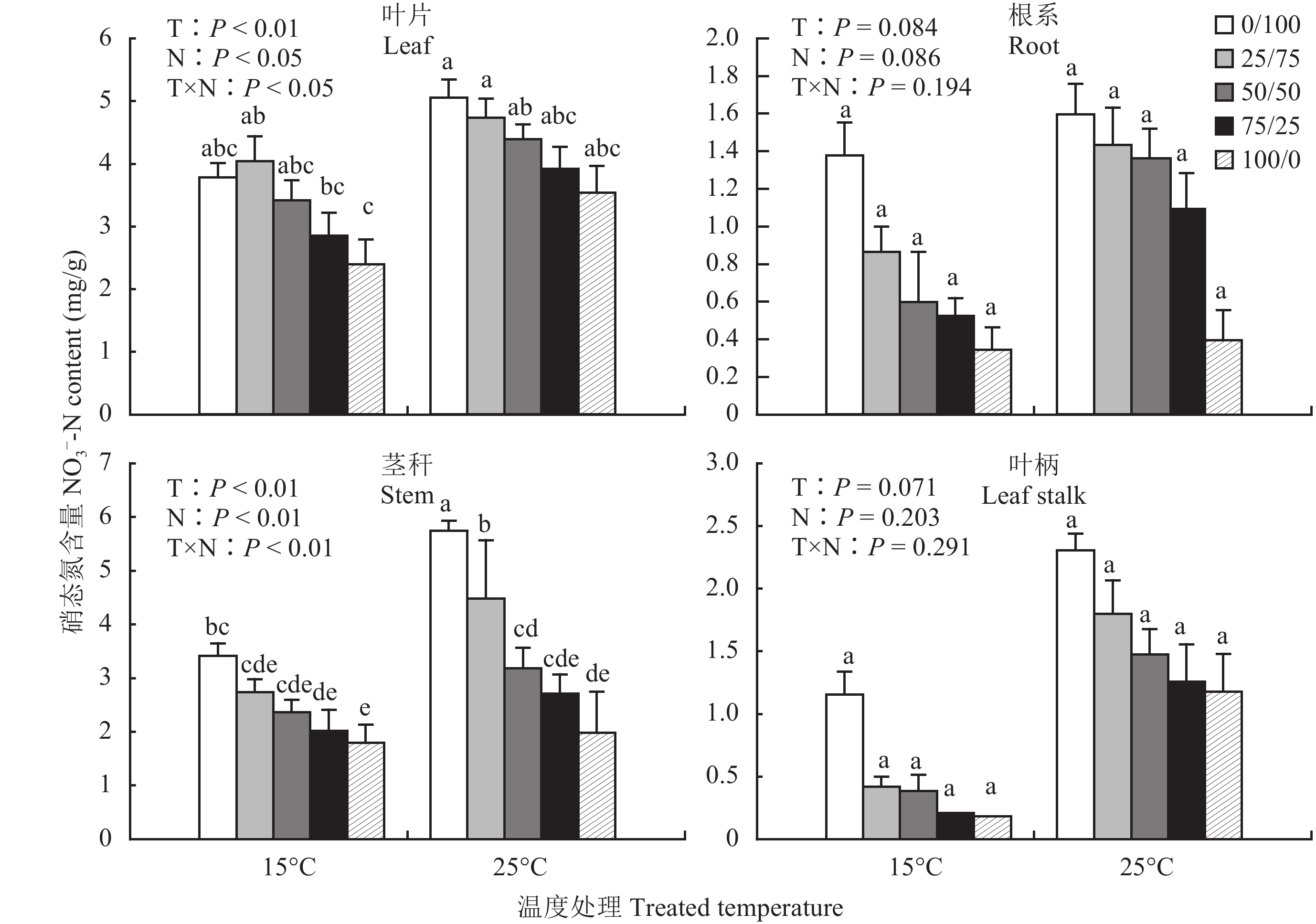
如图 1 所示,在常温和低温胁迫条件下,随着营养液中 NH4+-N 比例的增加,棉苗茎秆、叶柄和根系中的硝态氮含量均呈明显降低趋势,在纯铵营养下达到最低值,其中,茎秆内硝态氮含量差异显著 (P < 0.05)。回归分析表明,在常温和低温时,棉花叶片和茎秆中硝态氮含量与营养液中硝态氮含量之间均呈现极显著的线性相关,但根系则表现为低温时极显著相关,常温时显著相关,且各类相关中其决定系数 R2 值均在 0.7 以上。
 |
|
图1
不同 NH4+/NO3– 对低温胁迫下棉花幼苗各器官 NO3–-N 含量的影响
Fig. 1
Effects of different NH4+/NO3– ratios on the NO3–-N concentration of different organs of cotton seedlings under low-temperature stress
|
低温抑制了植物对硝态氮的吸收,棉花各器官中硝态氮含量均呈降低趋势。低温胁迫条件下,NH4+-N/NO3–-N 比从 0/100 到 100/0 时,棉花叶片中硝态氮含量从 3.78 mg/g 减少到 2.40 mg/g,降低了 36.5%;根系中硝态氮含量从 1.38 mg/g 减少到 0.34 mg/g,减少了 75.4%;茎秆中硝态氮含量从 3.41 mg/g 减少到 1.79 mg/g,减少了 47.5%。显然,与茎叶相比,根系硝态氮的含量受到营养液中 NH4+-N/NO3–-N 比值的影响更为显著。不同器官间比较,根系硝态氮含量远远小于地上部各营养器官的硝态氮含量。
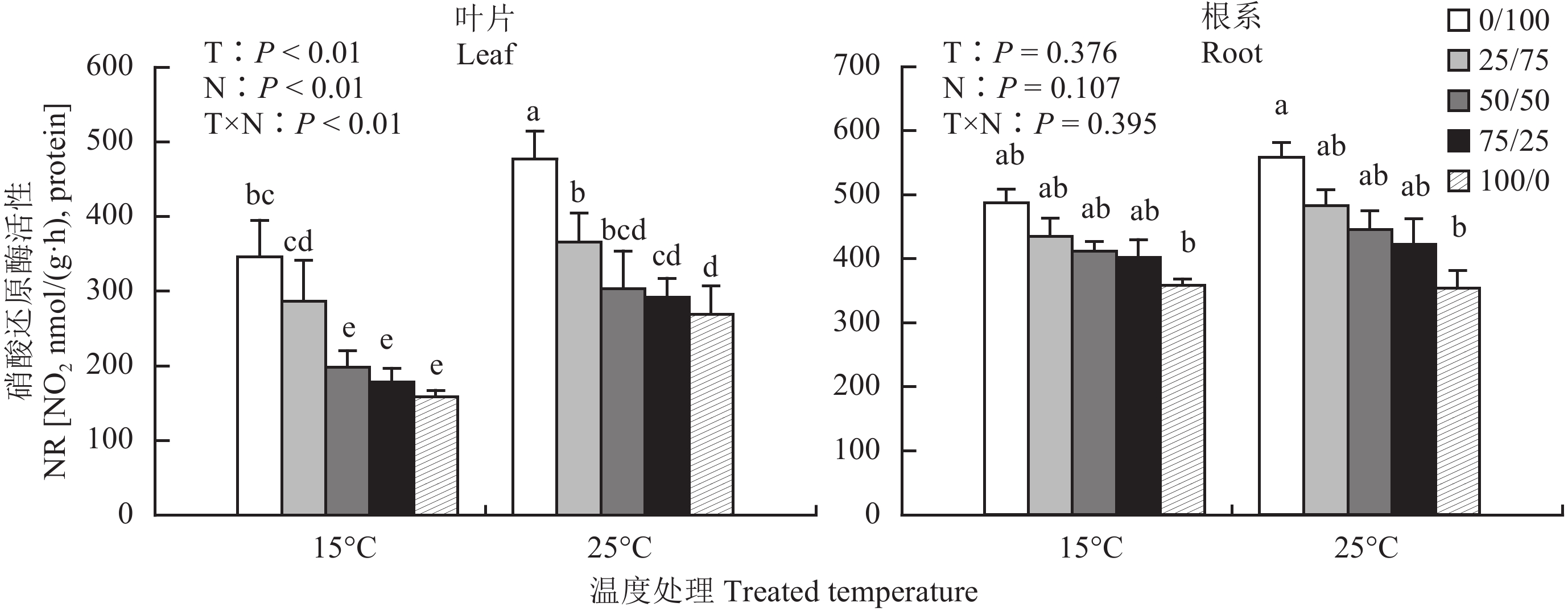
2.4 不同铵硝配比对低温胁迫下棉花幼苗 NR 活性的影响硝酸还原酶 (NR) 是一种诱导酶,其作用的直接底物是 NO3–,NR 活性的大小与供应的氮素形态密切相关 (图 2)。在正常温度和低温胁迫条件下,棉苗叶片和根系 NR 活性随着营养液中 NH4+-N 比例的增加均明显减小,叶片 NR 处理间差异显著 (P < 0.01)。同一温度条件下,棉苗叶片 NR 活性在纯硝营养处理时最大,纯铵处理时最小,且二者之间有显著性差异。纯硝与纯铵营养处理相比,棉花叶片 NR 活性在 15℃ 和 25℃ 时分别增提高了 54.0% 和 43.6%;根系 NR 活性则分别提高了 26.3% 和 36.6%。低温胁迫处理使棉苗体内 NR 活性降低。随着营养液中 NH4+-N 比例的增加,低温胁迫条件下棉花叶片 NR 活性比正常温度分别降低了 27.5%、21.6%、34.7%、39.0% 和 40.9%。
 |
|
图2
不同 NH4+/NO3– 对低温胁迫下棉苗叶片和根系内硝酸还原酶活性的影响
Fig. 2
NR activity of the leaves and roots of cotton seedlings affected by different NH4+/NO3– ratios under low-temperature stress
|
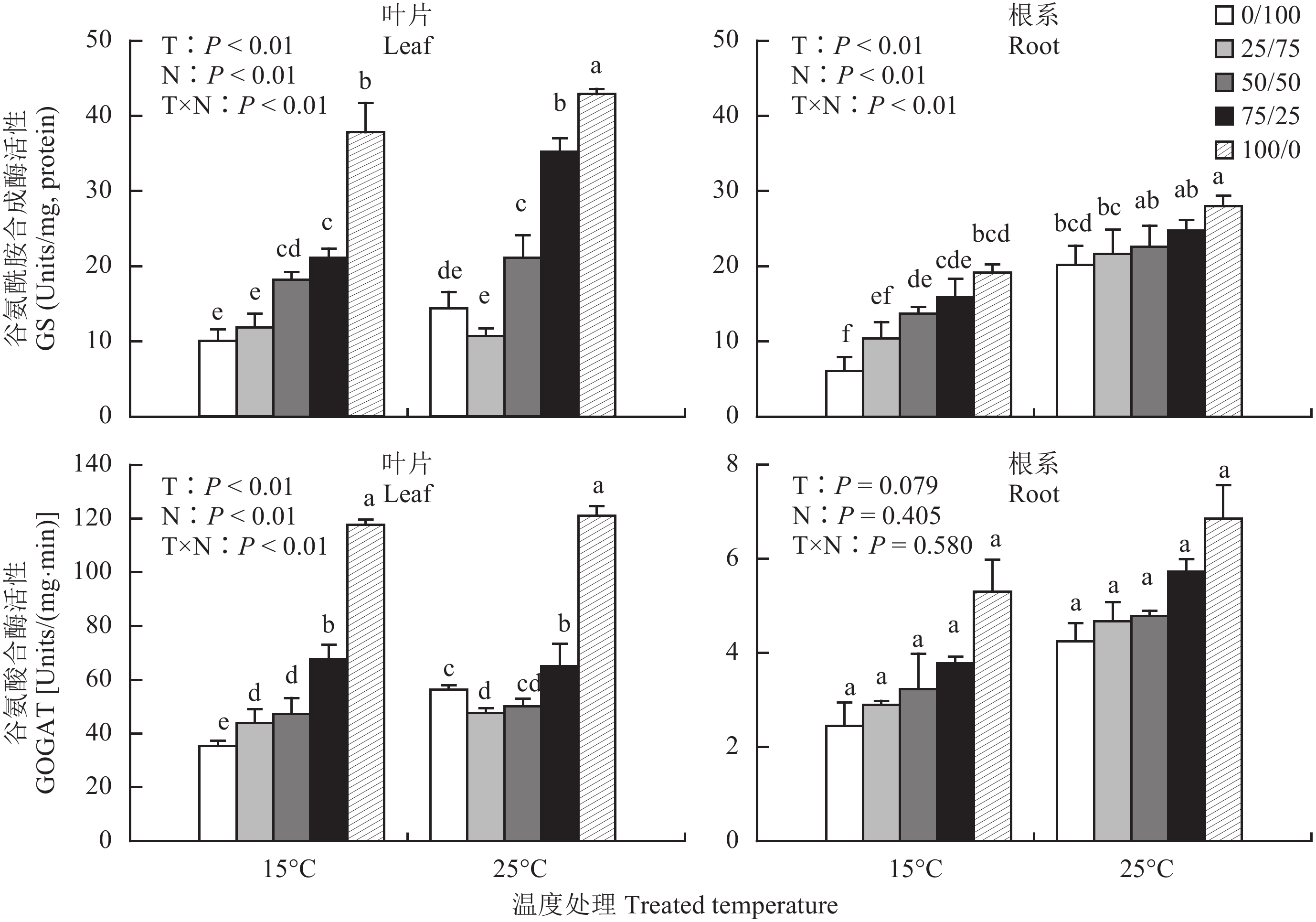
谷氨酰胺合成酶 (GS) 是氮素同化代谢的关键酶。如图 3 所示,相同温度条件下,棉花幼苗叶片和根系中 GS 活性随着营养液中 NH4+-N 比例的增加极显著升高 (P < 0.01),在纯铵营养处理达到最大值。纯铵处理的叶片 GS 活性比纯硝处理在常温和低温时分别提高了 70.7% 和 73.3%;根系 GS 活性分别提高了 27.9% 和 68.3%。随着温度的降低棉苗叶片和根系的 GS 活性极显著降低 (P < 0.01),叶片 GS 活性降低幅度明显大于根系。
对 GOGAT 而言,无论常温还是低温胁迫条件下,棉花幼苗叶片和根系的 GOGAT 活性均随着营养液中 NH4+-N/NO3–-N 比例的增大而明显增强,其中,叶片 GOGAT 活性的增强达极显著水平 (P < 0.01)。15℃ 处理,纯铵营养 (NH4+-N/NO3–-N 比为 100/0) 比 NH4+-N/NO3–-N 比为 75/25、50/50、25/75 和纯硝营养 (NH4+-N/NO3–-N 比为 0/100) 叶片 GOGAT 活性分别增强了 42.4%、59.9%、62.8% 和 70.0%。低温胁迫明显降低了棉花幼苗叶片和根系的 GOGAT 活性,叶片 GOGAT 活性变化差异极显著 (P < 0.01)。
 |
|
图3
不同 NH4+/NO3– 对低温胁迫下棉苗叶片和根系谷氨酰胺合成酶和谷氨酸合酶活性的影响
Fig. 3
Activity of GS and GOGAT of leaves and roots in cotton seedlings affected by different NH4+/NO3– ratios under low-temperature stress
|
线性方程的斜率大小表示了低温胁迫条件下,不同铵硝配比棉花幼苗含氮量对氮素吸收量、硝酸还原酶、谷氨酰胺合成酶及谷氨酸合酶活性的影响程度,斜率绝对值大小顺序为:GOGAT > NR > GS 活性 > 氮素吸收量,说明 GOGAT 活性受棉株含氮量影响最大,氮素吸收量受其影响最小。棉花叶片含氮量与氮素吸收量呈显著的线性负相关关系 (Y = –0.3169X + 1.1055,P < 0.05),而与硝酸还原酶 (Y = 17.11X + 245.36,P < 0.05)、谷氨酰胺合成酶 (Y = 13.86X – 10.328,P < 0.01)、谷氨酸合酶 (Y = 62.92X – 83.022,P < 0.01) 等氮代谢关键酶活性呈显著或极显著正相关关系。
3 讨论与结论不同铵硝配比的氮素营养对于作物氮素吸收和累积有重要影响。曹翠玲等[16]的研究表明,单纯供应硝态氮时,作物幼苗体内氮素转化快,植株氮素累积量最大。章笑赟等[17]发现,营养液增铵处理芥蓝全氮含量显著高于纯硝处理,但不同增铵处理间无显著差异,不同器官含氮量表现为叶 > 根 > 茎;不同器官氮吸收累积量大小为叶 > 茎 > 根。本研究结果表明,常温和低温胁迫条件下,棉花地上部、根系中全氮含量随着营养液中 NH4+-N 比例增加而逐渐递增,且低温处理极显著高于常温处理 (P < 0.01);氮素吸收量先增加后减少,常温处理极显著高于低温胁迫处理 (P < 0.01),低温胁迫抑制了棉株对氮素的吸收,铵硝混合营养可明显减轻低温胁迫对棉苗氮素吸收的抑制作用。相同温度条件下,不同器官中全氮含量为叶 > 根 > 茎,氮素吸收量为叶片 > 茎秆 > 根系,这与前人的研究结果一致[17–18]。而雷玉玲等[18]在莴苣上的试验结果表明,营养液 NH4+-N /NO3–-N 比为 10/90 处理可明显促进莴苣植株的生长,提高其地上部和根系的全氮含量和氮素积累量,增铵 25% 和 50% 则以上指标显著降低。其可能原因是不同种类植物对增铵营养的敏感程度不同导致的差异。
在常温和低温胁迫条件下,随着营养液中 NH4+-N 比例的增加,棉苗叶片、茎秆、叶柄和根系中的硝态氮含量均明显降低,在纯铵营养下达到最低值,其中,叶片和茎秆内硝态氮含量下降达显著水平,且与营养液中硝态氮含量之间呈显著的直线相关,这与汪建飞等[19]在菠菜上的研究结果一致。本研究发现,低温胁迫明显抑制了棉花叶片和茎秆对硝态氮的吸收,这与高青海等[20]在甜瓜幼苗上的研究结果相符。棉株根系中硝态氮含量远远低于地上部分,可能是因为根系吸收的未被还原的硝态氮,由于白天旺盛的蒸腾作用,在蒸腾拉力作用下通过茎秆、叶柄被运输到叶片中去。
硝酸还原酶 (NR) 是一种诱导酶,由外源 NO3– 诱导而产生,同时,作为植物体内 NO3– 转化过程的第一个酶,其活性大小受植物生长介质中硝酸盐的浓度制约,与氮素形态有密切的关系[21]。有研究表明,棉花 NR 活性随着 NH4+-N 浓度的增加而降低[22–23];但也有报道指出,作物在增铵营养条件下,NR 活性比单一硝态氮营养要高[11, 24–25]。本研究表明,在正常温度和低温胁迫条件下,棉苗体内 NR 活性随着营养液中 NH4+-N 比例的增加均明显减小,叶片中 NR 减小达极显著差异;低温胁迫处理使棉苗体内 NR 活性升高。龚士琛[25]的研究中也得出两叶期玉米受低温冷害后,体内 NR 活性显著增加的结论。
张金秋等[26]和高娇等[27]分别在牡丹和玉米幼苗上研究发现,短期的低温可能使得作物体内 GS 和 GOGAT 活性暂时升高,加速氮代谢过程,从而减轻低温胁迫带来的危害,但随着低温持续时间的延长,GS 和 GOGAT 活性逐渐下降,植株的氮代谢活动减缓,进而影响到植物体内其他生理代谢活动,最终导致植物生长速度的变慢。本研究结果表明,低温胁迫下 (30 d 以上) 棉苗叶片和根系的 GS 活性极显著降低。有研究报道指出,随着 NH4+-N 比例增加 GS 活性明显增加[25–26]。郑朝峰[28]研究指出,NH4+-N 和 NO3–-N 均能促进小麦叶片的 Fd-GOGAT (铁氧还蛋白-谷氨酸合酶) 活性,NH4+-N 和 NO3–-N 同时供应时 GOGAT 活性最高,只供应 NO3–-N 或 NH4+-N 处理时较低。本试验结果表明,相同温度条件下,棉花幼苗叶片和根系中 GS 活性随着营养液中 NH4+-N 比例的增加极显著增大,在纯铵营养处理达到最大值;叶片和根系的 GOGAT 活性均随着营养液中 NH4+-N/NO3–-N 比例的增大而明显增强,叶片 GOGAT 活性的增强达极显著水平。不论何种铵硝营养配比,棉苗叶片的 GS 和 GOGAT 活性均比根系为高,这与 Athilde 等[10]的研究结果相同,这可能是由于叶片中的 GS 和 GOGAT 同时参与了无机氨的同化和光呼吸释放氨的再同化。
综上所述,铵硝混合营养 (尤其是 NH4+-N/NO3–-N 为 50/50 处理) 可使棉花幼苗植株内氮代谢趋于协调,棉株生理代谢旺盛,养分吸收能力增强,提高植株对低温胁迫的抗性。同时,良好的氮素代谢状况有利于碳水化合物的形成和干物质积累,从而促进低温下棉花生长发育。
| [1] |
张启明, 赵学强, 陈荣府, 等. 铵态氮/硝态氮对水稻铝毒害的影响[J].
江苏农业学报, 2010, 26(5): 976–981.
Zhang Q M, Zhao X Q, Chen R F, et al. Effect of ammonium nitrogen/nitric nitrogen on Al toxicity in rice[J]. Jiangsu Journal Agricultural Science, 2010, 26(5): 976–981. |
| [2] |
沈丽, 石磊, 王曼, 朴世领. 不同氮素形态对延边烤烟几种关键酶活性的影响[J].
延边大学农学学报, 2011, 33(1): 25–29.
Shen L, Shi L, Wang M, Piao S L. Effect of nitrogen forms on the activities of several key enzymes for flue cured tobacco of Yanbian[J]. Journal of Agricultural Science of Yanbian University, 2011, 33(1): 25–29. |
| [3] |
代建龙, 董合忠, 段留生. 盐分差异分布下不同形态氮素对棉苗生长及主要营养元素吸收的影响[J].
中国农业大学学报, 2012, 17(4): 9–15.
Dai J L, Dong H Z, Duan L S. Effect of different nitrogen forms on seedling growth and main nutrient elements uptake under unequal salt distribution in cotton seedlings[J]. Journal of China Agricultural University, 2012, 17(4): 9–15. |
| [4] | Flores P, Carvajal M, Cerda A, Martinez V. Salinity and ammonium/nitrate interactions on tomato plant development, nutrition, and metabolites[J]. Journal of Plant Nutrition, 2001, 24: 1561–1573. DOI:10.1081/PLN-100106021 |
| [5] | Surya K, Pragya K, Herman L, Simon B. Partial substitution of NO3– by NH4+ fertilization increases ammonium assimilating enzyme activities and reduces the deleterious effects of salinity on the growth of barley [J]. Journal of Plant Physiology, 2007, 164: 303–311. DOI:10.1016/j.jplph.2005.12.011 |
| [6] |
陈斌, 郭爱珍, 韩鹏远. 不同土壤水分条件下不同形态氮素配比对茼蒿生长发育的影响[J].
山西农业科学, 2014, 42(12): 1289–1293.
Chen B, Guo A Z, Han P Y. Effect of nitrogen form ratios on the growing of C. coronarium L. under different soil moisture condition [J]. Journal of Shanxi Agricultural Sciences, 2014, 42(12): 1289–1293. DOI:10.3969/j.issn.1002-2481.2014.12.17 |
| [7] |
李良霞, 李建龙, 王艳, 等. 不同氮源对高温胁迫下高羊茅抗氧化酶活性的影响[J].
贵州农业科学, 2007, 35(6): 11–14.
Li L X, Li J L, Wang Y, et al. Effect of different nitrogen forms on antioxidative enzyme activity in leaves of Festuca arundinacea under heat stress [J]. Guizhou Agricultural Science, 2007, 35(6): 11–14. |
| [8] | Cao W, Tibbitts T W. Study of various NH4+/NO3– mixtures for enhancing growth of potatoes [J]. Journal of Plant Nutrition, 1993, 16(9): 1691–1704. DOI:10.1080/01904169309364643 |
| [9] |
陈鹏, 张茂星, 张明超, 等. 不同氮素营养形态对香蕉生长及其根系质子泵活性的影响[J].
南京农业大学学报, 2015, 38(1): 101–106.
Chen P, Zhang M X, Zhang M C, et al. Influence of nitrate/ammonium ratio on the growth and root plasma membrane H+-ATPase activity of banana [J]. Journal of Nanjing Agricultural University, 2015, 38(1): 101–106. DOI:10.7685/j.issn.1000-2030.2015.01.015 |
| [10] | Athilde O, Krapp A, Francoise D V. Analysis of the NRT2 nitrate transporter family Arabidopsis structure and gene expression [J]. Plant Physiology, 2002, 129: 886–896. DOI:10.1104/pp.005280 |
| [11] | Gashaw L, Mugwira L M. Ammonium-N and nitrate-N effects on growth and mineral compositions of Triticale, wheat and rye[J]. Journal of Agronomy, 1981, 73: 47–51. DOI:10.2134/agronj1981.00021962007300010011x |
| [12] | Hammer P A, Tibbitts T W, Langhans R W. Baseline growth studies of ‘Grand Rapids’ lettuce in controlled environments[J]. Annual Botany, 1989, 63: 643–649. DOI:10.1093/oxfordjournals.aob.a087793 |
| [13] |
鲍士旦. 土壤农化分析(第三版)[M]. 北京: 中国农业出版社, 2002: 264–268.
Bao S D. Soil agrochemistry analysis (3rd edition) [M]. Beijing: China Agriculture Press, 2002: 264–268. |
| [14] |
邹琦主编. 植物生理学实验指导[M]. 北京: 中国农业出版社, 2000.
Zou Q. Plant physiology experiment instruction [M]. Beijing: China Agriculture Press, 2000. |
| [15] | Teixeira. High salinity and drought act on an organ-dependent manner on potato glutamine synthetase expression and accumulation[J]. Enviromental and Experimental Botany, 2007, 60: 121–126. DOI:10.1016/j.envexpbot.2006.09.003 |
| [16] |
曹翠玲, 李生秀. 氮素形态对作物生理特性及生长的影响[J].
华中农业大学学报, 2004, 23(5): 581–586.
Cao C L, Li S X. Effect of N form on crop physiological characteristics and growth[J]. Journal of Huazhong Agricultural University, 2004, 23(5): 581–586. |
| [17] |
章笑赟, 祁百福, 宋世威, 等. 不同铵硝配比对芥蓝伤流液组分及植株氮磷钾积累的影响[J].
中国蔬菜, 2014, (1): 31–36.
Zhang X Y, Qi B F, Song S W, et al. Effects of different ammonium and nitrate ratios on Chinese Kale bleeding sap component and its plant nitrogen, phosphorus and potassium accumulation[J]. China Vegetables, 2014, (1): 31–36. |
| [18] |
雷玉玲, 陈紫妍, 宋世威, 等. 不同铵硝配比对叶用莴苣生长及氮磷钾养分积累的影响[J].
中国蔬菜, 2015, (9): 48–52.
Lei Y L, Chen Z Y, Song S W, et al. Effects of different ammonium and nitrate ratios on lettuce growth and accumulation of plant nitrogen, phosphorus and potassium[J]. China Vegetables, 2015, (9): 48–52. |
| [19] |
汪建飞, 董彩霞, 谢越, 沈其荣. 铵硝比和磷素营养对菠菜生长、氮素吸收和相关酶活性的影响[J].
土壤学报, 2006, 43(6): 954–960.
Wang J F, Dong C X, Xie Y, She Q R. Effects of NH4+/NO3– ratio and phosphorus levels on growth, nitrogen uptake and relevant enzymes activity of spinach [J]. Acta Pedologica Sinica, 2006, 43(6): 954–960. DOI:10.11766/trxb200602280611 |
| [20] |
高青海, 贾双双, 苗永美, 等. 亚低温条件下外源褪黑素对甜瓜幼苗氮代谢及渗透调节物质的影响[J].
应用生态学报, 2016, 27(2): 519–524.
Gao Q H, Jia S S, Miao Y M, et al. Effects of exogenous melatonin on nitrogen metabolism and osmotic adjustment substances of melon seedlings under sub?low temperature[J]. Chinese Journal of Applied Ecology, 2016, 27(2): 519–524. |
| [21] |
董海荣, 李金才, 李存东. 不同NH4+/NO3–比例的氮素营养对棉花氮素代谢的影响
[J].
应用生态学报, 2004, 15(4): 728–730.
Dong H R, Li J C, Li C D. Influence of different NH4+/ NO3– ratios on nitrogen metabolism of cotton [J]. Chinese Journal of Applied Ecology, 2004, 15(4): 728–730. |
| [22] |
董海荣, 李金才, 李存东. 不同形态外源氮素营养对棉花苗期氮素代谢的影响[J].
河北农业大学学报, 2009, 32(3): 17–20.
Dong H R, Li J C, Li C D. Influence of different ratios of NH4+/NO3– on nitrogen metabolism of cotton [J]. Journal of Agricultural University of Hebei, 2009, 32(3): 17–20. |
| [23] | Catarina C N, Helenice M, Nidia M. Levels of nitrogen assimilation in bromeliads with different growth habbit[J]. Journal of Plant Nutrition, 2001, 24(9): 1387–1398. DOI:10.1081/PLN-100106989 |
| [24] | Li B Z, Xin W J, Sun S B, et al. Physiological and molecular responses of nitrogen-starved rice plants to re-supply of different nitrogen sources[J]. Plant and Soil, 2006, 287: 145–159. DOI:10.1007/s11104-006-9051-1 |
| [25] |
龚士琛. 玉米幼苗硝酸还原酶活性受低温的影响[J].
玉米科学, 2003, 11(2): 73–74, 88.
Gong S C. Nitrate reductase activity in maize seedling stage as influenced by low temperature[J]. Journal of Maize Sciences, 2003, 11(2): 73–74, 88. |
| [26] |
张金秋, 张晓玲, 王春华, 等. 牡丹花芽休眠解除进程中碳氮比的变化与低温处理时间的关系[J].
中国农学通报, 2012, 28(2): 231–235.
Zhang J Q, Zhang X L, Wang C H, et al. Correlation analysis between C/N and the amount of chilling treatment during the release of dormant floral buds in Paeonia suffruticosa [J]. Chinese Agricultural Science Bulletin, 2012, 28(2): 231–235. |
| [27] |
高娇, 董志强, 徐田军, 等. 聚糠萘水剂对低温胁迫玉米幼苗氮代谢酶活的调控效应[J].
玉米科学, 2013, 4: 48–54.
Gao J, Dong Z Q, Xu T J, et al. Effects of PASP-KT-NAA on nitrogen metabolism enzyme activities of maize seedlings under low temperature stress[J]. Journal of Maize Sciences, 2013, 4: 48–54. DOI:10.3969/j.issn.1005-0906.2013.03.009 |
| [28] |
郑朝峰. 氮素形态对小麦叶片谷氨酸合成酶的影响[J].
植物生理学通讯, 1986, 4: 46–48.
Zhen C F. Effect of nitrogen forms on glutamate synthase in wheat leaves[J]. Plant Physiology Communications, 1986, 4: 46–48. |
 2017, Vol. 23
2017, Vol. 23  doi:
doi: 

