2. 新疆生产建设兵团特色果蔬栽培生理与种质资源利用重点实验室,新疆石河子 832003
2. Key Laboratory of Special Fruits and Vegetables Cultivation Physiology and Germplasm Resources Utilization of Xinjiang Production and Construction Groups, Shihezi, 832003, China
土壤盐渍化已成为设施生产的主要限制因素和可持续发展的严重障碍。盐胁迫对植物造成的伤害主要表现为离子毒害、渗透胁迫和氧化胁迫。植物获得耐盐能力的重要策略之一就是维持盐胁迫环境下细胞内稳态 (离子和渗透平衡)。Na+、K+、Ca2+、Mg2+ 和 Cl– 是盐胁迫下进行渗透调节的主要无机离子。近年来许多研究报道外源施用 ABA、Ca2+、腐胺、硅和高铁血红素等物质能够显著降低植株叶片或根系 Na+ 和 Cl– 含量,提高 K+/Na+ 和 K+/Cl– 比值,从而维持根部的离子稳态,提高植株的抗盐性[1–6]。
谷胱甘肽 (glutathione,GSH) 是植物体内含量丰富的含巯基的低分子肽,是机体内重要的水溶性抗氧化物质,在抗氧化和对氧化还原 (redox) 敏感的信号传导的调节中起着关键性作用。植物细胞中 GSH 库受到严格的稳态调控,当植物细胞感知调节 redox 平衡的 GSH 库的高度稳态遭到破坏,则积极进行细胞或基因表达的适应性改变。因此,GSH 与植物对各种生物和非生物环境胁迫的耐性密切相关。有研究表明,外源 GSH 处理可以提高植物对低温、盐渍、重金属等逆境胁迫的抗性[7]。我们前期的研究结果亦表明,外源 GSH 通过诱导提高盐胁迫下番茄幼苗叶片的还原库力水平和活性氧清除能力,维持细胞 redox 平衡处于还原状态,有效保护光合系统,促进光系统Ⅱ光化学反应活性, 降低盐胁迫对光合暗反应的抑制,从而缓解盐胁迫对番茄植株的危害,提高其耐盐性[8]。但 GSH 提高番茄耐盐性是否与其对植物在盐害下的离子稳态的维持有关还不太清楚。
因此,本研究以番茄为材料,采用 X 射线电子探针方法研究分别喷施 GSH、BSO(GSH 合成抑制剂) 和 BSO+GSH 对盐 (NaCl) 胁迫下番茄幼苗叶片及根尖选择性吸收离子特别是与植物耐盐性密切相关的 K+、Ca2+、Mg2+ 和 Na+、Cl– 等离子的微域分布和平衡的影响, 以期进一步阐明 GSH 缓解番茄盐胁迫的效应和作用机理,为加速开发利用盐渍土提供科学依据。
1 材料与方法 1.1 试验材料与处理试验于石河子大学农学院试验站进行。以番茄品种‘中蔬四号’为试材,种子催芽后播种于草炭和蛭石体积比为 2∶1 的基质中。在四叶一心期,挑选形态长势整齐一致的番茄幼苗移入带泡沫盖板的 12 L 水桶中,装入 10 L 用去离子水配制的 Hoagland 营养液 (pH = 6.2)。待幼苗长至六叶一心时进行不同处理,其中氯化钠 (NaCl) 于处理时直接加入营养液中,于每日 9:00 叶片喷施 5 mmol/L 谷胱甘肽 (GSH) 和 1 mmol/L GSH 合成抑制剂 (BSO),试验期间全天通气。
试验设置 5 个处理:1) 无 NaCl 胁迫营养液,叶片喷施蒸馏水 (CK);2) NaCl 胁迫营养液,叶面喷施蒸馏水 (NaCl);3) NaCl 胁迫营养液,叶片喷施 GSH (+ GSH);4) NaCl 胁迫营养液,叶片喷施 1 mmol/L BSO (+ BSO);5) NaCl 胁迫营养液,叶片喷湿 GSH 和 BSO (+ BSO + GSH)。
每个处理重复 3 次,每个重复 5 株。处理后 10 d 取样进行根系与叶片离子微域分布的分析测定。
1.2 叶片矿质元素 (离子) 分布的 X-射线能谱微域分析参照施卫明等[9]的方法进行样品处理。在处理后 10 d,各处理每一重复随机选取番茄 1 株,取自生长点倒数第三片功能叶,用锋利的刀片切割叶片主脉基部的部分作叶样,迅速投入液氮 (–196℃) 中冷冻 2~3 min,利用冷冻断裂获取根的横截面,以冷冻真空干燥仪 (HUS-5GB,Hitachi) 干燥 12 h 后,再用离子溅射仪 (E-1010,Hitachi) 喷镀金膜,在扫描电子显微镜 (S-3000N,Hitachi) 上,用能谱仪 (EMAX-250,Hitachi) 分析元素。工作条件:加速电压为 20 kV,束流 40 μA,工作距离 15 cm,光斑大小 400 μm,样品与能谱探头的夹角为 35°,附带表样程序计算机判断各峰值代表的元素种类,并自动计算出峰谱中 K、Na、Mg、Cl、Ca 5 种元素分别占细胞中矿质元素总重量的百分数。按番茄叶片的解剖学结构特点,同一叶片每一微区选取 3 个点分析,分析微区为表皮、木质部、韧皮部、薄壁组织、栅栏组织、海绵组织的细胞 (图 1),每处理 3 次重复。
1.3 根系矿质元素 (离子) 分布的 X-射线能谱微域分析在处理后第 10 d 随机选取各处理的番茄植株 3 株,清洗根系,用双面刀片取距根尖 3~4 cm 的根段,之后方法同叶片的材料处理及测定方法。按番茄根系的解剖学结构特点,分析微区为表皮、外皮层、中皮层、内皮层、中柱的细胞 (图 1),每处理 3 次重复。
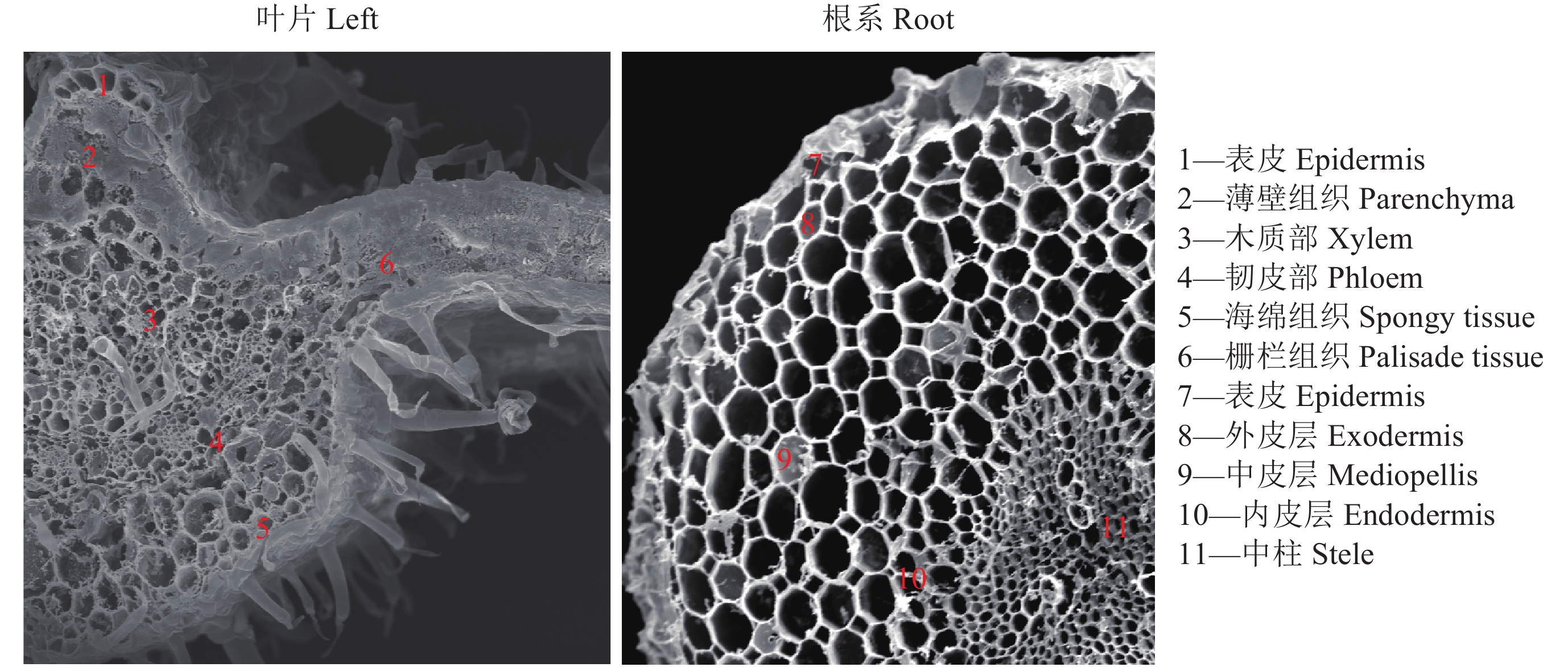 |
| 图1 冷冻真空干燥后番茄不同器官横切面电镜扫描图 Fig. 1 Electron-microscope scanning image of freeze-vacuum-dried cross-section of different organs of tomato |
采用 Microsoft Excel 和 SPSS16.0 对所得数据进行处理和差异显著性检验 (Duncan’s 法)。
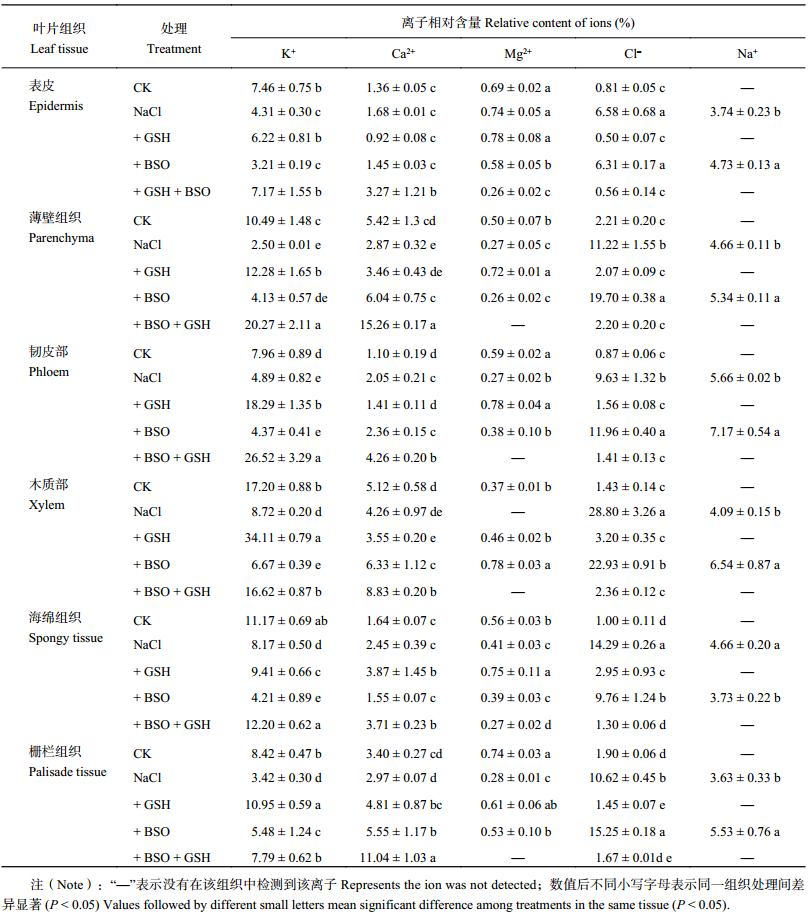
2 结果与分析 2.1 外源 GSH 对 NaCl 胁迫下番茄幼苗叶片细胞中离子相对含量的影响由表 1 可见,对照处理下番茄叶片各组织的细胞中未检测到 Na+。与对照相比,NaCl 胁迫下番茄叶片各组织的细胞中 Na+ 和 Cl– 元素相对含量均显著提高,Cl– 相对含量在表皮、薄壁组织、韧皮部、木质部、海绵组织及栅栏组织中的增幅分别为 716.1%、407.5%、766.7%、190.9%、132.4% 和 458.9%;K+ 相对含量在叶片各组织细胞中均显著降低,降幅分别为 73.1%、320.0%、62.7%、97.1%、36.7% 及 145.8%;Ca2+ 相对含量在薄壁组织显著降低,在韧皮部显著增加,而在其他组织细胞不存在显著差异;Mg2+ 相对含量在木质部未检测到,在表皮不存在显著差异,在薄壁组织、韧皮部、海绵组织和栅栏组织显著降低。
NaCl 胁迫下喷施外源 GSH 使番茄叶片各组织细胞中的 Na+ 相对含量降低至检测限之下,即恢复至对照水平;各组织细胞中 Cl– 相对含量均显著下降,K+ 相对含量均显著升高;Ca2+ 相对含量在海绵组织和栅栏组织中显著增加,在韧皮部中显著降低。在其他组织中差异均不显著;Mg2+ 相对含量除在表皮中不存在显著差异外,在其他组织中均显著增加。
外源喷施 BSO 使 NaCl 胁迫下番茄叶片 Na+ 相对含量除在海绵组织中显著降低 24.8% 外,在其他组织中均显著提高;Cl– 相对含量在薄壁组织、韧皮部和栅栏组织中显著提高,在木质部、海绵组织中显著降低,在表皮中有所降低但不存在显著差异;K+ 相对含量在栅栏组织中显著提高,木质部和海绵组织中显著降低,而在表皮、韧皮部和薄壁组织中无显著差异;Ca2+ 相对含量在薄壁组织、木质部及栅栏组织中均显著提高,在表皮、海绵组织和韧皮部中不存在差异;Mg2+ 相对含量在木质部、栅栏组织细胞中显著增高,在表皮中显著降低,在其它组织中不存在显著差异。
与 + BSO 处理相比,+ BSO + GSH 处理下番茄叶片各组织细胞中均未检测出 Na+;Cl– 相对含量在各组织细胞中均显著降低;K+ 和 Ca2+ 相对含量在各组织中均显著提高;在表皮、海绵组织中 Mg2+ 相对含量显著降低。在薄壁组织、韧皮部、木质部和栅栏组织中未检测到 Mg2+。
| 表1 不同处理番茄幼苗叶片不同组织细胞中离子相对含量 Table 1 Relative content of ions in leaf tissues of tomato seedlings under different treatments |
 |
由表 2 可见,因对照叶片各组织中 Na+ 相对含量在检测限以下, 因此对照中未计算 K+/Na+ 和 Ca2+/Na+。与对照相比,NaCl 胁迫下番茄叶片细胞中 K+、Ca2+ 与 Na+ 和 Cl– 之间的平衡发生了显著改变。番茄叶片在各组织细胞中 K+/Na+ 和 Ca2+/Na+ 呈降低趋势。K+/Cl– 和 Ca2+/Cl– 亦均显著降低。
喷施 GSH 处理使 NaCl 胁迫下番茄叶片各组织中 Na+ 相对含量降至检出限以下,且显著增加各组织细胞中 K+/Cl– 和 Ca2+/Cl– 比值;喷施 BSO 处理使 NaCl 胁迫下番茄叶片表皮、薄壁组织和木质部细胞中 K+/Na+ 比值、表皮组织细胞中 Ca2+/Na+ 显著降低,对韧皮部、海绵组织和栅栏组织中 K+/Na+ 比值无显著影响。对各组织细胞中 K+/Cl– 和 Ca2+/Cl– 亦无显著影响。
+ BSO + GSH 处理的番茄叶片各组织细胞中 Na+ 相对含量降至检出限以下;与+BSO 处理相比,K+/Cl– 和 Ca2+/Cl– 均显著增加。
| 表2 不同处理番茄幼苗叶片不同组织细胞中离子相对含量比值 Table 2 Ratio of ion relative contents in cells of leaf tissues of tomato seedlings under different treatments |
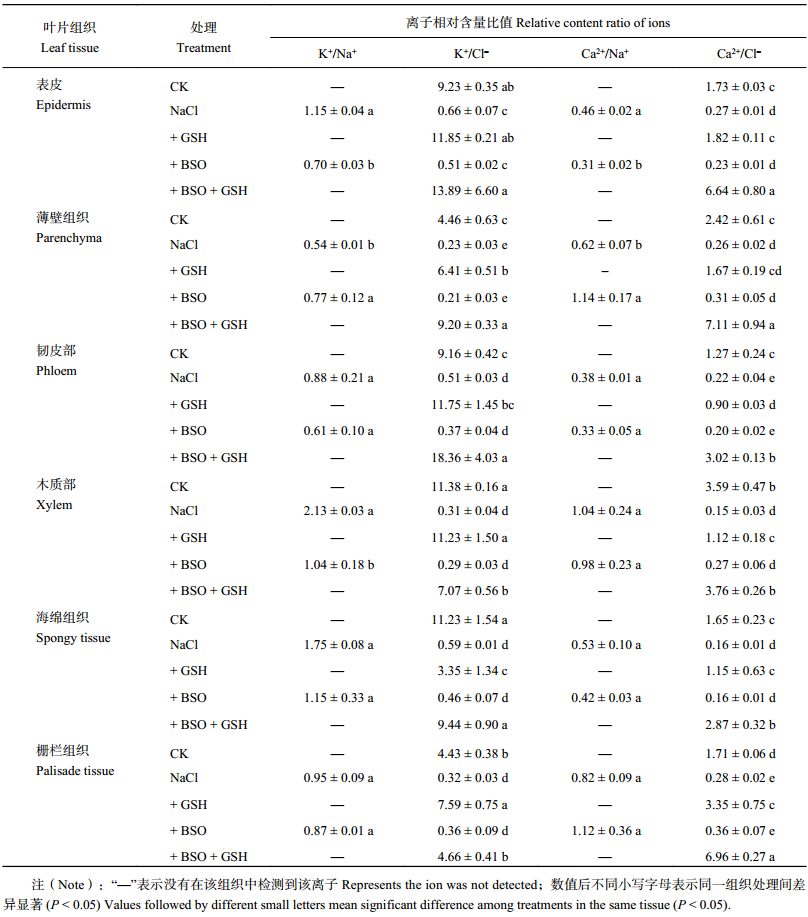 |
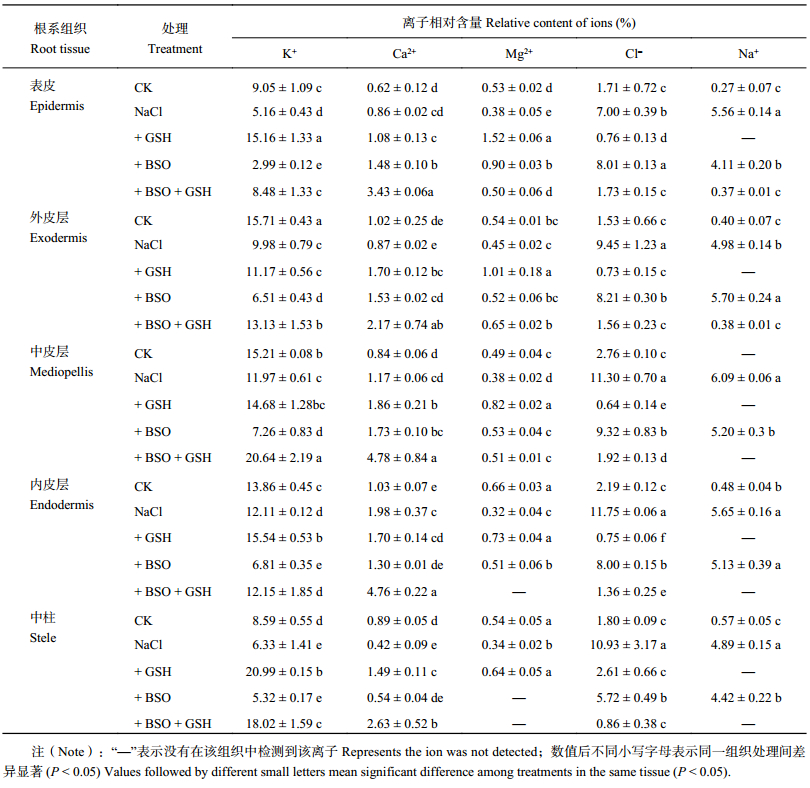
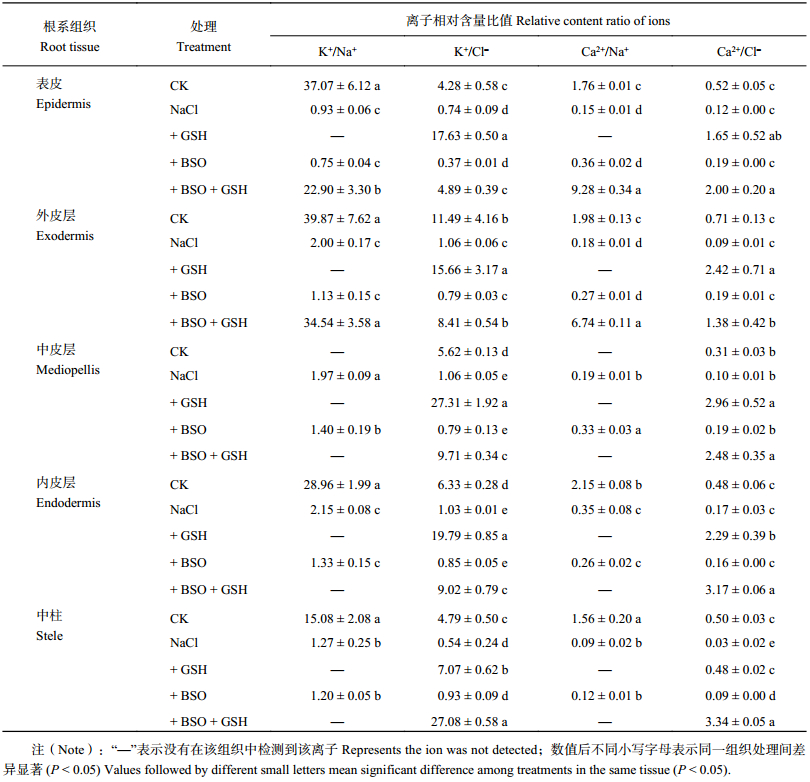
表 3 是根据不同处理下根尖各组织细胞的分析图谱计算出的各离子相对含量百分数 (不同处理下番茄幼苗根尖组织细胞的 X 射线电子探针点分析图谱略)。与对照相比,NaCl 胁迫下番茄根系在表皮、外皮层、中皮层、内皮层和中柱细胞中 Na+ 和 Cl– 相对含量均显著提高,Na+ 相对含量增幅范围在 753.5%~1908.4%,其中以表皮增幅最大,中柱增幅最小。Cl– 在外表皮和中柱增幅较大,分别达到 518.8% 和 508.5%,表皮增幅最小,为 309.7%;NaCl 胁迫下番茄根系各组织的细胞中 K+ 相对含量均较对照显著降低;Ca2+ 相对含量在内皮层显著增加,在中柱显著降低,在其他组织无显著差异;Mg2+ 相对含量除外表皮无显著差异外,在其他组织中均显著降低。
喷施外源 GSH 使 NaCl 胁迫下的番茄根系各组织中的 Na+ 的相对含量均降至检出限以下;Cl– 的相对含量在各组织中均显著降低,较对照分别降低了 826.0%、1188.2%、1665.1%、1466.2% 及 318.4%;K+ 的相对含量在表皮、内皮层和中柱组织细胞中显著增加;Ca2+ 的相对含量在外皮层、中皮层和中柱细胞中显著增加,在内皮层和表皮细胞不存在显著差异;Mg2+ 的相对含量在根系各组织中均显著增加。显然,喷施外源 GSH 显著降低了对番茄根系细胞有毒害作用的离子相对含量,改善了盐胁迫下根系中离子的微域分布。
外源喷施 BSO 使 NaCl 胁迫下番茄根系各组织中的 Na+ 相对含量除在外表皮显著升高 14.5% 外,在表皮、中皮层和中柱中均显著降低,在内皮层中不存在显著变化;Cl– 相对含量除在表皮中显著升高 14.4% 外,在其他组织细胞中均显著降低;K+ 相对含量除在中柱中无显著差异外,在表皮、外皮层、中皮层和内皮层中均显著降低;Ca2+ 相对含量在中皮层和中柱中无显著变化,在表皮及外皮层中显著增加,在内皮层中显著降低;Mg2+ 相对含量在表皮、中皮层和内皮层组织细胞中均显著增加,在外皮层不存在显著差异,在中柱细胞中降至检出限以下。
与 + BSO 处理相比,+ BSO + GSH 处理下番茄根系表皮及外皮层细胞中的 Na+ 相对含量显著降低,降幅分别为 1011.7%、1400.0%,在中皮层、内皮层和中柱组织中降至检出限以下;Cl– 相对含量在各组织细胞中均显著降低;各组织细胞中 K+ 和 Ca2+ 相对含量均显著增加;Mg2+ 相对含量在表皮、内皮层中显著降低,在其它组织细胞中不存在显著变化。
| 表3 不同处理番茄幼苗根系组织细胞中离子相对含量 Table 3 Relative content of ions in root tissues of tomato seedlings under different treatments |
 |
由表 4 可以看出,与对照相比,NaCl 胁迫下番茄根系各组织细胞中 K+、Ca2+ 与 Na+、Cl– 之间的平衡发生了改变。NaCl 胁迫下番茄根系表皮、外皮层、内皮层和中柱细胞中 K+/Na+ 和 Ca2+/Na+ 均显著降低;K+/Cl– 在各组织细胞中均显著降低;Ca2+/Cl– 比值除在中柱细胞中显著降低外,在其他组织细胞中均不存在显著差异。
与 NaCl 相比,NaCl 胁迫下喷施外源 GSH 使番茄根系各组织细胞中的 Na+ 相对含量降至检出限以下,且显著增加 K+/Cl– 和 Ca2+/Cl– 比值,这与在番茄叶片上表现相同。
喷施外源 BSO 处理使 NaCl 胁迫下番茄根系中皮层细胞中 K+/Na+ 比值显著降低、Ca2+/Na+ 显著提高,但对其他组织细胞中的 K+/Na+ 和 Ca2+/Na+ 比值无显著影响;喷施外源 BSO 处理对番茄根系各组织细胞中 K+/Cl– 比值亦无显著影响,显著提高中柱细胞中 Ca2+/Cl–,但对其他组织细胞中该比值无显著影响。
与 + BSO 处理相比,+ BSO + GSH 处理的番茄根系表皮、外皮层中 K+/Na+ 和 Ca2+/Na+ 比值显著增加。各组织细胞中 K+/Cl 和 Ca2+/Cl– 比值均显著提高。
| 表4 不同处理番茄幼苗根系不同组织细胞中离子相对含量比值 Table 4 Ratio of ion relative contents in root tissue cells of tomato seedlings under different treatments |
 |
盐分对植物的危害主要取决于盐分离子浓度、分布及植物的耐盐性,盐分对植物毒害的机制之一是植物体内过多的盐分离子对植物产生的离子毒害效应。盐胁迫下,Na+ 和 Cl– 等有害离子大量进入植株体内,破坏离子和水分平衡,最终对植株生长造成伤害[10–11]。盐胁迫下一些植物根系和叶片等部位产生的“盐斑”是盐分在体内分布不均匀从而使植物受伤害的外在表现。植物往往通过根的选择性吸收限制 Na+ 进入,促进 Na+ 外排及区隔化,维持离子平衡,降低盐害影响[12–13]。K+、Ca2+ 和 Mg2+ 等离子对提高植物的耐盐性起着非常重要的作用[14–16]。所以控制植物对离子的选择性吸收和区隔化对植物在逆境下的正常生长有至关重要的作用[17]。
本试验的 X 射线电子探针 (EDX) 技术分析结果表明,NaCl 胁迫下的番茄叶片和根系所有组织的细胞中 Na+ 和 Cl– 相对含量均较对照显著提高,同时 K+ 相对含量降低,K+/Na+、Ca2+/Na+、K+/Cl– 比值均呈降低趋势。说明 NaCl 胁迫使细胞中的离子稳态受到严重破坏,Na+ 和 Cl– 有害离子的积累及其胞内离子平衡的严重失调是造成番茄幼苗伤害的重要原因。而 NaCl 胁迫下喷施外源 GSH 可明显降低番茄叶片和根系各个组织细胞中 Cl– 相对含量,Na+ 相对含量均降低到检测限之下,恢复至对照水平。K+、Ca2+ 和 Mg2+ 的相对含量的变化表现出器官和组织差异性,但总体表现为在根系和叶片组织细胞中提高,且 K+/Na+、Ca2+/Na+、K+/Cl– 比值均显著提高。说明喷施外源 GSH 抑制了盐胁迫下番茄对 Na+ 的吸收,显著降低了对番茄根系细胞有毒害作用的离子相对含量,改善了盐胁迫下根系中离子的微域分布,从而缓解了盐胁迫对番茄的毒害作用,提高了番茄的耐盐性。这一发现为 GSH 提高盐胁迫番茄体内 K+、Ca2+ 和 Mg2+ 浓度,降低 Na+ 和 Cl– 浓度,进而提高番茄的耐盐性提供了直接的证据。Liang[18]研究认为,盐胁迫下硅对根系 H+-ATPase 活性的提高可能是硅提高钾、钠选择性比率的原因。我们前期的研究亦表明外源 GSH 介导高的还原库力和活性氧清除能力,有效缓解了盐胁迫导致的膜脂过氧化程度,维持了膜的完整性和正常功能[19]。Chen 等[20]研究认为耐盐大麦根系质膜的 Na+、K+ 转运体控制盐胁迫后的 K+/Na+ 平衡。因此,外源 GSH 通过何种途径调控盐胁迫下番茄幼苗叶片及根尖选择性吸收离子来提高耐盐性的作用机制还有待进一步研究。
BSO 是谷胱甘肽合成抑制剂。金晓芬[21]研究认为,外源 BSO 处理使 Pb 胁迫下东南景天 GSH 含量降低,因此叶片受害加剧。本试验中,喷施外源 BSO 使 NaCl 胁迫下番茄叶片表皮、薄壁组织和木质部细胞中 K+/Na+ 比值、表皮细胞中 Ca2+/Na+ 显著降低,使番茄根系皮层细胞中 K+/Na+ 比值显著降低、Ca2+/Na+ 和 Ca2+/Cl– 显著提高。Chen 等[20]认为维持细胞的 K+/Na+ 平衡是植物耐盐性的关键因素。而细胞内 Ca2+ 作为第二信使、代谢调节因子和膜稳定剂参与细胞膜生物电和胞内生化过程,在细胞正常机能活动和抗逆调控中起重要作用。本试验结果说明外源 BSO 施用进一步加剧了离子失衡,从而导致 NaCl 胁迫对番茄的伤害加剧,而 NaCl 胁迫下番茄叶片和根系 Ca2+ 相对含量的提高,可能是逆境下植物的一种适应性反应,这有待进一步研究。而盐胁迫下喷施外源 BSO 后再喷施 GSH 使番茄叶片各组织细胞及根系中皮层、内皮层和中柱组织细胞均未检测出 Na+,恢复至对照水平,根系和叶片各组织中 Cl– 相对含量显著降低,K+ 和 Ca2+ 相对含量及 K+/Na+、Ca2+/Na+、K+/Cl–、Ca2+/Cl– 显著提高,进一步证明了外源 GSH 在降低有毒害作用的离子吸收、改善盐胁迫下离子微域分布和维持离子平衡上发挥重要作用,这是 GSH 提高番茄耐盐性和减轻番茄盐害的重要机制之一。
综上所述,外源喷施 GSH 通过抑制盐胁迫番茄对 Na+ 的吸收,显著降低对番茄叶片和根系细胞有毒害作用的离子吸收,改善盐胁迫下根系中离子的微域分布和维持离子平衡,从而缓解了盐胁迫对番茄的毒害作用,提高了番茄的耐盐性。
| [1] |
郭小俊, 谢成俊. 外源ABA对NaCl胁迫下黄瓜幼苗不同离子含量的影响[J].
中国蔬菜, 2008, (9): 27–30.
Guo X J, Xie C J. Effect of exogenous ABA on ionic contents of cucumber seedling under NaCl stress[J]. China Vegetables, 2008, (9): 27–30. |
| [2] |
闫永庆, 袁晓婷, 刘威, 等. 盐胁迫及外源Ca2+对白刺离子吸收、运输的影响
[J].
东北农业大学学报, 2014, 45(3): 71–78.
Yan Y Q, Yuan X T, Liu W, et al. Effects of salt stress and exogenous Ca2+ on ion absorption and transportation of Nitraria [J]. Journal of Northeast Agricultural University, 2014, 45(3): 71–78. |
| [3] |
束胜, 孙锦, 郭世荣, 等. 外源腐胺对盐胁迫下黄瓜幼苗叶片PSⅡ光化学特性和体内离子分布的影响[J].
园艺学报, 2010, 37(7): 1065–1072.
Su S, Sun J, Guo S R, et al. Effects of exogenous putrescine on PSⅡ photochemistry and ion distribution of cucumber seedlings under salt stress[J]. Acta Horticulturae Sinica, 2010, 37(7): 1065–1072. |
| [4] |
李青云, 葛会波, 胡淑明, 等. 盐胁迫下外源钙对草莓内源激素含量的影响[J].
西北植物学报, 2008, 28(3): 540–545.
Li Q Y, Ge H B, Hu S M, et al. Effects of exogenous calcium on endogenous hormone of strawberry seedling under NaCl stress[J]. Acta Botanica Boreali-occidentalia Sinica, 2008, 28(3): 540–545. |
| [5] |
雷玉娟. 外源硅对盐胁迫下赤霞珠葡萄幼苗的影响[D]. 陕西杨凌: 西北农林科技大学硕士学位论文, 2008.
Lei Y J. The influence of silicon on cabernet sauvignon seedling under salt stress [D]. Yangling, Shaanxi: MS Thesis of Northwest A&F University, 2008. |
| [6] |
胡冰, 贺子义, 林国庆, 等. 高铁血红素对盐胁迫下小麦根部生长受抑的缓解和根尖中离子微域分布的影响[J].
植物生理学通讯, 2008, 44(5): 865–868.
Hu B, He Z Y, Lin G Q, et al. Effects of hematin on mitigation of growth inhibition and ion micro-distribution of wheat roots under salt stress[J]. Plant Physiology Communications, 2008, 44(5): 865–868. |
| [7] |
刘传平, 郑爱珍, 田娜, 等. 外源GSH对青菜和大白菜镉毒害的缓解作用[J].
南京农业大学学报, 2004, 27(4): 26–30.
Liu C P, Zheng A Z, Tian N, et al. Alleviation of glutathione on cadmium toxicity of Brassicachinensis L. and Brassica pekinensis Rupr [J]. Journal of Nanjing Agricultural University, 2004, 27(4): 26–30. |
| [8] |
刘会芳, 何晓玲, 肖春燕, 等. 外源GSH对NaCl胁迫下番茄幼苗光合特性及碳同化关键酶基因表达的影响[J].
应用生态学报, 2014, 25(9): 2637–2644.
Liu H F, He X L, Xiao C Y, et al. Effects of exogenous GSH on photosynthetic characteristics and expression of key enzyme genes of CO2 assimilation in leaves of tomato seedlings under NaCl stress [J]. Chinese Journal of Applied Ecology, 2014, 25(9): 2637–2644. |
| [9] |
施卫明, 徐梦熊, 刘芷宇. 土壤–植物根系微区养分状况的研究—Ⅳ. 电子探针制样方法的比较及其应用[J].
土壤学报, 1987, 24(3): 286–290.
Shi W M, Xu M X, Liu Z Y. The nutrient status of soil-root interface—Ⅳ. Study on sample preparation procedure for electron microprobe and its application[J]. Acta Pedologica Sinica, 1987, 24(3): 286–290. |
| [10] | Munns R, Termaat A. Whole-plant responses to salinity[J]. Australian Journal of Plant Physiology, 1986, 13(1): 143–160. DOI:10.1071/PP9860143 |
| [11] | Yeo A R, Flowers T J. Salinity resistance rice (Oryza sativa L.) and a pyramiding approach to breeding varieties for saline soils [J]. Australian Journal of Plant Physiology, 1986, 13(1): 161–173. DOI:10.1071/PP9860161 |
| [12] | Parida A K, Das A B. Salt tolerance and salinity effects on plants: a review[J]. Ecotoxicology and Environmental Safety, 2005, 60(3): 324–349. DOI:10.1016/j.ecoenv.2004.06.010 |
| [13] | Munns R, Tester M. Mechanisms of salinity tolerance[J]. Annual Review of Plant Biology, 2008, 59(1): 651–681. DOI:10.1146/annurev.arplant.59.032607.092911 |
| [14] |
郑青松, 刘兆普, 刘友良, 等. 等渗的盐分和水分胁迫对芦荟幼苗生长和离子分布的效应[J].
植物生态学报, 2004, 28(6): 823–827.
Zhen Q S, Liu Z P, Liu Y L, et al. Effects of iso osmotic salt and water stresses on growth and ionic distribution in Aloe seedlings[J]. Acta Phytoecologica Sinica, 2004, 28(6): 823–827. DOI:10.17521/cjpe.2004.0107 |
| [15] | Shabala S, Demidchik V, Shabala L, et al. Extracellular Ca2+ ameliorates NaCl-induced K+ loss from arabidopsis root and leaf cells by controlling plasma membrane K+-permeable channels [J]. American Society of Plant Biologists, 2006, 141(4): 1653–1665. |
| [16] | Kopittke P M. Interactions between Ca, Mg, Na and K: alleviation of toxicity in saline solutions[J]. Plant and Soil, 2012, 352(1): 353–362. |
| [17] | Flowers T J, Colmer T D. Salinity tolerance in halophytes[J]. New Phytologist, 2008, 179(4): 945–963. DOI:10.1111/nph.2008.179.issue-4 |
| [18] | Liang Y C. Effects of silicon on enzyme activity, and sodium, potassium and calcium concentration in barley under salt stress[J]. Plant and Soil, 1999, 209(2): 217–224. DOI:10.1023/A:1004526604913 |
| [19] |
何晓玲. 外源硒对NaCl胁迫下加工番茄幼苗光合碳同化的影响[D]. 新疆石河子: 石河子大学硕士学位论文, 2015.
He X L. Effect of exogenous Se on photosynthetic carbon assimilation in tomato seedlings under NaCl stress [D]. Shihezi, Xinjiang: MS Thesis of Shihezi University, 2015. |
| [20] | Chen Z, Pottosin I, Cuin T, et al. Root plasma membrane transporters controlling K+/Na+ homeostasis in salt stressed barley [J]. Plant Physiology, 2007, 145(4): 1714–1725. DOI:10.1104/pp.107.110262 |
| [21] |
金晓芬. 镉超积累植物东南景天谷胱甘肽代谢特征及比较蛋白质组学研究[D]. 杭州: 浙江大学博士学位论文, 2008.
Jing X F. Glutathione metabolisms in cadmium hyperaccumulator Sedum alfredii Hance and its proteomics analysis[D]. Hangzhou: PhD Dissertation of Zhejiang University, 2008. |
 2017, Vol. 23
2017, Vol. 23  doi:
doi: 

