2. 山西师范大学生命科学学院,山西临汾 041000;
3. 沈阳农业大学土地与环境学院,辽宁沈阳 110866
2. College of Life Science, Shanxi Normal University, Linfen, Shanxi 041000, China;
3. College of Land and Environmental Sciences, Shenyang Agricultural University, Shenyang 110866, China
水分在植物各器官中的运输与分布在植物生长发育过程中发挥着重要的作用。非生物胁迫如干旱、盐害等会导致植物失水,严重限制了植物的生长和产量[1]。在干旱和高盐胁迫下,水分的高效率运输是维持植物正常生长的重要条件[2–4]。植物体内的水分运输通常是通过质外体和共质体途径调控完成的[1]。在非生物胁迫下,植物体通过共质体途径高效快速地调节水分的跨膜运输[5–7],而共质体途径主要是由水通道蛋白调控的[8]。
根据基因结构及其分布特征将水通道蛋白分为 4 类:质膜内在蛋白 (PIPs)、液泡膜内在蛋白 (TIPs)、NOD26-like 内在蛋白 (NIPs) 及小分子内在蛋白 (SIPs),其中对质膜内在蛋白及液泡膜内在蛋白研究较多[9–10]。非生物胁迫下,水通道蛋白通过调控植物多种生物过程,包括水分运输、细胞伸长与分化、气孔开闭、渗透调节等[11–12]有效提高植物的抗逆性。TaAQP8 的过表达能够促进盐胁迫下根的伸长[13]。NtAQP1 能够提高盐胁迫下烟草的水分利用效率、渗透系数和产量[14]。盐胁迫下,OsPIP1;1 的过表达大大提高了水稻根的导水性,进而增强抗盐性[15]。同样,TdPIP1 基因在烟草中的过表达促进了根的生长,增大了叶片面积,提高了烟草的抗逆性[16]。TIPs 参与细胞质和液泡之间的水分交换,降低细胞质的渗透波动[17]。Beebo 等研究结果表明敲除 AtTIP1;1 的拟南芥虽能正常生长,但其对渗透胁迫敏感[18]。
小盐芥是一种生长于滨海盐渍土上的典型盐生植物,具有极强的耐盐能力。本研究从小盐芥中克隆了水通道蛋白质膜内在蛋白 TsPIP1;1 基因及液泡膜内在蛋白 TsTIP1;1 基因,并分别构建到植物表达载体转化水稻,通过盐胁迫处理转基因水稻,明确小盐芥水通道蛋白基因 TsPIP1;1 及 TsTIP1;1 参与转基因水稻的光合作用参数及渗透调节的生理应答效果。
1 材料与方法 1.1 供试材料采用 RT-PCR 基因克隆技术获得小盐芥 TsPIP1;1 与 TsTIP1;1 完整 cDNA 序列,命名 TsPIP1;1 (accession No: JX133234.1) 与 TsTIP1;1 基因 (accession No: JX133236),将其分别构建植物表达载体 pCAMBIA 1304 与 pCAMBIA 1307,并转化水稻,经连续 3 年检测获得稳定遗传的 T3 转 TsPIP1;1 基因水稻与转 TsTIP1;1 基因水稻。
水稻品种:野生型日本 Kitaake 水稻;T3 代转 TsPIP1;1 基因水稻株系 19 与转 TsTIP1;1 基因水稻株系 5 和 7。
1.2 试验设计水培盐胁迫试验于 2016 年 8 月在中国农业科学院农业资源与农业区划研究所温室进行,白天室内温度为 25~35℃,光合有效辐射为 1000~1600 μmol/(m2·s) 左右。
将水稻种子放入装有蒸馏水的培养皿中,于 30℃ 的培养箱恒温培养发芽,3 天后将已经发芽的水稻幼苗,移栽于长 40 cm、宽 25 cm、高 20 cm 的水培箱中,幼苗在 1/2 Hoagland 营养液中正常培养,pH 值为 5.5 ± 0.5,3 d 更换一次营养液,培养 14 d 后,以正常 Hoagland 营养液为基础,分别进行 0、100、200 mmol/L NaCl 胁迫处理,处理一周后分别测定正常和盐胁迫下水稻的光合参数、株高及生物量、相对含水量及失水率、渗透势、Na+ 和 K+ 含量。
1.2.1 光合参数的测定 在水稻盐处理后的第 7 天的 9:00~11:30 时间段内,使用便携式光合测定仪 Li-6400XT 分别测定各处理水稻顶部的第一片完全展开叶的净光合速率 (Pn)、气孔导度 (Gs)、蒸腾作用 (Tr) 和胞间 CO2 浓度 (Ci)。水分利用效率 (WUE) 是 Pn 与 Tr 的比值。测定时的光量子密度为 1200 μmol/(m2·s),参比室 CO2 浓度为 (400 ± 10) μmol/mol,每个处理测定 3 株。
1.2.2 相对含水量及失水率的测定 将水培盐处理水稻取样后,立即称得鲜重 (mf) 后,将其置于清水中,过夜,使叶片充分吸水达到饱和状态,取出叶片,称重 (ms),将水稻放置于室内,使其自然脱水,每隔 1 小时对其进行称重 (m1,m2,……,mn)。处理 7 小时后重量不再改变后,将水稻放入 80℃ 烘箱中烘干至恒重 (md)。相对含水量为 (mf – md)/(ms – md) × 100%,脱水 1 小时的失水率为 (ms – mn)/ms × 100%,以此类推,以脱水时间为横坐标,失水率为纵坐标观察野生型与各转基因株系的失水情况。
1.2.3 渗透势的测定 将水培样品取样后迅速放入–80℃ 超低温冰箱中,冷冻 3 小时后,将样品剪碎,放入注射器中,将细胞液挤压出存于 2 mL EP 管中,使用 Wescor 5520 露点渗透压仪测定水稻组织渗透势。
1.2.4 钠、钾含量的测定 将样品的地上部与根分开,105℃ 杀青 30 min 后,80℃ 恒温烘干至恒重,用震荡粉碎机充分粉碎后,过 1 mm 筛备用。称取 0.2 g 样品,用 H2SO4–H2O2 消煮,火焰光度计测定钠、钾含量。
1.3 数据分析采用 Microsoft Excel 2007 和 SPSS 软件进行试验数据的处理及相关分析,用 LSD 法即最小显著差数法对不同处理的结果进行显著性检验。
2 结果与分析 2.1 盐胁迫对水稻生长状况的影响野生型与转基因水稻的株高及生物量在盐胁迫下显著降低,随着 NaCl 浓度的增加,下降的幅度也显著增加,并且野生型下降的程度大于转基因水稻。由表 1 看出,正常条件下转基因水稻的株高、单株鲜重与单株干重与野生型并没有显著差异。在 100 mmol/L NaCl 处理下,TsTIP-5、TsTIP-7 和 TsPIP-19 株系的株高、单株鲜重与干重都高于野生型,但 TsPIP-19 株系与野生型没有显著差异。在 200 mmol/L NaCl 处理下,TsTIP-5、TsTIP-7 及 TsPIP-19 的株高比野生型分别高出 8.2%、11.6%、4.9%;单株鲜重比野生型分别高出 17.1%、19.1%、13.9%;单株干重比野生型分别高出 17.9%、23.9%、16.9%。盐胁迫条件下,转基因水稻特别是转 TsTIP;1 水稻较野生型的生长速率更快,从而使株高和单株鲜干重都显著地高于野生型。
| 表1 野生型与转基因水稻在不同盐处理下的株高、鲜重和干重 Table 1 Shoot height, plant fresh and dry weight of the wild type and transgenic rice lines under different salt treatments |
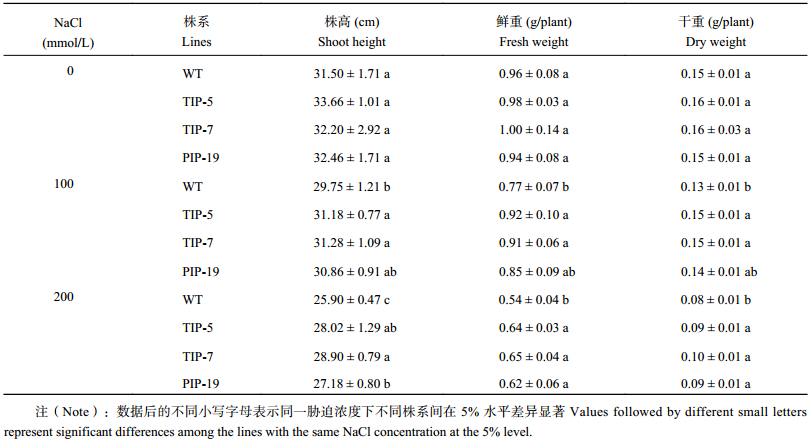 |
正常条件下,转基因水稻地上部及根中的 Na+、K+ 含量及 Na+/K+ 比与野生型并没有显著性的差异。盐胁迫显著增加了野生型与转基因水稻的地上部及根中 Na+ 含量及 Na+/K+ 比,降低了 K+ 含量,并且野生型变化程度大于转基因水稻。在 100 mmol/L NaCl 处理下,与野生型相比,TsTIP-5、TsTIP-7 及 TsPIP-19 的地上部 Na+ 含量分别降低了 10.8%、8.8%、9.9%,K+ 含量分别提高了 6.1%、6.8%、7.1%,Na+/K+ 比分别降低了 15.88%、14.53%、15.79%。在 100 mmol/L NaCl 处理下,TsTIP-5、TsTIP-7 及 TsPIP-19 的根部 Na+ 含量比野生型分别降低了 8.8%、8.7%、15.4%,K+ 含量比野生型分别提高了 26.6%、27.2%、26.9%,Na+/K+ 比分别比野生型降低了 27.9%、28.2%、33.2% (表 2)。200 mmol/L NaCl 处理下,转基因水稻中钠和钾含量的变化表现出相似的变化规律,地上部 Na+/K+ 比分别降低 24.3%、24.4%、24.8%;根 Na+/K+ 比分别降低 29.6%、27.5%、32.4%。盐胁迫下转基因水稻通过降低体内 Na+ 的含量并积累更多的 K+ 维持植物体内的离子平衡,减轻 Na+ 对植物体的毒害作用,并降低转基因水稻的 Na+/K+ 比,增强了转基因水稻的耐盐胁迫的能力。
| 表2 野生型与转基因水稻在不同盐胁迫下的 Na+、K+ 含量及 Na+/K+ 比 Table 2 Contents of Na+ and K+ and Na+/K+ ratio in the wild types and transgenic rice lines under different salt treatments |
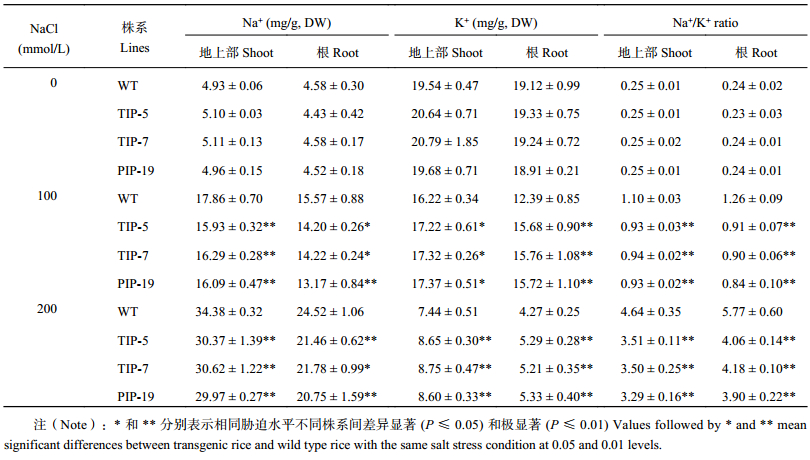 |
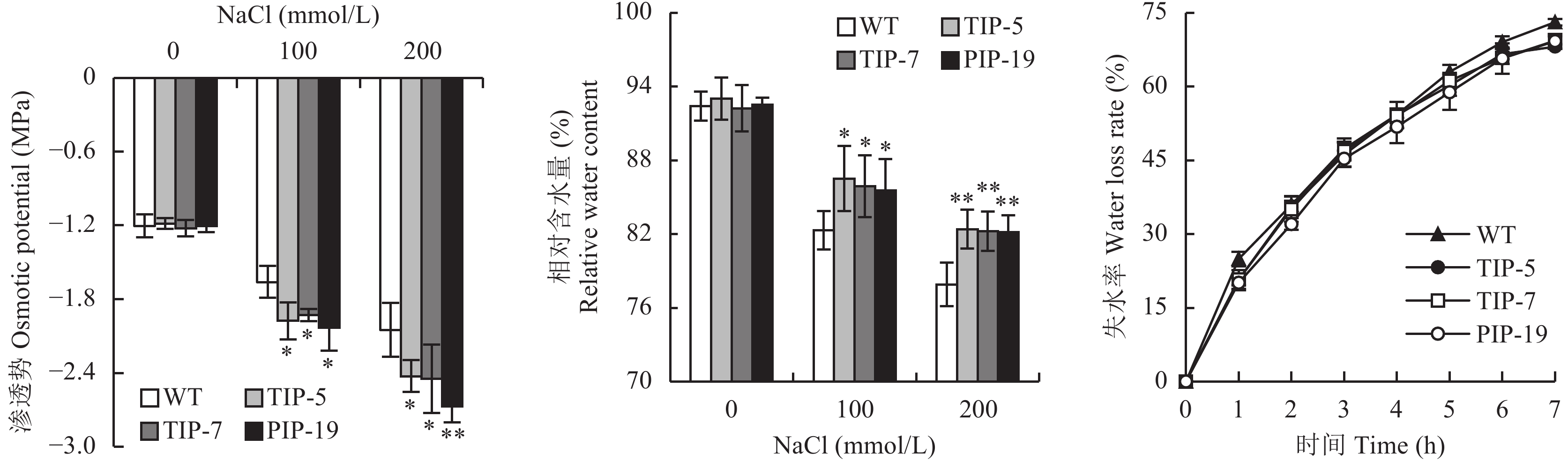
从图 1 可以看出,在正常条件下,转基因水稻和野生型的渗透势及相对含水量并没有显著差异,4 个水稻的渗透势和相对含水量随 NaCl 浓度的增加都呈下降趋势,在 100 mmol/L NaCl 处理下,TsTIP-5、TsTIP-7 及 TsPIP-19 的渗透势比野生型分别降低了 19.0%、16.2%、22.2%,相对含水量比野生型分别增加了 5.1%、4.3%、4.0%,都达到了显著水平 (P ≤ 0.05)。在 200 mmol/L NaCl 处理下,TsTIP-5、TsTIP-7 及 TsPIP-19 的渗透势比野生型分别显著降低了 18.3%、19.4%、30.3%,其中 TsPIP-19 达到了极显著水平 (P≤ 0.01) ,相对含水量比野生型分别增加了 5.8%、5.5%、5.4%,三者均达到极显著水平。在 100 mmol/L NaCl 处理下,转基因水稻和野生型的失水率随着处理时间的增加而增加,7 小时后转基因水稻增加的幅度显著低于野生型,分别降低了 6.8%、5.1%、5.3%。
 |
|
图1
野生型与转基因水稻在不同盐处理下的渗透势、相对含水量及失水率
Fig. 1
Osmotic potential, relative water content and water loss rate of the wild and transgenic rice lines under different salt treatments
|
盐胁迫显著降低野生型和转基因水稻的光合参数,包括净光合速率、气孔导度、胞间 CO2 浓度、蒸腾速率以及水分利用效率,并且野生型各个光合参数降低的程度显著大于 3 种转基因株系。由表 3 看出,在 100 mmol/L NaCl 处理下,TsTIP-5、TsTIP-7 及 TsPIP-19 的 5 种光合参数都与野生型具有显著差异 (P ≤ 0.05),其中 TsTIP-7 株系增加的幅度最高,分别比野生型提高了 17.2%、14.2%、1.7%、7.9% 和 8.6%,TsTIP-5 株系次之,TsPIP-19 株系增加的幅度最低,分别比野生型提高了 7.1%、5.8%、1.1%、3.0% 和 4.4%,TsTIP-7 与 TsPIP-19 在净光合速率、气孔导度及蒸腾速率上具有显著差异。在 200 mmol/L NaCl 处理下,TsTIP-5、TsTIP-7 及 TsPIP-19 的 5 种光合参数降低的程度远小于野生型,达到显著水平,其中 TsTIP-7 株系的的光合参数最高,分别比野生型增加了 78.5%、84.1%、14.4%、31.9%和 35.4%;TsTIP-5 增加了 50.4%、49.7%、10.8%、14.7% 和 31.4%;TsPIP-19 增加 56.2%、55.6%、10.6%、19.8% 和 0.3%,且 TsTIP-7 在净光合速率、气孔导度、胞间 CO2 浓度及蒸腾速率上比 TsTIP-5 和 TsPIP-19 显著增加 (P ≤ 0. 05)。
| 表3 野生型与转基因水稻在不同盐处理条件下的光合参数 Table 3 Photosynthetic parameters of the wild type and transgenic rice lines under different salt treatments |
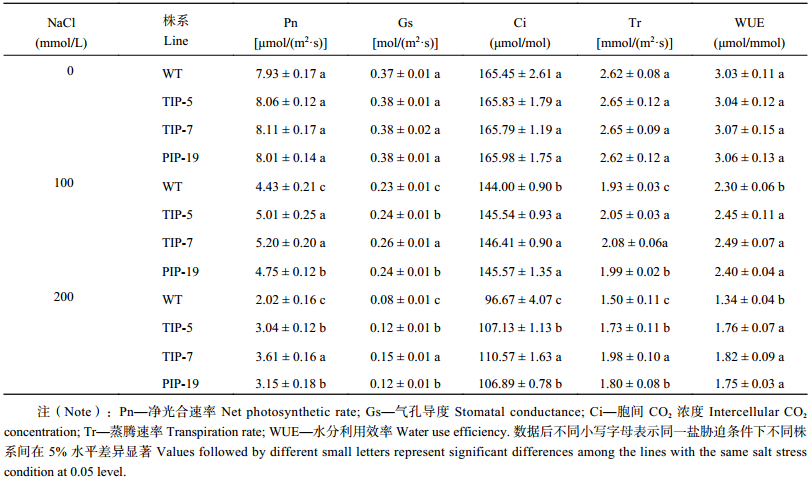 |
水通道蛋白 (AQP) 通过调控体内渗透平衡、水分吸收及转运、气孔的开闭及细胞质的离子平衡应对非生物胁迫[19–20]。在高盐下,植物细胞能够维持一个较高的 K+/Na+ 比,降低盐对细胞的伤害,而高 K+/Na+ 比是判断植物耐盐性的公认指标[21]。在植物质膜上有许多不同的离子转运及通道蛋白,例如 SOS1、NHX、HKT。在非生物胁迫中,这些蛋白在维持植物体内的离子平衡方面发挥了重要的作用,AtSOS1 和 SlSOS1 作为 Na+/H+ 逆向运输蛋白能够通过输出 Na+ 增强烟草的耐盐性[22]。在渗透胁迫下,McTIP1;2 参与胞内离子的再分布过程维持植物的渗透平衡[23]。本研究结果表明,盐胁迫下,与野生型相比,转 TsTIP1;1 与 TsPIP1;1 的水稻都能够降低转基因水稻根和地上部的 Na+ 含量,提高 K+ 的含量。前人的研究表明,水通道蛋白的超表达能够提高盐胁迫下植物体内的 K+/Na+ 比,如在转基因拟南芥中,TaNIP 的超表达会使 K+ 含量更高,Na+ 的含量更低[12]。TaAQP8 超表达的转基因烟草茎中也表现出相似的钠、钾含量分布规律[13]。本研究表明,盐胁迫下,与野生型相比,转 TsTIP1;1 与 TsPIP1;1 的水稻能够减少体内 Na+ 的累积,增加 K+ 的吸收,致使 Na+/K+ 比显著降低,增强植物的耐盐能力。
盐胁迫中,植物的保水力对于其生存生长至关重要,水通道蛋白能够促进水分的快速运输,维持细胞内水分的平衡稳定。徐娜等[24]证明,在盐胁迫下,转 SlMIP 基因的拟南芥通过增加脯氨酸等渗透调节物质的含量,提高细胞液的浓度,降低渗透势,增强了细胞的吸水能力。徐毅等[25]研究发现,MaPIP1;1 的超表达能够使转基因拟南芥的失水率降低,提高植物的保水率,脯氨酸及可溶性糖的含量显著增加。这些结果表明 MaPIP1;1 参与植物体内的渗透调节。本研究结果表明,盐胁迫下,与野生型时相比,转 TsTIP1;1 与 TsPIP1;1 基因水稻能够降低渗透势以提高自身的相对含水量,减少失水速率,具有较强的渗透调节能力,通过维持体内水分平衡以适应盐胁迫。
盐胁迫会使植物水分的传导速度迅速下降,导致气孔关闭,蒸腾速率下降,同时也会使植物的光合速率降低,植物生长速度减缓,产量下降[26]。盐胁迫能够降低气孔和叶肉导度,从而影响叶片中 CO2 的扩散[27]。水通道蛋白介导的细胞渗透压的改变,有助于气孔调节,并调控植物的蒸腾作用,最终促进植物的生长及提高作物产量[28]。Groszmann 等研究表明,PIPs 能够通过增加叶肉细胞及保卫细胞膜的透性来运输 CO2,同时增加了 1,5-二磷酸核酮糖羧化酶的活性,而 1,5-二磷酸核酮糖羧化酶是植物光合作用系统所必需的[29]。在盐胁迫下,SlTIP2;2 的超表达能够显著提高植物蒸腾速率、光合速率及水分的利用效率,促进转基因拟南芥的生长发育[30]。本研究结果表明,盐胁迫下,与野生型相比,转 TsTIP1;1 和 TsPIP1;1 基因水稻能够通过显著减缓气孔导度、胞间 CO2 浓度、蒸腾速率及光合速率的下降,促进光合呼吸作用,促进了转基因水稻的生长发育,显著增加了生物量,增强了水稻的耐盐能力。
| [1] | Aharon R, Shahak Y, Wininger S, et al. Overexpression of a plasma membrane aquaporin in transgenic tobacco improves plant vigor under favorable growth conditions but not under drought or salt stress[J]. Plant Cell, 2003, 15(2): 439–447. DOI:10.1105/tpc.009225 |
| [2] | Bray E A. Molecular responses to water deficit[J]. Plant Physiology, 1993, 103(4): 1035–1040. DOI:10.1104/pp.103.4.1035 |
| [3] | Cheeseman J M. Mechanisms of salinity tolerance in plants[J]. Plant Physiology, 1988, 87(3): 547–550. DOI:10.1104/pp.87.3.547 |
| [4] | Blumwald E. Sodium transport and salt tolerance in plants[J]. Current Opinion in Cell Biology, 2000, 12(4): 431–434. DOI:10.1016/S0955-0674(00)00112-5 |
| [5] | Suga S, Komatsu S, Maeshima M. Aquaporin isoforms responsive to salt and water stresses and phytohormones in radish seedlings[J]. Plant Cell Physiology, 2002, 43(10): 1229–1237. DOI:10.1093/pcp/pcf148 |
| [6] | Lian H L, Yu X, Ye Q, et al. The role of aquaporin RWC3 in drought avoidance in rice[J]. Plant Cell Physiology, 2004, 45(3): 481–489. |
| [7] | Vera-Estrella R, Barkla B J, Bohnert H J, et al. Novel regulation of aquaporins during osmotic stress[J]. Plant Physiology, 2004, 135(4): 2318–2329. DOI:10.1104/pp.104.044891 |
| [8] | Amodeo G, Dorr R, Vallejo A, et al. Radial and axial water transport in the sugar beet storage root[J]. Journal of Experimental Botany, 1999, 50(333): 509–516. DOI:10.1093/jxb/50.333.509 |
| [9] | Chaumont F, Barrieu F, Wojcik E, et al. Aquaporins constitute a large and highly divergent protein family in maize[J]. Plant Physiology, 2001, 125(3): 1206–1215. DOI:10.1104/pp.125.3.1206 |
| [10] | Rupesh D, Richard R B. Molecular evolution of aquaporins and silicon influx in plants[J]. Functional Ecology, 2016, 30(8): 1277–1285. DOI:10.1111/1365-2435.12570 |
| [11] | Eisenbarth D A, Weig A R. Dynamics of aquaporins and water relations during hypocotyl elongation in Ricinuscommunis L. seedlings [J]. Journal of Experimental Botany, 2005, 56(417): 1831–1842. DOI:10.1093/jxb/eri173 |
| [12] | Gao Z, He X, Zhao B, et al. Overexpressing a putative aquaporin gene from wheat, TaNIP, enhances salt tolerance in transgenic Arabidopsis [J]. Plant Cell Physiology, 2010, 51(5): 767–775. DOI:10.1093/pcp/pcq036 |
| [13] | Hu W, Yuan Q, Wang Y, et al. Overexpression of a wheat aquaporin gene, TaAQP8, enhances salt stress tolerance in transgenic tobacco [J]. Plant Cell Physiology, 2012, 53(12): 2127–2141. DOI:10.1093/pcp/pcs154 |
| [14] | Sade N, Gebretsadik M, Seligmann R, et al. The role of tobacco Aquaporin1 in improving water use efficiency, hydraulic conductivity, and yield production under salt stress[J]. Plant Physiology, 2010, 152(1): 245–254. DOI:10.1104/pp.109.145854 |
| [15] | Liu C W, Fukumoto T, Matsumoto T, et al. Aquaporin OsPIP1;1 promotes rice salt resistance and seed germination [J]. Plant Physiology and Biochemistry, 2013, 63: 151–158. DOI:10.1016/j.plaphy.2012.11.018 |
| [16] | Avadi M, Cavez D, Miled N, et al. Identification and characterization of two plasma membrane aquaporins in durum wheat (Triticum turgidum L. subsp. durum) and their role in abiotic stress tolerance [J]. Plant Physiology and Biochemistry, 2011, 49(9): 1029–1039. DOI:10.1016/j.plaphy.2011.06.002 |
| [17] |
李兵. 植物水通道蛋白生理作用的研究进展[J].
现代农业科技, 2006, (7): 143–145.
Li B. Research advances in plant physiological role of aquaporins[J]. Modern Agricultural Science and Technology, 2006, (7): 143–145. |
| [18] | Beebo A, Thomas D, Der C, et al. Life with and without AtTIP1;1, an Arabidopsis aquaporin preferentially localized in the apposing tonoplasts of adjacent vacuoles [J]. Plant Molecular Biology, 2009, 70(2): 193–209. |
| [19] | Maurel C, Javot H, Lauvergeat V, et al. Molecular physiology of aquaporins in plants[J]. International Review of Cytology, 2002, 215: 105–148. DOI:10.1016/S0074-7696(02)15007-8 |
| [20] | Tyerman S D, Niemietz C M, Bramley H. Plant aquaporins: multifunctional water and solute channels with expanding roles[J]. Plant Cell Environment, 2002, 25(2): 173–194. DOI:10.1046/j.0016-8025.2001.00791.x |
| [21] | Ruiz-Lozano J M, Porcel R, Azcón C, et al. Regulation by arbuscular mycorrhizae of the integrated physiological response to salinity in plants: new challenges in physiological and molecular studies[J]. Journal of Experimental Botany, 2012, 63(11): 4033–4044. DOI:10.1093/jxb/ers126 |
| [22] | Deng X, Hu W, Wei S, et al. TaCIPK29, a CBL-interacting protein kinase gene from wheat, confers salt stress tolerance in transgenic tobacco[J]. PLoS One, 2013, 8: e69881. DOI:10.1371/journal.pone.0069881 |
| [23] | Vera-Estrella R, Barkla B J, Bohnert H J, et al. Novel regulation of aquaporins during osmotic stress[J]. Plant Physiology, 2004, 135(4): 2318–2329. DOI:10.1104/pp.104.044891 |
| [24] |
徐娜, 辛士超, 强晓晶, 等. 番茄SlMIP基因参与转基因拟南芥的渗透调节
[J].
植物营养与肥料学报, 2014, 20(1): 195–204.
Xu N, Xin S C, Qiang X J, et al. Tomato SlMIP gene is involved in osmotic adjustment in the transgenic Arabidopsis thaliana [J]. Journal of Plant Nutrition and Fertilizer, 2014, 20(1): 195–204. DOI:10.11674/zwyf.2014.0122 |
| [25] | Xu Y, Hu W, Liu J H, et al. A banana aquaporin gene, MaPIP1;1, is involved in tolerance to drought and salt stresses [J]. BMC Plant Biology, 2014, 14: 59–73. DOI:10.1186/1471-2229-14-59 |
| [26] | Steudle E. Water uptake by roots: Effects of water deficit[J]. Journal of Experimental Botany, 2000, 51(350): 1531–1542. DOI:10.1093/jexbot/51.350.1531 |
| [27] | Flexas J, Bota J, Loreto F, et al. Diffusive and metabolic limitations to photosynthesis under drought and salinity in C-3 plants[J]. Plant Biology, 2004, 6(3): 269–279. DOI:10.1055/s-2004-820867 |
| [28] | Maurel C, Verdoucq L, Rodrigues O. Aquaporins and plant transpiration[J]. Plant Cell Environment, 2016, 39(11): 2580–2587. DOI:10.1111/pce.12814 |
| [29] | Groszmann M, Osborn H L, Evans J R. Carbon dioxide and water transport through plant aquaporins[J]. Plant Cell Environment, 2016, 40(6): 938–961. |
| [30] | Sade N, Vinocur B J, Diber A, et al. Improving plant stress tolerance and yield production: is the tonoplast aquaporin SlTIP2; 2 a key to isohydric toanisohydric conversion [J]. The New Phytologist, 2009, 181(3): 651–661. DOI:10.1111/j.1469-8137.2008.02689.x |
 2017, Vol. 23
2017, Vol. 23  doi:
doi: 

