2. 农业部微生物产品质量安全风险评估实验室,北京 100081;
3. 黑龙江省农业科学院土壤肥料与环境资源研究所,哈尔滨 150086
2. Laboratory of Quality & Safety Risk Assessment for Microbial Products (Beijing), Ministry of Agriculture, Beijing 100081, China;
3. Institute of Soil Fertility and Environmental Sources, Heilongjiang Academy of Agricultural Sciences, Harbin 150086, China
黑土有机质含量高、土质肥沃,是最宝贵的土壤资源。我国东北黑土作为世界四大黑土区之一,面积达103万km2、占全国陆地总面积的10.7%,其中耕地面积3000万hm2、占全国耕地总面积的22.2%[1],因此东北黑土在保障国家粮食安全、区域生态环境安全和农业可持续发展中具有不可替代的地位。然而由于长期不合理施肥导致土壤质量退化,如长期施用无机肥使得黑土土壤侵蚀严重、土层变薄、有机质含量下降、土壤酸化、土壤微生物活性降低等一系列问题[2–3]。而施用有机肥是提高作物产量、增加土壤有机质和改善土壤生物学性状的有效措施[4–5]。但近五十年来我国有机肥使用量持续下降,调查数据表明,在1960、1980、2000、2010年我国有机肥施用量占总施肥量的80%、60%、30%、10%[6]。面对无机肥施用量增加,有机肥施用量逐年减少的现状,我国提出了有机无机肥配施的施肥指导策略。研究土壤微生物生物量、群落组成等对施肥、耕作等措施的快速响应变化,可以指示土壤质量变化[7]。
关于施肥对土壤微生物影响的研究报道很多,有机肥与无机肥配施会提高土壤微生物生物量碳氮、土壤酶活[8]。真菌作为土壤微生物中的重要组成部分,在土壤生态中具有不可忽视的地位,与土传病害、植物互作、分解有机物质等密不可分[9–10],因此探究施肥对土壤真菌的影响具有重要意义。研究表明施入氮肥会降低真菌的生物量[11],降低多样性和改变真菌的组成结构[12–13];相对细菌来说,真菌有更强的吸收氮素和磷素的能力[14]。无机肥减少菌根真菌的生长,而粪肥增加菌根真菌的生长[15]。施有机肥土壤理化性质与常规农田没有显著差异,但生物量高于常规农田,且菌根真菌量增加[16]。在温室试验中发现,生物有机肥可以降低土壤真菌的数量,尤其是病原真菌的数量,降低作物病害发病率,且改变真菌的组成结构[17]。高通量测序技术可进行环境中所有微生物群落的研究,获得数据量大,能更真实地揭示微生物群落的复杂性和多样性,极大的促进环境中不可培养微生物以及痕量菌的更深入研究[18–19]。本课题组的Zhou等[20]借助高通量测序技术研究不同施氮量和不同量氮、磷肥配施对东北黑土真菌群落结构变化的影响,发现氮肥和氮、磷肥配施可增加真菌数量,降低真菌多样性,改变真菌群落结构的组成。本研究首次应用高通量测序技术研究长期有机肥无机肥配施条件下东北黑土真菌群落结构是如何演变的,及其与土壤理化性质的偶联关系。
真菌核糖rDNA内部转录间隔区 (internal transcribed spacer,ITS) 序列分析技术已被应用到物种属内、近缘属间乃至科内研究系统进化关系[21]。由于ITS的序列分析能实质性地反映出属间、种间的碱基对差异,且序列片段较小、易于分析,目前已被广泛应用于真菌属内不同种间或近似属间的系统发育研究中[22]。本研究选取4个施肥处理,探讨长期有机无机配施和单施无机肥条件下,真菌微生物丰度、多样性和组成的演变规律,及其与土壤理化性质的偶联关系。借助qPCR技术和Illumina Miseq高通量测序平台,以真菌ITS基因为分子标靶探讨以上问题。研究结果将为东北黑土建立合理施肥制度,维持土壤肥力,调节土壤微生物结构,改善其生态功能提供参考依据。
1 材料与方法 1.1 试验地概况试验在黑龙江省农业科学院长期定位试验站进行,试验站位于黑龙江省哈尔滨市 (45°40' N,126°35' E),地势平坦,属于松花江二级阶地,海拔151 m,无霜期135 d,年均气温3.5℃,年降水量533 mm。该试验站1979年成立,自次年起,按小麦–大豆–玉米顺序轮作,2015年为玉米季。本文选取4个施肥处理:不施肥处理 (CK);有机肥处理 (M);施氮肥、磷肥和钾肥的无机肥处理 (NPK);有机肥配施无机肥处理 (MNPK)。每个处理3个重复。氮、磷、钾肥分别为尿素、重过磷酸钙、硫酸钾。氮、磷、钾肥小麦季和玉米季施用量为N 150 kg/hm2、P2O5 75 kg/hm2、K2O 75 kg/hm2;大豆季施用量为N 75 kg/hm2、P2O5 150 kg/hm2、K2O 75 kg/hm2。有机肥为马粪,施用量为18600 kg/hm2。基础土壤理化性质 (1980年):pH 7.22、有机质含量26.7 g/kg、全氮1.47 g/kg、全磷1.07 g/kg、碱解氮151.1 mg/kg、速效钾200 mg/kg、有效磷51.0 mg/kg。
1.2 样品采集玉米收获季 (2015年9月) 取5—25 cm的耕层土壤,在每个小区随机抽取10个点取样,去除土壤中杂草石块等杂质,混合均匀作为该处理的一个平行样品,每个处理3个重复。土壤样本保存于封口塑料袋中,一部分于温室风干、研磨后过0.2 mm筛,用于测定土壤理化性质 (用鲜土测定土壤铵态氮和硝态氮含量);另一部分样品保存于–80℃冰箱,用于微生物群落分析。
1.3 试验方法1.3.1 土壤理化性质测定 以下土壤理化性质参照鲁如坤[23]方法,采用酸度计法 (土水比为1∶1)测定土壤pH;采用半微量凯氏定氮法测定土壤全氮;Olsen法测定土壤有效磷;采用乙酸铵浸提—原子吸收分光光度法测定土壤速效钾;通过重铬酸钾—容量法—外加热法测定土壤有机质。全自动流动分析仪 (AA3) 测定硝态氮和铵态氮的含量[24]。
1.3.2 土壤DNA的提取和ITS基因的高通量测序 使用美国MOBIO公司的Power Max Soil DNA Isolation Kit试剂盒提取土壤总DNA,准确称取0.25 g土壤样品,依据试剂盒说明书方法提取土壤总DNA。为了使土壤总DNA具有重复性和代表性,每个处理的每个重复样品,提取6次DNA,把所提取的6次DNA混合均匀作为该重复土壤总DNA进行后续实验[25]。用核酸定量仪 (NanoDrop ND-1000) 检测土壤总DNA浓度和纯度。符合要求的DNA送至北京奥维森基因科技有限公司应用Illumina MiSeq平台进行测序。
测序引物为ITS1F/ITS2(ITS1F: 5′-CTTGGTCATTTAGAGGAAGTAA-3′, ITS2: 5′-GCTGCGTTCTTCATCGATGC-3′)[26]。Illumina Miseq平台测序的主要步骤:首先合成带有barcode的特异引物,并使用Qubit荧光定量系统对PCR产物进行定量检测。再依据每个样本的测序量要求以及定量结果进行相应比例的混合。然后将含有标签的接头与DNA片段链接。选择性地富集两端连有接头的DNA片段,扩增DNA文库,使用测序平台对真菌ITS1区基因进行测序。原始序列上传至NCBI的SRA数据库编号为SRP085784。
1.3.3 定量PCR分析 采用SYBR Green定量PCR分析ITS基因,反应在ABI 7500 Real-time PCR (ABI,USA) 仪器上进行。反应体系为FastFire qPCR PreMix (TIANGEN,China) 10 μL,ROX Reference Dye 0.4 μL,1μL DNA模板,10 nmol/L引物,补加ddH2O至20 μL。真菌定量PCR引物为ITS4/ITS5 (ITS4: 5′-TCCTCCGCTTATTGATATGC-3′, ITS5: 5′-GGAAGTAAAAGTCGTAACAAGG-3′)[27]。以含有目标基因的重组pGEMR-T载体为标准质粒,制备质粒和后续方法参照文献[28]。细菌16S rRNA基因丰度检测方法同真菌,其引物为515F/806R[29]。
1.3.4 高通量测序数据分析 通过Illumina MiSeq平台进行Paired-end测序,使用Trimmomatic软件修剪数据末端碱基,以Q20 ≥ 90的标准用Readfq (vertion 6.0) 软件将低质量的成对reads过滤掉;采用FLASH (version 1.2.10) 软件把成对的reads通过其overlap拼接到一条序列,拼接的错误匹配率为0.1。Mothur (version 1.31.2) 软件去除长度小于200 bp的序列和maxhomop大于10的序列,并去除嵌合体。QIIME (v 1.8.0) 软件将拼接过滤后的序列聚类为用于物种分类的OTU (Operational Taxonomic Units),OUT相似性设置为97%。为了得到每个OTU对应的物种分类信息,对OTU代表序列进行分类学分析,并在各个水平统计每个样品的群落组成,对比UNITE数据库。利用软件Mothur进行 α 多样分析。采用SPSS 19.1软件进行单因素ANOVA分析和Pearson相关性分析,并用Turkey显著差异法分析处理间的差异显著性。使用PAST软件,基于Bray-Curtis相似距离,对黑土中真菌群落结构进行聚类分析[30]。采用CANOCO 5.0将土壤理化性质和真菌群落组成进行典范对应分析 (CCA)。
2 结果与分析 2.1 不同施肥处理土壤理化性质由表1可知,与不施肥相比,单施无机肥降低了土壤pH,施有机肥提高了pH,NPK处理的土壤pH值比CK降低0.53,MNPK的pH要高出NPK处理0.40。有机无机配施和单施无机肥处理极显著增加土壤中全氮、硝态氮、有效磷和有机质等的含量 (P < 0.05),MNPK处理的有效磷含量较CK处理提高60.14 mg/kg,NPK处理也较CK处理提高57.81 mg/kg;而施肥对不同处理的铵态氮、速效钾含量影响不显著。总体上来说,施肥改变了土壤理化性质。
| 表1 不同施肥处理对黑土土壤理化性质的影响分析 Table 1 Variations of soil physicochemical properties under different fertilizer treatments |
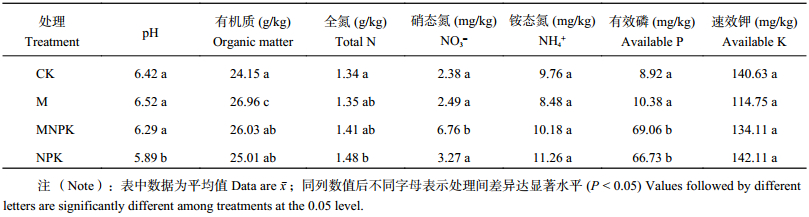 |
通过qPCR检测黑土中ITS基因和16S rRNA基因丰度,分析黑土土壤中真菌丰度,以及细菌/真菌比值 (16S rRNA基因丰度值与ITS基因丰度值做商),结果见图1。各处理ITS基因拷贝数为1.66 × 105~3.04 × 105/g, soil),NPK处理的最高 (3.04 × 105/g, soil ),比MNPK处理 (2.02 × 105/g, soil) 的高出1.02 × 105/g, soil,不同处理之间存在显著差异。通过分析细菌/真菌比值可知,MNPK处理 (26.91 × 104) 和M处理 (23.61 × 104) 均高于CK (19.58 × 104),而NPK处理 (9.90 × 104) 小于CK。另外,通过土壤理化性质和ITS基因丰度,以及细菌/真菌比值的相关性分析 (表2) 可知,ITS基因拷贝数同铵态氮和速效钾含量显著正相关;细菌/真菌比值同土壤pH值显著正相关,与铵态氮含量显著负相关。
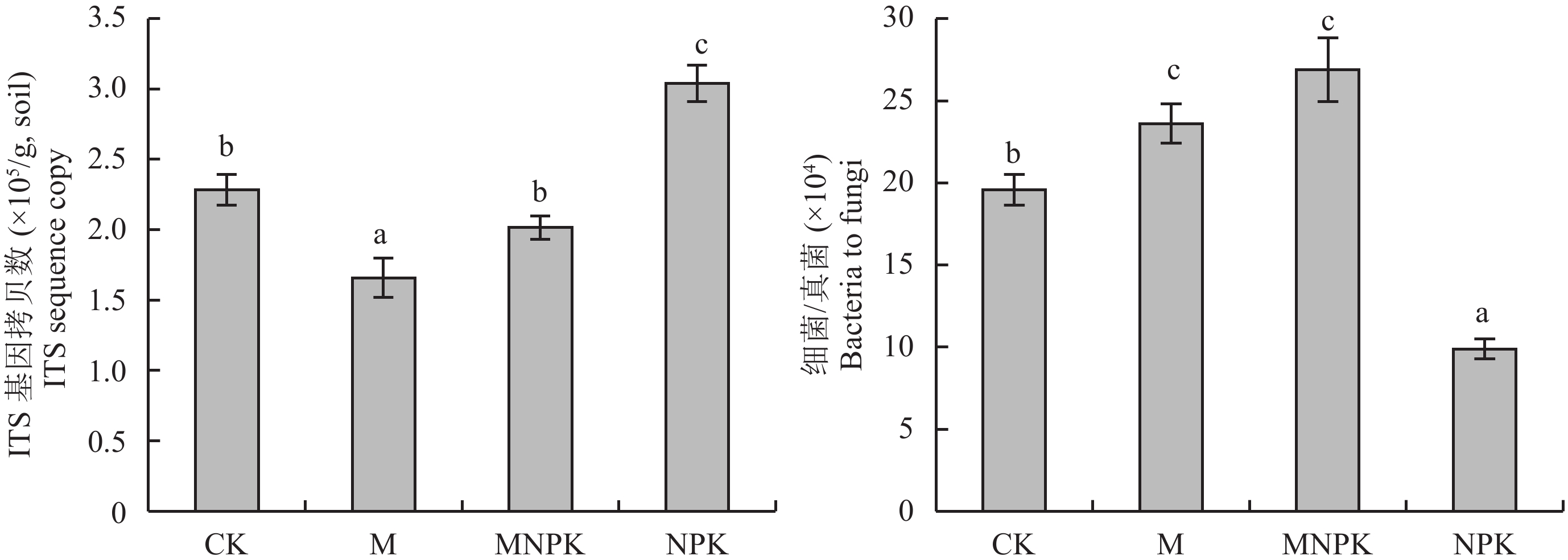 |
| 图1 施肥处理ITS基因丰度和细菌/真菌比值的qPCR结果 Fig. 1 The abundance of fungi as indicated by the number of ITS copies and bacteria-to-fungi ratio in different treatments analyzed by qPCR |
| 表2 ITS基因拷贝数、细菌/真菌比值与土壤理化性质Pearson相关性分析 Table 2 Pearson correlation coefficients between ITS gene sequence copy numbers, bacteria-to-fungi ratio and soil physiochemical characteristics |
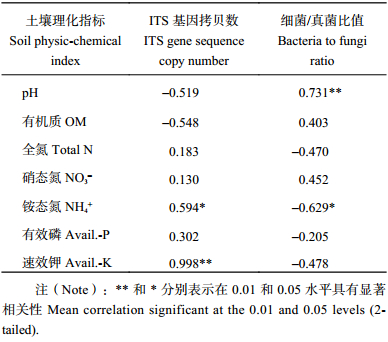 |
不同施肥处理之间的真菌 α 多样性分析结果 (表3) 表明,只有Observed Species分析,CK处理的最高 (735),与其他3个处理差异达到显著水平,3个施肥处理间虽有差异,但未达显著水平。Chao1、PD whole tree和Shannon指数,所有处理间均没有显著性差异。
| 表3 不同施肥处理黑土土壤中真菌 α 多样性指数 Table 3 α-diversity index of fungi under different fertilizer treatments |
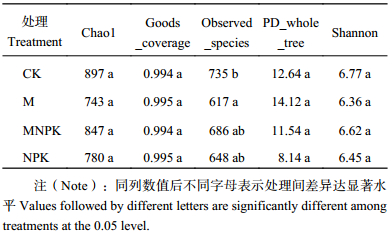 |
由图2中可以看到,长期施肥的黑土土壤中检测到6个真菌门,相对丰度大于1的有5个,分别为:Ascomycota (相对丰度35.47%~56.22%),Zygomycota (18.37%~25.66%),Basidiomycota (8.26%~12.14%),Glomeromycota (1.19%~2.63%),Chytridiomycota (1.96%~9.87%)。相对丰度大于1%的菌纲有10个和相对丰度大于0.1%的菌属40个 (图2)。
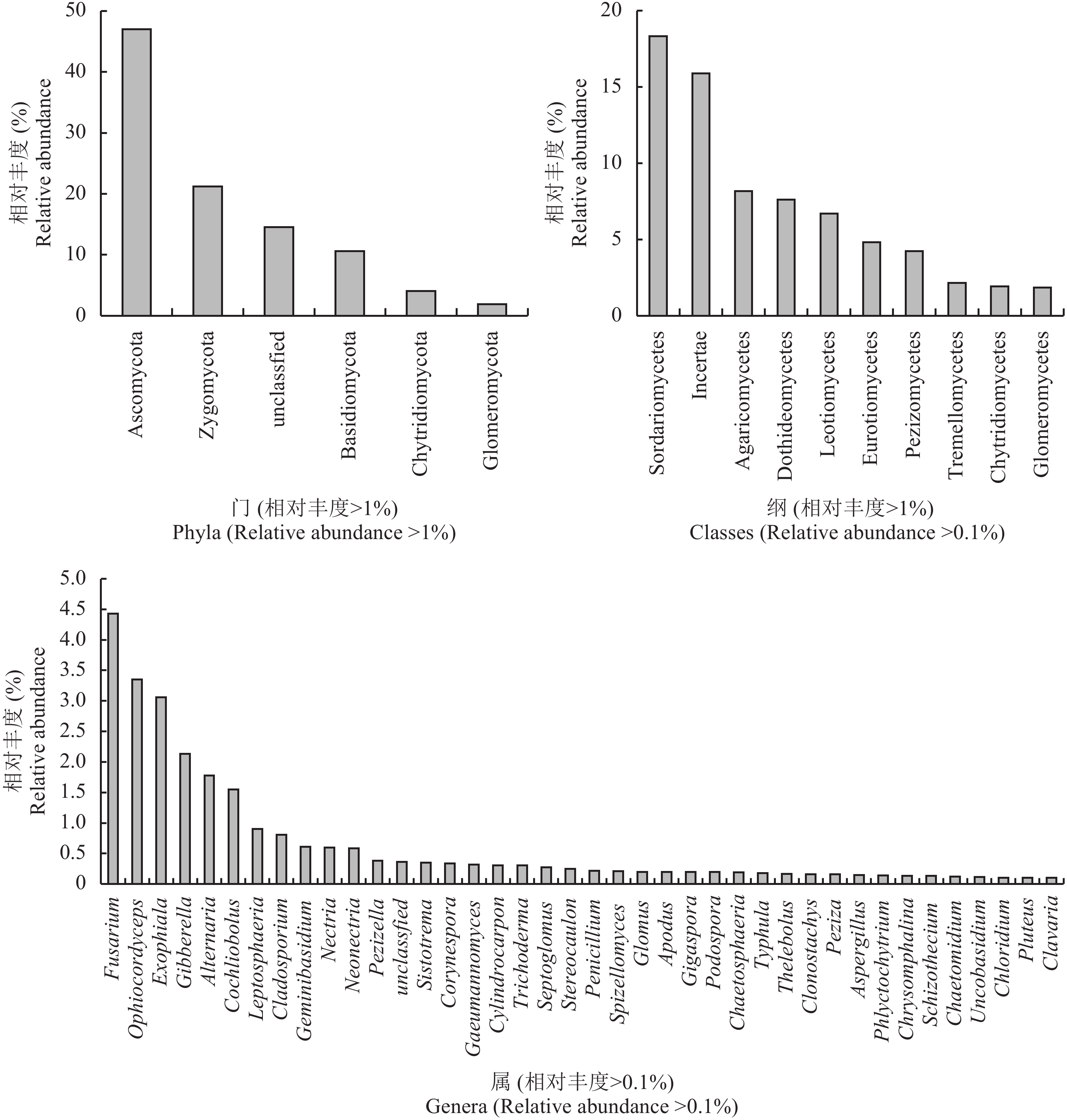 |
| 图2 长期施肥黑土土壤真菌组成 Fig. 2 Fungal community composition in long-term fertilized soils |
不同施肥处理土壤5个真菌门Ascomycota、Zygomycota、Basidiomycota、Glomeromycota和Chytridiomycota的相对丰度存在差异 (图3)。CK处理Ascomycota的相对丰度为45.35%,M处理的为35.47%,而MNPK处理和NPK处理的分别提高到50.93%和56.16%。Zygomycota的相对丰度在CK处理为20.91%,在M处理比CK增加了4.75%,而在MNPK处理和NPK处理分别减少为18.37%和19.95%。可见长期施肥引起了真菌优势菌门相对丰度的差异。
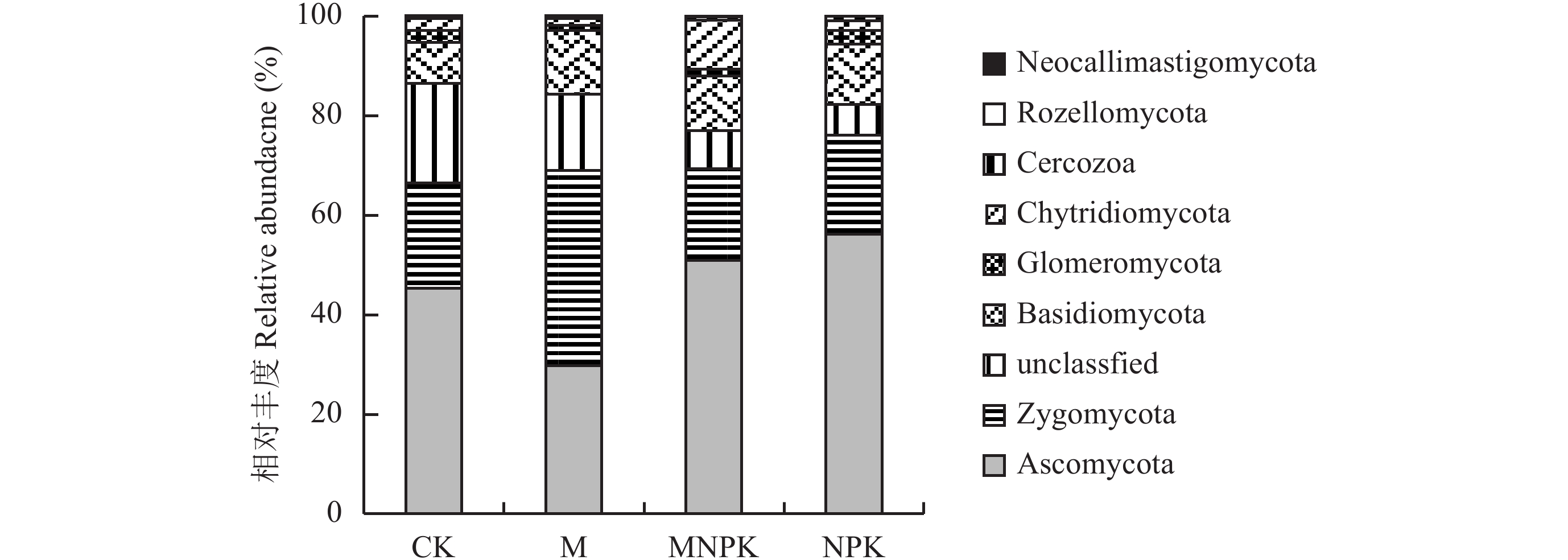 |
| 图3 不同施肥处理的真菌门水平相对丰度 Fig. 3 Relative abundances of fungal common phyla under different long-term fertilizer treatments |
另外,不同施肥处理土壤真菌属水平组成分析 (表4),4个处理之间优势菌属Fusarium的相对丰度没有显著性差异;而Cochliobolus在CK处理和NPK处理中分别为3.25%和2.08%,在施入有机肥的MNPK处理和M处理中的相对丰度分别降低到0.41%和0.39%。Exophiala和Alternaria也有类似变化趋势,它们的相对丰度在NPK处理 (分别为5.38%和2.49%) 均显著高于MNPK处理 (分别为3.15%和1.65%)。
| 表4 不同施肥处理黑土土壤中真菌属相对丰度 (%) Table 4 Relative abundances of fungal common genera under different treatments |
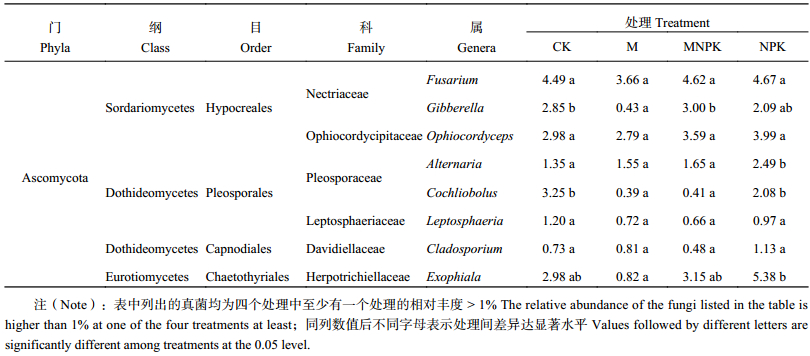 |
聚类分析根据每个样品OTU的组成情况,更直观地展示各个样品之间的关系,组成越相似的样品,聚类关系越近。通过此分析,具有相似 β 多样性的供试样品聚类在一起,本研究各处理的结果 (图4) 显示CK处理的几个重复先行相聚,再同M和MNPK聚类,最后与NPK聚类。4个处理之间彼此分开,说明处理之间的群落结构存在差异;MNPK处理与NPK处理相比较,MNPK处理与CK处理的亲缘关系更近。
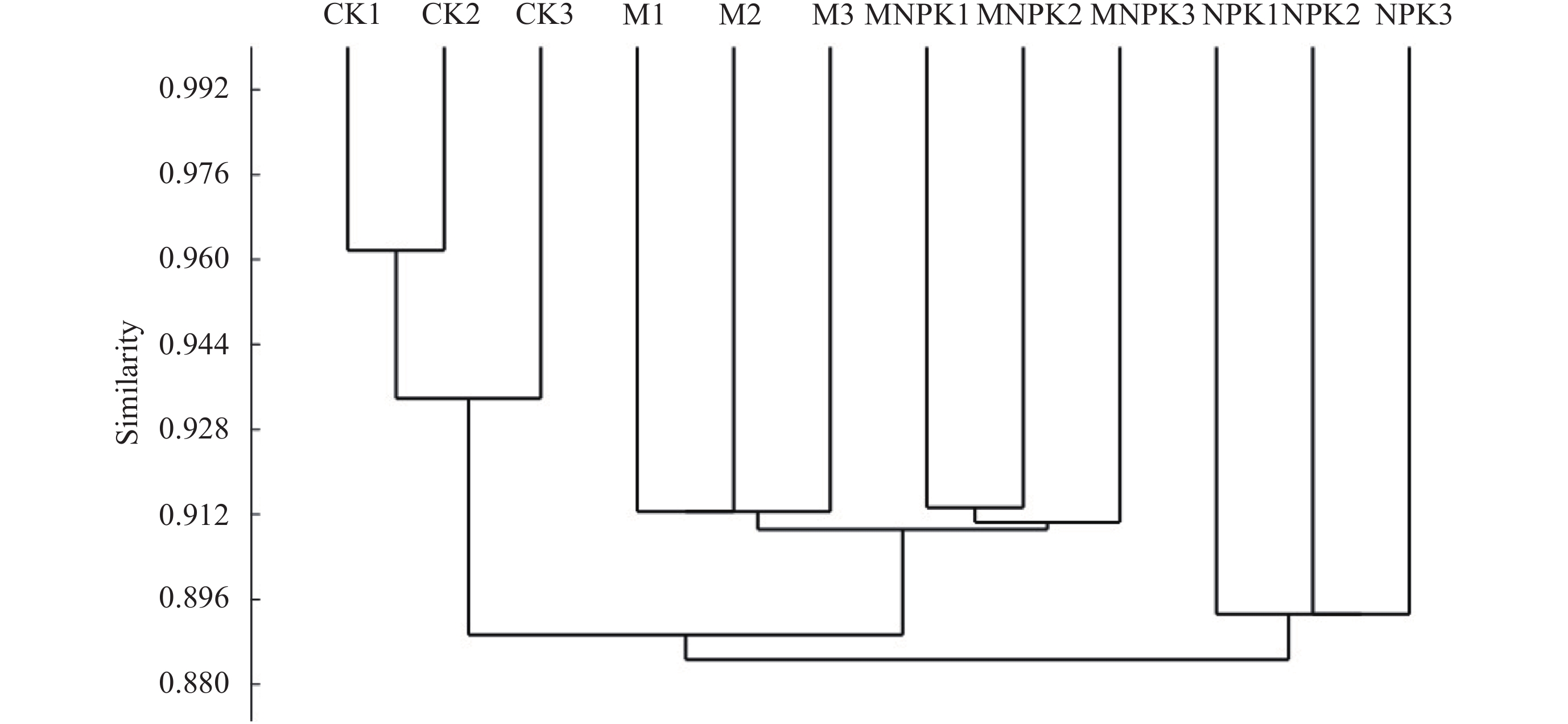 |
| 图4 不同施肥处理黑土土壤中真菌组成聚类分析 (OTU水平) Fig. 4 Results of clustering analysis based on fungal community composition in different fertilized soils (at OUT-level) |
CCA分析主要反映样品、菌群与环境因子之间关系。通过CCA分析长期不同施肥处理土壤中真菌群落与土壤理化性质之间的相互关系 (图5),本文选取的土壤理化性质包括:土壤pH、有机质、全氮、硝态氮、铵态氮、有效磷、速效钾等。土壤理化性质共解释土壤真菌群落结构变化的73.3%,前两轴累计解释量为56.53%,第一轴和第二轴的解释量分别为36.54%、19.99%。分析得知,对真菌群落结构解释量前三位的理化指标分别为:有效磷 (贡献量为32.4%,P=0.002)、铵态氮 (贡献量为14.8%,P=0.01) 和硝态氮 (贡献量为16.2%,P=0.048)。
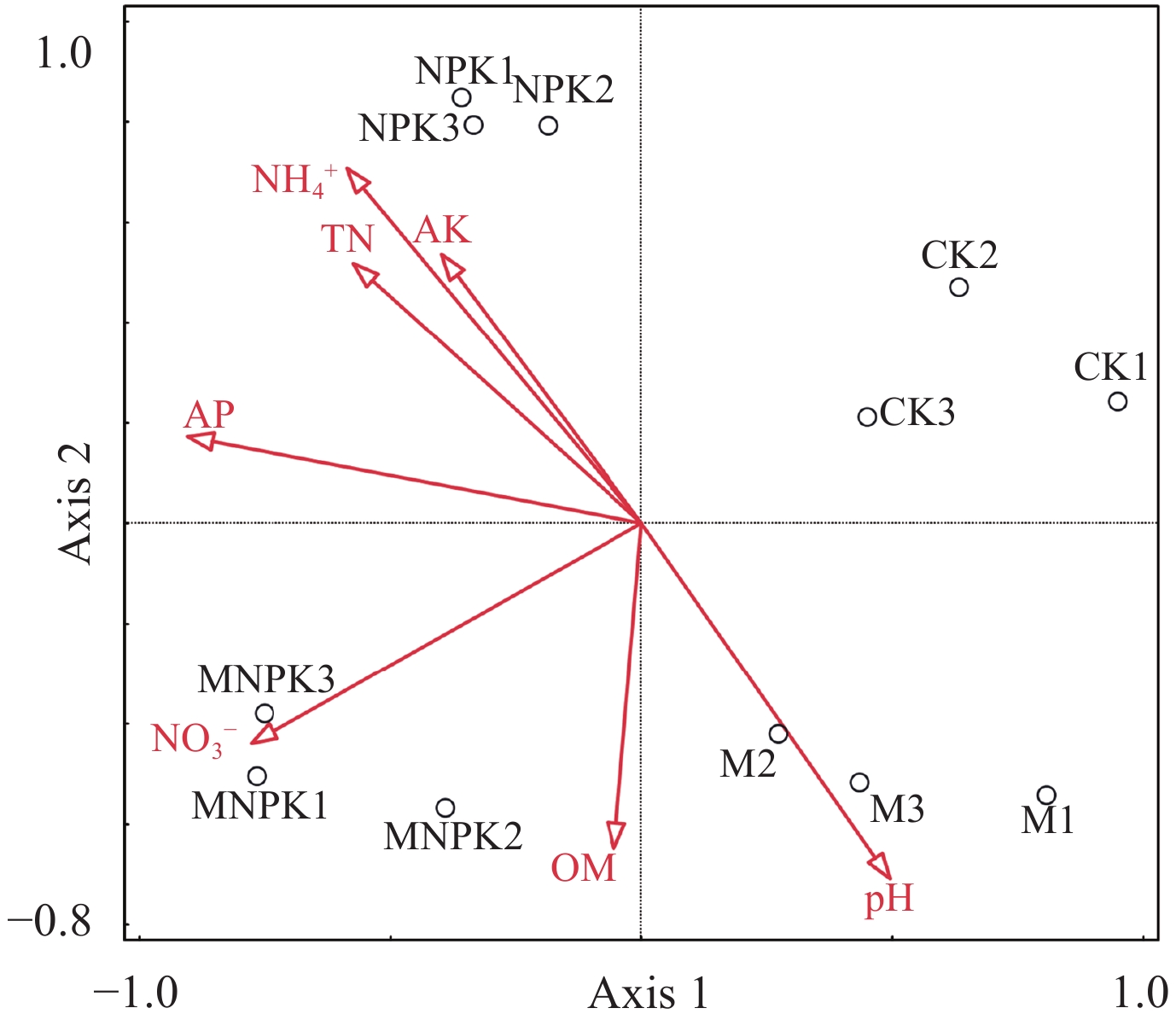 |
| 图5 不同施肥处理黑土土壤中真菌群落与土壤理化性质的CCA分析 Fig. 5 Relationship between dominant soil fungal communities and soil chemical characteristics presented by CCA |
有机肥配施无机肥和单施无机肥处理极显著增加土壤中全氮、硝态氮、有效磷和有机质等的含量。总体上来说,施肥改变了土壤理化性质。对比4个处理1980年的土壤基础pH值 (7.22) 和施肥36年后的pH值,可知多年的施肥引起了土壤的严重酸化,应采取优化施肥措施缓解酸化。NPK处理的pH (5.89) 明显低于CK、M和MNPK三个处理,说明施无机肥导致了土壤的酸化,而有机肥或者有机无机配施可以减缓土壤pH值的降低。酸性土壤pH因为施入粪肥而增加土壤pH,这可能是由于在粪肥中存在着大量的碳酸盐和碳酸氢盐[29, 31],另外,带有羟基和酚羟基的有机酸类在土壤中可以起到缓冲作用,而增加土壤pH[32]。
3.2 长期施肥对黑土中ITS基因丰度的影响通过qPCR分析结果显示,不施肥的ITS基因丰度明显小于无机肥处理,显著大于单施有机肥,略高于有机无机配施。这些结果说明施用无机肥会提高土壤中真菌的数量,施用有机肥减少了土壤中真菌数量,而有机无机配施的真菌数量与不施肥处理无显著差异。因为真菌适应生存的pH范围较宽 (pH 5~9)[33],且较低的pH相对更有利于真菌的繁殖生长[34],通过土壤pH分析得知,施用无机肥明显的降低了土壤pH,4个处理中施无机肥的土壤pH最低,所以施无机肥的真菌数最高。有机无机配施相对单施无机肥来说,可减缓土壤pH降低,所以土壤真菌含量相对较低。通过ITS基因拷贝数与土壤理化性质Pearson相关性分析,可知ITS基因拷贝数与土壤中的铵态氮含量显著正相关,这个结果与Zhou等[20]在研究氮肥对真菌丰度影响时得到的结论一致。
3.3 长期施肥对黑土中细菌与真菌比值的影响本文研究发现长期施用有机肥或者有机无机配施会提高黑土土壤中细菌/真菌比值 (MNPK处理的为26.91 × 104),施无机肥 (NPK处理的为9.90 × 104) 会降低细菌/真菌比值。这种比值变化是因为土壤pH与细菌数量有相关性[35],pH值较低时,细菌数量较小;无机肥处理的pH明显小于有机无机配施处理,分析可知长期施用无机肥会降低黑土土壤中细菌数量,而有机无机配施会提高土壤中细菌数量 (MNPK处理的16S rRNA基因拷贝数比NPK的高出 2.40 × 1010/g, soil)。另外一个原因是pH值越低越有利于真菌的生长[34]。综合长期施肥而使得细菌数量和真菌数量的变化,发现长期施用无机肥导致黑土由“细菌型”向“真菌型”转变,而有机无机配施可以避免“细菌型”向“真菌型”的转变。通过细菌/真菌比值和土壤理化性质Pearson相关性分析,可知其与土壤pH有正相关性。
3.4 长期施肥对黑土中真菌 α 多样性的影响本研究发现虽然不施肥处理、无机肥处理、有机无机配施处理的真菌 α 多样性总体上没有显著性差异,但是有机无机配施相对于无机肥有略提高真菌的多样性,无机肥有略降低土壤真菌的多样性的趋势,这与Zhou等[20]发现长期施用无机氮肥会降低土壤真菌的 α 多样性相一致。而Lou等[36]通过PCR-DGGE方法研究报道无机肥和有机肥均会显著增加真菌多样性,尤其是有机肥,结果的不同很可能是因为试验方法和土壤类型的差别。
3.5 长期施肥对黑土中真菌组成的影响Ascomycota的相对丰度在不施肥处理 (45.35%),有机无机配施处理 (50.93%) 和无机肥 (56.16%) 处理中大于单施有机肥处理 (35.47%) 的相对丰度,说明Ascomycota对无论有机肥和无机肥均不稳定。有机无机配施处理和无机肥处理中Ascomycota的相对丰度增加,是因为土壤中施入含氮的肥料使土壤中氮含量相对高,而土壤中施入适量氮能增加Ascomycota的百分比[13]。Zygomycota的相对丰度在单有机肥处理中要高于不施肥、有机无机配施和单施无机肥处理,有机粪肥提高了土壤中Zygomycota的含量,Neher等[37]研究发现Zygomycota的相对丰度与粪肥具有相关性。Cochliobolus在不施肥处理和单施无机肥处理均有较高的相对丰度,而在施入有机肥的MNPK处理和M处理中均大幅度降低;Exophiala和Alternaria有类似变化趋势。通过门和属两个水平的相对丰度分析得知,长期施用有机肥和无机肥会改变土壤中真菌组成的相对丰度。
丝状子囊菌属Cochliobolus具有高度的侵染性,其病原菌种对宿主植物具有特异性[38],引起作物病害,在M处理 (0.39%) 和MNPK处理 (0.41%) 含量均较低,而NPK处理 (2.08%) 比MNPK处理高1.67%,说明有机无机配施可以减少Cochliobolus的相对丰度,降低作物病害发生率。具有腐生性和病原性的真菌Exophiala[39]在无机肥处理中含量显著高于有机无机配施处理;虽然我们没有监测作物的发病情况,但从真菌的组成也可以初步分析得到有机肥无机肥配施具有潜在减少作物土传病害发生的作用。另外,通过土壤理化性质与真菌组成的CCA分析,可以知道土壤理化性质影响着土壤真菌群落结构,尤其是土壤的有效磷和铵态氮浓度是两个重要因素。影响真菌群落结构的主要理化性质均为速效养分,这可能是和土壤养分物质存在的形式有关系,土壤中养分物质存在形式又与地理环境、气候温度有相关性,例如,寒温带土壤中氮素化合物33%~42%的氮是以氨基酸形式存在,大约有10%的氨基酸水解成铵态氮[40]。
4 结论本研究通过对36年连续施用有机肥和无机肥土壤中真菌群落特征的研究,发现连续施用无机肥会导致土壤酸化,改变真菌群落结构,降低土壤真菌的多样性;而有机肥无机肥配施减缓土壤酸化,提高土壤真菌的多样性。从长期有机无机配施对真菌组成影响的分析可知,长期有机无机配施的真菌组成结构更有利于降低土传病害发生率。长期施用无机肥已导致黑土中真菌的数量增加,致使土壤由“细菌型”转化为“真菌型”,而有机无机配施可以改变这种变化趋势。CCA分析明确有效磷、铵态氮和硝态氮是影响土壤真菌群落结构变化重要土壤理化因素,同时土壤细菌/真菌比值与土壤pH正相关。
| [1] |
国家统计局黑龙江调查总队. 2014年黑龙江统计年鉴[M]. 北京: 中国统计出版社, 2014.
Heilongjiang survery office of national bureau of statistics of China. Heilongjiang statistical year book [M]. Beijing: China Statistica Press, 2014. |
| [2] | Wei D, Yang Q, Zhang J Z, et al. Bacterial communities structure and diversity in a black soil as affected by long-term fertilization[J]. Pedosphere, 2008, 18(5): 582–592. DOI:10.1016/S1002-0160(08)60052-1 |
| [3] | Zhou J, Guan D, Zhou B, et al. Influence of 34-years of fertilization on bacterial communities in an intensively cultivated black soil in northeast China[J]. Soil Biology and Biochemistry, 2015, 90: 42–51. DOI:10.1016/j.soilbio.2015.07.005 |
| [4] |
陶磊, 褚贵新, 刘涛, 等. 有机肥替代部分化肥对长期连作棉田产量、土壤微生物数量及酶活性的影响[J].
生态学报, 2014, 34(21): 6137–6146.
Tao L, Chu G X, Liu T, et al. Impacts of organic manure partial substitution for chemical fertilizer on cotton yield, soil microbial community and enzyme activities in mono-cropping system in drip irrigation condition[J]. Acta Ecologica Sinica, 2014, 34(21): 6137–6146. |
| [5] | Zhao J, Ni T, Li J, et al. Effects of organic-inorganic compound fertilizer with reduced chemical fertilizer application on crop yields, soil biological activity and bacterial community structure in a rice–wheat cropping system[J]. Applied Soil Ecology, 2016, 99: 1–12. DOI:10.1016/j.apsoil.2015.11.006 |
| [6] | Shen Q R, Tan J F, Qian X Q. An introduction to soil and fertilizer [J]. Beijing: Higher Education Press, 2001: 4–6, 270–271. |
| [7] | Krashevska V, Klarner B, Widyastuti R, et al. Impact of tropical lowland rainforest conversion into rubber and oil palm plantations on soil microbial communities[J]. Biology and Fertility of Soils, 2015, 51: 697–705. DOI:10.1007/s00374-015-1021-4 |
| [8] |
刘益仁, 郁洁, 李想, 等. 有机无机肥配施对麦-稻轮作系统土壤微生物学特性的影响[J].
农业环境科学学报, 2012, 31(5): 989–994.
Liu Y R, Yu J, Li X, et al. Effects of combined application of organic and inorganic fertilizers on soil microbiological characteristics in a wheat-rice rotation system[J]. Journal of Agro-Environment Science, 2012, 31(5): 989–994. |
| [9] | Van der Putten W H, Klironomos J N, Wardle D A. Microbial ecology of biological invasions[J]. International Society for Microbial Ecology, 2007, 1: 28–37. |
| [10] | Peršoh D. Plant-associated fungal communities in the light of meta’omics[J]. Fungal Diversity, 2015, 75(1): 1–25. DOI:10.1007/s13225-015-0334-9 |
| [11] | Wallenstein M D, Mcnulty S, Fernandez I J, et al. Nitrogen fertilization decreases forest soil fungal and bacterial biomass in three long-term experiments[J]. Forest Ecology and Management, 2006, 222(1-3): 459–468. DOI:10.1016/j.foreco.2005.11.002 |
| [12] | Edwards I P, Zak D R, Kellner H, et al. Simulated atmospheric N deposition alters fungal community composition and suppresses ligninolytic gene expression in a northern hard wood forest[J]. PLoS One, 2011, 6: e20421. DOI:10.1371/journal.pone.0020421 |
| [13] | Paungfoo-Lonhienne C, Yeoh Y K, Kasinadhuni N R, et al. Nitrogen fertilizer dose alters fungal communities in sugar cane soil and rhizosphere[J]. Scientific Report, 2015, 5: 8678. DOI:10.1038/srep08678 |
| [14] | Wu T. Can ectomycorrhizal fungi circumvent the nitrogen mineralization for plant nutrition in temperate forest ecosystems[J]. Soil Biology and Biochemistry, 2011, 43: 1109–1117. DOI:10.1016/j.soilbio.2011.02.003 |
| [15] | Gryndler M, Larsen J, Hrselová H, et al. Organic and mineral fertilization, respectively, increase and decrease the development of external mycelium of arbuscular mycorrhizal fungi in a long-term field experiment[J]. Mycorrhiza, 2006, 16(3): 159–166. DOI:10.1007/s00572-005-0027-4 |
| [16] | Mäder P, Fliessbach A, Dubois D, et al. Soil fertility and biodiversity in organic farming[J]. Science, 2002, 296(5573): 1694–1697. DOI:10.1126/science.1071148 |
| [17] | Lang J, Hu J, Ran W, et al. Control of cotton Verticillium wilt and fungal diversity of rhizosphere soils by bio-organic fertilizer[J]. Biology and Fertility of Soils, 2011, 48(2): 191–203. |
| [18] | Kiely P D, Call D F, Yates M D, et al. Anodic biofilms in microbial fuel cells harbor low numbers of higher-power-producingbacteria than abundant genera[J]. Applied Microbiology and Biotechnology, 2010, 88(1): 371–380. DOI:10.1007/s00253-010-2757-2 |
| [19] | Shokralla S, Spall J L, Gibson J F, et al. Next-generation sequencing technologies for environmental DNA research[J]. Molecular Ecology, 2012, 21(8): 1794–1805. DOI:10.1111/j.1365-294X.2012.05538.x |
| [20] | Zhou J, Jiang X, Zhou B, et al. Thirty four years of nitrogen fertilization decreases fungal diversity and alters fungal community composition in black soil in northeast China[J]. Soil Biology and Biochemistry, 2016, 95: 135–143. DOI:10.1016/j.soilbio.2015.12.012 |
| [21] |
陈剑山, 郑服丛. ITS序列分析在真菌分类鉴定中的应用[J].
安徽农业科学, 2007, 35(13): 3785–3786.
Chen J S, Zheng F C. Application of ITS sequences in fungi classification and identification[J]. Journal of Anhui Agricultural Sciences, 2007, 35(13): 3785–3786. |
| [22] |
燕勇, 李卫平, 高雯洁, 等. rDNA-ITS序列分析在真菌鉴定中的应用[J].
中国卫生检验杂志, 2008, 18(10): 1958–1961.
Yan Y, Li W P, Gao W J, et al. Application of rDNA ITS sequence analysis in fungus identification[J]. Chinese Journal of Health Laboratory Technology, 2008, 18(10): 1958–1961. |
| [23] |
鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 1999: 431–472.
Lu R K. Soil and agricultural chemistry analysis [M]. Beijing: China Agricultural Science and Technology Press, 1999: 431–472. |
| [24] |
马琳. 玉米施氮量与土壤硝态氮、铵态氮的动态变化[D]. 哈尔滨: 东北农业大学硕士学位论文, 2015.
Ma L. Nitrogen fertilizer rates on maize and the dynamic changes of nitrate and ammonium in soil [D]. Harbin: Master Dissertation of Northeast Agricultural University, 2015. |
| [25] | Fierer N, Lauber C L, Ramirez K S, et al. Comparative metagenomic, phylogenetic and physiological analyses of soil microbial communities across nitrogen gradients[J]. The ISME Journal, 2012, 6: 1007–1017. DOI:10.1038/ismej.2011.159 |
| [26] | Orgiazzi A, Lumini E, Nilsson R H, et al. Unravelling soil fungal communities from different Mediterranean land-use back grounds[J]. PloS One, 2012, 7: e34847. DOI:10.1371/journal.pone.0034847 |
| [27] | Schoch C L, Seifert K A, Huhndorf S, et al. Nuclear ribosomal internal transcribed spacer (ITS) region as a universal DNA barcode marker for fungi[J]. Proceedings of the National Academy of Sciences, 2012, 109: 6241–6246. DOI:10.1073/pnas.1117018109 |
| [28] | Chinnadurai C, Gopalaswamy G, Balachandar D. Long term effects of nutrient management regimes on abundance of bacterial genes and soil biochemical processes for fertility sustainability in a semi-arid tropical Alfisol[J]. Geoderma, 2014, 232: 563–572. |
| [29] | Ding J L, Jiang X, Ma M C, et al. Effect of 35 years inorganic fertilizer and manure amendment on structure of bacterial and archaeal communities in black soil of northeast China[J]. Applied Soil Ecology, 2016, 105: 187–195. DOI:10.1016/j.apsoil.2016.04.010 |
| [30] |
周晶, 姜昕, 周宝库, 等. 长期施用尿素对东北黑土中氨氧化古菌群落的影响[J].
中国农业科学, 2016, 49(2): 294–304.
Zhou J, Jiang X, Zhou B K, et al. Effects of long term application of urea on ammonia oxidizing archaea community in black soil in northeast China[J]. Scientia Agricultura Sinica, 2016, 49(2): 294–304. |
| [31] | Whalen J K, Chang C, Clayton G W, et al. Cattle manure amendments can increase the pH of acid soils[J]. Soil Science Society of America, 2000, 64(3): 962–966. DOI:10.2136/sssaj2000.643962x |
| [32] | GarcıÁ-Gil J C, Ceppi S B, Velasco M I, et al. Long-term effects of amendment with municipal solid waste compost on the elemental and acidic functional group composition and pH-buffer capacity of soil humic acids[J]. Geoderma, 2004, 121(1-2): 135–142. DOI:10.1016/j.geoderma.2003.11.004 |
| [33] | Rousk J, Bååth E, Brookes P C, et al. Soil bacterial and fungal communities across a pH gradient in an arable soil[J]. The ISME Journal, 2010, 4: 1340–1351. DOI:10.1038/ismej.2010.58 |
| [34] | Rousk J, Brookes P C, Bååth E. Contrasting soil pH effects on fungal and bacterial growth suggest functional redundancy in carbon mineralization[J]. Applied and Environmental Microbiology, 2009, 75(6): 1589–1596. DOI:10.1128/AEM.02775-08 |
| [35] | Ahn J H, Song J, Kim B Y, et al. Characterization of the bacterial and archaeal communities in rice field soils subjected to long-term fertilization practices[J]. Journal of Microbiology, 2012, 50(5): 754–765. DOI:10.1007/s12275-012-2409-6 |
| [36] | Luo P, Han X, Wang Y, et al. Influence of long-term fertilization on soil microbial biomass, dehydrogenase activity, and bacterial and fungal community structure in a brown soil of northeast China[J]. Annals of Microbiology, 2015, 65: 533–542. DOI:10.1007/s13213-014-0889-9 |
| [37] | Neher D A, Weicht T R, Bates S T, et al. Changes in bacterial and fungal communities across compost recipes, preparation methods, and composting times[J]. PLoS One, 2013, 8(11): e79512. DOI:10.1371/journal.pone.0079512 |
| [38] | Condon B J, Leng Y, Wu D, et al. Comparative genome structure, secondary metabolite, and effector coding capacity across cochliobolus pathogens[J]. PLoS Genetics, 2013, 9(1): e1003233. DOI:10.1371/journal.pgen.1003233 |
| [39] | Yu L, Nicolaisen M, Larsen J, et al. Organic fertilization alters the community composition of root associated fungi in Pisum sativum [J]. Soil Biology and Biochemistry, 2013, 58(8): 36–41. |
| [40] | Sowden F J, Chen Y, Schnitzer M. The nitrogen distribution in soils formed under widely differing climatic conditions[J]. Geochim Cosmochim Acta, 1977, 41(10): 1524–1526. DOI:10.1016/0016-7037(77)90257-5 |
 2017, Vol. 23
2017, Vol. 23  doi:
doi: 

