2 国家油料改良中心湖南分中心,湖南长沙 410128
2 National Center of Oilseed Crops Improvement, Hunan Branch, Changsha, Hunan 410128, China
氮 (N) 是作物生长所必需的营养元素之一,而生长后期氮素再利用是决定作物产量至关重要的因素之一[1–2]。据统计,目前油菜氮肥施用量已达200~300 kg/hm2,氮肥利用效率则不超过40%,造成了大量资源浪费和严重的环境问题[3]。硝态氮 (NO3–) 是旱地土壤中氮素的主要形态,是作物的重要氮源,高效利用从土壤中吸收的NO3– 并且累积在体内是作物应对缺氮环境的重要保证[4]。在蔬菜研究领域,NO3– 在叶片的累积和再利用一直是研究热点[5–6] ,但对经济作物有关的研究不多。
大量研究表明,开花前植物体内贮存的氮向籽粒的重新分配要比开花后期吸收的氮对籽粒氮贡献更重要[7],在作物收获期籽粒中50%~90%的氮来自营养器官氮素再利用[8]。NO3– 的再利用与氮素利用效率密切相关,开花后作物对氮素的吸收减少,油菜角果和花中氮的累积主要靠内源氮的再转运,NO3– 再利用量高的植株氮素利用效率也高[9–11]。NO3– 再分配对植株库器官发育乃至整个植株的代谢生理都能够产生重要影响。
植物生长后期氮素再转移主要由植株韧皮部来运输,NRT1.7基因的分离及其功能鉴定打破了无机氮不参与氮素再分配的传统理论,NO3– 可以通过叶片、根部韧皮部被直接转运[12–14]。迄今共发现3个NRT家族成员参与NO3– 韧皮部运输:NRT1.7、NRT1.9、NRT2.4,其中AtNRT1.7是叶片NO3– 再分配的重要调节基因[12],AtNRT1.9基因具有根部NO3– 韧皮部装载的功能[13],AtNRT2.4参与地上部韧皮部NO3– 的运输过程[14]。AtNRT1.5作为NRT1家族成员之一,具有装载根部木质部NO3– 的功能[15]。近年研究发现,拟南芥突变体nrt1.5中NO3– 在根与茎中的分配比例发生变化,有更多的NO3– 留在了植物根部[16–17]。乙烯是调控生长发育、成熟衰老的重要内源激素,具有影响果实成熟及植物的衰老等多种功能[18–19]。最近有研究表明,乙烯对拟南芥AtNRT1.5的表达有影响,在乙烯前体ACC的作用下AtNRT1.5表达量被抑制[20]。随着拟南芥NRT家族基因的相继克隆,越来越多NO3– 转运蛋白的具体功能被鉴定,但NRT家族基因的功能很少能在农作物生产实践中得到验证。通过前人的研究发现NRT1.5基因对NO3– 的转运具有很强的调控能力,因此猜想NRT1.5基因是否会对油菜生长后期叶片氮素营养的再利用起到一定的调控作用?
基于上述假设,本文以氮高效品种湘油15 (27号) 与氮低效品种814 (6号) 为试验材料,用不同基因型拟南芥 (col.0、nrt1.5) 材料作为验证,分别进行盆栽试验,研究NO3– 转运蛋白BnNRT1.5对油菜生长后期NO3– 累积和再利用的影响,进一步明确NRT1.5在植物生长后期NO3– 再利用过程中的作用,为进一步揭示油菜生长后期氮素再利用的调控机理及其与NUE的关系提供参考。
1 材料与方法 1.1 试验设计油菜试验于2015~2016年在湖南农业大学资源与环境试验基地的玻璃网室中进行,通风效果较好,与室外环境相通。供试油菜品种为本课题组经过大田试验筛选出的氮高效品种湘油15 (27号) 和氮低效品种814 (6号),其氮高效品种的氮素吸收与利用效率均高于氮低效品种。于2015年10月5日大田育苗,11月10日移栽,用32 cm × 23 cm × 24 cm红色塑料桶培育,每桶育一株,以水和稀盐酸清洗干净的珍珠岩作基质,进行砂培试验。在油菜不同生育期施用Hoagland完全营养液,每5天浇灌一次营养液,苗期、抽苔期、开花期、角果期浇灌量分别为400、750、500和250 mL [9]。营养液氮水平为15 mmol/L。于花期初期 (3月初) 开始浇灌1-氨基环丙烷-1-羧酸 (1-am-inocyclopropane-1-carboxylic acid,ACC),每7天浇灌一次,ACC体积为50 mL,浓度为100 μmol/L,以浇灌等量清水作为对照处理 (CK)。每个处理重复3次。
拟南芥试验于湖南农业大学资源环境学院温室中进行,室内温度控制在22℃,光照强度为80~200 mmol/(m2·s),16 h光照/8 h黑暗。试验为砂培试验,选取拟南芥野生型 (col.0) 和突变体 (nrt1.5-3,以col.0为背景的NRT1.5突变体) 材料[20]。育苗基质为蛭石∶珍珠岩 = 3∶1,发芽一周后移栽,采用10 cm × 10 cm × 10 cm塑料盒子培育 (外壁用黑色塑料袋包裹避光),以洗净的珍珠岩作基质,每盒培育8株。每5天浇灌一次1/4 Plant Nutrient Solution (PNS) 营养液 [20],苗期、抽苔期、开花期、角果期浇灌体积分别为100、150、100、50 mL。营养液氮水平均为2.25 mmol/L,每个突变体重复4次,随机区组排列。
1.2 取样及测定方法在油菜盛花期,摘取3株下、中、上部 (从下往上数第1、3、6叶位) 各一片叶,分别洗净、擦干、剪碎并称取1.00 g样品,用于不同叶位NO3– 含量的测定,重复3次;剪取油菜的最下端两片 (老叶) 叶柄及从下往上数第10、11片 (新叶) 叶柄,迅速将其平整面插入装有15 mL 10 mmol/L的EDTA-Na2溶液中,黑暗中,25℃恒温5小时,收集韧皮部汁液[21],提取液用于油菜老叶和新叶的韧皮部汁液NO3– 含量测定;在油菜花期和角果初期分别取地上生长健壮部叶片混匀,液氮速冻,于–80℃冰箱保存,用于测定BnNRT1.5的表达量。收获期样品于105℃下杀青,60℃~70℃烘干、称重,用于测定植株全氮,重复5次。在拟南芥盛花期,取8株莲座叶混合样、茎上叶混合样分别作为老叶、新叶,剪碎后称取0.500 g用于测定鲜样NO3– 的含量;韧皮部汁液收集液体积为1 mL,收集方法同上;在80%~90%角果变黄时收获,杀青、烘干后称重,用于测定全氮。
NO3– 含量用可见光分光光度计法测定[22];全氮测定采用浓硫酸–双氧水消化[23],用AA3连续流动分析仪 (型号: Auto Analyzer 3,德国) 测定[24];提取叶片RNA并转换成cDNA,采用表1的目标基因和参考基因的引物序列进行qPCR扩增[20],测定BnNRT1.5的相对表达量。
计算公式[25]:
籽粒产量为基础的氮素生理效率 = 籽粒产量/植株全氮总量
生物产量为基础的氮素生理效率 = 生物产量/植株全氮总量
氮收获指数 (NHI) = 籽粒全氮/植株全氮总量
收获指数 (HI) = 籽粒产量/生物产量
变化率 = (处理值 – 对照值)/对照值 × 100%
| 表1 油菜qRT-PCR的引物序列表 Table 1 Sequences of qRT-PCR primer for rape |
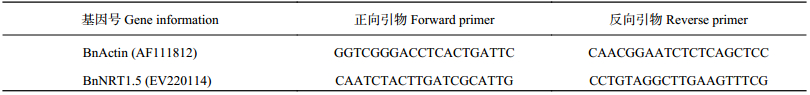 |
试验所得数据用Microsoft Excel软件计算,用DPS软件统计分析。
2 结果与分析 2.1 ACC处理对油菜叶片及韧皮部汁液中NO3– 含量及分配的影响表2表明,正常处理下,花期两油菜品种叶片NO3– 含量由高到低为上部叶片 > 中部叶 > 下部叶,6号上部叶与中部叶NO 3– 含量都显著高于27号,但是两品种下部衰老叶片的NO3– 含量差异不显著。说明花期叶片NO3– 主要集中在中、上部,并且6号品种叶片NO3– 含量总体高于27号。
ACC处理之后,6号各部位叶片NO3– 含量顺序变为上部叶 > 下部叶 > 中部叶,27号各部位叶片NO 3– 含量顺序变为下部叶 > 上部叶 > 中部叶。相对于对照,两品种的下部叶片NO 3– 含量都极显著提高。植株叶片NO3– 分配比例发生改变。6号下部叶片NO3– 含量与中部、上部叶片NO3– 含量比值在对照植株中分别为26.6% 和19.9%,处理后比例提高到161.4% 和51.1%。27号下部叶与中部叶片、上部叶NO3– 的比例为77.1%、59.4%,处理后比例提高到221.0%、106.0%。6号中部叶片NO3– 含量显著降低,27号没有显著变化。油菜上部叶片NO3– 含量相对稳定。说明ACC处理影响了油菜叶片NO3– 的分布,对下部老叶叶片NO3– 含量影响较大,对幼嫩叶片NO3– 的影响较小。
| 表2 不同氮效率油菜花期不同叶位NO3– 含量及比例 Table 2 NO3– content and proportion in different leaves of different B. napus genotypes at flowering stage |
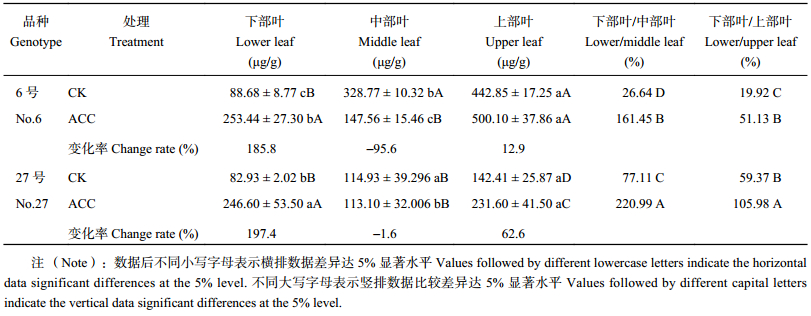 |
表3结果表明,不同氮效率油菜花期6号叶片韧皮部NO3– 含量比27号高。不同品种油菜韧皮部中NO3– 含量不同,但总趋势是新叶 (上部叶) > 老叶 (下部叶)。品种间叶片韧皮部NO 3– 含量比例不同。6号老叶/新叶为52.4%,而27号老叶/新叶则为79.6%,导致品种间老叶/新叶比例差异极显著的原因主要是6号的新叶韧皮部汁液NO3– 浓度较高。开花期6号、27号老叶韧皮部NO3– 量差异不显著。
ACC处理之后,6号老叶、新叶韧皮部NO3– 含量均显著降低,老叶下降了49.7%,新叶下降了40.39%;27号老叶韧皮部NO3– 含量下降了42.8%,新叶含量无显著变化,说明ACC影响油菜叶片韧皮部NO3– 含量及其转运,但不同油菜品种间的影响有差异。ACC处理后,6号和27号韧皮部老叶/新叶NO3– 含量比例,分别从52.4%、79.6%下降到43.1%、46.0%,说明ACC处理对老叶韧皮部NO3– 转运的影响要大于对新叶的影响。
| 表3 不同氮效率油菜花期老叶、新叶韧皮部汁液中NO3– 含量及比例 Table 3 NO3– content and proportion in phloem sap of the old leaves and new leaves in different B. napus genotypes |
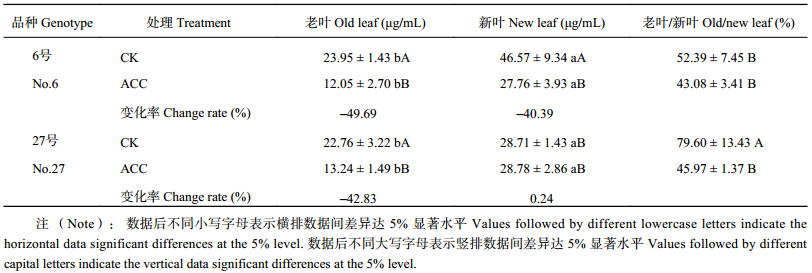 |
表4结果表明,27号生物产量、籽粒产量、籽粒含氮量、收获指数、氮收获指数和NUE (生物产量/植株全氮) 均显著高于6号品种,植株含氮量和植株全氮差异并不显著。
不同品种油菜对ACC的响应存在差异。6号品种ACC与CK相比,生物产量、籽粒产量、NUE (生物产量/植株全氮)、NUE (籽粒产量/植株全氮) 显著降低,但籽粒含氮量却显著提高;27号品种ACC与CK相比,ACC植株全氮和收获指数显著提高,虽然生物产量差异不显著,但NUE显著低于CK。
| 表4 不同基因型油菜产量及氮效率的变化值 Table 4 The variation of seed yield and N use efficiency of different B. napus genotypes |
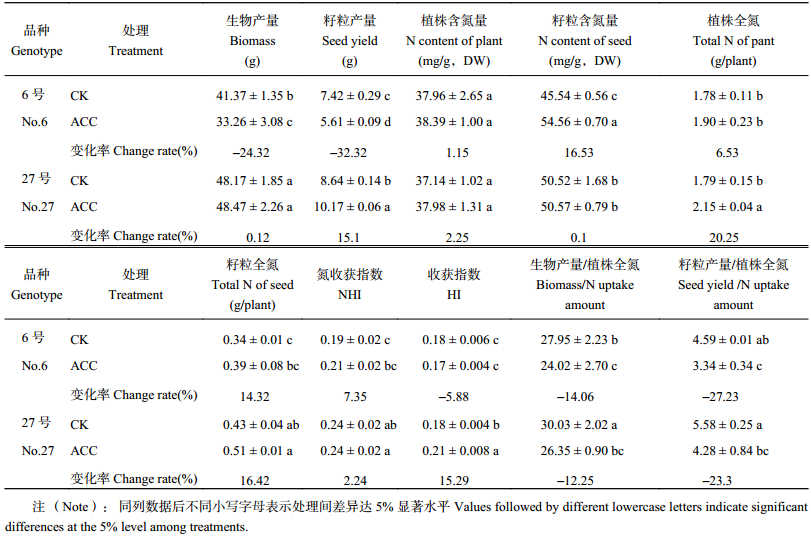 |
图1表明,ACC处理之后,27号和6号在花期以及角果初期BnNRT1.5的表达量显著下降。说明ACC处理可以显著抑制油菜生长后期BnNRT1.5的表达。相对于盛花期,角果初期BnNRT1.5的表达量显著升高,表明衰老对于BnNRT1.5的表达有强烈诱导作用。
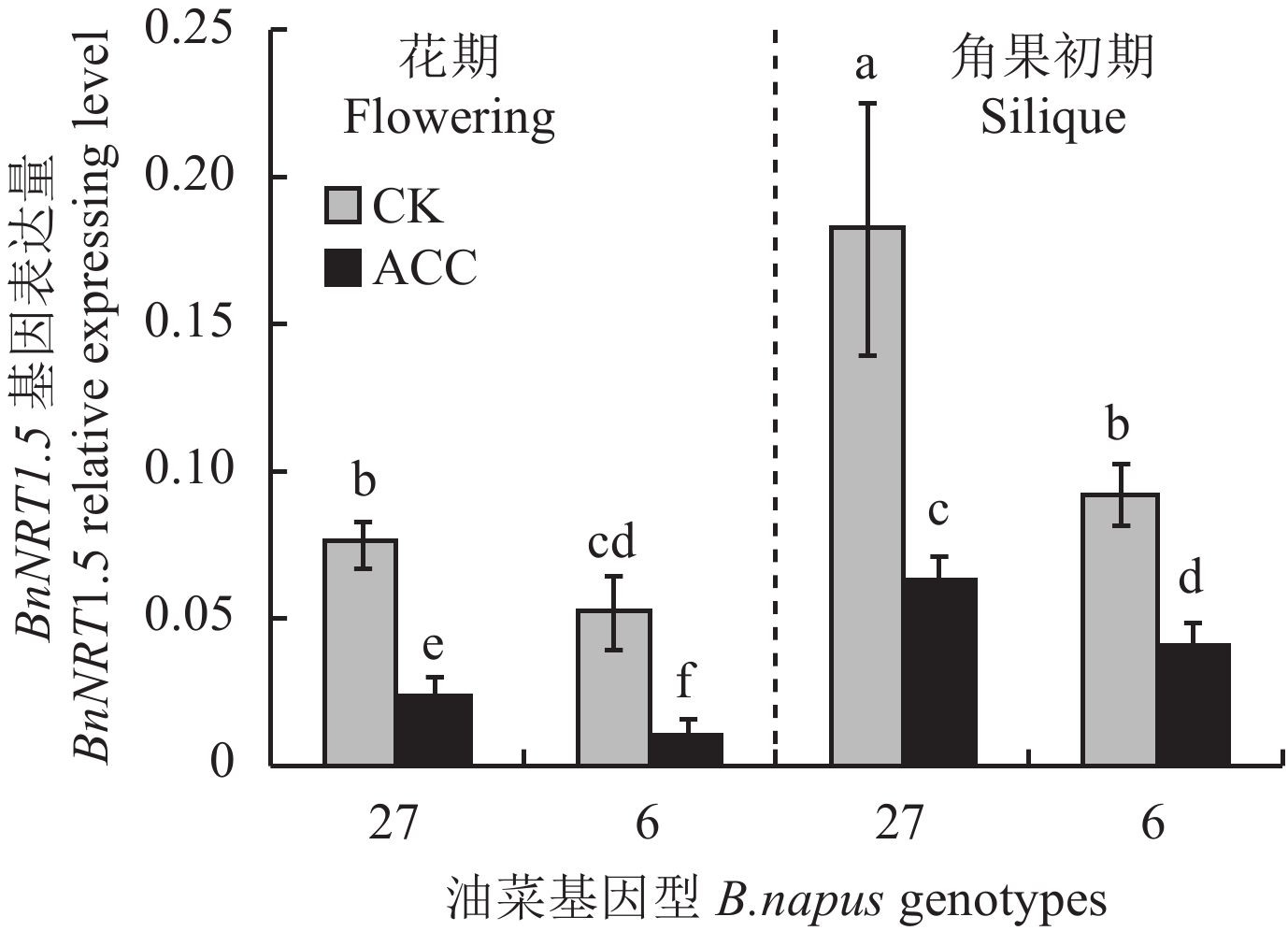 |
| 图1 不同油菜基因型地上部BnNRT1.5相对表达量 Fig. 1 Relative expression of BnNRT1.5 in shoot of B. napus genotypes [注(Note):方柱上不同字母表示处理间在 5% 水平差异显著 Different letters above bars mean significant differences among treatments at the 5% level.] |
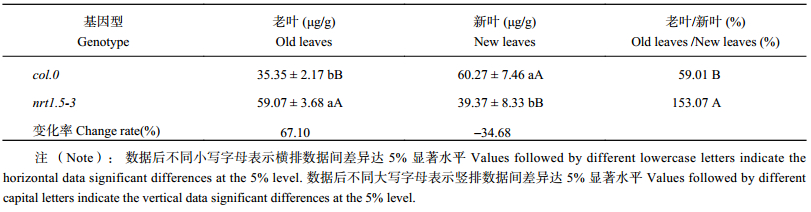
表5表明,col.0老叶中NO3– 含量显著低于新叶,NO3– 含量老叶/新叶为59.0%,但在nrt1.5-3中却相反,老叶中NO3– 含量显著高于新叶,NO3– 含量老叶/新叶为153.1%。说明AtNRT1.5突变之后,NO3– 在拟南芥老叶中显著积累。
| 表5 不同拟南芥老叶、新叶NO3– 含量及比例 Table 5 NO3– content and proportion in old leaves and new leaves of two A. thaliana genotypes |
 |
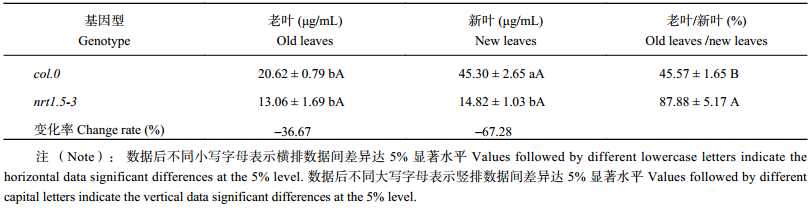
由表6看出,AtNRT1.5突变导致拟南芥韧皮部汁液NO3– 含量和分配改变。col.0新叶韧皮部汁液NO3– 含量为45.30 μg/mL,显著高于其老叶中含量。nrt1.5-3新叶韧皮部汁液NO3– 含量为59.07 μg/mL,显著低于其老叶中含量。与col.0相比,突变体nrt1.5-3新叶韧皮部汁液NO3– 含量下降67.3%,达到差异显著水平;老叶韧皮部汁液NO3– 含量下降36.7%,达到差异显著水平。col.0韧皮部NO3– 含量老叶/新叶比例为45.6%,而nrt1.5-3中比例高达87.9%。说明AtNRT1.5突变影响植株韧皮部汁液中NO3– 在库源之间的再运输,老叶中NO3– 通过韧皮部向新叶的转运减少,这是导致突变体nrt1.5-3老叶NO3– 显著积累的主要原因之一。
| 表6 不同拟南芥老叶、新叶韧皮部汁液NO3– 含量及比例 Table 6 NO3– content and d proportion in the phloem sap of old leaves and new leaves in two Athaliana genotypes |
 |
收获期产量及氮效率是评价植株生长情况的重要指标。从表7可知,拟南芥植株nrt1.5-3含氮量、籽粒含氮量显著高于col.0。nrt1.5-3生物产量、籽粒产量、籽粒全氮、NUE (籽粒产量/植株全氮) 和NUE (生物产量/植株全氮) 均显著低于col.0。可见,拟南芥AtNRT1.5基因突变会导致植株的生物量、籽粒产量、收获指数、氮收获指数和NUE显著下降。
| 表7 不同基因型拟南芥产量及氮效率的变化值 Table 7 The variation of yield and N use efficiency of different Athaliana genotypes |
 |
乙烯是重要的内源激素,能调控植物的代谢,同时乙烯作为一种信号分子,参与植物的抗病、机械损伤及抗逆性反应,影响果蔬的成熟与衰老,调控植物代谢基因的表达[26]。植物生长调节剂乙烯利通过释放乙烯起作用。ACC作为乙烯合成的前体物质,经过ACS、ACO等酶的催化合成乙烯[27],因此,外加ACC和乙烯利处理都可以被认为是添加乙烯处理。氮低效油菜 (6号) 在乙烯处理下,无论植株全氮还是籽粒全氮相对于对照没有显著变化,但籽粒含氮量却提高了16.5%;在乙烯作用下,氮高效油菜 (27号) 籽粒全氮有增加的趋势但是没有达到显著差异,植株全氮却显著提高20.2% (表4),与喷施一定浓度乙烯利能提高花生籽粒全氮和冬小麦地上部全氮的结果相一致[28–29]。可见,乙烯显著影响植株全氮以及籽粒全氮,但影响到底是正面还是负面还因作物基因型差异以及生育期不同而有所差异。
乙烯对提高作物产量方面的研究存在争议,有研究者认为乙烯处理能提高作物的产量[28],有研究者认为乙烯对产量因子没有显著影响[30],也有研究者认为乙烯通过降低光合作用降低产量[31]。氮低效油菜 (6号) 的研究发现,ACC确实会使收获期油菜生物产量以及籽粒产量降低,与程云清等用ACC处理大豆得到的结果一致,可能与乙烯改变油菜叶片NO3– 含量 (表2),降低NO3– 再利用能力有关 (表3)。但从ACC处理使氮高效油菜 (27号) 籽粒产量显著提高的研究结果 (表4) 来看,ACC处理提高油菜籽粒产量的结果与葛建军乙烯提高花生产量的研究一致。作物收获指数是作物收获时经济产量与生物产量之比,一定程度上反映了源器官光合产物转运到库器官的能力大小。6号、27号两油菜品种的收获指数为0.18 (表4) 与杨兰等[32]油菜收获指数为0.14~0.17的结果相近,但低于宋海星等[25]油菜收获指数为0.23~0.26的结果,可能与培养条件差异有关。因此乙烯是否能提高作物全氮、产量以及收获指数与作物的基因型及培养条件有关。
3.2 NO3– 转运蛋白基因 (NRT1.5) 对氮效率的调控作物拥有较高的氮素利用效率 (NUE) 是作物获得高产的重要保障,氮效率高低由氮素吸收效率和利用效率共同决定,作物生长后期由于根系吸收能力减弱,不能很好地利用环境中的氮素,所以植物生长后期提高氮素利用效率往往作为提高作物氮效率的重要手段。植物生长后期氮素转移主要以有机氮 (如Rubisco) 和无机氮 (NO3–) 的形式存在,无机氮 (NO3–) 不但为植物的生长提供营养,而且作为信号分子调控植物代谢过程[32–33]。近年来国内外越来越多的学者关注植物NO3– 的吸收转运过程以及NO3– 代谢有关基因的研究,与氮代谢有关转运蛋白与基因的研究或许将成为下一个提高NUE的研究重点与热点[34–35]。有发现超表达烟草中与氮素吸收、同化有关的基因,如GS基因能够提高植株的氮效率,但也有研究发现即使超表达苜蓿GS基因却并没使其氮效率得到提高[36–37]。NO3– 转运蛋白与NO3– 的吸收、同化以及利用密切相关。目前,已经克隆了4类NO3– 转运蛋白基因家族,主要包括NRT1、NRT2、CLC和SLAC[38]。NRT1.5属于NRT1家族成员,是一种低亲和双向转运蛋白,它位于质膜中,在靠近木质部的中柱鞘细胞中表达,具有装载根部木质部NO3– 的功能[15]。近年研究发现,当拟南芥受到Cd2+ 胁迫时,AtNRT1.5在根部的表达受抑制,同时AtNRT1.8表达上调;拟南芥突变体nrt1.5中更多的NO3– 累积在根部,AtNRT1.5缺失改变植物体NO3– 在根与茎中的分配比例[16–17]。乙烯处理后油菜BnNRT1.5的表达量显著降低 (图1),与前人用乙烯处理拟南芥,AtNRT1.5表达量被抑制的研究结果一致[17, 20];且角果期的抑制作用比花期的抑制强烈 (图1),可能与AtNRT1.5还受到衰老的诱导调控有关[22]。
拟南芥的试验也证实了NRT1.5参与植物生长后期氮素再转运的猜想。拟南芥AtNRT1.5不仅参与NO3– 在根与茎中的装载,而且对拟南芥生长后期叶片中NO3– 的累积和转运有重要意义。突变体nrt1.5-3衰老叶片中NO3– 显著积累,新叶NO3– 含量显著下降 (表5),NO3– 转运受阻,无论老叶还是新叶nrt1.5突变体韧皮部NO3– 含量相对于对照都降低 (表6)。由于NO3–不能及时转运到其它生长旺盛部位,造成突变体植株生物产量、籽粒产量,NUE均显著低于野生型col.0 (表7)。
4 结论油菜生长后期氮素的再利用能力受到乙烯 (100 μmol/L ACC处理) 的显著调控,油菜NRT1.5基因表达量受到抑制或者拟南芥NRT1.5基因发生突变时,会导致植株韧皮部汁液NO3– 再转运量减少,新叶NO3– 含量显著下降,更多NO3– 累积在衰老叶片中而不能得以高效的再利用,进而影响油菜生长后期的生物产量以及氮素利用效率。因此,调控NRT1.5的表达提高植株生长后期氮素的再转运和再利用可以作为提高植物NUE的有效手段。
| [1] | Gastal F, Lemaire G. N uptake and distribution in crops: an agronomical and ecophysiological perspective[J]. Journal of Experimental Botany, 2002, 53(370): 789–799. DOI:10.1093/jexbot/53.370.789 |
| [2] | Good A G, Shrawat A K, Muench D G. Can less yield more? Is reducing nutrient input into the environment compatible with maintaining crop production?[J]. Trends in Plant Science, 2004, 9(12): 597–605. DOI:10.1016/j.tplants.2004.10.008 |
| [3] |
杨睿, 伍晓明, 安蓉, 等. 同基因型油菜氮素利用效率的差异及其与农艺性状和氮营养性状的关系[J].
植物营养与肥料学报, 2013, 19(3): 586–596.
Yang R, Wu X M, An R, et al. Differences of nitrogen use efficiency of rapeseed (Brassica napus L.) genotypes and their relations to agronomic and nitrogen characteristics [J]. Journal of Plant Nutrition and Fertilizer, 2013, 19(3): 586–596. DOI:10.11674/zwyf.2013.0308 |
| [4] |
刘金鑫, 田秋英, 陈范骏, 米国华. 玉米硝酸盐累积及其在适应持续低氮胁迫中的作用[J].
植物营养与肥料学报, 2009, 15(3): 501–505.
Liu J X, Tian Q Y, Chen F J, Mi G H.. Nitrate accumulation in miaze and its role in adaptation to lasting low nitrogen environments[J]. Journal of Plant Nutrition and Fertilizer, 2009, 15(3): 501–505. |
| [5] |
张英鹏, 徐旭军, 林咸永, 等. 氮素形态对菠菜可食部分硝酸盐和草酸累积的影响[J].
植物营养与肥料学报, 2006, 12(2): 227–232.
Zhang Y P, Xu X J, Lin X Y, et al. Effects of nitrogen forms on nitrate and oxalate accumulation in edible parts of spinach[J]. Plant Nutrition and Fertilizer science, 2006, 12(2): 227–232. DOI:10.11674/zwyf.2006.0214 |
| [6] |
都韶婷, 章永松. 增施CO2降低小白菜硝酸盐积累的机理研究
[J].
植物营养与肥料学报, 2010, 16(6): 1509–1514.
Du S T, Zhang Y S. Mechanisms of CO2 enrichment-induced decrease of nitrate accumulation in Chinese cabbage (Brassica chinensis L.) [J]. Plant Nutrition and Fertilizer Science, 2010, 16(6): 1509–1514. DOI:10.11674/zwyf.2010.0630 |
| [7] | Malagoli P, Laine P, Ourry A, et al. Dynamics of nitrogen uptake and mobilization in field-grown winter oilseed rape (Brassica napus) from stem extension to harvest [J]. Annals of Botany, 2005, 95(7): 1187–1198. DOI:10.1093/aob/mci131 |
| [8] | Kichey T, Hirel B, Heumez E, Dubois F, Le Gouis J. In winter wheat (Triticum aestivum L.) post an thesis nitrogen uptake and remobilization to the grain correlates with agronomic traits and nitrogen physiological markers [J]. Field Crops Research, 2007, 102(1): 22–32. DOI:10.1016/j.fcr.2007.01.002 |
| [9] |
杨兰, 荣湘民, 宋海星, 等. 生长调节剂对油菜产量及氮素利用效率的影响[J].
湖南农业科学, 2012, 33(05): 27–29.
Yang L, Rong X M, Song H X, et al. Effects of growth regulator on yield and nitrogen physiological efficiency of rape[J]. Hunan Agricultural Sciences, 2012, 33(05): 27–29. DOI:10.3969/j.issn.1006-060X.2012.05.008 |
| [10] | Zhang Z H, Song H X, Liu Q, Rong X M, et al. Study on differences of nitrogen efficiency and nitrogen response in different oilseed rape (Brassica napus L.) varieties [J]. Asia Journal of Crop Science, 2009, 1(2): 105–112. DOI:10.3923/ajcs.2009.105.112 |
| [11] | Marschner H. Mineral nutrition in higher plants[J]. Plant, Cell & Environment, 1988, 11(2): 147–148. |
| [12] | Fan S C, Lin C S, Hsu PK, et al. The Arabidopsis nitrate transporter NRT1.7, expressed in phloem, is responsible for source-to-sink remobilization of nitrate [J]. Plant Cell, 2009, 21(9): 2750–2761. DOI:10.1105/tpc.109.067603 |
| [13] | Wang Y Y, Tsay Y F. Arabidopsis nitrate transporter NRT1.9 is important in phloem nitrate transport[J]. The Plant Cell, 2011, 23(5): 1945–1957. DOI:10.1105/tpc.111.083618 |
| [14] | Kiba T, Feriabourrellier A B, Lafouge F, et al. The Arabidopsis nitrate transporter NRT2.4 plays a double Role in roots and shoots of nitrogen-starved plants [J]. The Plant Cell, 2012, 24(1): 830–835. |
| [15] | Lin S H, Kuo H F, Canivenc G, et al. Mutation of the Arabidopsis NRT1.5 nitrate transporter causes defective root-to-shoot nitrate transport [J]. The Plant Cell, 2008, 20(9): 2514–2528. DOI:10.1105/tpc.108.060244 |
| [16] | Zhang G B, Yi H Y, Gong J M. The Arabidopsis Ethylene/Jasmonic acid-NRT signaling module coordinates nitrate reallocation and the trade-off between growth and environmental adaptation [J]. The Plant Cell, 2014, 26(10): 3984–3998. DOI:10.1105/tpc.114.129296 |
| [17] | Chen C Z, Lv X F, Li J Y, et al. Arabidopsis NRT1.5 is another essential component in the regulation of nitrate reallocation and stress tolerance[J]. Plant Physiology, 2012, 159(4): 1582–1590. DOI:10.1104/pp.112.199257 |
| [18] |
杨晓颖, 胡伟, 徐碧玉, 金志强. 乙烯与果实成熟关系的研究进展[J].
热带农业科学, 2008, 28(2): 70–75.
Yang X Y, Hu W, Xu B Y, Jin Z Q. Advances on the relationship between ethylene and fruit ripening[J]. Chinese Journal of Tropical Agriculture, 2008, 28(2): 70–75. |
| [19] | Xie Q, Hu Z, Zhu Z, et al. Over expression of a novel MADS-box gene SlFYFL delays senescence, fruit ripening and abscission in tomato[J]. Scientific Reports, 2014, 4(7491): 4367. |
| [20] | Han Y L, Song H X, Yu Y, et al. Nitrogen use efficiency is mediated by vacuolar nitrate sequestration capacity in roots of Brassica napes [J]. Plant Physiology, 2016, 170(3): 1684–1698. |
| [21] | King R W, Zeevaart J A. Enhancement of phloem exudation from cut petioles by chelating agents[J]. Plant Physiology, 1974, 53(1): 96–103. DOI:10.1104/pp.53.1.96 |
| [22] |
李合生主编. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
Li H S. Plant physiology and biochemistry experiment principle and technology [M]. Beijing: Higher Education Press, 2000. |
| [23] |
鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000.
Bao S D. Soil chemistry analysis [M]. Beijing: Agricultural Press Chinese, 2000. |
| [24] |
张英利, 许安民, 尚浩博, 马爱生. AA3型连续流动分析仪测定土壤和植物全氮的方法研究[J].
西北农林科技大学学报, 2006, 34(10): 128–132.
Zhang Y L, Xu A M, Shan H B, Ma A S. Determination study of total nitrogen in soil and plant by continuous flow analytical system[J]. Journal of Northwest Sci-Tech University of Agriculture, 2006, 34(10): 128–132. DOI:10.3321/j.issn:1671-9387.2006.10.026 |
| [25] |
宋海星, 彭建伟, 刘强, 等. 不同氮素生理效率油菜生育后期氮素再分配特性研究[J].
中国农业科学, 2008, 41(6): 1858–1864.
Song H X, Peng J W, Liu Q, et al. Nitrogen redistribution characteristics of oilseed rape varieties with different nitrogen physiological efficiency during later growing period[J]. Scientia Agricultura Sinica, 2008, 41(6): 1858–1864. |
| [26] |
穆师洋, 胡文忠, 姜爱丽, 等. 乙烯的信号分子作用及其在采后果蔬生理代谢调控的研究进展[J].
食品工业科技, 2015, 36(3): 375–378.
Mu S Y, Hu W Z, Jing A L, et al. Research progress in the role of ACC as signal molecule and regulation of physiological metabolism in postharvest fruits and vegetables[J]. Science and Technology of Food Industry, 2015, 36(3): 375–378. |
| [27] |
陈新建, 刘国顺, 陈占宽, 等. 乙烯生物合成途径及其相关基因工程的研究进展[J].
热带亚热带植物学报, 2002, 10(1): 83–98.
Chen X J, Liu G S, Chen Z K, et al. A review of the pathway of ACC biosynthesis and the relevant genetic engineering[J]. Journal of Tropical and Subtropical Botany, 2002, 10(1): 83–98. |
| [28] |
葛建军, 朱林, 张国良, 等. 乙烯利对花生氮代谢和光合特性的影响[J].
花生学报, 2008, 37(2): 22–27.
Ge J J, Zhu L, Zhang G L, et al. Effects of ethephon on nitrogen metabolism and photosynthesis characters of peanut[J]. Journal of Peanut Science, 2008, 37(2): 22–27. |
| [29] |
Van Sanford D A, 等. 乙烯利和氮在冬小麦中的应用[J].
麦类作物学报, 1990, 6(6): 43–45.
Van Sanford D A, et al. Application of ethephon and nitrogen in winter wheat[J]. Journal of Triticeae Crops, 1990, 6(6): 43–45. |
| [30] |
叶德练, 王玉斌, 周琳, 等. 乙烯利和氮肥对夏玉米氮素吸收与利用及产量的调控效应[J].
作物学报, 2015, 41(11): 1701–1710.
Ye D L, Wang Y B, Zhou L, et al. Effect of ethephon and nitrogen fertilizer on nitrogen uptake, nitrogen use efficiency and yield of summer maize[J]. Acta Agronomica Sinica, 2015, 41(11): 1701–1710. |
| [31] | 程云清, 赵桂兰, 刘剑锋. 乙烯抑制剂AVG和促进剂ACC对大豆幼苗叶片光合特征的影响[J]. 浙江大学学报, 2010, 36(4): 419–426. |
| [32] | Chen X Q, Zhao G L, Liu J F, et al. Effects of ACC inhibitor and promoter on photosynthetic characteristics of soybean (Glycine max) seedling leaves [J]. Journal of Zhejiang University, 2010, 36(4): 419–426. |
| [33] |
张振华. 油菜体内氮素再分配与氮素生理效率的关系研究[D]. 长沙: 湖南农业大学硕士论文, 2007.
Zhang Z H, Studies on the relationship between the nitrogen distribution and the nitrogen physiological efficiency in oilseed rape [M]. Changsha: Master Dissertation of Hunan Agricultural Universally, 2007. |
| [34] |
李建勇, 龚继明. 植物硝酸根信号感受与传导途径[J].
植物生理学报, 2011, 47(2): 111–118.
Li J Y, Gong G M. Nitrate signal sensing and transduction in higher[J]. Plant Physiology Journal, 2011, 47(2): 111–118. |
| [35] |
张鹏, 张然然, 都韶婷. 植物体对硝态氮的吸收转运机制研究进展[J].
植物营养与肥料学报, 2015, 21(3): 752–762.
Zhang P, Zhang R R, Du S T. Research advances in nitrate uptake and transport in plants[J]. Journal of Plant Nutrition and Fertilizer, 2015, 21(3): 752–762. DOI:10.11674/zwyf.2015.0323 |
| [36] |
付捷, 田慧, 高亚军. 分子生物学途径提高作物氮效率研究进展[J].
中国土壤与肥料, 2013, (4): 1–5.
Fu J, Tian H, Gao Y G. Advances in molecular biological approaches for improving nitrogen efficiency of crops[J]. Soil and Fertilizer Sciences in China, 2013, (4): 1–5. |
| [37] | Oliveira I C, Brears T, Knight T J, et al. Overexpression of cytosolic glutamine synthetase: relation to nitrogen, light and photorespiration[J]. Plant Physiology, 2002, 129(3): 1170–1180. DOI:10.1104/pp.020013 |
| [38] | Ortega J L, Temple S J, Sengupta-Gopalan C. Constitutive overexpression of cytosolic glutamine synthetase (GS1) gene in transgenic alfalfa demonstrates that GS1 may be regulated at the level of RNA stability and protein turnover [J]. Plant Physiology, 2001, 126(1): 109–121. DOI:10.1104/pp.126.1.109 |
| [39] | Wang Y, et al. Uptake, allocation and signaling of nitrate[J]. Trend in Plant Science, 2012, 17(8): 458–467. DOI:10.1016/j.tplants.2012.04.006 |
 2017, Vol. 23
2017, Vol. 23  doi:
doi: 

