近半个世纪以来,随着工业的发展,大气CO2浓度不断上升。预计到本世纪中叶达到550 μmol/mol,到本世纪末CO2浓度将超过730 μmol/mol[1–2]。大气CO2浓度的这种不正常升高引起的以气候变暖为标志的全球气候变化可能导致中国干旱、半干旱区降水量发生改变[3–5]。降水量的大小决定了植物可利用水分的多少,水分改变既可以影响养分从土壤向根表的迁移速率,也可以影响根系的呼吸能力。CO2和水分作为植物生命活动最重要的因子对根系形态结构的影响已引起许多学者的关注。目前,多数研究认为,高CO2浓度和干旱条件对根系生长有促进作用,植物的细根总长度、根生物量、根冠比均会明显增加[6–7]。但也有研究指出,降水减少导致的干旱胁迫会抑制CO2浓度升高对根系的促进作用[8],而单纯的降水量增加对植物幼苗根系各指标均有促进作用[9]。此外,CO2和水分改变除了影响植物根系形态的变化外,也会影响植物根系碳氮含量的改变,但不同植物的变化不同[10]。这些研究说明,不同植物的根系形态及功能特征对CO2升高和降水变化的响应存在一定差异,这种差异因植物自身特性或研究方法而异。
红砂 (Reaumuria soongorica) 是荒漠地区优势植物之一,具有耐瘠薄、适应性广、集沙能力强等特点,对荒漠地区的生态保护具有重要作用[11]。但因其长期生长在条件严酷、人类活动频繁的环境中,致使分布面积缩小、种群数量减少,严重影响了荒漠生态系统的稳定性。虽然前人逐渐认识到红砂研究的重要性,在红砂种子、叶片、根系、种群结构以及抗旱生理等方面已做了大量的研究[12–17],但在未来荒漠生态系统对大气CO2浓度升高响应的敏感度很大程度上依赖于降水量多少的形势下[18],红砂如何应对这种变化还未得知。为此,本文以两年生红砂为研究对象,在其生长季节内通过人工控制CO2浓度和降水量来开展模拟试验,旨在探讨CO2浓度升高和降水变化对红砂根系形态结构及其功能特征的影响,为科学预测未来气候变化对荒漠植被生长的影响趋势及植被恢复提供理论指导和科学依据。
1 材料与方法 1.1 试验材料和设计试验于2015年4月~2016年11月在甘肃农业大学校内试验基地进行。2015年4月底,从苗圃选取生长一致的同一批民勤种源幼苗移栽到30 cm × 60 cm,高50 cm的种植盒内培育,每盒栽种8株。盒内实验用土均取自种源地民勤红砂灌木林下0—20 cm土壤。种植盒底部有排水孔,并在排水孔下套塑料袋以防止水泄漏。2016年3月对苗木充分浇水,待缓苗1个多月后于5月初开始进行CO 2熏气和降水处理。选择民勤种源红砂作为研究材料的主要原因:1) 民勤是红砂自然集中分布区;2) 全球气候变暖条件下该区降水格局发生了明显变化。因此,可在此降水的基础上,合理地设计不同降水处理。
试验设对照 (现在的大气CO2浓度,345~355 μmol/mol)、540~550 μmol/mol和690~710 μmol/mol 3个CO2浓度水平,每个浓度水平3次重复,共设9个开顶式CO2控制气室。气室面积3.75 m2 (1.5 m × 2.5 m),高1.5 m。以液体钢瓶CO 2为气源,CO2自动控制系统24 h不间断进行控制和监测气室CO2浓度。气室内光源为自然光,温度通过顶部气体流通和气室侧面换气扇控制在外界温度 ± 1.5℃,气室内气温和相对湿度用干湿温度计 (KTH-2型,天津市凯隆达仪器仪表有限公司) 进行测定。
在每个CO2浓度水平下,根据选取红砂民勤种源生长季 (5~9月) 每月平均降水 (1961~2008年近50年这几个月的月平均值降水量为基准) 设置降水。民勤荒漠区气象资料显示,1961~2008年的年平均降水主要集中在5~9月份,这几个月的总降水量为95.5 mm,月均降水量为19.5 mm,占年降水量的86.1%[19]。降水控制试验主要考虑降水量,设置5个降水处理:降水量减少30% (–30%)、减少15% (–15%)、对照 (100%)、增加15% (+15%) 和增加30% (+30%),对照是指以民勤荒漠区近50年红砂生长旺盛期 (5~9月) 每月的降水量为基准对照,换算为各处理每月的总灌水量,分10次施入 (每3天一次),雨天及时扣上罩子防雨。每个气室内每个水分处理设3次重复。月平均降水量及各水分处理每次灌水量见表1。
| 表1 1961~2008年月平均降水量及每次灌水量 Table 1 Average monthly precipitation during 1961–2008 and each irrigation amount |
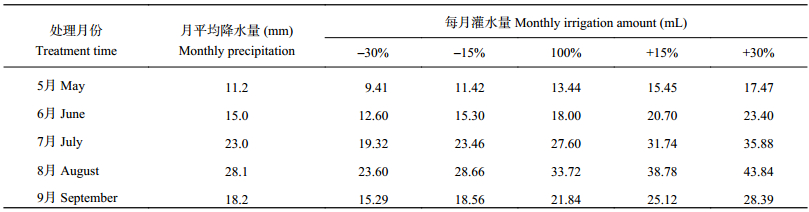 |
于10月中旬在每个处理下选3盒红砂,每盒选2株具有代表性植株进行破坏性取样,用小铲挖出整株根系,除去沙土并用钢卷尺测定主根长,然后从基径处将植物地上部分与根系分离,用数字化扫描仪 (Epson Scanner Perfection 1200型,北京华逸融晖科技有限公司) 进行根系扫描,扫描完成后用WinRhizon根系分析系统 (北京易科泰生科技有限公司) 进行红砂根系形态指标分析,获得总根长、总表面积、总根体积、根平均直径,将扫描后的根系装入信封在80℃下烘干至恒重后称重,得到其根系生物量。并计算根冠比、比根长和比表面积:
根冠比 (root/shoot ratio,RSR) = 地下生物量 (g)/地上生物量 (g)
比根长 (specific root length,SRL) = 根长 (m)/根生物量 (g)
比表面积 (specific root area,SRA) = 根表面积 (cm2)/根生物量 (g)
根中碳含量用重铬酸钾氧化外加热法测定,根中氮含量采用凯氏定氮仪 (KDN-04B,浙江托普仪器有限公司) 测定。根据测定结果计算红砂各个器官的C/N。
1.3 数据处理与分析基本数据分析和绘图采用Microsoft Excel 2010,采用SPSS 17.0单因素方差分析 (two-way ANOVA) 对不同降水量间红砂根系形态指标及碳 (C)、氮 (N) 含量和C/N进行差异显著性水平的检验 (P = 0.05),用双因素方差分析 (two-way ANOVA) 检验CO2浓度和降水量的主效应及其交互作用。
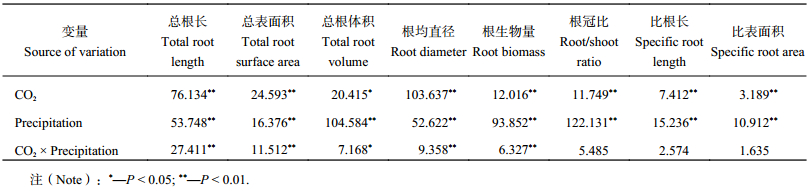
2 结果与分析 2.1 CO2浓度升高及降水变化对红砂总根长、总表面积和总根体积变化的影响双因素方差分析结果 (表2) 显示,CO2浓度升高、降水量变化及二者的交互作用对红砂总根长和总表面积均有极显著影响 (P < 0.01);降水量对总根体积有极显著影响 ( P < 0.01),而CO 2浓度及其与降水量的交互作用对总根体积有显著影响 (P < 0.05)。
| 表2 CO2浓度升高及降水变化对红砂根系形态指标影响的双因素方差分析结果(F值) Table 2 Root morphology indexes of R. soongorica affected by the elevated CO2 concentration and precipitation |
 |
CO2浓度升高,红砂根系总根长、总表面积和总根体积3个形态指标在5种降水量下均呈增加趋势 (图1),CO2浓度增加到700 μmol/mol时,降水–30%、–15%、100%、+15%、+30%处理总根长比350 μmol/mol CO2浓度下分别增加33.3%、54.4%、23.5%、59.8%和46.6% (P < 0.05),总表面积分别增加38.2%、41.4%、29.2%、48.4%和46.4%,总根体积分别增加28.9%、31.5%、24.1%、26.8%和27.3%。
 |
| 图1 不同CO2浓度和降水处理红砂总根长、总表面积和总根体积的变化 Fig. 1 Variations of total root length, root surface area and root volume of R.soongorica affected by CO2 concentration and precipitation [注(Note):方柱上不同小写字母代表同一CO2浓度下不同降水量间差异显著(P < 0.05) Different letters above the bars are significantly different among different precipitation treatments under the same CO2 concentration at the P < 0.05 level.] |
随着降水量的变化 (减少或增加),红砂根系总根长、总表面积和总根体积均比自然降水下的有所增加,CO2浓度增加虽然显著增加了这几个指标的值,但并没有改变随降水量而变化的趋势。当CO2浓度增加至700 μmol/mol,降水–30%、–15%、+15%、+30%处理总根长分别比对照降水100%的增加38.8%、21.9%、11.6%和25.5%,总表面积分别增加51.6%、32.2%、43.5%和62.9%,总根体积分别增加82.7%、62.2%、25.51%和33.7%。
2.2 CO2浓度升高及降水变化对红砂根平均直径、根生物量和根冠比变化的影响双因素方差分析结果 (表2) 显示,CO2浓度升高、降水量变化及二者的交互作用对红砂根平均直径和根生物量均有极显著影响 (P < 0.01),根冠比仅在CO 2浓度升高、降水量变化下有极显著差异 (P < 0.01),而交互作用对其影响不显著 ( P > 0.05)。
CO2浓度增加显著性地促进了5种降水处理下红砂的根平均直径和根生物量 (图2)。当CO2浓度从350 μmol/mol增加到700 μmol/mol时,降水–30%、–15%、100%、+15%、+30%处理根平均直径分别增加136.5%、65.7%、12.6%、12.8%和25.3%,根生物量分别增加17.8%、23.0%、21.2%、39.7%和31.6%。CO2浓度增加对红砂的根冠比没有促进作用,700 μmol/mol CO2浓度时各降水处理的根冠比分别降低18.6%、16.9%、14.8%、19.8%和20.2%。
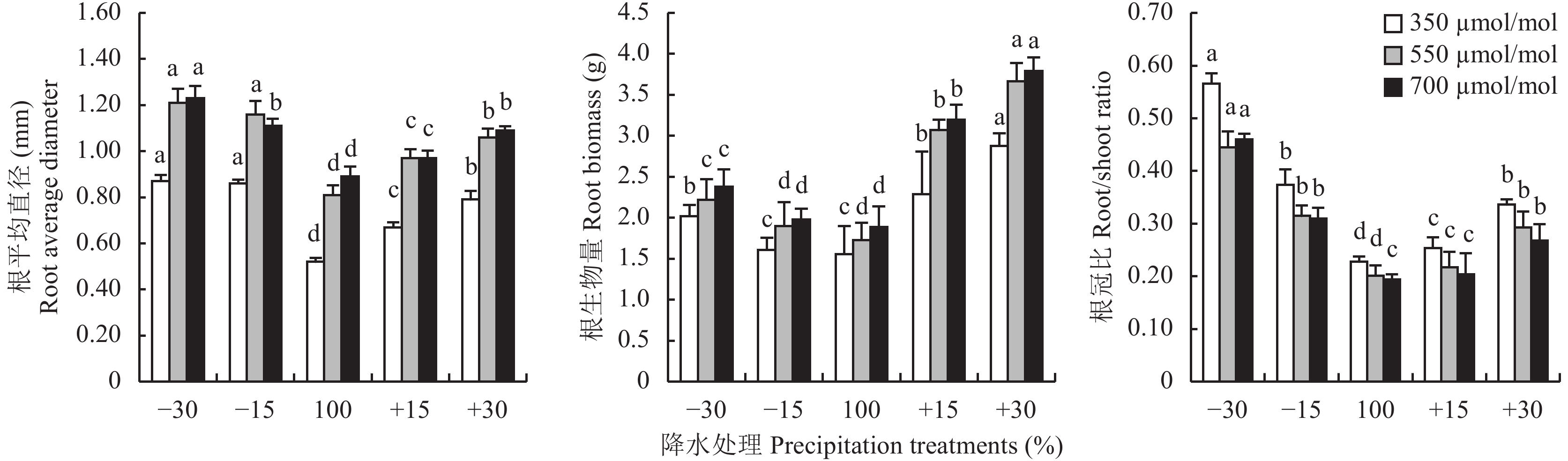 |
| 图2 不同CO2浓度和降水量下红砂根平均直径、根生物量和根冠比的变化 Fig. 2 Dynamics of root average diameter,root biomass and root/shoot ratio of R. soongorica in different CO2 concentrations and precipitation [注(Note):方柱上不同小写字母代表同一CO2浓度不同降水量间差异显著(P < 0.05) Different letters above the bars are significantly different among different precipitation treatments under the same CO2 concentration at the P < 0.05 level.] |
随着降水量的变化 (减少或增加) 红砂根平均直径、根生物量和根冠比均高于自然降水,CO2浓度增加虽然改变了其值,但并没有改变其随降水量而产生的变化趋势。当CO2浓度增加至700 μmol/mol,降水–30%、–15%、+15%、+30%处理的根平均直径分别比对照降水100%的增加38.2%、24.7%、9.0%和22.5%,根生物量分别增加25.9%、4.8%、69.3%和100.6%,根冠比分别增加137.3%、56.0%、5.0%和38.3% (P < 0.05)。
2.3 CO2浓度升高及降水变化对红砂幼苗比根长和比表面积变化的影响双因素方差分析结果 (表2) 显示,CO2浓度升高和降水量变化对红砂比根长和比表面积均有极显著影响 (P < 0.01),但二者的交互作用对其影响不显著 ( P > 0.05)。
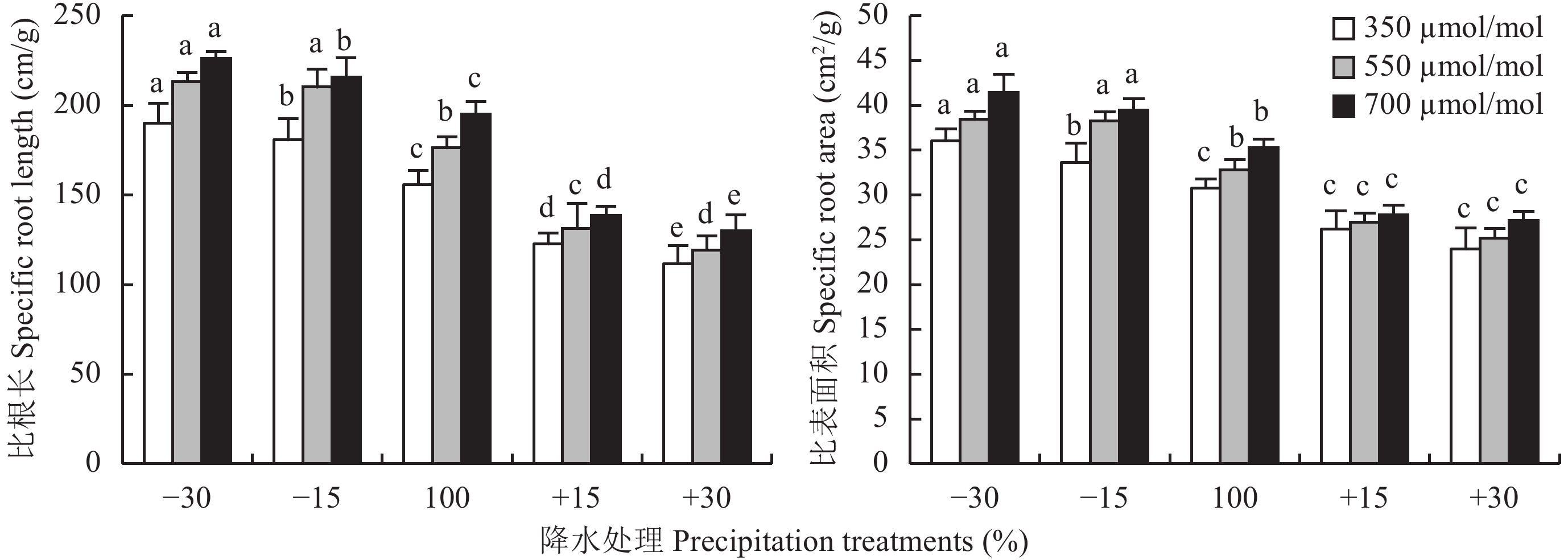 |
| 图3 不同CO2浓度和降水量下红砂比根长和比表面积的变化 Fig. 3 Dynamics of specific root length and specific root area of R. soongorica under different CO2 concentrations and precipitation [注(Note):方柱上不同小写字母代表同一CO2浓度不同降水量间差异显著(P < 0.05) Different letters above the bars are significantly different among different precipitation treatments under the same CO2 concentration at the P < 0.05 level.] |
CO2浓度增加可显著增加红砂在5种降水量下的比根长和比表面积 (图3)。CO2浓度从350 μmol/mol增加到700 μmol/mol时,降水–30%、–15%、100%、+15%、+30%处理下的比根长分别增加19.0%、19.4%、25.3%、13.1%和16.3%,比表面积分别增加17.3%、15.0%、14.6%、6.2%和13.2%。
随降水量从–30%到+30%的变化,红砂比根长和比表面积在3种CO2浓度下均呈逐渐降低趋势。当CO2浓度增加至700 μmol/mol,降水–30%、–15%、+15%、+30%处理的比根长分别比对照降水100%的增加15.8%、10.5%、–28.9%和–33.4%,比表面积分别增加12.0%、17.4%、–21.1%和–23.0%。
2.4 CO2浓度升高及降水变化对红砂幼苗根系碳、氮含量特征的影响双因素方差分析结果 (表3) 显示,CO2浓度升高、降水量变化及二者的交互作用对红砂根系的碳含量和氮含量均有极显著影响 (P < 0.01);CO 2浓度升高对碳氮比有极显著影响 (P < 0.01),降水量对碳氮比无显著影响 ( P > 0.05),而两者的交互作用却对碳氮比有显著影响 ( P < 0.05)。
| 表3 CO2浓度及降水对红砂根系碳、氮含量影响的双因素方差分析 (F值) Table 3 Two-way ANOVA of the effects of the CO2 concentration and precipitation on carbon and nitrogen contents in roots of R. soongorica (F-value) |
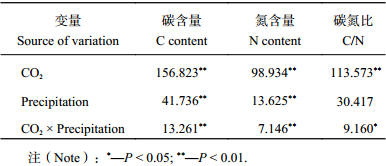 |
CO2浓度升高可显著增加红砂在5种降水量下的根系碳含量,而显著降低根系氮含量 (图4)。CO2浓度增至700 μmol/mol时,降水–30%、–15%、100%、+15%、+30%处理的根系碳含量分别增加89.9%、145.7%、163.0%、200.4%和193.9%,根系氮含量分别降低38.2%、28.5%、36.1%、29.0%和15.4%。CO2浓度升高显著促进了红砂根系C/N的增加,CO2浓度增加至700 μmol/mol时,各降水处理的C/N分别增加246.7%、402.97%、447.1%、363.5%和317.2%。
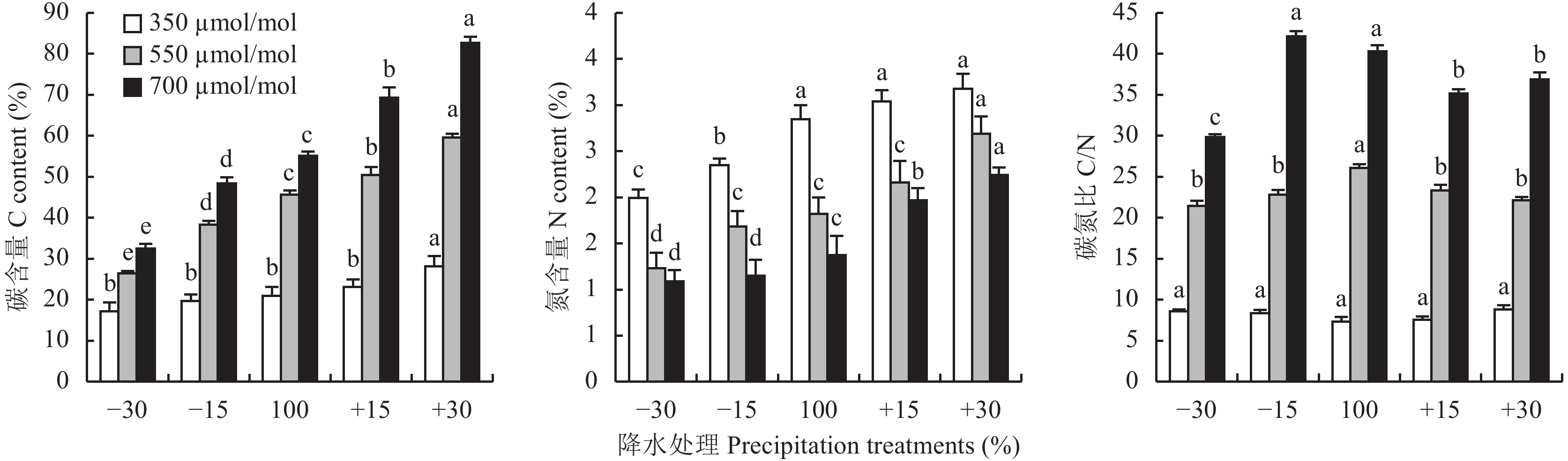 |
| 图4 不同CO2浓度和降水量下红砂根系碳、氮含量及碳氮比的变化 Fig. 4 Dynamics of the carbon, nitrogen contents and C/N of roots of R. soongorica at different CO2 concentrations and precipitation [注(Note):方柱上不同小写字母代表同一CO2浓度不同降水量间差异显著(P < 0.05) Different letters above the bars are significantly different among different precipitation treatments under the same CO2 concentration at the P < 0.05 level.] |
在三种CO2浓度下,红砂碳、氮含量随降水量增多而增加 (图4),在CO2浓度为700 μmol/mol时,降水–30%、–15%、+15%、+30%的红砂根碳含量比对照降水100%的分别增加–41.1%、–12.3%、25.5%和49.8%,氮含量分别增加–20.4%、–16.2%、43.8%和63.5%。CO2浓度增至700 μmol/mol时,降水量减少,C/N先增高后减小,–30%与对照间差异显著 (P < 0.05);在对照基础上降水量增加,C/N先减小后增高,且均与对照间差异显著 ( P < 0.05)。
3 讨论 3.1 CO2浓度升高及降水变化对红砂根系形态的影响环境变化会引起同种植物产生不同的形态变化,而形态是功能的基础,植物形态变化必然引起其生理生态功能的改变。多数文献都已证实增加CO2浓度会导致植物根长、根平均直径和根表面积增加[20–22]。本研究发现,CO2浓度升高,红砂的根长、总根体积、根平均直径和根系表面积显著增加,这和前人的研究结果相似,说明CO2浓度升高对红砂根系的生长有正效应,增加CO2可增加红砂根系与土壤的接触面积,从而有助于提高根系对土壤养分的吸收能力。
大气CO2浓度升高可显著提高不同植物群落类型的净初级生产力[23]。本研究中,CO2浓度倍增可使红砂在这五个水分条件下的根生物量显著增加20%以上,说明CO2升高对荒漠植物的生物量同样存在“CO2的施肥效应”[24]。比根长和比表面积分别是总根长和总表面积与根系生物量的比值,CO2浓度增加,红砂根生物量、总根长和总表面积均显著增加,但由于CO2倍增下总根长的增量 (平均49%) 和总表面积的增量 (平均40%) 比根系生物量的增量 (平均26%) 更显著,导致红砂比根长和比表面积呈显著增加趋势。CO2浓度会促进光合产物向根系分配[25],从而改变根/冠比,这种相对变化是植物体内碳分配模式对CO2升高的响应。但目前对于高浓度CO2是否会增加植物根冠比有不同的观点,Norby等[26]认为,CO2增加时植物的根冠比会提高,而Princhard和Rogers[27]则认为CO2浓度升高并没有改变植物的根冠比。本研究发现,CO2浓度增加,红砂根冠比降低,与前人的研究结果不同。这可能是因为,CO2浓度升高增加了红砂碳同化物的积累,茎叶和根系生物量都显著增多,但红砂地上器官对CO2的响应比地下器官积极,导致CO2浓度升高对茎叶生物量分配的刺激作用高于对根系生物量的分配。也可能是一些非结构性碳水化合物在植物体内的积累影响了CO2浓度对植物生长变化的影响,尤其对根冠比的影响[28]。
根系是植物吸收水分和养分的重要器官,其生长是植物响应水分胁迫中最灵敏的反应。因此,水分在植物响应高CO2浓度对根系形态的影响中扮演着重要作用[29]。本研究结果显示,在任何降水量下,CO2浓度增加对红砂除根冠比以外的其它根系形态指标均有显著的促进作用。但这些指标对降水量的响应增幅不同,根长、总根体积、根平均直径和根冠比的增幅在降水量减少时大于降水量增加时,说明水分匮乏会显著增加CO2对红砂根系的根长、总根体积、根平均直径和根冠比这几个形态指标的促进作用。这与Berntson等[7]的研究结果相似,而与Gorissen等[6]和Owensby等[8]的研究认为CO2升高条件下根的生物量增加在湿润年份大于干旱年份的结论不同。这可能是因为红砂为荒漠典型旱生植物,水分资源对其生长发育有显著的促进作用,在水分充足时其根系会因拥有较多的资源而积极生长,从而使根系的各个形态指标增加。但在降水减少、水分匮乏时红砂表现出典型的旱生植物特征,其根系长度不断增加、直径扩大、总根体积和根冠比显著提高以获取更大范围的水分资源,借此植株可以储存更多的水分来供给地上部分生长。高素华等[24]认为随着土壤干旱程度的加剧,荒漠生态系统各植物的生物量明显下降,本研究发现降水量下降,红砂根系的生物量并没有减少,和高素华等[24]的研究结果不同。这是因为不同植物对CO2浓度升高和水分的敏感程度不同,红砂在降水量增多或减少时均可促进地上和地下生物量的生长,但在降水量增多时地上生物量增幅大于地下生物量增幅,而在降水量减少时地下生物量增幅大于地上生物量增幅,从而导致红砂根冠比在降水量减少时增幅大于降水量增加时。这是荒漠植物红砂通过重新分配各器官生物量来调整对不同降水量的响应机制。很多研究发现,在降水减少或者CO2浓度升高的情况下,植物根系的SRL和SRA会显著增加[30–33],也有研究表明,土壤水分和N缺乏时,植物根系木质素含量增大,SRL和SRA减小[34–35]。本研究发现,随着降水量的减少和CO2浓度的增加,红砂根系氮含量减少,而SRL和SRA增大,与前人的研究结果不完全相同,可能是因为CO2浓度升高和土壤水分降低了木质素含量[36],导致SRL和SRA增加,同时也说明不同植物对环境条件变化的响应差异较大。
3.2 CO2浓度升高和降水量变化对红砂根系形态及与碳、氮特征关系的影响一般认为,CO2浓度升高植物会降低含氮量而提高输入到根部的碳量以满足其生长对营养物质需求的增加,C/N增加[37–38],朱春梧等[39]也认为,CO2增高时植物根部C/N比会显著上升。但也存在CO2浓度升高对氮素含量没有任何影响的现象[40–41];还有少数研究表明CO2浓度升高会增加植物和土壤有机质中氮的含量[42]。本研究发现,在5种降水条件下,CO2浓度升高可显著地提高红砂根系碳的含量而降低氮的含量,最终导致C/N比升高。这一结果和朱春梧等的研究结论一致,而与有些研究结果相反,说明当CO2浓度升高时,植物组织中碳氮含量的变化可能会因植物的差异而不同。Zak等[43]的研究表明地下部生物量在CO2浓度升高的情况下显著增加,在缺氮的情况下植物分配其生物量的50%~70%到根。本研究发现,CO2浓度升高,红砂根系生物量增加,而氮含量减少,和前人研究结果相似。
水分的多少对于植物养分的吸收和分配起着关键的作用。张玲等[44]认为,干旱有助于提高枫香根系对氮素的吸收和利用,从而引起C/N的降低。钟波元等[45]也研究发现,减少降水可使根系碳含量降低,氮含量增加,从而导致根系C/N显著降低。本研究结果显示,红砂根系的碳含量和氮含量与降水量呈显著正相关关系,而CO2浓度增高会显著提高这一相关性。这与张玲等[44]的研究结果不一致,可能是因为张玲等研究的主要是细根,而耿东梅等[46]认为红砂细根 (低级根序) 单位重量的根长度和表面积越大,吸收养分的效率就越高,导致细根中的氮含量增加,而越粗越长的根系 (高级根序) 则有利于植物对碳的储存。在本研究中红砂根系的碳、氮含量测定的是所有根系的,导致研究结果和张玲等的不符。降水和CO2浓度改变对植物的根系结构会产生显著的影响,尤其是产生细根或分枝,而根系结构又会显著影响植物对碳、氮的吸收和利用,进而影响根系的C/N[45–46]。本研究表明,红砂根系的C/N在三种CO2浓度下随降水量变化而产生的变化趋势完全不同,虽然CO2浓度升高使红砂根系的C/N增高了,但与降水量耦合时,无论降水量增多或减少红砂根系的C/N在CO2550 μmol/mol 下均会显著降低。这可能是因为在降水量严重匮乏时,红砂产生大量的细根,而细根对水分的吸收能力增强,促使更多的氮分配到根系中,导致C/N比下降[46],钟波元等[45]对杉木的研究也得出了相同的结论;而降水增加时,红砂光合能力增强,主根生长迅速,而主根运输和储藏了较多的营养元素,从而使氮含量增高,C/N降低[47]。CO2 700 μmol/mol 浓度下红砂根系的C/N和降水量之间的关系更为复杂,但在–30%降水量时的C/N最低。比根长 (SRL) 和比表面积 (SRA) 是指示根系功能的重要指标,可综合反映植物吸收营养的能力与生态适应性。CO2浓度增加和降水减少使植物根长和表面积增加,导致SRL和SRA增加,从而加快根的穿透和扩张[32, 48],致使地下器官竞争加剧,土壤输入有机碳/氮数量增加,其C/N升高[27, 33]。本研究结果发现,CO2浓度增加、降水量减少,红砂根系SRL和SRA增大,碳含量增加,氮含量减少,而C/N变化趋势较为复杂。这些结果一方面说明降水量减少时红砂根系的细根具有明显的形态可塑性,可通过调节碳、氮含量的变化来实现逆境胁迫下对养分的吸收[46];另一方面也说明CO2和降水量对红砂根系的形态的影响是一个综合的过程,进而对红砂根系碳、氮分配的影响也较为复杂。因为没有对红砂的根系进行分级研究,所以CO2和降水对其C/N的耦合影响到底是哪一级根系起主导作用还不得而知,需要进一步的研究。
| [1] |
蒋高明, 韩兴国. 大气CO2浓度升高对植物的直接影响—国外十余年来模拟实验研究之主要手段及基本结论
[J].
植物生态学报, 1997, 21(6): 489–502.
Jiang G M, Han X G. Response of plant growth to elevated [CO2]: a review on the chief methods and basic conclusions based on experiments in the external countries in past decade [J]. Chinese Journal of Plant Ecology, 1997, 21(6): 489–502. |
| [2] |
吴建国. 未来气候变化对7种荒漠植物分布的潜在影响[J].
干旱区地理, 2011, 34(1): 70–85.
Wu J G. Potential effects of climate change in future on the distributions of 7 desert plants in China[J]. Arid Land Geography, 2011, 34(1): 70–85. |
| [3] | Ainsworth E A, Rogers A. The response of photosynthesis and stomatal conductance to rising CO2: mechanisms and environmental interactions [J]. Plant, Cell & Environment, 2007, 30(3): 258–270. |
| [4] |
陈威霖, 江志红. 全球海气耦合模式对中国区域年代际气候变化预测能力的评估[J].
气候与环境研究, 2012, 17(1): 81–91.
Chen W L, Jiang Z H. Evaluation of the decadal prediction skill over China based on four global atmosphere-ocean coupled climate models[J]. Climatic and Environmental Research, 2012, 17(1): 81–91. |
| [5] |
王澄海, 李健, 李小兰, 等. 近50a中国降水变化的准周期性特征及未来的变化趋势[J].
干旱区研究, 2012, 29(1): 1–10.
Wang C H, Li J, Li X L, et al. Analysis on quasi-periodic characteristics of precipitation in recent 50 years and trend in next 20 years in China[J]. Arid Zone Research, 2012, 29(1): 1–10. |
| [6] | Gorissen A, Cotrufo M F. Decomposition of leaf and root tissue of three perennial grass species grown at two levels of atmospheric CO2 and N supply [J]. Plant and Soil, 2000, 224(1): 75–84. DOI:10.1023/A:1004744914998 |
| [7] | Berntson G M, Woodward F I. The root system architecture and development of Senecio vulgaris in elevated carbon dioxide and drought [J]. Functional Ecology, 1992, 6(3): 324–333. DOI:10.2307/2389524 |
| [8] | Owensby C E, Coyne P I, Ham J M, et al. Biomass production in a tall grass prairie ecosystem exposed to ambient and elevated CO2[J]. Ecological Applications, 1993, 3(4): 644–653. DOI:10.2307/1942097 |
| [9] |
段桂芳, 单立山, 李毅, 等. 红砂幼苗根系形态特征对降水格局变化的响应[J].
草业学报, 2016, 25(10): 95–103.
Duan G F, Shan L S, Li Y, et al. Response of root morphology to precipitation change in Reaumuria soongorica seedlings [J]. Acta Prataculturae Sinica, 2016, 25(10): 95–103. DOI:10.11686/cyxb2015459 |
| [10] |
洪江涛, 吴建波, 王小丹. 全球气候变化对陆地植物碳氮磷生态化学计量学特征的影响[J].
应用生态学报, 2013, 24(9): 2658–2665.
Hong J T, Wu J B, Wang X D. [J]. Chinese Journal of Applied Ecology, 2013, 24(9): 2658–2665. |
| [11] |
刘玉冰, 张腾国, 李新荣, 等. 红砂(Reaumuria soongorica)忍耐极度干旱的保护机制: 叶片脱落和茎中蔗糖累积
[J].
中国科学(C辑: 生命科学), 2006, 36(4): 328–333.
Liu X B, Zhang T G, Li X R, et al. Protective mechanism of desiccation tolerance in Reaumuria soongorica: leaf abscission and sucrose accumulation in the stem [J]. Science in China (Series C: Life Sciences), 2006, 36(4): 328–333. |
| [12] |
董秋莲, 李毅, 单立山, 等. 张掖市龙首山红砂种群结构和分布格局研究[J].
水土保持通报, 2013, 33(4): 284–288.
Dong Q L, Li Y, Shan L S, et al. Population structure and distribution pattern of Reaumuria soongorica in Longshou Mountain of Zhangye City [J]. Bulletin of Soil and Water Conservation, 2013, 33(4): 284–288. |
| [13] |
高茜, 李毅, 苏世平, 等. 盐胁迫对红砂(Reaumuria soongorica)种子吸胀过程中生理特性的影响
[J].
中国沙漠, 2014, 34(1): 83–87.
Gao Q, Li Y, Su S P, et al. Effects of salt stress on physiological characteristics of Reaumuria soongorica seeds during imbibition [J]. Journal Desert Research, 2014, 34(1): 83–87. DOI:10.7522/j.issn.1000-694X.2013.00288 |
| [14] |
种培芳, 苏世平, 李毅, 等. 不同地理种源红砂幼苗对PEG胁迫的生理响应[J].
草业学报, 2013, 22(1): 183–192.
Chong P F, Su S P, Li Y, et al. Physiological responses to PEG stress of Reaumuria soongorica seedlings from different geographical origins [J]. Acta Prataculturae Sinica, 2013, 22(1): 183–192. DOI:10.11686/cyxb20130122 |
| [15] |
杨小林, 张希明, 单立山, 等. 塔克拉玛干沙漠腹地塔克拉玛干柽柳根系构筑型研究[J].
干旱区研究, 2008, 25(5): 660–667.
Yang X L, Zhang X M, Shan L S, et al. Analysis on root structure of Tamarix taklamakanensis in the hinter land of the Taklimakan Desert [J]. Arid Zone Research, 2008, 25(5): 660–667. |
| [16] |
单立山, 李毅, 董秋莲, 等. 红砂根系构型对干旱的生态适应[J].
中国沙漠, 2012, 32(5): 1283–1290.
Shan L S, Li Y, Dong Q L, et al. Ecological adaptation of Reaumuria soongorica root system architecture to arid environment [J]. Journal Desert Research, 2012, 32(5): 1283–1290. |
| [17] |
种培芳, 李航逸, 李毅. 荒漠植物红砂根系对干旱胁迫的生理响应[J].
草业学报, 2015, 24(1): 72–80.
Chong P F, Li H Y, Li Y. Physiological responses of seedling roots of the desert plant Reaumuria soongorica to drought stress [J]. Acta Prataculturae Sinica, 2015, 24(1): 72–80. DOI:10.11686/cyxb20150110 |
| [18] |
任会利, 李萍, 申卫军, 等. 荒漠生态系统对大气CO2浓度升高响应的干湿年差异
[J].
热带亚热带植物学报, 2006, 14(5): 389–396.
Ren H L, Li P, Shen W J, et al. Difference of desert ecosystem responses to elevated atmospheric CO2 concentration between dry and wet years [J]. Journal of Tropical and Subtropical Botany, 2006, 14(5): 389–396. |
| [19] |
常兆丰, 韩福贵, 仲生年. 民勤荒漠区气候变化对全球变暖的响应[J].
中国沙漠, 2011, 31(2): 505–510.
Chang Z F, Han F G, Zhong S N. Response of desert climate change to global warming in Minqin, China[J]. Journal Desert Research, 2011, 31(2): 505–510. |
| [20] |
马永亮, 王开运, 孙卿, 等. 大气CO2浓度升高对植物根系的影响
[J].
生态学杂志, 2007, 26(10): 1640–1645.
Ma Y L, Wang K Y, Sun Q, et al. Effects of elevated atmospheric CO2 on plants root system [J]. Chinese Journal of Ecology, 2007, 26(10): 1640–1645. |
| [21] |
侯颖, 王开运, 张远彬, 等. CO2浓度和温度升高对川西亚高山红桦幼苗根系结构的影响
[J].
北京林业大学学报, 2008, 30(1): 29–33.
Hou Y, Wang K Y, Zhang Y B, et al. Effects of elevated CO2 concentration and temperature on root structure of subalpine Betula albo-sinensis seedlings in western Sichuang, southwestern China [J]. Journal of Beijing Forestry University, 2008, 30(1): 29–33. |
| [22] | Rogers H H, Runion G B, Krupa S V. Plant responses to atmospheric CO2 enrichment with emphasis on roots and the rhizosphere [J]. Environmental Pollution, 1994, 83(1/2): 155–189. |
| [23] |
陈春梅, 谢祖彬, 朱建国, 等. CO2浓度升高对小麦秸秆性质、数量及其分解的影响
[J].
中国生态农业学报, 2007, 15(6): 1–5.
Chen C M, Xie Z B, Zhu J G, et al. Effects of CO2-induced change on wheat straw quality, quantity and decomposition [J]. Chinese Journal of Eco-Agriculture, 2007, 15(6): 1–5. |
| [24] |
高素华, 郭建平. 毛乌素沙地优势种在高CO2浓度条件下对土壤干旱胁迫的响应
[J].
草业学报, 2002, 16(6): 116–118.
Gao S H, Guo J P. Responses of some dominant species in Maowusu sandland under high CO2 concentration to drought stress [J]. Acta Prataculturae Sinica, 2002, 16(6): 116–118. |
| [25] | Hungate B A, Holland E A, Jackson R B, et al. The fate of carbon in grasslands under carbon dioxide enrichment[J]. Nature, 1997, 388(6642): 576–579. DOI:10.1038/41550 |
| [26] | Norby R J. Issues and perspectives for investigating root responses to elevated atmospheric carbon-dioxide[J]. Plant and Soil, 1994, 165(1): 9–20. DOI:10.1007/BF00009958 |
| [27] | Pritchard S G, Rogers H H. Spatial and temporal deployment of crop roots in CO2-enriched environments [J]. New Phytologist, 2000, 147(1): 55–71. DOI:10.1046/j.1469-8137.2000.00678.x |
| [28] | Wong S C. Elevated atmospheric partial pressure of CO2 and plant growth: II. Non-structural carbohydrate content in cotton plants and its effect on growth parameters [J]. Photosynthesis Research, 1990, 23(2): 171–180. DOI:10.1007/BF00035008 |
| [29] |
牛耀芳, 宗晓波, 都韶婷, 等. 大气CO2浓度升高对植物根系形态的影响及其调控机理
[J].
植物营养与肥料学报, 2011, 17(1): 240–246.
Niu Y F, Zong X B, Du S T, et al. Effects of elevated CO2 on morphology change of plants root and its regulatory mechanism [J]. Plant Nutrition and Fertilizer Science, 2011, 17(1): 240–246. DOI:10.11674/zwyf.2011.01240 |
| [30] | Olmo M, Lopez–Iglesias B, Villar R. Drought changes the structure and elemental composition of very fine roots in seedlings of ten woody tree species: Implications for a drier climate[J]. Plant and Soil, 2014, 384(1/2): 113–129. |
| [31] | Metcalfe D B, Meir P, Leoc A, et al. The effects of water availability on root growth and morphology in an Amazon rain forest[J]. Plant and Soil, 2008, 311(1/2): 189–199. |
| [32] | Chaudhuri U N, Kirkham M B, Kanemasu E T. Root growth of winter wheat under elevated carbon dioxide and drought[J]. Crop Science, 1990, 30(4): 853–856. DOI:10.2135/cropsci1990.0011183X003000040017x |
| [33] | Li T Q, Di Z Z, Han X, et al. Elevated CO2 improves root growth and cadmium accumulation in the hyper accumulator Sedum alfredii [J]. Plant and Soil, 2012, 54(1): 325–334. |
| [34] | Markesteijn L, Poorter L. Seedling roots morphology and biomass allocation of 62 tropical tree species in relation to drought and shade tolerance[J]. Journal of Ecology, 2009, 97(2): 311–325. DOI:10.1111/jec.2009.97.issue-2 |
| [35] | Wahl S, Ryser P. Root tissue structure is linked to ecological strategies of grass[J]. New Phytologist, 2000, 148(3): 459–471. DOI:10.1046/j.1469-8137.2000.00775.x |
| [36] | Newman J A, Abner M L, Dado R G, et al. Effects of elevated CO2 nitrogen and fungal endophyte-infection on tall fescue growth, photosynthesis, chemical composition and digestibility [J]. Global Change Biology, 2003, 9(3): 425–437. DOI:10.1046/j.1365-2486.2003.00601.x |
| [37] |
许振柱, 周广胜, 肖春旺, 等. CO2浓度倍增条件下土壤干旱对两种沙生灌木碳氮含量及其适应性的影响
[J].
生态学报, 2004, 24(10): 2186–2191.
Xu Z Z, Zhou G S, Xiao C W, et al. Responses of two dominated desert shrubs to soil drought under doubled CO2 condition [J]. Acta Ecologica Sinica, 2004, 24(10): 2186–2191. DOI:10.3321/j.issn:1000-0933.2004.10.014 |
| [38] |
谢祖彬, 朱建国, 张雅丽, 等. 水稻生长及其体内C、N、P组成对开放式空气CO2浓度增高和N、P施肥的响应
[J].
应用生态学报, 2002, 13(10): 1223–1230.
Xie Z B, Zhu J G, Zhang Y L, et al. Responses of rice (Oryza sativa) growth and its C, N and P composition to FACE (Free-air Carbon Dioxide Enrichment) and N, P fertilization [J]. Chinese Journal of Applied Ecology, 2002, 13(10): 1223–1230. DOI:10.3321/j.issn:1001-9332.2002.10.006 |
| [39] |
朱春梧, 曾青, 朱建国, 等. 大气CO2浓度升高对水稻和稗草根系生长的影响
[J].
生态与农村环境学报, 2006, 22(1): 1–4.
Zhu C W, Zeng Q, Zhu J G, et al. Effect of Free-Air CO2 Enrichment (FACE) on root growth of C3 crop (rice, Oryza sative) and C4 weed (Barnyardgrass,Echinochloa crusgalli) [J]. Journal of Ecology and Rural Environment, 2006, 22(1): 1–4. |
| [40] | Zanetti S, Hartwig U A, Kessel C V, et al. Does nitrogen nutrition restrict the CO2 response of fertile grassland lacking legumes? [J]. Oecologia, 1997, 112(1): 17–25. DOI:10.1007/s004420050278 |
| [41] | Luscher A, Hendrey G R, Nosberger J. Long-term responsiveness to free air CO2 enrichment of functional types, species and genotypes of plants from fertile permanent grassland [J]. Oecologia, 1998, 113: 37–45. |
| [42] | John H M, Thornley G R C. Dynamics of mineral N availability in grass land ecosystems under increased [CO2]: Hypotheses evaluated using the Hurley Pasture Model [J]. Plant and Soil, 2000, 224(1): 153–170. DOI:10.1023/A:1004640327512 |
| [43] | Zak D R, Pregitzer K S, Curtis P S, et al. Elevated atmospheric CO2 and feedback between carbon and nitrogen cycles [J]. Plant and Soil, 1993, 151(1): 105–117. DOI:10.1007/BF00010791 |
| [44] |
张玲, 王树凤, 陈益泰, 等. 3种枫香的根系构型及功能特征对干旱的响应[J].
土壤, 2013, 45(6): 1119–1126.
Zhang L, Wang S F, Chen Y T, et al. Response of architecture and functions of roots in three kinds of sweet gums under drought stress[J]. Soils, 2013, 45(6): 1119–1126. |
| [45] |
钟波元, 熊德成, 史顺增, 等. 隔离降水对杉木幼苗细根生物量和功能特征的影响[J].
应用生态学报, 2016, 27(9): 2807–2814.
Zhong B Y, Xiong D C, Shi S Z, et al. Effects of precipitation exclusion on fine-root biomass and functional traits of Cunninghamia lanceolata seedlings [J]. Chinese Journal of Applied Ecology, 2016, 27(9): 2807–2814. |
| [46] |
耿东梅, 单立山, 李毅. 土壤水分胁迫对红砂幼苗细根形态和功能特征的影响[J].
水土保持通报, 2014, 36(4): 36–42.
Geng D M, Shan L S, Li Y. Effect of soil water stress on fine root morphology and functional characteristics of Reaumuria soongorica [J]. Bulletin of Soil and Water Conservation, 2014, 36(4): 36–42. |
| [47] | Guo D L, Li H, Mitchell R J, et al. Fine root heterogeneity by branch order: Exploring the discrepancy in root turnover estimates between minirhizotron and carbon isotopic methods[J]. New Phytologist, 2008, 177(2): 443–456. |
| [48] | Idso S B, Kimball B A. Seasonal fine-root biomass development of sour orange trees grown in atmospheres of ambient and elevated CO2 concentrations [J]. Plant, Cell & Environment, 1992, 15(3): 337–341. |
 2017, Vol. 23
2017, Vol. 23  doi:
doi: 

