拮抗菌单独施入土壤后不易定殖,提高拮抗菌在土壤根际的定殖成为生物防控的研究重点。目前采用拮抗菌结合有机肥或经过2次发酵制成生物有机肥来调节土壤微生态、改善土壤微生物多样性、抑制病原菌的生长或提高植物自身抗性,从而抑制病害的发生[1–2],如Qiu等[3]利用生物有机肥显著降低黄瓜枯萎病的发病率并改善土壤的微生物群落结构;Zhao等[4]利用SQR21拮抗菌的生物有机肥降低西瓜枯萎病真菌尖镰孢菌的数量级,进而达到防控效果;Wu等[5]利用解淀粉芽孢杆菌和枯草芽孢杆菌制成的生物有机肥,抑制病原菌的生长取得很好的防控效果;Ding等[6]研制的BIO-36和BIO-23生物有机肥对马铃薯青枯病防控效果分别可以达到96%和91%。刘艳霞等[7]利用生物有机肥防控烟草青枯病,在田间防控率可高达95.4%。
近年来,有机肥特别是具有特殊功能性的生物有机肥的施用成为修复烟田土壤、防治各种土传病害的新思路。但田间生物有机肥的用量大,这样势必会增加成本。而且,烟苗移栽于烟田后,同时接触拮抗菌和病原菌,病原菌依然可能侵入到烟草根际,从而大大降低了生物有机肥的保护功效。
本研究针对贵州省烟草青枯病,筛选青枯菌高效拮抗菌,并二次固体发酵为烟草专用拮抗青枯病型生物有机肥 (BIO),通过向传统育苗基质中施入一定比例的BIO,分别在苗期和盆栽时调查青枯病病情及监测细菌、真菌、青枯菌和拮抗菌的数量变化,以及微生物生态多样性差异,研究并验证在烟草育苗期间施入烟草专用拮抗青枯病型生物有机肥,拮抗菌在烟苗根际形成一层保护鞘,从而提高移栽后烟苗对烟草青枯病的抵御效果,旨在为有效生物防控烟草青枯病提供一条经济可行的途径。
1 材料与方法 1.1 供试材料供试烟草品种分别为K326和红花大金元,K326为中抗青枯病品种,红花大金元为中感青枯病品种[8]。
托盘育苗基质采用烤烟专用育苗基质,其主要以蚯蚓粪便和珍珠岩为生产原料 (专利证号为ZL200710202167.6)。盆栽试验所用病土取自贵州省黔南州长顺县广顺镇石洞村 (26.03°N,106.45°E),经检测土壤中青枯菌 (Ralstonia solanacearum) 数量为3.79 × 10 6 cfu/g土。病土与健康土均取自同一田块,将烟株根部连带上面附着的土壤一并取回,经超声处理分离出根际土壤。采集土壤样品为黄壤,pH 5.45、有机质48.6 g/kg、全氮2.29 g/kg、碱解氮158 mg/kg、速效磷48.9 mg/kg、速效钾543 mg/kg。
供试烟草青枯菌拮抗菌NJL-14由本实验室采用稀释平板涂布结合喷雾法筛选分离[9],拮抗圈半径达到10 mm (图1),经分子生物学鉴定为蜡状芽孢杆菌 (Bacillus cereus)。烟草专用拮抗青枯病型生物有机肥 (BIO) 制备:NJL-14在牛肉膏蛋白胨液体培养基中于30℃摇床中170 rpm培养48 h;有机肥为菜粕酶解的菜粕有机肥与牛粪堆肥以1︰1 (质量比) 混合而成 (简称有机肥),经测定含有机质33.8%、氨基酸4.3%、N 4.20%、P2O5 2.26%、K2O 1.08%;将拮抗菌NJL-14培养液以5%的接种量接入上述有机肥中,调节温度为30~45℃,含水量为30%~40%,发酵4~5天,期间不断翻抛,发酵完成后含水量达到34.9%,即为含有NJL-14的烟草专用拮抗青枯病型生物有机肥[10]。
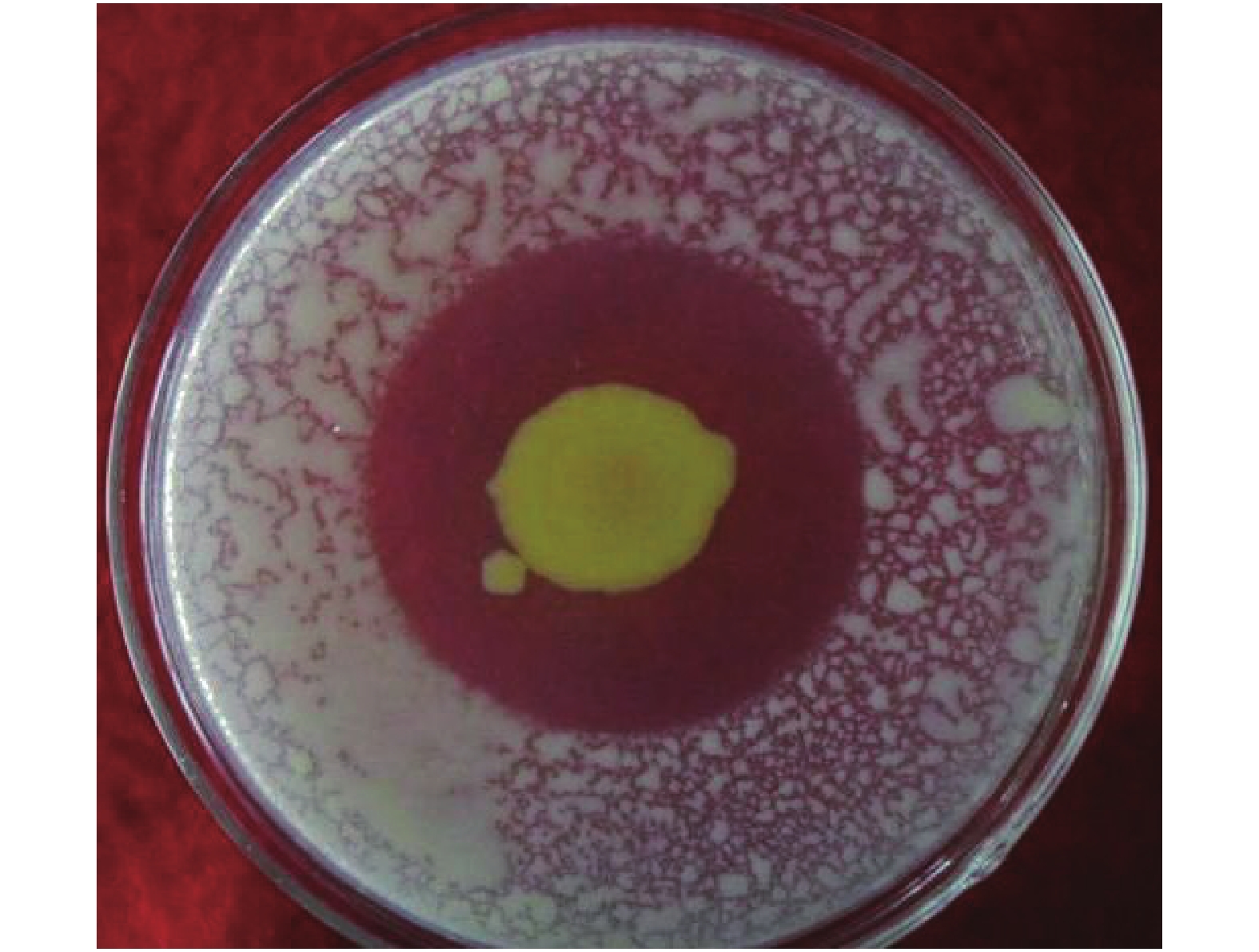 |
| 图1 拮抗菌NJL-14对青枯菌的平板拮抗效果 Fig. 1 Suppression of R. solanacearum by the isolated antagonist NJL-14 |
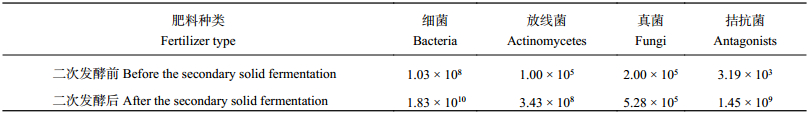
BIO二次发酵前后的细菌、放线菌、真菌和拮抗菌的数量见表1。经拮抗菌二次发酵后的BIO与发酵前的有机肥相比,细菌、放线菌和真菌的数量都有所增加,细菌放线菌增加幅度较大,而真菌数量增加较少。拮抗菌蜡状芽孢杆菌NJL-14发酵后其数量增加了6个数量级,表明拮抗菌通过二次固体发酵数量显著增加。
| 表1 BIO 二次固体发酵前后可培养微生物和拮抗菌数量 (cfu/g) Table 1 Counts of culturable microorganisms and antagonist before and after the BIO secondary solid fermentation |
 |
1.2.1 BIO对烟草发芽率的影响试验 将烟草专用拮抗青枯病型生物有机肥分别以1%、2%、3%、4%和5%比例掺入普通育苗基质中,以不添加为对照。玻璃培养皿灭菌后每平板分别铺约1 cm厚基质,基质表面放置100粒K326和红花大金元种子,每个处理15次重复,放置于光照培养箱中25℃、75%水分中培养,每天定期测定其出芽率。
1.2.2 BIO基质育苗试验 根据对烟草发芽率的影响结果,将BIO以适合烟草种子发芽的浓度施入到烟草常规育苗基质中。分别采用常规漂浮育苗和托盘育苗[11],K326和红花大金元分别设置4个处理:1) 常规漂浮育苗对照 (CK);2)BIO漂浮育苗 (BIO);3) 托盘育苗对照 (CKn);4)BIO托盘育苗 (BIOn)。分别采集育苗期0、30和60 d的基质,采用荧光定量PCR检测基质中的蜡状芽孢杆菌数量。60 d时测量烟苗的生物量。
1.2.3 BIO盆栽试验 盆栽试验在贵州省烟草科学研究院人工气候室进行。烟草育苗结束后移栽在青枯病病土中,有机肥和BIO以50 g/plot与土壤混合均匀,每盆装土10 kg移栽1株烟。红花大金元和K326分别设5个处理,具体育苗和土壤处理见表2,每个处理15次重复。移栽当天采集土壤样品,分别于30、60和90 d统计病情,计算青枯病发病率和防控率[12],并采集根际土壤约50 g用荧光定量PCR检测土壤中病原菌、拮抗菌、细菌和真菌数量的变化。移栽80 d后根据烟叶成熟情况由下至上分次采收并烘烤,计算不同处理烟叶产量。
|
$\text{发病率} = \left {\text{病株数}/\text{总株数}} \right \times 100{{\%}} $
|
病害严重度分级 (以株为单位分组调查):0级,全株无病;1级,茎部偶有退绿斑,或病侧二分之一以下叶片凋萎;3级,茎部有黑色条斑,但不超过茎高二分之一,或病侧二分之一至三分之二叶片凋萎;5级,茎部黑色条斑超过茎高二分之一,但未到达茎顶部,或病侧三分之二以上叶片凋萎;7级,茎部黑色条斑到达茎顶部,或病株叶片全部凋萎;9级,病株基本枯死。
| 表2 烟草专用拮抗青枯病型生物有机肥育苗盆栽试验处理 Table 2 Treatments in the pot experiment of the BIO nursery |
 |
|
$\begin{aligned}\text{病情指数} = & \left \sum {\left ({\text{病情级数} \times \text{此级菌株数}} \right)} / \right.\\& \Big \left ({\text{总级数} \times \text{总株数}} \right) \Big\times 100\end{aligned}$
|
|
$\begin{aligned}\text{防控效果} = & \left ({\text{对照病情指数} - \text{处理病情指数}} \right)/ \\& \left. \text{对照病情指数} \right \times 100{{\%}}\end{aligned}$
|
荧光定量PCR采用TaKaRa公司的实时荧光PCR试剂盒SYBR®Premix Ex TaqTM在ABI 7500TM实时荧光定量PCR检测仪上运行。茄科劳尔氏菌的荧光定量PCR反应中,特异性引物为[13]正向引物Flic-F: GAACGCCAACGGTGCGAACT;反向引物Flic-R:GGCGGCCT TCAGGGAGGTC;蜡样芽孢杆菌的特异性引物分别为gyrBF: 5′-CCTTGTAACGGATAATGGAC-3′,gyrBR: 5′-CCACCACCAAACTTACCAC-3′[14]。荧光定量PCR扩增反应体系 (20 μL):SYBR® Premix Ex TaqTM(2 ×) (TaKara) 10.0 μL、ROX Reference Dye(50 ×) 0.4 μL、flicF 0.4 μL、filcR 0.4 μL、DNA模板2.0 μL。DDH 2O 6.8 μL反应程序为95℃预变性30 s、95℃变性5 s、60℃退火30 s、72℃延伸30 s,40个循环。溶解曲线步骤为95℃ 15 s、60℃ 1 min、95℃ 15 s,反应结束后确认扩增曲线和溶解曲线。
细菌和真菌扩增反应体系为50 μL,SYBR® Premix Ex TaqTM(2 ×)25 μL,ROX Reference Dye II(50 ×)1 μL,上下游引物 (10 mmol/L) 各1 μL,DNA模板4 μL,双蒸水18 μL。细菌特异性引物为USU1:5′-AACTGGAGGAAGGTGGGGA-3′ [15]、USU2:5′-AGGAGGTGATCCAACCGCA-3′;真菌特异性引物为Fung:5′-ATTCCCCGTTACCCGTTG-3′、NS1:5′-GTAGTCATATGCTTGTCTC-3′[16]。反应程序为95℃ 10 s、95℃ 5 s,细菌退火温度为58℃,真菌退火温度为54℃ 30 s、72℃ 30 s,40个循环。最后添加熔解曲线步骤为95℃ 15 s、60℃ 1 min、95℃ 15 s。
1.4 土壤微生物功能多样性检测根际土壤微生物功能多样性用BiologEcoPlate系统 (Biolog Inc. Hayward Cal. USA) 通过比较31种碳源利用情况测定[17]。土壤悬液在4℃、3000 × g转速下离心5 min,然后用0.85%的NaCl溶液稀释100倍。土壤稀释液接种于EcoPlates,在Biolog恒温 (25℃) 培养箱中暗培养72 h。EcoPlates上每孔颜色变化度为OD值与对照OD值差 [18]。微生物活性用微孔板平均颜色变化度 (AWCD) 值表示,Shannon指数、Simpson指数和McIntosh指数指征土壤微生物功能多样性。
|
${\rm {Shannon\;index}} = - \sum {P_i\ln P_i} \quad\quad$
|
|
${\rm {Simpson\;index}} = \sum {\frac{{\left ({n_i\left ({n_i - 1} \right)} \right)}}{{N\left ({N - 1} \right)}}} \,\,\,$
|
|
${\rm {McIntosh\;index}} = \sqrt {\sum {{n_i}^\small2} }\quad\quad\quad\, $
|
式中:Pi=Ai/Atotal;ni=Ai;N= Atotal;A代表590 nm处吸光度。
1.5 数据分析试验数据采用Microsoft Excel 2003处理,显著性分析采用SPSS Base Ver.13.0统计软件 (SPSS, IL, Chicago, USA) 进行,用LSD、Duncan新复极差进行多重比较 (P ≤ 0.05)。
2 结果与分析 2.1 BIO对烟草发芽率的影响由图2可以看出,当BIO浓度在2%以内时,烟草的发芽率与对照相比无显著差异,而当BIO浓度高于2%时,发芽率降低。因此,选用2%作为烟草基质育苗中加入BIO的比例。
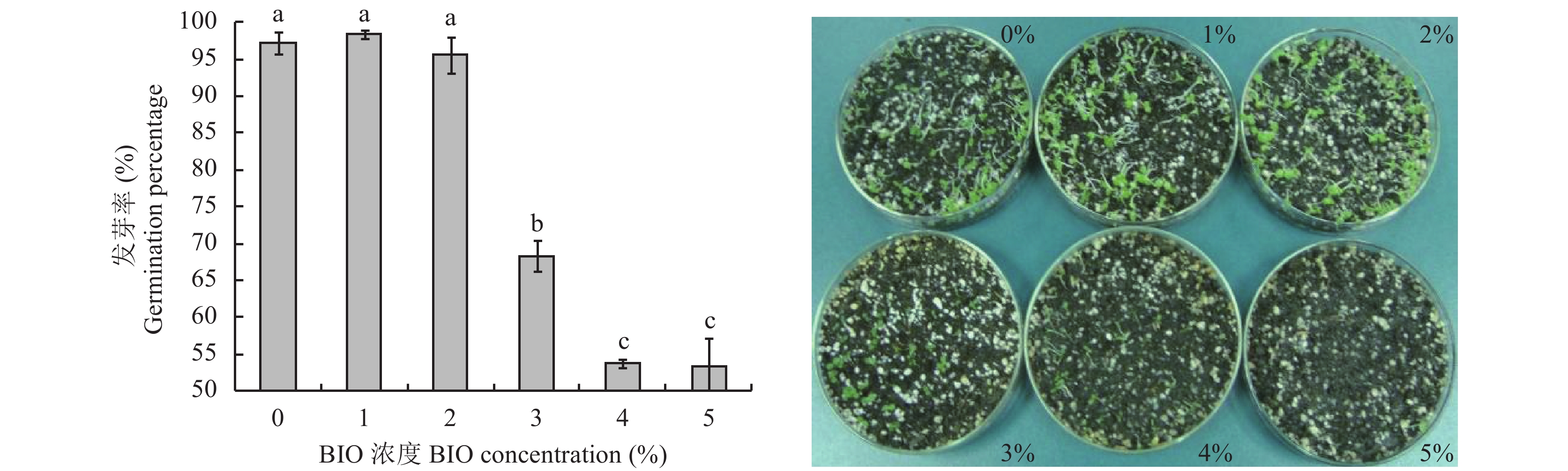 |
| 图2 烟草专用拮抗青枯病生物有机肥接种量对烟草发芽率的影响 Fig. 2 Effects of the BIO inoculation amounts on tobacco seed germination [注(Note):柱上不同字母表示不同BIO浓度处理间差异显著 (P ≤ 0.05) Different letters above the bars indicate significant differences among different BIO concentration treatments (P ≤ 0.05).] |
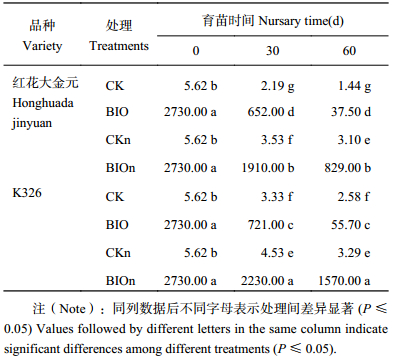
通过荧光定量PCR计数,原始基质中含有的蜡状芽孢杆菌数量达到104 copies/g土 (表3)。随着育苗时间延长,漂浮育苗和托盘育苗中的拮抗菌数量都呈现逐渐下降趋势。两品种的漂浮育苗对照和托盘育苗对照中原始基质中的蜡状芽孢杆菌数量随时间延长逐渐下降,但都保持在同一数量级水平上。育苗30 d时,漂浮育苗BIO处理的拮抗菌数量从107 copies/g土下降一个数量级至106 copies/g土,而托盘育苗BIO处理的拮抗菌数量虽然有小幅下降,但在数量级上没有改变。育苗60 d时,漂浮育苗BIO处理的拮抗菌数量与30 d相比又下降一个数量级,红花大金元和K326托盘育苗BIO处理蜡状芽孢杆菌数量分别比对应品种30 d下降56.6%和29.6%。在整个育苗过程中,托盘育苗拮抗菌数量的减少显著低于漂浮育苗,可能是由于托盘育苗提供相对干燥的环境,提供更多的氧气,使得拮抗菌更易定殖。两品种间比较,同等处理的K326拮抗菌数量随时间减少的趋势明显低于红花大金元。
| 表3 育苗基质中拮抗菌数量动态变化 (× 104 copies/g, soil) Table 3 Dynamics of antagonists’ population in the seedling substrate |
 |
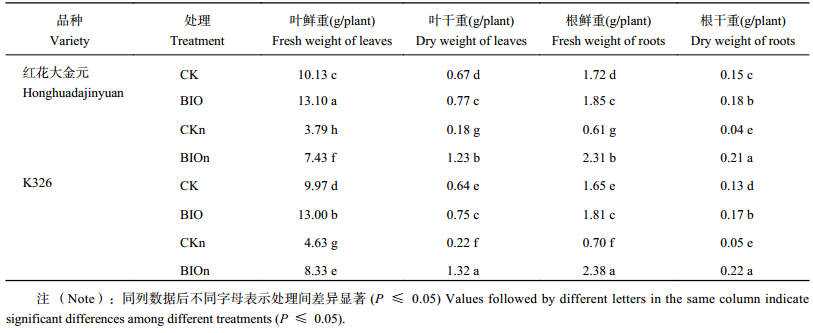
BIO育苗不但可以增强拮抗菌的定殖能力,还可以对苗期烟株的生长起到一定的促生作用。对于红花大金元和K326两个品种,用BIO漂浮育苗后,生物量都比对照的常规基质育苗有所增加,K326的地上部和地下部的干重分别增加17.2%和30.8% (表4),红花大金元的地上部和地下部的干重分别增加14.9%和20.0%。用黑色塑胶盘培育的烟苗 (托盘育苗),基质的相对湿度要小于漂浮育苗的烟苗,BIO对烟苗生长的促生作用更明显,K326经BIO育苗处理的烟苗地上部和地下部的干重分别比常规基质育苗的处理高5.0和3.4倍,而红花大金元分别高5.8和4.3倍。两个品种经托盘育苗生物量都要小于漂浮育苗,可能是由于漂浮育苗更利于烟苗对营养元素的吸收,因此烟苗的生长相对更迅速。
| 表4 烟草专用拮抗青枯病型生物有机肥对烟草苗期生物量的影响 Table 4 Effects of bio–organic fertilize on tobacco seedling biomass in the nursery experiment |
 |
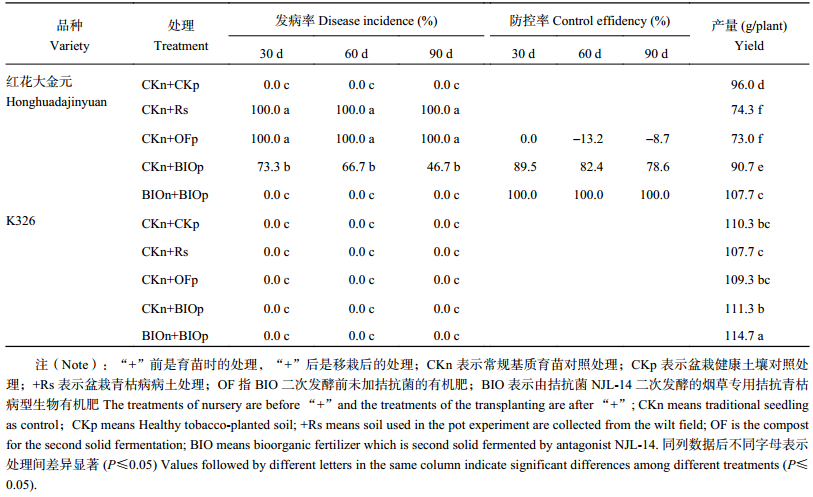
从图3中可以看出,K326所有处理均未发生青枯病,同处理红花大金元发病率高于K326。
 |
| 图3 盆栽试验不同处理烟草青枯病发病情况 Fig. 3 Tobacco bacterial wilt occurrence of different treatments in the pot experiment [注(Note):“+”前是育苗时的处理,“+”后是移栽后的处理;CKn 表示常规基质育苗对照处理;CKp 表示盆栽健康土壤对照处理;+Rs 表示盆栽青枯病病土处理;OF 指 BIO 二次发酵前未加拮抗菌的有机肥;BIO 表示由拮抗菌 NJL-14 二次发酵的烟草专用拮抗青枯病型生物有机肥 The treatments of nursery are before “+”and the treatments of the transplanting are after “+”; CKn means traditional seedling as control;CKp means Healthy tobacco-planted soil; +Rs means soil used in the pot experiment are collected from the wilt field; OF is the compost for the second solid fermentation; BIO means bioorganic fertilizer which is second solid fermented by antagonist NJL-14.] |
在病土基础上施加普通有机肥的处理 (CKn+OFp),其60 d和90 d发病率高于病土对照,青枯病防控率为负值 (表5),这可能是由于有机肥为土壤中的病原菌提供了丰富的营养,促进了病土中青枯菌的生长,使得病原菌数量增加,反而使得烟株更易感病。在育苗基质和盆栽土壤中都施入烟草专用拮抗青枯病型生物有机肥的处理,对青枯病的防控要显著好于对照处理或是只在盆栽中加入生物有机肥的处理,可能由于育苗期间拮抗菌已经定殖在烟苗根际,因此,当盆栽试验基质中有病原菌的存在时,拮抗菌照样可以发挥作用,从一开始就能降低病原菌的数量,起到保护烟株的作用。
| 表5 盆栽不同处理对烟草青枯病防控率和产量的影响 Table 5 Control efficiency to tobacco bacterial wilt and yield of different treatments in the pot experiment |
 |
对红花大金元品种,健康土对照由于未接入病原菌和拮抗菌,在烟叶生长的全生育期,病原菌和拮抗菌都维持在103 cfu/g土左右 (图4);CKn+Rs和CKn+OFp两处理病原菌数量先增加后降低,而且CKn+OFp处理由于有机肥的存在,为病原菌提供了丰富的营养物质,因此烟草全生育期土壤病原菌的数量比病土对照 (CKn+Rs) 分别增加31.8%~73.8%,拮抗菌数量也呈现先上升后下降的趋势。CKn+BIOp处理和BIOn+BIOp处理由于BIO中拮抗菌的存在,烟草移栽后土壤中病原菌的数量逐渐减少,而在育苗基质和盆栽土壤中都施入BIO的处理 (BIOn+BIOp) 育苗期间拮抗菌已经定殖在烟苗根际,盆栽试验又施入BIO强化了根际拮抗菌,因此病原菌在每一时期都显著低于只在盆栽时施入BIO处理 (CKn+BIOp),且数量稳定保持在107 cfu/g 土以下,并随生育期递减。CKn+BIOp处理的拮抗菌数量随生育期递减,移栽后90 d拮抗菌数量降到移栽时的6.5%,而BIOn+BIOp处理的拮抗菌数量在移栽后30 d略有上升,然后随生育期呈持续下降趋势,移栽后90 d时拮抗菌数量比移栽时减少69.8%,明显缓于CKn+BIOp处理。
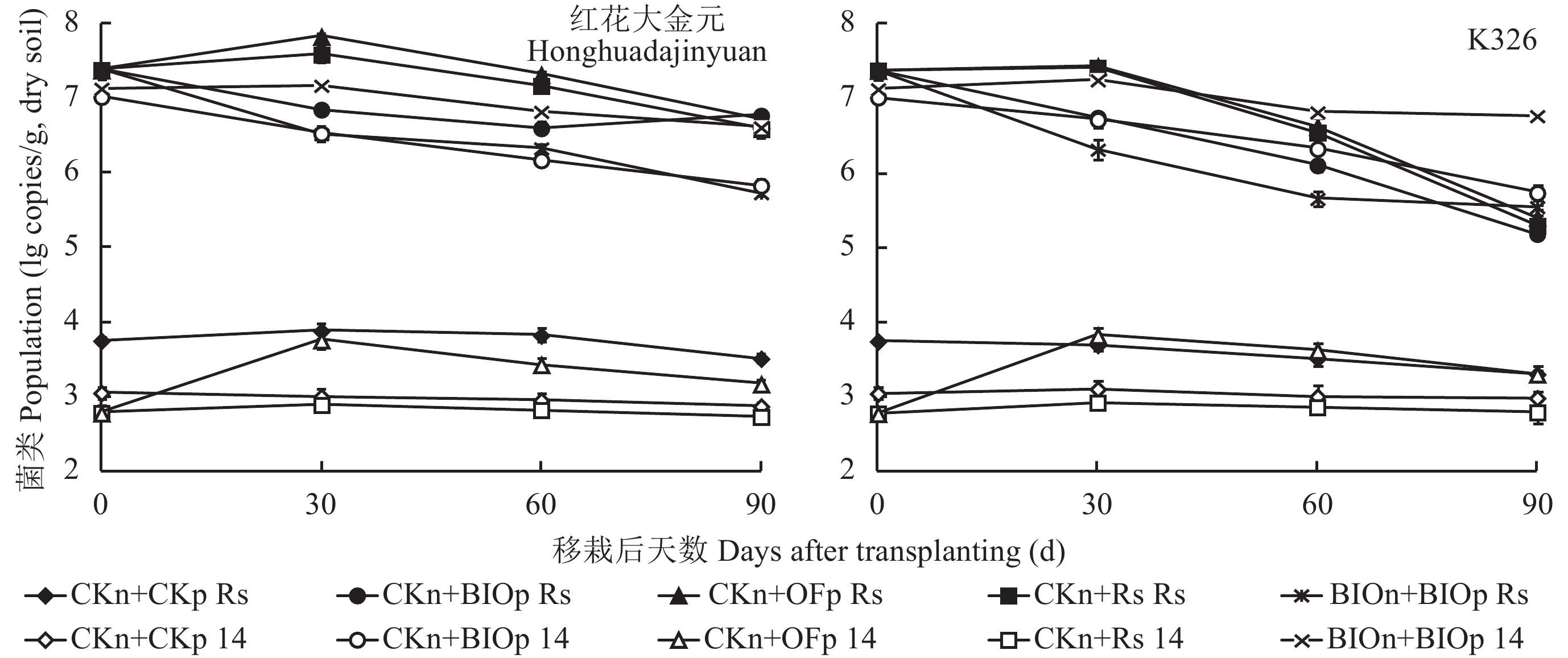 |
| 图4 盆栽试验土壤青枯病病原菌与拮抗菌数量消长关系 Fig. 4 Population of pathogen and antagonist of soil in the pot experiment [注(Note):“+”前是育苗时的处理,“+”后是移栽后的处理;CKn 表示常规基质育苗对照处理;CKp 表示盆栽健康土壤对照处理;+Rs 表示盆栽青枯病病土处理;OF 指 BIO 二次发酵前未加拮抗菌的有机肥;BIO 表示由拮抗菌 NJL-14 二次发酵的烟草专用拮抗青枯病型生物有机肥 The treatments of nursery are before “+”and the treatments of the transplanting are after “+”; CKn means traditional seedling as control;CKp means Healthy tobacco-planted soil; +Rs means soil used in the pot experiment are collected from the wilt field; OF is the compost for the second solid fermentation; BIO means bioorganic fertilizer which is second solid fermented by antagonist NJL-14. 实心图标为病原菌数量,图例中标为 Rs;空心图标为拮抗菌数量,图例中标为 14 The solid icon represents the population of R. solanacearum, marked as Rs, and the hollow icon represents the count of antagonist, marked as 14.] |
对于K326品种,除病土对照 (CKn+Rs) 和有机肥处理 (CKn+OFp) 两处理中的病原菌数量在移栽后30 d略有上升外,其他处理中的病原菌数量都迅速降低,所有处理中的茄科劳尔氏菌在移栽后90 d都降至105 cfu/g土水平。在育苗基质和盆栽土壤中都施入BIO的处理 (BIOn+BIOp) 在移栽后各时期的拮抗菌数量都显著高于只在盆栽时施入BIO处理 (CKn+BIOp),前者在移栽后30 d、60 d和90 d的拮抗菌数量分别为后者的3.39、3.09和10.72倍,表明烟草专用拮抗青枯病型生物有机肥育苗并在盆栽中强化能够有效延长拮抗菌在根际的定殖。
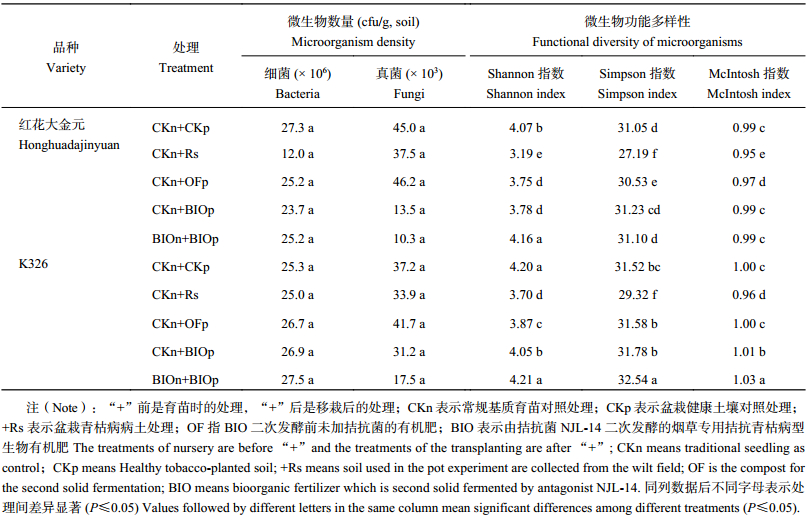
2.6 盆栽试验根际微生物数量和群落功能多样性从表6可以看出,所有处理的细菌和真菌数量无显著差异,无论是红花大金元还是K326病土对照的细菌数量在所有处理中最低,施入烟草专用拮抗青枯病型生物有机肥处理的细菌数量相对较高,育苗基质和盆栽试验双重施入BIO处理的细菌数量最多,真菌数量最少,分别比只在盆栽中施入BIO处理细菌高6.3% (红大) 和2.2% (K326),真菌少23.7% (红大) 和43.9% (K326)。两品种病土对照的Shannon指数、Simpson指数和McIntosh指数显著小于健康土对照,功能多样性下降。红花大金元的只在盆栽中施入BIO(CKn+BIOp) 和育苗、盆栽中都施入BIO(BIOn+BIOp) 处理的Simpson指数和McIntosh指数间无显著差异,但Shannon指数差异显著,BIOn+BIOp的Shannon指数比CKn+BIOp高10.0%。K326的育苗和盆栽都施入BIO处理 (BIOn+BIOp) 的Shannon指数、Simpson指数和McIntosh指数显著高于只在盆栽中施生物有机肥处理 (CKn+BIOp) 处理。
| 表6 盆栽不同处理根际土壤微生物数量和群落功能多样性 Table 6 Counts of bacteria and fungi and the functional diversity of microorganisms in the rhizosphere soil |
 |
单一的菌株制剂[19]或者纯有机肥产品对土传病害的防控效果都很有限。土传病原菌拮抗菌与适合其生长的有机载体 (优质有机肥) 一起结合施入于土壤,使得拮抗菌更易在根际定殖,形成优势种群,阻止病原菌对作物根系的侵染,从而起到较好的防控效果,这一结果已经在烟草[16]、番茄和辣椒[20]、西瓜[21]、棉花[22]、甜瓜[23]等作物上得到验证。近年来有学者从施用有机肥的角度,通过外源微生物和有机碳的输入来进行土壤改良进行克服连作障碍、防控土传病害,但这类实践存在争议且效果并不稳定[24]。例如,在长期连作条件下,单独的生物有机肥施用并不能有效缓解马铃薯连作障碍,减少块茎产量损失[25]。
生物有机肥在育苗和盆栽中双重使用,不但可以减少肥料用量,以大幅度地降低生物有机肥施用成本,还能促使拮抗菌在植物根系表面形成“微生物生物防御层”,提前定殖后防止或减少病原菌,有效防控病害发生,维持植物根系正常生长[26]。张苗等[27]利用具有促生及生物防控效果的PGPR菌株Bacillus amyloliquefaciens SQR9研制出活性育苗基质和生物有机肥,育苗及盆栽试验对黄瓜和茄子具有一定的促生效果,并且对黄瓜枯萎病的防控效果达到40.39%。滕桂香等[28]研究表明,苗床期施用微生物有机肥有助于培育壮苗,移栽大田后再次穴施微生物有机肥极大提高烤烟的产量和品质。烟草由于一直以来采用漂浮育苗,漂浮水影响了拮抗菌的定殖,因此拮抗菌育苗很少在烤烟上使用。本研究通过将拮抗菌二次固体发酵后,并采用托盘育苗方式,拮抗菌在育苗基质中的定殖能力大大增强。与传统的飘浮育苗相比,托盘育苗的拮抗菌更易生存,因此在烟苗移栽后其拮抗菌的数量在所有处理中也是最多的。育苗时就加入拮抗菌,比在烟苗移栽后加入拮抗菌的处理,拮抗菌可以更快地进入增长阶段,由此保证了拮抗菌在基质中的数量,这样对于拮抗病原菌就提供了有力的保障。
葛慈斌等[29]通过番茄组培试验发现青枯病发病浓度为8.0 × 10 6 cfu/g土,但烤烟前期研究表明当土壤中茄科劳尔氏菌数量降到107 cfu/g土以下时,不易发生烟草青枯病[7]。由于番茄和烤烟品种不同,加之番茄采用组培试验,而烤烟是田间实际生产,土壤比培养琼脂更具复杂性和缓冲性。因此,在烤烟实际生产中,其土壤中能够诱导青枯病发生的浓度要高于组培番茄能够诱导青枯病发生的浓度。本试验中,盆栽中施用生物有机肥和育苗+盆栽双重施用生物有机肥两处理,在移栽30 d后都可以将土壤中病原菌降到107 cfu/g土以下,在烟草生长全生育期青枯病的防控率都达78.6%以上。育苗+盆栽双重施用生物有机肥处理对病原菌的抑制作用优于只在盆栽中施用生物有机肥处理,在全生育期土壤病原菌数量下降两个数量级。
由于K326对烟草青枯病具有中抗性,因此K326所有处理均未发生青枯病,施入烟草专用拮抗青枯病型生物有机肥与否在青枯病防控效果上无差异;而红花大金元对烟草青枯病具有中感性,因此病土处理青枯病发病达到100%,施用生物有机肥处理防控效果明显。另外,不同抗性品种间烟草的根系分泌物组分存在较大差异,其对根际微生物种类和数量的影响不同[30],导致施入生物有机肥前后两品种根际的病原菌和拮抗菌数量不同,K326根际土壤的病原菌数量减少比红花大金元更为迅速,但总体而言,施入生物有机肥后,根际土壤中的病原菌数量显著下降。Yin等[31]研究表明,水稻苗期枯萎病与土壤有机质含量及微生物活性成负相关,施入有机肥后土壤微生物活性和酶活增加,发病情况降低。在本研究中,无论是红花大金元还是K326品种,育苗+盆栽双重施用生物有机肥处理的Shannon多样性指数、Simpson指数和McIntosh指数显著高于只在盆栽中施用生物有机肥处理,表明多次施用生物有机肥能够增加土壤微生物功能多样性。生物有机肥的施用可以提高土壤微生物活性,改善微生物结构和功能,从而实现土壤微生物生态平衡,抑制作物病害[32]。近来很多研究表明,对土传病害的抑制在一定程度上是土壤微生物群体的作用[33]。本研究中,只在盆栽中施入生物有机肥和育苗+盆栽双重施用生物有机肥处理能够有效防控烟草青枯病,防控率分别达到78.6%和100%,其土壤微生物功能多样性显著高于其它处理,说明微生物群体作用有效降低了青枯病的发病情况,这可能是生物有机肥的施用增加了有益微生物的碳源利用强度,与土传病原菌形成“营养竞争”,使病原菌得不到足够的营养物质不能大量繁殖[34],此论点与本研究中施入生物有机肥处理茄科劳尔氏菌数量显著减少的结果相符。
由功能微生物二次固体发酵的生物有机肥不但能够抑制土传病害发生、增加土壤微生物活性,还能起到一定的促生作用。Wang等[35]研究表明,施用由Bacillus amyloliquefaciens W19制得的微生物肥料可显著提高香蕉植株干重。赵青云等[36]研究发现,施用生物有机肥香草兰地上部干重和根系干重均显著高于对照, 分别增加了63.1%和59.4%。部分微生物兼具促生和生防的效果,例如短短芽孢杆菌二次固体发酵的生物有机肥对烟草青枯病的防控率达到92.3%,同时可显著提高烟叶和根系生长[9],与本研究结果相似,即施用生物有机肥对烟苗生长具有显著的促进作用。
| [1] | Abawi G S, Widmer T L. Impact of soil health management practices on soilborne pathogens, nematodes and root diseases of vegetable crops[J]. Applied Soil Ecology, 2000, 15: 37–47. DOI:10.1016/S0929-1393(00)00070-6 |
| [2] |
李胜华, 谷丽萍, 刘可星, 等. 有机肥配施对番茄土传病害的防治及土壤微生物多样性的调控[J].
植物营养与肥料学报, 2009, 15(4): 965–969.
Li S H, Gu L P, Liu K X, et al. Effect of combined application of organic fertilizers on the control of soilborne diseases and the regulation of soil microbial diversity[J]. Plant Nutrition and Fertilizer Science, 2009, 15(4): 965–969. |
| [3] | Qiu M, Zhang R, Xue C, et al. Application of bio-organic fertilizer can control fusarium wilt of cucumber plants by regulating microbial community of rhizosphere soil[J]. Biology and Fertility of Soils, 2012, 48(7): 807–816. DOI:10.1007/s00374-012-0675-4 |
| [4] | Zhao S, Liu D, Ling N, et al. Bio-organic fertilizer application significantly reduces the fusarium oxysporum population and alters the composition of fungi communities of watermelon fusarium wilt rhizosphere soil[J]. Biology and Fertility of Soils, 2014, 50(5): 765–774. DOI:10.1007/s00374-014-0898-7 |
| [5] | Wu Y, Zhao C, Farmer J, et al. Effects of bio-organic fertilizer on pepper growth and fusarium wilt biocontrol[J]. Scientia Horticulturae, 2015, 193: 114–120. DOI:10.1016/j.scienta.2015.06.039 |
| [6] | Ding C, Shen Q, Zhang R, et al. Evaluation of rhizosphere bacteria and derived bio-organic fertilizers as potential biocontrol agents against bacterial wilt (Ralstonia solanacearum) of potato [J]. Plant and Soil, 2012, 366(1): 453–466. |
| [7] |
刘艳霞, 李想, 曹毅, 等. 抑制烟草青枯病型生物有机肥的田间防效研究[J].
植物营养与肥料学报, 2014, 20(5): 1203–1211.
Liu Y X, Li X, Cao Y, et al. Field control efficiency of tobacco specific bio-organic fertilizer on tobacco bacterial wilt[J]. Plant Nutrition and Fertilizer Science, 2014, 20(5): 1203–1211. DOI:10.11674/zwyf.2014.0517 |
| [8] |
杨春元, 任学良, 吴春. 贵州烟草品种资源[M]. 贵阳: 贵州科技出版社, 2008.
Yang C Y, Ren X L, Wu C. Tobacco variety resource in Guizhou province [M]. Guiyang: Guizhou Science and Techonology Publishing House, 2008. |
| [9] | Liu Y X, Shi J X, Feng Y G, et al. Tobacco bacterial wilt can be biologically controlled by the applicaiton of antagonistic strains in combination with organic fertilizer[J]. Biology and Fertility of Soils, 2013, 49: 447–464. DOI:10.1007/s00374-012-0740-z |
| [10] |
刘艳霞. 土传烟草青枯病的生物防控及其机理研究[D]. 南京: 南京农业大学博士论文, 2012.
Liu Y X. Study on biological control of tobacco bacterial wilt and its mechanisms of action[D]. Nanjing: PhD dissertation, Nanjing Agricultural University, 2012. |
| [11] |
唐远驹, 李继新, 潘文杰, 等. 烟草托盘水床育苗方法[P]. 中国专利: 02123373, 2003.
Tang Y J, Li J X, Pan W J, et al. Tobacco tray with water bed seedling method[P]. China Patent: 02123373, 2003. |
| [12] |
GB/T-2008, 烟草病虫害分级及调查方法[S].
GB/T-2008, Grade investigation method tobacco diseases, insect and pests[S]. |
| [13] | Schonfeld J, Heuer H, Van Elsas J D, et al. Specific and sensitive detection of ralstonia solanacearum in soil on the basis of pcr amplification of flic fragments[J]. Appl Environ Microbiol, 2003, 69(12): 7248–7256. DOI:10.1128/AEM.69.12.7248-7256.2003 |
| [14] |
张志鸿, 甘蓓, 谭强来, 等. 基于不同靶基因的荧光定量PCR快速检测蜡样芽孢杆菌的研究[J].
食品工业科技, 2013, 34(23): 160–163.
Zhang Z H, Gan B, Tan Q L, et al. Development of real-time PCR method based on different target genes for rapid detection of Bacillu cereus [J]. Science and Technology of Food Industry, 2013, 34(23): 160–163. |
| [15] |
李聪智, 谭德明, 鲁猛厚, 等. 聚合酶链反应检测细菌16s rna基因[J].
湖南医科大学学报, 1999, 24(2): 136–138.
Li Z C, Tan D M, Lu M H, et al. PCR for the detection of 16S rRNA gene bacteria[J]. Bulletin of Hunan Medical University, 1999, 24(2): 136–138. |
| [16] | Das M, Royer TV, LG L. Diversity of fungi, bacteria, and actinomycetes on leaves decomposing in a stream[J]. Applied & Environmental Microbiology, 2007, 73(3): 756–767. |
| [17] | Bissett A, Richardson A E, Baker G, et al. Long-term land use effects on soil microbial community structure and function[J]. Applied Soil Ecology, 2011, 51: 66–78. DOI:10.1016/j.apsoil.2011.08.010 |
| [18] | Garland J L, Mills A L. Classification and characterization of heterotrophic microbial communities on the basis of patterns of community-level sole-carbon-source utilization[J]. Applied and Environmental Microbiology, 1991, 57: 2351–2359. |
| [19] | Leonardo D, Blanca L F, Landa B. Host crop affects rhizosphere colonization and competitiveness of 2, 4-diacetylphloroglucinol-producing Pseudomonas fluorescens [J]. Phytopathology, 2006, 96: 751–762. DOI:10.1094/PHYTO-96-0751 |
| [20] |
张鹏, 王小慧, 李蕊, 等. 生物有机肥对田间蔬菜根际土壤中病原菌和功能菌组成的影响[J].
土壤学报, 2013, 50(2): 381–387.
Zhang P, Wang X H, Li R, et al. Effect of bio-organic fertilizer on pathogenic and functional bacteria composition in rhizospheric soil of field vegetables[J]. Acta Pedologica Sinica, 2013, 50(2): 381–387. DOI:10.11766/trxb201203020057 |
| [21] |
凌宁. 根际施用生物有机肥防控西瓜土传枯萎病效果及机理研究[D]. 南京: 南京农业大学博士论文, 2012.
Ling N. The effects and mechanisms of bio-organic fertilizer on biological control of Fusarium wilt of watermel in Fusarium-infestedsoil [D]. Nanjing: PhD dissertation, Nanjing Agricultural University, 2012. |
| [22] |
罗佳, 赵爽, 袁玉娟, 等. 施用微生物有机肥对棉花抗病性相关酶活性的影响[J].
南京农业大学学报, 2011, 34(3): 89–93.
Luo J, Zhao S, Yuan Y J, et al. Effect of a bio-organic fertilizer on the disease resistance-related enzymes activities of cotton[J]. Journal of Nanjing Agricultural University, 2011, 34(3): 89–93. DOI:10.7685/j.issn.1000-2030.2011.03.016 |
| [23] | Zhao Q, Dong C, Yang X, et al. Biocontrol of fusarium wilt disease for cucumis melo melon using bio-organic fertilized [J]. Applied Soil Ecology, 2011, 47: 67–75. DOI:10.1016/j.apsoil.2010.09.010 |
| [24] |
王丽丽, 石俊雄, 袁赛飞, 等. 微生物有机肥结合土壤改良剂防治烟草青枯病[J].
土壤学报, 2013, 50(1): 150–156.
Wang L L, Shi J X, Yuan S F, et al. Control of tobacco bacterial wilt with biomanure plus soil amendments[J]. Acta Pedologica Sinica, 2013, 50(1): 150–156. DOI:10.11766/trxb201112210498 |
| [25] |
刘星, 张文明, 张春红, 等. 土壤灭菌–生物有机肥联用对连作马铃薯及土壤真菌群落结构的影响[J].
生态学报, 2016, 36(20): 1–14.
Liu X, Zhang W M, Zhang C H, et al. Combination of the application of soil disinfection and bio-organic fertilizer amendment and its effects on yield and quality of tubers, physiological characteristics of plants, and the soil fungal community in a potato monoculture system[J]. Acta Ecologica Sinica, 2016, 36(20): 1–14. |
| [26] |
凌宁, 王秋君, 杨兴明, 等. 根际施用微生物有机肥防治连作西瓜枯萎病研究[J].
植物营养与肥料学报, 2009, 15(5): 1136–1141.
Ling N, Wang QJ, Yang M, et al. Control of Fusarium wilt of watermelon by nursery application of bio-organic fertilizer[J]. Plant Nutrition and Fertilizer Science, 2009, 15(5): 1136–1141. |
| [27] |
张苗. 含bacillus amyloliquefaciens sqr9的育苗基质和生物有机肥的研制及其应用[D]. 南京: 南京农业大学硕士学位论文, 2014.
Zhang M. The development and application of bio-soilless medium and bio-organic fertilizer containing Bacillus amyloliquefaciens SQR9[D]. Nanjing: MS Thesis, Nanjing Agricultural University, 2014. |
| [28] |
滕桂香, 邱慧珍, 张春红, 等. 微生物有机肥对烤烟育苗、产量和品质的影响[J].
中国生态农业学报, 2011, 19(6): 1255–1260.
Teng G X, Qiu H Z, Zhang C H, et al. Effect of microbial organic fertilizer on seedling growth, yield and qulity of flue-cured tobacco[J]. Chinese Journal of Eco-Agriculture, 2011, 19(6): 1255–1260. |
| [29] |
葛慈斌, 刘波, 泉育菁. 青枯雷尔氏菌致病力的番茄组培苗鉴定方法研究[J].
武夷科学, 2004, 20(20): 13–16.
Ge C B, Liu B, Quan Y Q. Study on the methods on identifying the virulence of Ralstonia solanacearum using tissue cultured tomatoes [J]. Wuyi Sciences, 2004, 20(20): 13–16. |
| [30] |
邱文龙. 不同品种烟草根系分泌物的组分分析与抗黑胫病的关系[D]. 泰安: 山东农业大学硕士学位论文, 2014.
Qiu W L. Researches on the relationship between root exudates of different flu-cured tobacco variaties and resistant of black shank disease (phytophora parasitica var. nicotiana) [D]. Taian: MS Thesis, Shandong Agricultural University, 2014. |
| [31] | Yin S, Dong Y, Xu Y, et al. Upland rice seedling wilt and microbial biomass and enzyme activities of compost-treated soils[J]. Biol Fertil Soils, 2011, 47: 303–313. DOI:10.1007/s00374-010-0537-x |
| [32] |
胡可, 李华兴, 卢维盛, 等. 生物有机肥对土壤微生物活性的影响[J].
中国生态农业学报, 2010, 18(2): 303–306.
Hu K, Li H X, Lu W S, et al. Effect of microbial organic fertilizer application on soil microbial activity[J]. Chinese Journal of Eco-Agriculture, 2010, 18(2): 303–306. |
| [33] |
张瑞福, 沈其荣. 抑病型土壤的微生物区系特征及调控[J].
南京农业大学学报, 2012, 35(5): 125–132.
Zhan R F, Shen Q R. Characterization of the microbial flora and management to induce the disease suppressive soil[J]. Journal of Nanjing Agricultural University, 2012, 35(5): 125–132. |
| [34] | Irikiin Y, Nishiyama M, Otsuka S. Rhizobacterial affects the delay in the bacterial wilt of tomato grown in rhizobacterial community model system[J]. Applied Soil Ecology, 2006, 34: 27–32. DOI:10.1016/j.apsoil.2005.12.003 |
| [35] | Wang B B, Yuan J, Zhang J. Effects of novel bioorganic fertilizer produced by bacillus amyloliquefaciens w19 on antagonism of fusarium wilt of banana [J]. Biology and Fertility of Soils, 2013, 49(4): 435–446. DOI:10.1007/s00374-012-0739-5 |
| [36] |
赵青云, 赵秋芳, 王辉, 等. 根际促生菌Bacillus subtilis y-ivi在香草兰上的应用效果研究
[J].
植物营养与肥料学报, 2013, 49(4): 435–446.
Zhao Q Y, Zhao Q F, Wang H, et al. Beneficial effects of plant growth promoter rhizobacteria on vanilla (Vanilla planifolia Ames.) growth [J]. Plant Nutrition and Fertilizer Science, 2013, 49(4): 435–446. |
 2017, Vol. 23
2017, Vol. 23  doi:
doi: 

