木霉菌 (Trichoderma spp.) 属真菌界、双核菌门、半知菌亚门、丝孢纲丛、梗孢目、丛梗孢科,广泛存在于土壤、森林、植株根际或叶面、树皮及枯枝落叶中[1]。大量研究表明,一些木霉菌株属于重要的植物根际促生真菌 (PGPF),具有良好的促进植物生长和抑制植物病原菌的功能。木霉菌株通过竞争、重寄生和分泌次生代谢产物等方式,能抑制多种植物病菌的生长;通过分泌植物生长激素等物质,能显著促进作物的生长[2–5]。Vinale等[6]利用哈茨木霉T22和深绿木霉Pl对莴苣、番茄和胡椒等作物进行处理后,植株果实数量、株高、地下部鲜重和干重均显著提高。杨春林等[7]利用哈茨木霉菌株T-h-30 对黄瓜、芹菜和番茄等几种蔬菜进行大田试验,结果发现木霉对植株的叶片数、株高等具有显著的促进作用,且有效提高了蔬菜的品质和产量。因此,一些木霉属菌株如哈茨木霉 (T. harzianum) 和绿色木霉 (T. aviride) 作为生物肥料或生物农药,在农业生产上具有广阔的应用前景[8–9]。然而,目前市场上木霉菌生物肥料或生物农药并不常见,其中限制木霉菌应用的主要瓶颈之一是产品中木霉分生孢子数量偏低。
国内外对木霉发酵工艺的研究并不多见,有学者利用固体发酵工艺研究了木霉纤维素酶[10]、木聚糖酶[11]和挥发性有机物[12]。Verma等[13–14]利用液体发酵工艺研究了活性污泥含量和预处理及溶解氧对木霉分生孢子数量的影响。张良等[15]通过固液发酵实验表明固体发酵产孢效果明显优于液体发酵。与液体发酵相比,固体发酵能较容易利用低成本的农业或工农业副产物作为培养基质,在资金和操作成本上较液体发酵低。固体发酵是在无重力水状态下进行的,所需设备简单,同时减少了液体发酵下游工程带来的成本[16–18]。
小麦秸秆资源丰富,容易获得,其中富含的纤维素在发酵过程中能被木霉利用。本研究以哈茨木霉T-E5 为试验菌株,以小麦秸秆为发酵基质,经过温度、酸浓度、含水量、接种量、添加氮源、添加碳源等单因子条件优化,再通过正交试验优化,获得产孢量最大的配方。通过盆栽试验,以小麦秸秆发酵物作为生物有机肥研究其对黄瓜生长的影响。本研究初步探索到哈茨木霉TE-5菌株固体发酵产孢的较优工艺条件,为该菌的深入研究提供了有益的试验数据,并为木霉菌肥和木霉类生物有机肥的推广应用提供理论参考。
1 材料与方法 1.1 供试材料菌株:哈茨木霉T-E5,南京农业大学国家有机肥料工程研究中心提供。T-E5菌株是由本课题组张风革[19]通过紫外诱变对野生菌株哈茨木霉SQR-T037经过多级筛选,获得一株性状稳定、活性更强的诱变菌株。
固体发酵基质:经粉碎的纯小麦秸秆粉。
供试作物:黄瓜新津春4号。
盆栽土壤:江苏宜兴地区养分贫瘠的亚表层水稻土,pH 6.8、有机质9.61 g/kg、全氮0.12 g/kg、有效磷5.42 mg/kg、速效钾67.30 mg/kg。
有机肥:江苏联业生物科技公司生产的猪粪,养分含量为N 0.95%、P2O5 2.08%、K2O 1.26%。
木霉生物有机肥:木霉固体发酵物与普通猪粪有机肥以1∶10的比例复配得到,生物有机肥中木霉菌孢子数量为3.0 × 10 8个/g。
1.2 试验方法1.2.1 培养基的配制 PDA固体培养基:马铃薯200 g、葡萄糖20 g、琼脂20 g、自来水1000 mL、pH自然。马丁氏培养基:KH2PO4 1 g、MgSO4·7H2O 0.5 g、蛋白胨5 g、葡萄糖10 g、琼脂15~20 g、水1000 mL,此培养基1000 mL加1%孟加拉红水溶液3.3 mL。临用时每100 mL培养基中加1% 链霉素液0.3 mL。固体发酵培养基质:称取10 g固体发酵基质,装入250 mL三角瓶中,121℃下灭菌30 min,烘干待用。
1.2.2 孢子悬液的制备 PDA平板接菌放置在恒温培养箱,温度设置在28℃,8天后取出,在平板中添加10 mL左右的无菌水,并用无菌的涂布棒来回刮洗平板制备孢子悬液,用血球计数板法测定孢子悬液中的孢子含量。
1.2.3 孢子量的检测 称取10 g发酵产物,加入100 mL无菌水及5粒玻璃珠 (破碎混合均匀) 至三角瓶中,摇床设置在28℃,振荡30 min,四层灭菌纱布过滤后测定孢子悬液的孢子量,用马丁氏培养基通过梯度稀释依次涂布的方法进行准确计数,测定发酵物的含水量,得到每克干物质孢子量,每个处理4次重复。
1.2.4 固体发酵培养方式 在10 g发酵基质中,加入15 mL无菌水及5 mL孢子悬液,搅拌均匀,分别放入三角瓶 (三角瓶法)、自封袋 (袋装法[20]) 和方盒 (浅盘平板法[21]) 28℃培养7天。按1.2.3方法检测发酵物中孢子量。
1.2.5 固体发酵条件的单因素优化试验方法
1) 培养温度:在10 g发酵基质中,加入15 mL无菌水混匀,加入5 mL菌液,搅拌均匀,设置温度梯度24℃、26℃、28℃、30℃、32℃浅盘培养7天。按1.2.3方法检测发酵物中孢子量。
2) 酸浓度:在10 g发酵基质中,分别加入15 mL 浓度为0.2 mol/L、0.1 mol/L、0.01 mol/L、1 × 10 –3 mol/L、1 × 10 –4 mol/L和1 × 10 –5 mol/L(10–3~10–5,稀释得到) 的稀硝酸以及超纯水,搅拌均匀,静置8小时,再加入5 mL菌液,搅拌均匀,28℃浅盘培养8天。按1.2.3方法检测发酵物中孢子量。
3) 酸种类:在10 g发酵基质中,分别加入0.1 mol/L的硝酸、硫酸、盐酸、磷酸的灭菌稀酸溶液15 mL,搅拌均匀,静置8小时,加入5 mL菌液,搅拌均匀,28℃浅盘培养7天。按1.2.3方法检测发酵物中孢子量。
4) 含水量:在10 g发酵基质中,加入0.1 mol/L的硝酸溶液,静置8小时,再加入5 mL菌液,使含水量分别达到50%、60%、70%、75%、80%(湿基) 后,搅拌均匀,28℃浅盘培养7天。按1.2.3方法检测发酵物中孢子量。
5) 接种量:在10 g发酵基质中,加入0.1 mol/L的稀硝酸25 mL,搅拌均匀,静置8小时,再加入1%、3%、5%、7%、9%等不同浓度的菌液5 mL,并使含水量达75%,搅拌均匀,28℃浅盘培养7天。按1.2.3方法检测发酵物中孢子量。
6) 氮源:在10 g发酵基质中,加入0.1 mol/L的稀硝酸25 mL,分别加入1%的蛋白胨、酵母粉、尿素、硝酸钾、硫酸铵搅拌均匀,静置8小时,再加入3%的菌液5 mL,含水量75%,搅拌均匀,28℃浅盘培养7天。按1.2.3方法检测发酵物中孢子量。
7) 碳源:在10 g发酵基质中,加入0.1 mol/L的稀硝酸25 mL,1%的尿素,分别加入1%的玉米粉、小麦粉、大豆粉、葡萄糖、蔗糖,搅拌均匀,静置8小时,再加入3%的菌液5 mL,含水量75%,搅拌均匀,28℃浅盘培养7天。按1.2.3方法检测发酵物中孢子量。
1.2.6 发酵时间 在10 g发酵基质中,加入0.1 mol/L 的稀硝酸25 mL,1%的尿素,1%的玉米粉搅拌均匀,静置8小时,再加入3%的菌液5 mL,含水量75%,搅拌均匀,28℃培养,从第2天开始取样至第10天。按1.2.3方法检测发酵物中孢子量。
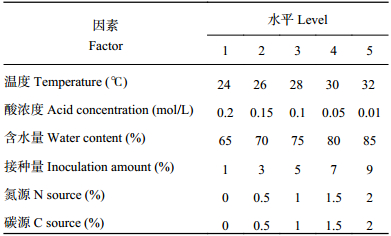
1.3 发酵条件正交优化设计选取发酵条件中影响最大的6个因子:温度、酸浓度、含水量、接种量、氮源 (选取尿素)、碳源 (选取玉米粉),通过正交试验进一步优化培养基的发酵条件。选用6因素5水平的L25 (56) 正交表进行试验,正交试验因素及水平见表1,共安排25个试验组,每个试验组3次重复。
| 表1 正交试验因素水平表 Table 1 Factors and levels of the orthogonal test |
 |
试验分2季,第1季于2016年4~6月,收获后,盆栽用土暴晒3天,混合均匀,重新装盆;第2季于2016 年7~9月在江苏宜兴中宜生物肥料工程中心温室内进行。试验设5个处理:1) 不施肥 (CK);2) 尿素 0.814 g/钵,过磷酸钙 1.486 g/钵,硫酸钾 0.935 g/钵 (化肥CCK);3) 猪粪有机肥 (干重) 40 g/钵,氮磷钾养分施用量与化肥处理相等 (有机肥OCK);4) 化肥+木霉发酵物 (干重) 4 g/钵 (CT);5) 猪粪有机肥 (干重) 40 g/钵+木霉发酵物 (干重) 4 g/钵 (OT)。每个处理6次重复。每钵装土3 kg。肥料与土壤搅拌均匀后分别装入盆钵,将长势均匀的两叶一心的健康黄瓜苗移植到盆钵里面。温室内按日常栽培方法管理。培养至1个月后,按常规方法测定各处理的株高、叶面积及地上部干重。叶面积选取每株黄瓜苗由下至上按叶片顺序同一位置 (第6片叶),测量其长度和宽度,计算面积 (长 × 宽)。
真菌群落及木霉菌计数:土壤中真菌总数和木霉菌数的测定采用平板稀释涂布计数法,称取根际土5 g溶于45 mL无菌水中,振荡30 min保证土样与无菌水混合均匀后进行梯度稀释,总真菌稀释涂布于马丁氏培养基平板上,28℃培养平板计数。木霉菌稀释涂布于木霉选择性培养基[22]:马丁氏培养基用前加入1%氯霉素25 mL/L、3%链霉素3 mL/L、五氯硝基苯0.2 g/L、曲拉通1 mL/L、霜霉威1.2 mL/L。
1.5 数据分析采用Origin8.5和SPSS软件进行数据统计分析并作图,使用最小显著差异法 (Least significant difference, LSD) 检验进行多重比较 (P < 0. 05)。
2 结果与分析 2.1 固体发酵培养方式为找到适合木霉菌大量培养的发酵方式,本研究对三角瓶法、袋装法和浅盘法三种培养方式进行对比。结果表明,使用袋装法和浅盘法的孢子产量比三角瓶法高 1 倍,其中使用浅盘平板法所产生的孢子最多,可达到 1.06 × 10 8个/g (图1)。
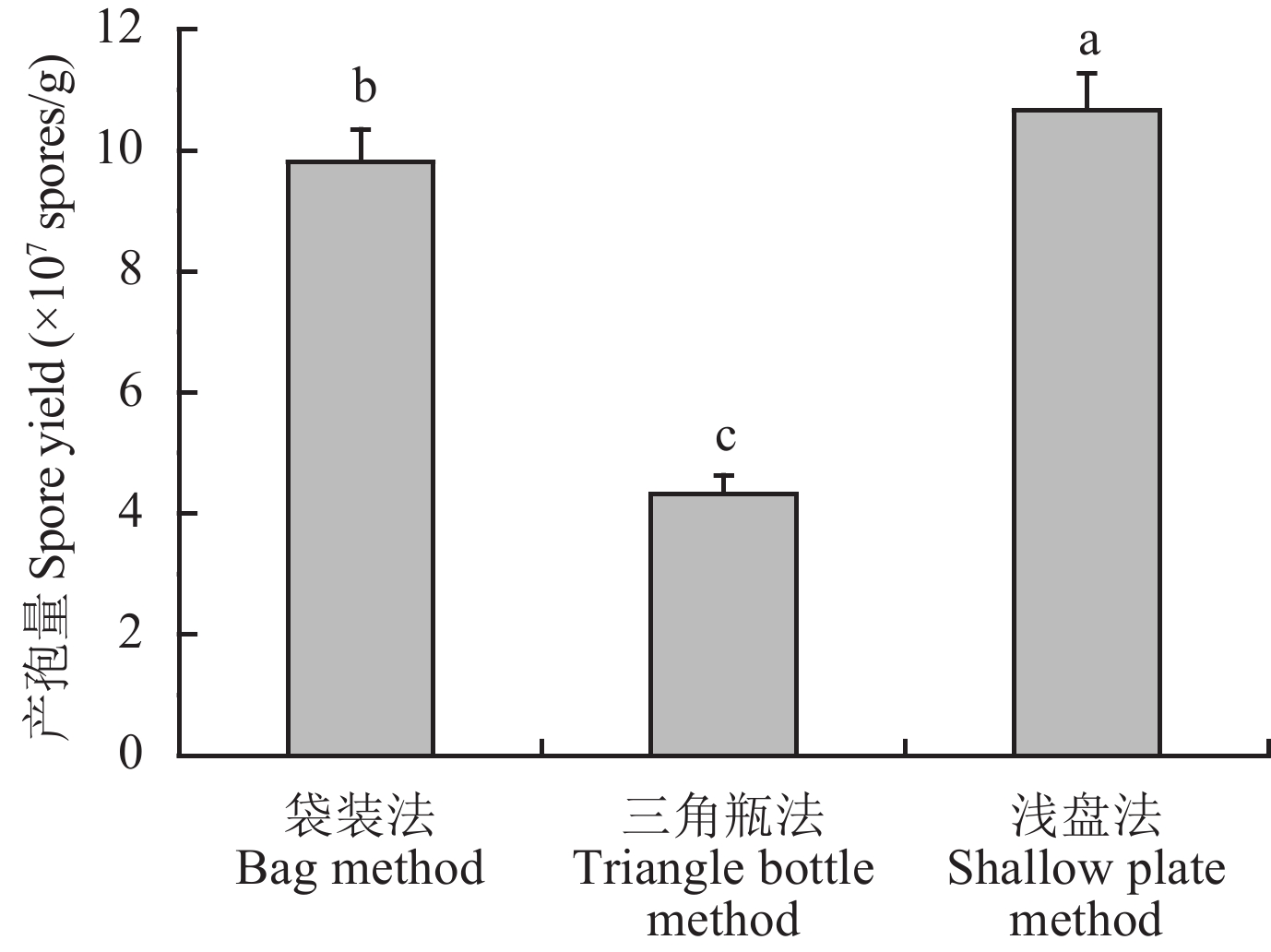 |
| 图1 哈茨木霉 T-E5 在三种培养方式下的产孢量 Fig. 1 Sporulation of Trichoderma harzianum T-E5 in three culture modes [注 (Note):柱上不同字母表示处理间差异显著 (P < 0.05) Different letters above the bars indicate significant difference among the treatments (P < 0.05).] |
2.2.1 培养温度 温度对微生物生长及固体发酵产生很大的影响,不同的发酵温度对木霉产孢的影响不同。表2 表明,在 28℃时孢子产量最高,达到 1.34 × 10 8个/g,其中温度低于 28℃时,木霉的产孢量要大于 30℃及 32℃,因此 28℃左右是木霉固体发酵的最佳产孢温度。在接种木霉后的前 3 天,当温度在 30℃及 32℃时,可能是由于培养基上的菌丝生长受到高温抑制,因而后期的孢子产量较低;在 24℃和 26℃时,菌丝生长速度减缓,直接影响到孢子的形成。
| 表2 不同固体发酵单因素条件下的产孢量 Table 2 Spores produced under different single factor condition in solid state fermentation |
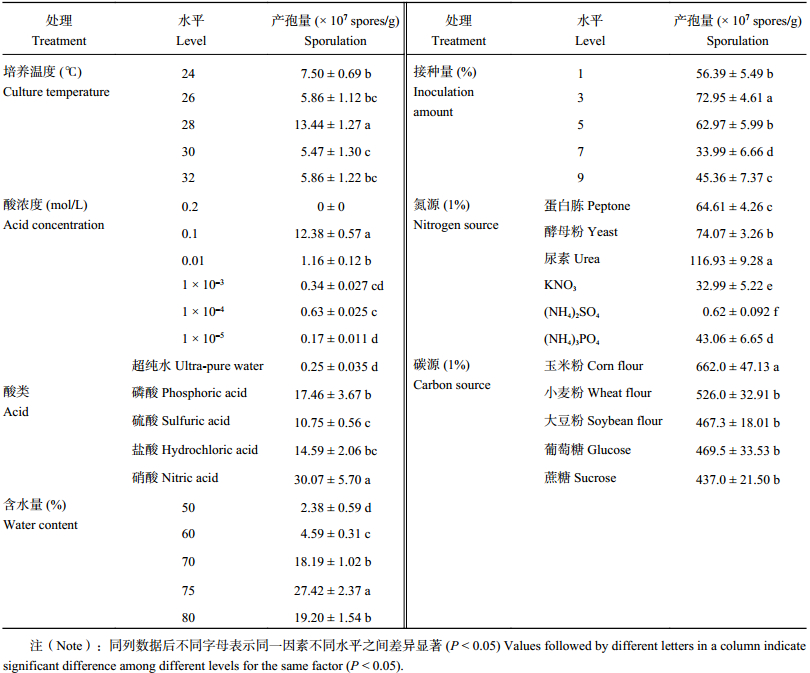 |
2.2.2 酸浓度 前期预备试验及查阅文献发现,pH值对基质产孢量的影响较大。研究采用硝酸溶液调节固体基质的pH,基质的pH对产孢量的影响差异显著。直接在固体秸秆物质中调节酸度,容易出现固体基质pH调节不稳定,木霉不能进行有效的生长,因此本实验通过加入不同浓度梯度的酸液对固体基质进行调节,以期达到调节均一稳定的状态。采用 0.1 mol/L的硝酸溶液进行调节,固体发酵产物产生的分生孢子产孢量最高,达到 1.24 × 10 8个/g,与超纯水处理相比增加了 2 个数量级。而采用 0.01 mol/L、1 × 10 –3 mol/L、1 × 10 –4 mol/L和1 × 10 –5 mol/L 的硝酸溶液处理的产孢量均出现降低的现象 (表2)。
2.2.3 酸种类 pH对微生物的生长有很大影响,本实验通过添加相同浓度的四种常用酸溶液进行固体基质pH的调节。结果表明,不同的酸类对木霉孢子的产生具有显著的影响。如表2 所示,四种酸均能调节基质pH,同时提高木霉固体发酵孢子的产量,其中以硝酸作为固体发酵培养基的酸度调节剂时尤为显著,达到3.0 × 10 8个/g。
2.2.4 含水量 不同含水量对于木霉孢子的产生具有显著的影响。如表2所示,含水量在70%~80%时木霉孢子产量较高,其中75%含水量时孢子产量达到最高2.74 × 10 8个/g。含水量在80%时,相比75%含水量木霉孢子产量下降30%左右。而含水量在50%~60%时,由于培养基较干,不适宜木霉菌的生长,产孢量较低。因此在以小麦秸秆作为发酵培养基时,初始含水量在 75%时为最适。
2.2.5 接种量 木霉接种量对固体发酵的产孢量影响较为明显。在分别加入 1%、3%、5%、7%、9%接种量的孢子悬液培养 8 天后,取样测定孢子数。表2表明,1%、5%、7%、9%的处理木霉的产孢量显著 (P < 0.05) 低于 3% 的处理。接种量过低,木霉在固体基质中的生物量较低;而接种量过高时,菌体之间的养分竞争作用增加也不利于木霉生长。
2.2.6 氮源 添加 1%的不同氮源对木霉孢子的产量有显著性的影响(表2)。以尿素作为外加氮源时,木霉孢子产量最高,可达到 1.17 × 10 9个/g。以蛋白胨和酵母粉作为氮源时孢子产量分别为 6.46 × 10 8个/g和 7.41 × 10 8个/g,两者差异显著。而以磷酸铵、硝酸钾、硫酸铵作为外加氮源时孢子产量较低,相比尿素处理,磷酸铵处理产孢量下降 62.87%;硝酸钾处理下降71.56%;而硫酸铵处理产孢量下降了 2 个数量级,这与酸种类实验中使用硫酸处理产孢量较低的趋势相似,可能与硫能够抑制微生物生长作用相关。
2.2.7 碳源 试验选取玉米粉等五种碳源作为添加物,旨在增加接入菌液后发酵前期的孢子萌发率及菌丝生长量。考虑到生产成本,故确定其添加量为 1%。添加碳源玉米粉、小麦粉、大豆粉、葡萄糖及蔗糖,木霉孢子产量分别是 6.62 × 10 9、5.26 × 10 9、4.67 × 10 9、4.69 × 10 9、4.37 × 10 9个/g。添加碳源均能提高产孢量,其中以玉米粉处理的木霉孢子产量增加最高。
2.3 发酵时间为确定发酵时间对木霉孢子生长的影响,从接种后的第 24 h开始取样,作为发酵取样的第 1天,之后连续取样 10 天。图2结果表明,哈茨木霉在固体发酵培养基上,1~3 d产孢量较低;4~8 d产孢量大幅度增加;第 8 d达到最大值 5.11 × 10 9个/g。故确定哈茨木霉T-E5 的最佳发酵时间为 8 天。以上述单因素发酵条件为基础,浅盘发酵8天,最终木霉菌孢子产量可达 8.87 × 10 9个/g。
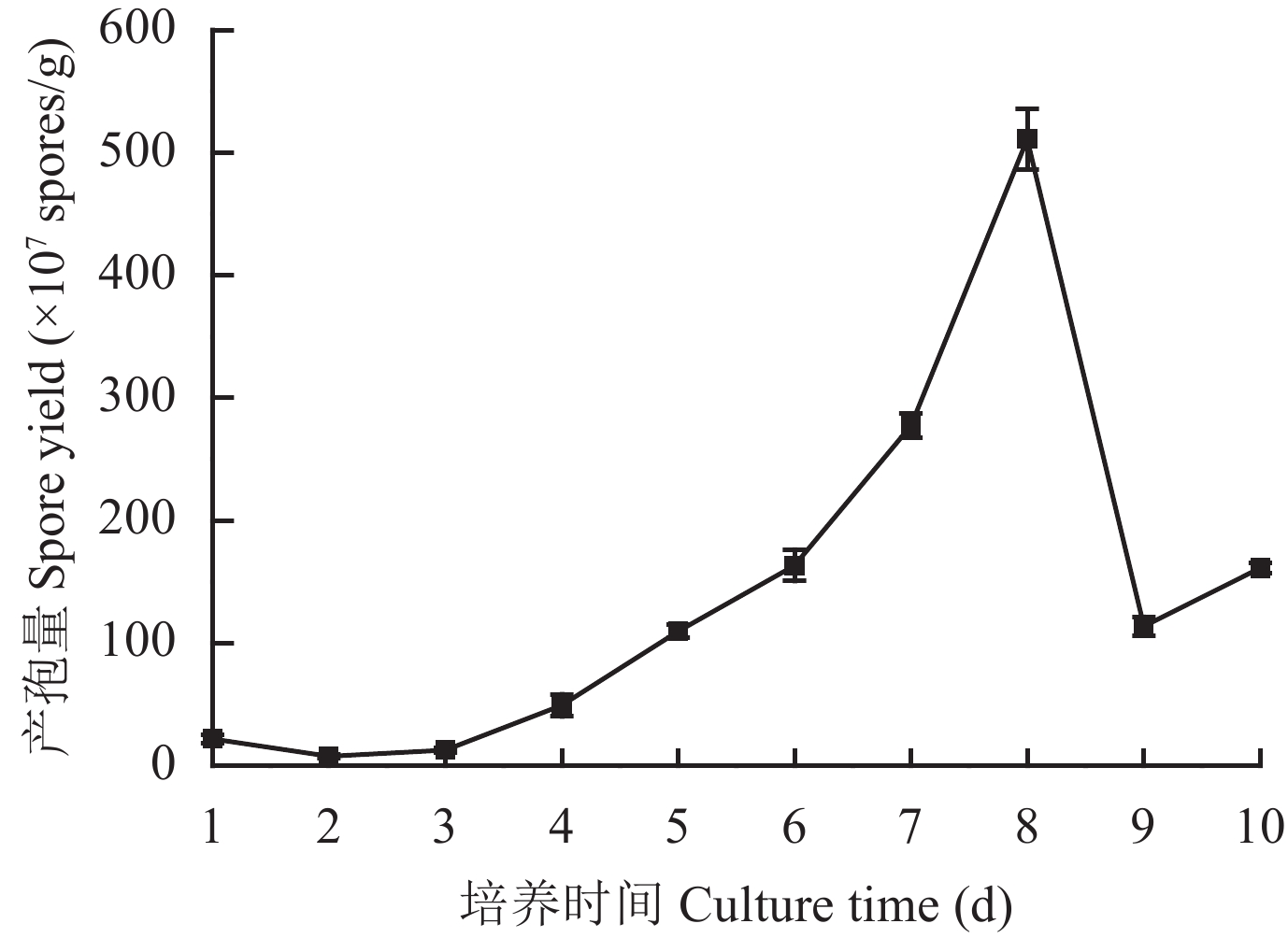 |
| 图2 哈茨木霉 T-E5 在 10 天内孢子产量趋势 Fig. 2 Trichoderma harzianum T-E5 spore yield trends in 10 days |
为了优化发酵条件,进行了六因素五水平L25(56) 的正交试验,选择温度、酸浓度、含水量、接种量、尿素及玉米粉加入量作为 6 个因素。结果 (表3) 表明,试验 19 得到的发酵条件下基质的平均产孢量最高达到 1.10 × 10 10个/g,故选择发酵条件为:添加硝酸浓度为 0.05 mol/L、含水量 70%、尿素 1% 、不添加玉米粉、接种量为 9%、30℃ 下培养 8 天。
| 表3 发酵条件的正交优化结果 Table 3 Orthogonal optimization of the fermentation conditions |
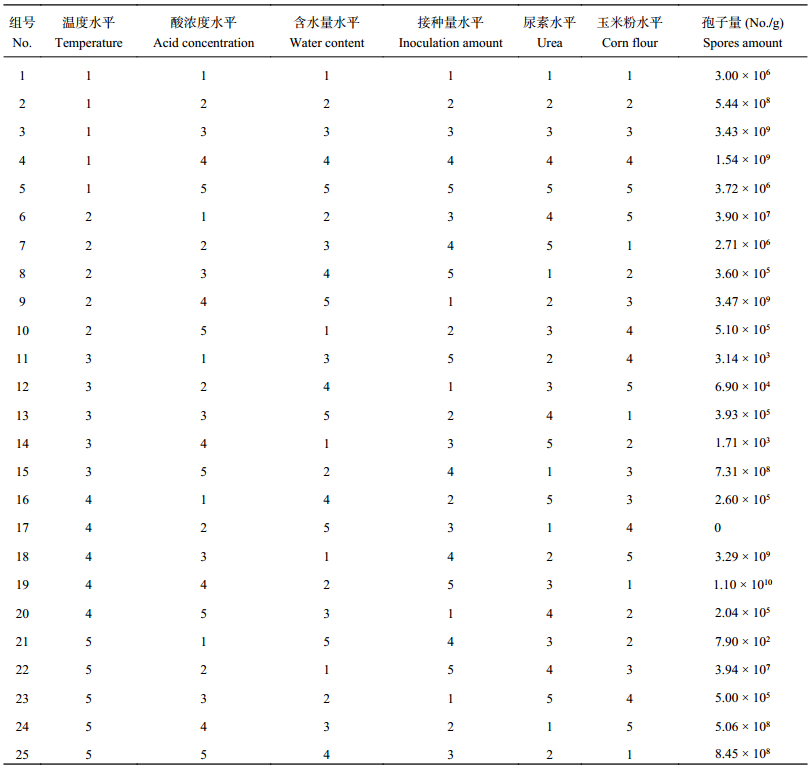 |
优化后的发酵培养基配方为每 10 g小麦秸秆,加入浓度为0.05 mol/L的硝酸18.3 mL调节基质酸度值,接种9%的菌液5 mL,含水量70%(湿基),添加尿素的量为1%,30℃浅盘培养8天。
2.5 木霉发酵物对黄瓜生长的影响2.5.1 干重 两季盆栽结果 (表4)显示,OT处理效果最好,CT和OCK次之,CK最差。可见,木霉秸秆发酵物配施肥料比单施肥料对黄瓜的干物量积累更具有积极的促进作用。第一季的CT处理比CCK处理的干重增加 14.97%,OT比OCK增加 10.62%;第二季的CT处理的干重比CCK增加 12.83%,OT比OCK增加 5.96%。
| 表4 不同肥料处理对黄瓜生长指标的影响 Table 4 Effects of different fertilizer treatments on cucumber growth |
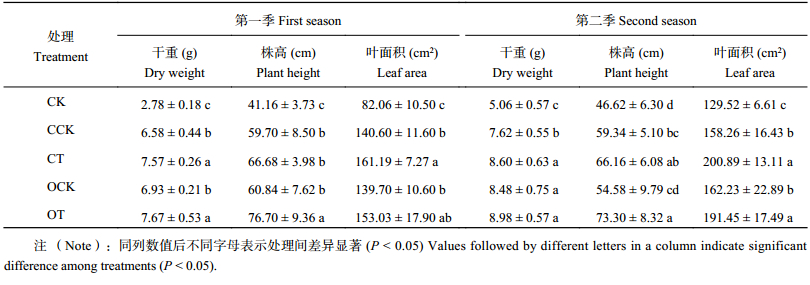 |
2.5.2 株高 OT处理的黄瓜植株明显高于其他四个处理 (表4)。与有机肥处理相比较,化肥处理的黄瓜株高较低。两季盆栽CT处理比CCK处理株高分别增加 16.75% 和 11.49%,OT处理比OCK处理分别增加 26.06% 和 34.29%。其中第一季OT处理的株高明显高于CT处理。说明木霉发酵物配施有机肥能明显促进黄瓜植株的株高。
2.5.3 叶面积 第1季和第2季盆栽的叶面积,CT处理比CCK处理分别增加14.64% 和 26.93%,OT处理相比OCK处理分别增加了 9.53% 和 18.01%。两季盆栽CCK和OCK处理的叶面积大小无显著差异且明显小于CT与OT处理。同时,CT处理的叶面积略高于OT处理。说明木霉秸秆发酵物配施肥料可以明显促进黄瓜叶片的生长。
2.6 黄瓜根际总真菌及木霉数量2.6.1 总真菌数量 从盆栽根际土中总真菌涂布计数结果 (图3)可知,两季盆栽CT和OT处理的总真菌数量均显著高于其他处理,且CT处理显著高于OT处理,分别达到 3.17 × 10 5、2.10 × 10 5个/g和 2.31 × 10 5、1.91 × 10 5个/g。这表明配施木霉菌的处理能够增加土壤中总真菌的数量。
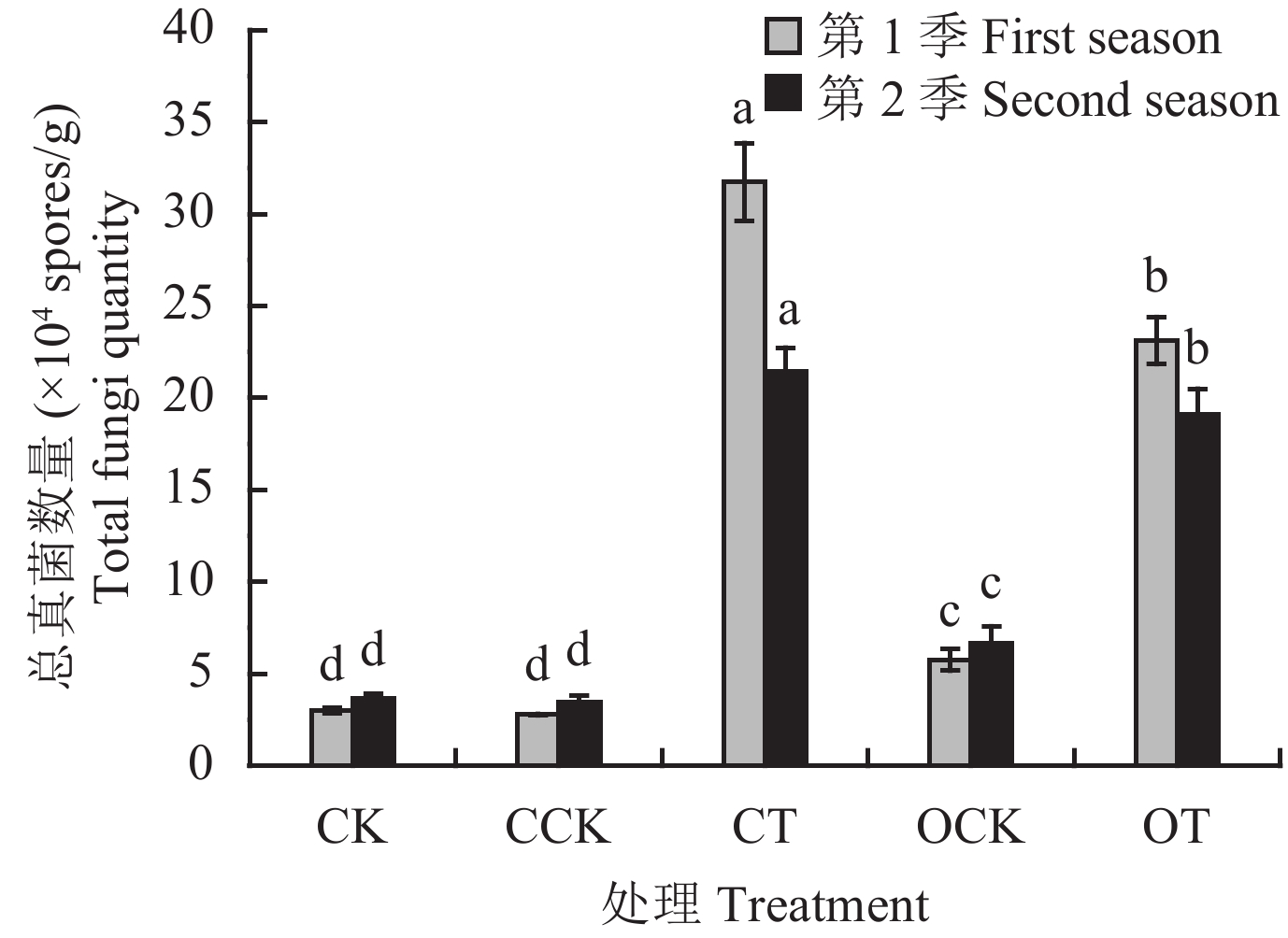 |
| 图3 不同肥料处理下黄瓜根际土总真菌的数量 Fig. 3 Quantity of total fungi in rhizosphere soil of cucumber from different fertilizer treatments [注 (Note):柱上不同字母表示同季不同处理间差异显著 (P < 0.05) Different letters above the bars indicate significant difference among treatments for the same season (P < 0.05).] |
2.6.2 木霉菌数量 从黄瓜根际土木霉菌涂布计数结果 (图4)可知,两季盆栽CT和OT处理的木霉菌数量均显著高于其他处理。其中第一季盆栽木霉菌数CT处理显著高于OT处理,分别为1.88 × 10 4 和 1.23 × 10 4个/g;而第二季盆栽中OT处理高于CT处理,分别为1.37 × 10 4和 1.25 × 10 4个/g。添加木霉发酵物的肥料处理中,涂布得出的木霉菌数量要比未添加处理高 1 个数量级。结果表明,添加发酵物的处理木霉菌数与总真菌数量相比较,增加趋势相近,且均能显著增加土壤中木霉菌的数量。
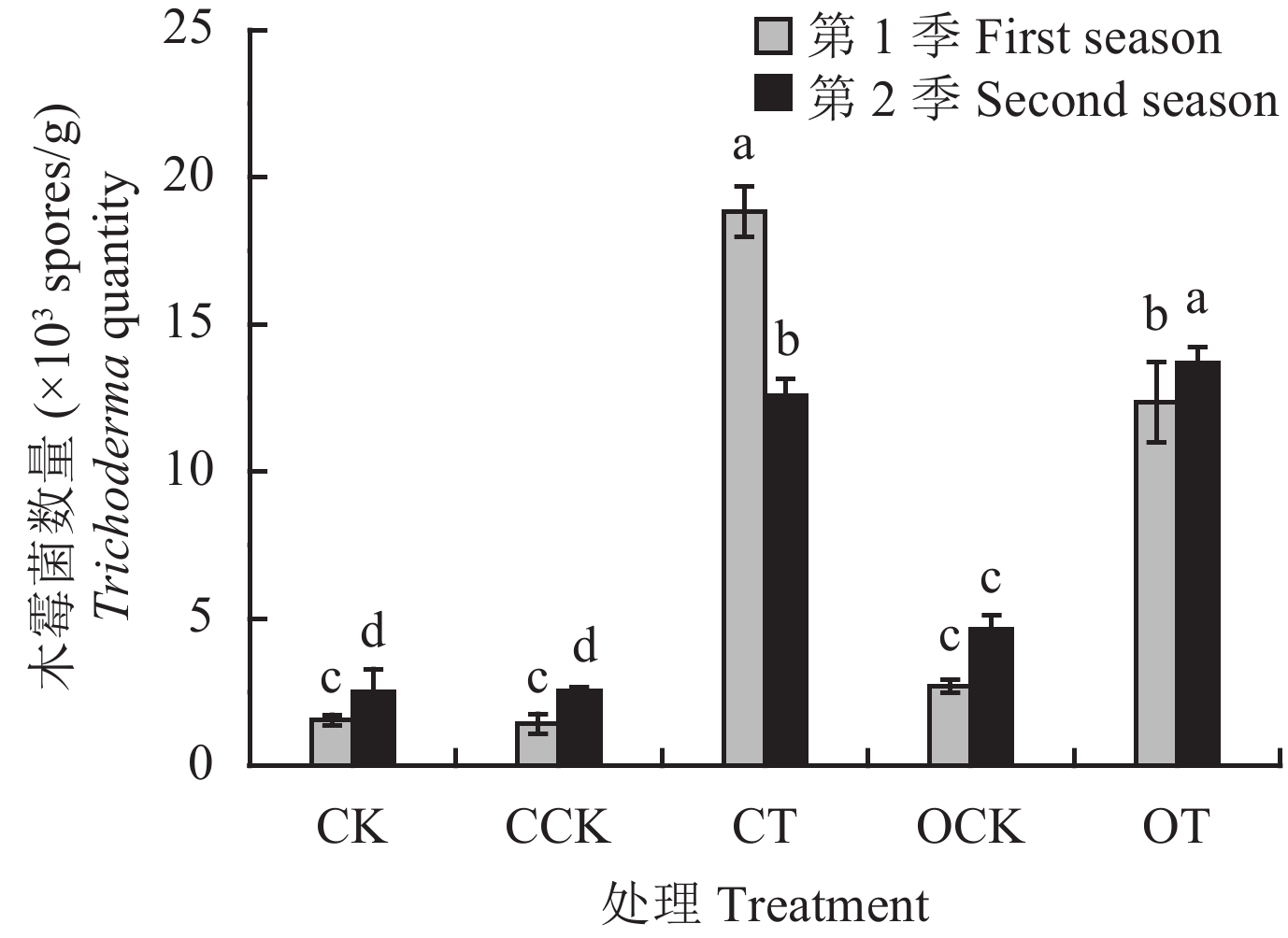 |
| 图4 不同肥料处理下黄瓜根际土木霉菌的数量 Fig. 4 The Trichoderma quantity in the rhizosphere soil of cucumber from different fertilizer treatments [注 (Note):柱上不同字母表示同季不同处理间差异显著 (P < 0.05) Different letters above the bars for the same season indicate significant difference among treatments (P < 0.05).] |
我国小麦秸秆资源量大,使用秸秆作为发酵基质有利于降低有高附加值的木霉生物有机肥的生产成本。本研究对木霉菌T-E5 固体发酵条件进行了分析与优化。三种培养方式比较试验中,平板法即浅盘发酵法的孢子产量明显高于三角瓶法和袋装法,且采用浅盘法进行发酵有利于工厂化的扩大培养[23]。前期预备试验发现,在不同pH值培养基下,产孢量变化幅度较大。由于直接以秸秆即培养基质自身的pH值来衡量酸度对木霉菌发酵的影响,易出现基质pH值不稳定、不能有效掌控发酵条件、木霉不能良好生长的问题。由此,通过单因子试验加入不同浓度的稀酸溶液对固体基质进行调节,同时比较硫酸、盐酸、磷酸和硝酸四种常用酸对产孢量的影响,其中加入 0.1 mol/L硝酸溶液的发酵基质产孢量最大。与类似发酵相比较,调低发酵基质pH值的做法在以往的报道中出现较少。Li等[24]在哈茨木霉菌SH2303 产厚垣孢子的液体发酵优化实验中,调节液体培养基的初始pH值为 4.17,得到最大产孢量为 4.5 × 10 8个/mL。固体发酵培养基中,水分含量的多少直接影响菌体的生长。含水量低,培养基较干燥,不利于菌株孢子萌发及菌丝的生长;含水量高,自由水太多,培养基较湿润,影响基质的透气性,同样不利于菌株孢子萌发及菌丝的生长。曾庆才等[25]通过单因素试验获得当初始含水量为 50% 时,菌株FJAT-9490 产孢量最大,为 3.67 × 10 9个/g;而张广志等[26]以玉米秸秆为培养基,基质含水量在 60%~70% 时产孢量达到最高。这或许与所选用的培养基以及培养基的孔隙度不同有关。添加营养成分对木霉孢子产量有所影响。王永东等[27]在哈茨木霉H-13 的固体发酵条件优化中添加蔗糖、蛋白胨、硝酸铵等碳源与氮源,产孢量达到 1.0 × 10 10个/g。在实际生产发酵过程中,除取样检测菌体生长量外,还可通过发酵产物的外观判断是否终止发酵过程。综合分析表明,本研究获得了以小麦秸秆为发酵基质的哈茨木霉T-E5 的固体发酵生产分生孢子的最佳条件。
木霉能够对植物的生长产生明显的影响,可通过对根际微生态环境以及土壤中养分的循环产生直接或间接的影响,微生物的活动直接增加根际养分的有效性、加速循环利用,同时也能促进根系的生长发育,间接影响养分的循环过程及其有效性[28–31]。哈茨木霉SQRT037是一株高效的植物促生菌,可产生类植物激素Harzianolide,能够显著增加植株的根系长度和根尖数量[29],同时其可活化部分土壤难溶养分,包括P、Fe、Zn和Cu[30]。本试验采用的哈茨木霉T-E5 是SQRT037 经过紫外诱变得到的一株稳定性更强、活性更高的木霉菌。哈茨木霉T-E5 通过促进根系生长和根系分泌物的产生对植株的促生长效应已被验证[32–33]。木霉菌发酵产物的好坏直接影响其实际应用效果。本研究利用哈茨木霉T-E5 固体发酵物制成的生物有机肥对黄瓜生长具有显著的促进作用。各生理指标的检测结果表明,添加有机肥量 10% 的固体发酵产物处理黄瓜苗,木霉固体发酵物配施肥料比单施肥料对黄瓜的干物质量、株高和叶面积有显著促进作用;功能菌有效活菌数是生物有机肥在促进作物生长方面的关键因素[34],根际土总真菌和木霉菌数量结果表明,促生作用是固体发酵物中哈茨木霉T-E5 菌体成分为主发挥的作用,而非固体发酵培养基质所起的作用。本试验结果为推广应用木霉生物有机肥提供了初步的理论基础,今后应在中试和工厂化生产水平进一步研究木霉孢子固体发酵的工艺参数。
| [1] |
陈立华. 哈兹木霉及其微生物有机肥对黄瓜土传枯萎病的生物防治及其机理[D]. 南京: 南京农业大学博士学位论文, 2011.
Chen L H. Biological control and mechanism of Trichoderma harzianum and its microbial organic fertilizer on cucumber soil [D]. Nanjing: PhD Dissertation of Nanjing Agricultural University, 2011. |
| [2] | Howell C R, Hanson L E, Stipanovic R D, Puckhaber L S. Induction of terpenoid synthesis in cotton roots and control of Rhizoctonia solani by seed treatment with Trichoderma virens [J]. Phytopathol, 2000, 90: 248–252. DOI:10.1094/PHYTO.2000.90.3.248 |
| [3] | Gravel V, Antoun H, Tweddell R J. Growth stimulation and fruit yield improvement of greenhouse tomato plants by inoculation with Pseudomonas putida or Trichoderma atroviride: possible role of indole acetic acid (IAA) [J]. Soil Biology and Biochemistry, 2007, 39: 1968–1977. DOI:10.1016/j.soilbio.2007.02.015 |
| [4] | Yedidia I, Srivastva A K, Kapulnik Y, Chet I. Effect of Trichoderma harzianum on microelement concentrations and increased growth of cucumber plants [J]. Plant and Soil, 2001, 235: 235–242. DOI:10.1023/A:1011990013955 |
| [5] |
魏林. 哈茨木霉发酵液中对豇豆具促生活性物质的研究[D]. 长沙: 湖南农业大学博士学位论文, 2005.
Wei L. Study on the growth promoting substance of the fermentation liquid of Trichoderma harzianum on black straw crop [D]. Changsha: PhD Dissertation of Agricultural University of Hunan, 2005. |
| [6] | Vinale F D, Ambrosio G, Abadi K, et al. Application of Trichoderma harzianum (T22) and Trichoderma atroviride (Pl) as plant growth promoters, and their compatibility with copper oxychloride [J]. Journal of Zhejiang University (Agricuture & Life Sciences), 2004, 30: 2–8. |
| [7] |
杨春林, 席亚东, 刘波微, 等. 哈茨木霉T-h-30对几种蔬菜的促生作用及病害防治初探[J].
西南农业学报, 2008, (6): 1603–1607.
Yang C L, Xi Y D, Liu B W, et al. Primary study on growth-promoting and biological control effects of Trichoderma harzianum T-h-30 on vegetable [J]. Southwest China Journal of Agricultural Sciences, 2008, (6): 1603–1607. |
| [8] |
穆红梅, 杨重军, 何宝玉. 哈茨木霉对三种作物种子萌发及生长的影响[J].
吉林农业科学, 2014, (5): 5–7.
Mu H M, Yang C J, He B Y. Impact of Trichoderma solution on seed germination and growth of three crops [J]. Journal of Jilin Agricultural Sciences, 2014, (5): 5–7. |
| [9] | Masunaka A, Hyakumachi M, Takenaka S. Plant growth-promoting fungus, Trichoderma koningi suppresses isoflavonoid phytoalexin vestitol production for colonization on/in the roots of Lotus japonicas [J]. Microbes and Environments, 2011, 26: 128–134. DOI:10.1264/jsme2.ME10176 |
| [10] | Sun T, Liu B H, Liu D M, Li Z H. Effect of elevated temperature on Trichoderma viride SL-1 in solid state fermentations [J]. Biotechnology Letters, 1997, 19: 171–174. DOI:10.1023/A:1018372616637 |
| [11] | Sanjay K, Samiran S G, Arpan D, et al. Process optimization of xylanase production using cheap solid substrate by Trichoderma reesei SAF3 and study on the alteration of behavioral properties of enzyme obtained from SSF and SmF [J]. Bioprocess and Biosystems Engineering, 2013, 36: 57–68. DOI:10.1007/s00449-012-0761-x |
| [12] | Aráujo A A D, Pastore G M, Berger R G. Production of coconut aroma by fungi cultivation in solid-state fermentation[J]. Applied Biochemistry and Biotechnology, 2002, 98: 747–751. |
| [13] | Verma M, Brar S K, Tyagi R D, et al. Wastewater sludge as a potential raw material for antagonistic fungus (Trichoderma sp.): role of pre-treatment and solids concentration [J]. Water Research, 2005, 39: 3587–3596. DOI:10.1016/j.watres.2005.07.001 |
| [14] | Verma M, Brar S K, Tyagi R D, et al. Dissolved oxygen as principal parameter for conidia production of biocontrol fungi Trichoderma viride in non-Newtonian wastewater [J]. Journal of Industrial Microbiology & Biotechnology, 2006, 33(11): 941–952. |
| [15] |
张良, 纪明山, 张玉芬, 宋佳. 绿色木霉TR-8发酵工艺条件筛选[J].
沈阳农业大学学报, 2005, 36(4): 494–496.
Zhang L, Ji M S, Zhang Y F, Song J. Screaning of fermentation conditions of Trichoderma viride TR-8 strain [J]. Journal of Shenyang Agricultural University, 2005, 36(4): 494–496. |
| [16] | Holker U, Lenz J. Solid-state fermentation-are there any biotechnological advantages[J]. Current Opinion in Microbiology, 2005, 8(3): 301–306. DOI:10.1016/j.mib.2005.04.006 |
| [17] | Nigam P S, Pandey A. Solid-state fermentation technology for bioconversion of biomass and agricultural residues[A]. Niqam P S N, Pandey A. Biotechnology for agro-industrial residues utilisation [M]. Springer Netherlands, 2009, 197–221. |
| [18] | Raghavarao K S M S, Ranganathan T V, Karanth N G. Some engineering aspects of solid-state fermentation[J]. Biochemical Engineering Journal, 2003, 13(2-3): 127–135. DOI:10.1016/S1369-703X(02)00125-0 |
| [19] |
张风革. 哈茨木霉诱变菌株T-E5及其生物有机肥对黄瓜生长的影响及机理研究[D]. 南京: 南京农业大学博士学位论文, 2015.
Zhang F G. The Effects and mechanisms of putative Trichoderma harzianum mutant T-E5 and its bio-organic fertilizer on growth of cucumber [D]. Nanjing: PhD Dissertation of Nanjing Agricultural University, 2015. |
| [20] |
肖荣凤, 刘波, 唐建阳, 等. 哈茨木霉FJAT-9040生防菌剂固体发酵及其对苦瓜枯萎病的防治效果[J].
中国生物防治学报, 2015, (4): 508–515.
Xiao R F, Liu B, Tang J Y, et al. Solid-state fermentation of biocontrol agent Trichoderma harzianum FJAT-9040 and its efficiency against bitter gourd fusarium wilt [J]. Chinese Journal of Biological Control, 2015, (4): 508–515. |
| [21] |
梁昌聪, 刘磊, 张建华, 等. 绿色木霉菌H06固体浅盘发酵工艺优化[J].
菌物学报, 2014, 33(6): 1313–1326.
Liang C C, Liu L, Zhang J H, et al. Optimization of shallow tray fermentation process of Trichoderma viride H06 [J]. Mycosystema, 2014, 33(6): 1313–1326. |
| [22] |
康萍芝, 张丽荣, 沈瑞清, 等. 哈茨木霉制剂对设施连作番茄根际土壤微生物的生态效应及防病作用[J].
农药, 2013, 52(2): 128–131.
Kang P Z, Zhang L R, Shen R Q, et al. Ecological effect of Trichoderma harzianum preparations on rhizosphere soil microbes in facilities continuous cropping tomato and their disease prevention [J]. Agrochemicals, 2013, 52(2): 128–131. |
| [23] |
易征璇, 王征, 谭著名. 康氏木霉固体发酵产孢子粉工艺研究[J].
现代农业科技, 2013, (8): 194–196.
Yi Z X, Wang Z, Tan Z M. Study on production technical of spores by adopting Koningii Trichoderma solid-state fermentation [J]. Modern Agricultural Science and Technology, 2013, (8): 194–196. |
| [24] | Li Y Q, Song K, Li Y C, Chen J. Statistical culture-based strategies to enhance chlamydospore production by Trichoderma harzianum SH2303 in liquid fermentation [J]. Journal of Zhejiang University (Science B: Biomedicine & Biotechnology), 2016, 17(8): 619–627. |
| [25] |
曾庆才, 肖荣凤, 刘波, 等. 生防菌哈茨木霉FJAT-9040固体发酵条件的响应面优化[J].
福建农业学报, 2015, (2): 192–197.
Zeng Q C, Xiao R F, Liu B, et al. Optimization of solid-state fermentation condition for the biocontrol strain of Trichoderma harzianum FJAT-9040 by response surface methodology [J]. Fujian Journal of Agricultural Sciences, 2015, (2): 192–197. |
| [26] |
张广志, 李纪顺, 扈进冬, 等. 利用玉米秸秆培养木霉菌分生孢子的研究[J].
中国农学通报, 2013, 29(15): 169–172.
Zhang G Z, Li J S, Hu J D, et al. Study on utilizing corn stalk to cultivate conidiophore of Trichoderma spp. [J]. Chinese Agricultural Science Bulletin, 2013, 29(15): 169–172. DOI:10.11924/j.issn.1000-6850.2012-1933 |
| [27] |
王永东, 蒋立科, 岳永德, 等. 生防菌株哈茨木霉H-13固体发酵条件的研究[J].
浙江大学学报(农业与生命科学版), 2006, 32(6): 645–650.
Wang Y D, Jiang L K, Yue Y D, et al. Studies on the solid fermentation conditions for the biocontrol agents of Trichoderma harzianum strain H-13 [J]. Journal of Zhejiang University (Agriculture & Life Sciences), 2006, 32(6): 645–650. |
| [28] |
李成亮, 黄波, 孙强生, 等. 控释肥用量对棉花生长特性和土壤肥力的影响[J].
土壤学报, 2014, 51(2): 295–305.
Li C L, Huang B, Sun Q S. Effects of application rates of controlled release fertilizers on cotton growth and soil fertility[J]. Acta Pedologica Sinica, 2014, 51(2): 295–305. DOI:10.11766/trxb201305200245 |
| [29] | Cai F, Yu G, Wang P, et al. Harzianolide, a novel plant growth regulator and systemic resistance elicitor from Trichoderma harzianum [J]. Plant Physiology and Biochemistry, 2013, 73: 106–113. DOI:10.1016/j.plaphy.2013.08.011 |
| [30] | Li R X, Cai F, Pang G, et al. Solubilisation of phosphate and micronutrients by Trichoderma harzianum and its relationship with the promotion of tomato plant growth [J]. Plos One, 2015, 10(6): e0130081. DOI:10.1371/journal.pone.0130081 |
| [31] | Cai F, Chen W, Wei Z, et al. Colonization of Trichoderma harzianum strain SQR-T037 on tomato roots and its relationship to plant growth, nutrient availability and soil microflora [J]. Plant and Soil, 2015, 388: 337–350. DOI:10.1007/s11104-014-2326-z |
| [32] | Zhang F G, Yuan J, Yang X M, et al. Putative Trichoderma harzianum mutant promotes cucumber growth by enhanced production of indole acetic acid and plant colonization [J]. Plant and Soil, 2013, 368: 433–444. DOI:10.1007/s11104-012-1519-6 |
| [33] | Zhang F G, Zhu Z, Yang X M, et al. Trichoderma harzianum T-E5 significantly affects cucumber root exudates and fungal community in the cucumber rhizosphere [J]. Applied Soil Ecology, 2013, 72: 41–48. DOI:10.1016/j.apsoil.2013.05.016 |
| [34] | Wang B B, Yuan J, Zhang J, et al. Effects of novel bio-organic fertilizer produced by Bacillus amyloliquefaciens W19 on antagonism of Fusarium wilt of banana [J]. Biology and Fertility of Soils, 2013, 49: 435–446. DOI:10.1007/s00374-012-0739-5 |
 2017, Vol. 23
2017, Vol. 23  doi:
doi: 

