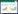文章信息
- 刘仁杰, 刘俊杰, 张尧, 王婧瑶, 王一超, 张婧曦, 梁文吉, 赵雅宁, 李建民
- LIU Renjie, LIU Junjie, ZHANG Yao, WANG Jingyao, WANG Yichao, ZHANG Jingxi, LIANG Wenji, ZHAO Yaning, LI Jianmin
- 亚低温通过调控内质网应激激活自噬改善蛛网膜下腔出血大鼠早期脑损伤
- Moderate Hypothermia Activates Autophagy and Reduces Early Brain Injury in Rats with Subarachnoid Hemorrhage by Regulating Endoplasmic Reticulum Stress
- 中国医科大学学报, 2018, 47(9): 824-828, 833
- Journal of China Medical University, 2018, 47(9): 824-828, 833
-
文章历史
- 收稿日期:2017-11-24
- 网络出版时间:2018-08-28 9:03
2. 华北理工大学临床医学院实验中心, 河北 唐山 063000
2. Central Laboratory, College of Clinical Medicine, North China University of Science and Technology, Tangshan 063000, China
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是一种常见的神经外科急症,致死率、致残率高,发病多见于中青年,严重威胁人类健康和生命[1]。减轻早期脑损伤是治疗的关键靶点。内质网应激在神经系统疾病的发生发展中发挥着重要作用,内质网应激可以抑制神经细胞的凋亡,减少神经细胞的丢失[2]。自噬可维持细胞自我稳态,促进神经细胞的存活[3]。并且众多学者认为内质网应激对自噬的激活有显著作用[4-5]。目前亚低温作为一种新型治疗方法,通过控制性降低患者核心温度以保护器官免受损伤影响,在实验研究及外科手术中得到了广泛应用,并且在SAH的治疗过程中取得了良好的效果[6],但其作用机制目前认识尚不明确。因此,本研究引入内质网应激和自噬,探讨亚低温与内质网应激和自噬的关系,明确亚低温治疗的作用机制,为其应用和推广提供一定的理论基础。
1 材料与方法 1.1 实验动物及分组成年清洁级雄性SD大鼠(体质量350~450 g)48只,购于北京维通利华实验动物技术有限公司,许可证号SCXK(京)2012-0001。于华北理工大学动物实验中心适应性饲养2周。采用随机数字表法将48只大鼠随机分成4组,分别为假手术组(S组,n = 12)、蛛网膜下腔出血组(SAH组,n = 12)、全身亚低温组(H组,n = 12)和内质网应激抑制剂组(TUDCA组,n = 12)。本研究获得华北理工大学伦理委员会批准。
1.2 试剂及仪器兔抗Bcclin-1、LC3-Ⅱ一抗,兔抗GRP78、CHOP一抗,购自美国Abcam公司。二抗及其辅助用品,购自博奥森生物技术有限公司。枸橼酸盐缓冲液、PBS缓冲液、DAB显色试剂盒,购自北京中杉金桥生物技术有限公司。820-Ⅱ型切片机,购自德国LEICA公司。TP-1型摊片机、HP-1型烤箱,购自天津天利机电公司。Olympus摄像显微镜、Motic 6.0图像采集及分析系统、BHS显微镜,购自日本奥林巴斯公司。电泳仪,购自北京东方仪器厂。电转槽,购自瑞典Phmarcia公司。
1.3 模型制备及干预方法如文献[7]所述,采用颈内动脉穿刺法制备SAH模型。大鼠麻醉后仰卧位,颈正中做切口,逐步分离出颈总、颈外、颈内动脉,结扎、离断颈外动脉,反转180°,使之与颈内动脉呈一条直线,在颈外动脉近心断端打孔,锐化的4-0聚丙烯纺织纤维缝合线引入到右侧颈内动脉,推进明显阻力感后再推3 mm,刺破大脑中动脉与大脑前动脉分叉处。S组操作同模型组,但不刺破血管。
造模成功判定标准:大体标本脑表面散在分布血凝块;镜下可见蛛网膜下腔分布大量红细胞。
H组于造模成功后即刻向大鼠全身喷洒乙醇配合冰浴行体表降温,将直肠温度维持在30~32 ℃ 4 h;TUDCA组于造模前1 h腹腔注射溶于生理盐水(100 mg/mL)的牛磺熊去氧胆酸(tauroursodesoxycholic acid,TUDCA,内质网应激抑制剂)溶液,再制备SAH模型。
1.4 HE染色各组取6只大鼠,于造模成功后24 h将大鼠处死,4%多聚甲醛灌注取脑,常规石蜡包埋,切片(片厚5 μm);梯度乙醇水化,行HE染色,脱水、封片,在光学显微镜(×400)下观察结果。每只大鼠海马CA1区取6张切片,应用Motic 6.0图像采集及图像分析系统观察每组大鼠(n = 6)神经细胞形态变化,计数单位高倍视野下的存活神经细胞数并计算平均值。
1.5 免疫组化取上述步骤的石蜡切片,常规脱蜡水化,用高压抗原修复2 min,分别滴加GRP78、CHOP、Beclin-1多克隆抗体(均1:200稀释)、LC3-Ⅱ多克隆抗体(1:300稀释)在湿盒温育于4 ℃过夜;滴加二抗,37 ℃温箱30 min,DAB溶液显色,镜下观察显色符合要求后,流水终止显色,梯度乙醇脱水、二甲苯透明、封片。PBS代替一抗进行阴性对照。每只大鼠每个因子(GRP78、CHOP、Beclin-1以及LC3-Ⅱ)取出3张切片待测,其中每张切片定位海马CA1区,随机抽取5个独立视野,在Olympus显微镜(×400)下观察海马CA1区阳性细胞数量,以胞核、胞质或胞膜呈浅褐色为入选标准。计数400倍视野下的阳性细胞数量并计算平均值。
1.6 Western blotting于造模成功后24 h断头,冰上取脑,分离海马,液氮研磨法进行总蛋白提取,BCA法测定海马区蛋白浓度,计算待测品蛋白浓度的上样量。测定每个因子对应条带的灰度值,以GAPDH为内参照,应用Image Lab5.0对条带进行分析,将目标蛋白与GAPDH灰度值的比值作为各因子相对的表达量,分析数据。
1.7 统计学分析采用EXCEl软件建立数据库,采用SPSS 22.0软件进行统计分析,计量资料以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用Tukey法。P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠海马CA1区神经元形态比较S组大鼠海马区神经元排列整齐,形态正常,细胞核大而圆,核膜清楚,核仁明显。SAH组神经细胞形态不规则,胞核浓缩、溶解,正常神经细胞数量相对减少,差异有统计学意义(P < 0.05)。H组较SAH组胞核浓缩现象减轻,存活神经细胞数量明显增多,差异有统计学意义(P < 0.05)。TUDCA组较SAH组神经细胞存活数量明显减少,差异有统计学意义(P < 0.05)。见图 1、表 1。
|
| A, S group; B, SAH group; C, H group; D, TUDCA group. 图 1 各组24 h大鼠海马区神经细胞形态变化 HE×400 Fig.1 Neuronal morphology in the hippocampus of rats in each group after 24 hours HE staining×400 |
| Item | S group(n= 6) | SAH group(n= 6) | H group(n= 6) | TUDCA group(n= 6) |
| Viable cells(/Hp) | 130.74±2.23 | 70.68±2.781) | 104.55±2.462) | 53.56±2.592) |
| Number of GRP78-positive neurons(/Hp) | 25.33±1.05 | 43.45±2.351) | 59.33±1.522) | 31.43±1.652) |
| Number of CHOP-positive neurons(/Hp) | 16.74±0.85 | 34.50±1.781) | 47.00±1.462) | 21.89±0.782) |
| Number of Beclin-1-positive neurons(/Hp) | 22.56±1.23 | 34.68±1.781) | 52.55±2.052) | 20.56±0.592) |
| Number of LC3-Ⅱ-positive neurons(/Hp) | 13.74±0.43 | 36.56±1.781) | 43.58±2.062) | 23.54±0.892) |
| GRP78/GAPDH | 0.071 6±0.005 3 | 0.064 3±0.041 01) | 0.085 1±0.006 62) | 0.057 9±0.005 32) |
| CHOP/GAPDH | 0.071 2±0.005 0 | 0.063 9±0.040 61) | 0.084 1±0.005 92) | 0.057 4±0.004 92) |
| Beclin-1/GAPDH | 0.071 3±0.005 3 | 0.064 2±0.041 01) | 0.084 5±0.006 22) | 0.057 3±0.004 82) |
| LC3-Ⅱ/GAPDH | 0.071 4±0.005 1 | 0.064 5±0.041 21) | 0.084 7±0.006 32) | 0.057 7±0.005 22) |
| 1) P < 0.05 vs S group;2) P < 0.05 vs SAH group. | ||||
2.2 各组GRP78和CHOP蛋白表达量比较
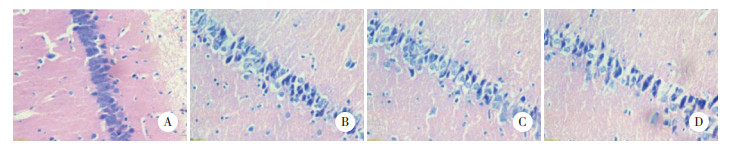
免疫组化结果显示:CHOP蛋白主要表达于胞质,GRP78蛋白主要表达于胞核,阳性细胞胞质中可见大量棕褐色颗粒。与S组相比,SAH组海马区GRP78、CHOP蛋白阳性细胞数量增加(P < 0.05);与SAH组相比,H组海马区GRP78、CHOP蛋白阳性细胞数量明显增加(P < 0.05);与SAH组相比,TUDCA组海马区GRP78、CHOP蛋白阳性细胞数量明显减少(P < 0.05)。见图 2、表 1。
|
| 图 2 各组24 h大鼠海马区神经细胞GRP78和CHOP的表达 免疫组化染色×400 Fig.2 The expression of GRP78 and CHOP proteins in the hippocampal neurons of rats in each group after 24 hours Immunohistochemical staining×400 |
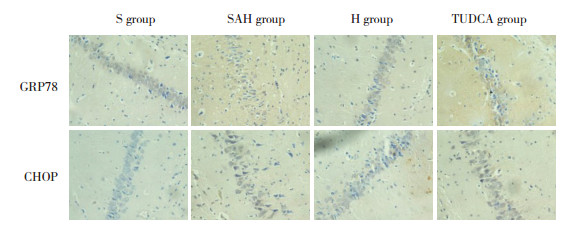
Western blotting结果显示:与S组相比,SAH组海马区GRP78、CHOP蛋白表达水平升高(P < 0.05);与SAH组相比,H组海马区GRP78、CHOP蛋白表达水平明显升高(P < 0.05);与SAH组相比,TUDCA组海马区GRP78、CHOP蛋白表达水平明显下降(P < 0.05)。见图 3、表 1。
|
| 1, S group; 2, SAH group; 3, H group; 4, TUDCA group. 图 3 各组24 h大鼠海马GRP78和CHOP蛋白Western blotting检测结果 Fig.3 Western blotting for GRP78 and CHOP proteins in the hippocampus of rats in each group after 24 hours |
2.3 各组Beclin-1和LC3-Ⅱ蛋白表达量比较
免疫组化结果显示:Beclin-1和LC3-Ⅱ蛋白主要表达于细胞质,阳性细胞胞质中可见大量棕褐色颗粒。与S组相比,SAH组海马区Beclin-1和LC3-Ⅱ蛋白阳性细胞数量增加(P < 0.05);与SAH组相比,H组海马区Beclin-1和LC3-Ⅱ蛋白阳性细胞数量明显增加(P < 0.05);与SAH组相比,TUDCA组海马区Beclin-1和LC3-Ⅱ蛋白阳性细胞数量明显减少(P < 0.05)。见图 4、表 1。
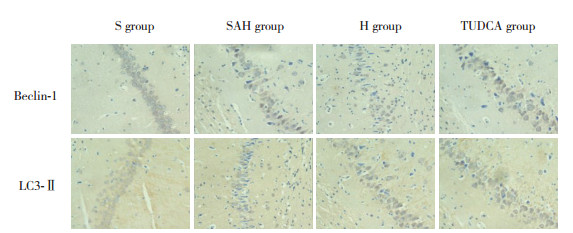
|
| 图 4 各组24 h海马区神经元细胞Beclin-1和LC3-Ⅱ的表达 免疫组化染色×400 Fig.4 The expression of Beclin-1 and LC3-Ⅱ proteins in the hippocampus of rats in each group after 24 hours Immunohistochemical staining×400 |
Western blotting结果显示:与S组相比,SAH组海马区Beclin-1和LC3-Ⅱ蛋白表达水平升高(P < 0.05);与SAH组相比,H组海马区Beclin-1和LC3-Ⅱ蛋白表达水平明显升高(P < 0.05);与SAH组相比,TUDCA组海马区Beclin-1和LC3-Ⅱ蛋白表达水平明显下降(P < 0.05)。见图 5、表 1。
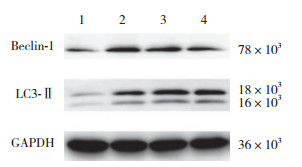
|
| 1, S group; 2, SAH group; 3, H group; 4, TUDCA group. 图 5 各组24 h大鼠海马Beclin-1和LC3-Ⅱ蛋白Western blotting检测结果 Fig.5 Western blotting for Beclin-1 and LC3-Ⅱ proteins in the hippocampus of rats in each group after 24 hours |
3 讨论
本研究结果显示,亚低温干预后,存活神经细胞数量明显增加,提示亚低温干预对SAH后神经细胞的死亡可能起到一定的抑制或者延缓作用。研究[8]发现,低温的脑保护作用是通过降低活性氧自由基、脂质过氧化,降低兴奋性谷氨酸活性,从而起到对脑神经的保护作用。魏红艳等[9]发现亚低温治疗可能在一定程度上减轻血管壁的病理损伤,从而对维持脑供血、减轻因脑缺血造成的神经细胞损伤起到改善作用。同时,亚低温治疗可以通过减轻血管痉挛,减轻大鼠神经细胞的凋亡,从而起到脑保护的作用。本研究结果与此一致。
本研究结果还发现,SAH大鼠实施亚低温能够使GRP78、CHOP蛋白表达增加,提示亚低温干预可以进一步使内质网应激化。内质网具有极强的内稳态体系,但受到外界因素如缺血再灌注损伤、氧化应激、同型半胱氨酸等多种物理、化学或遗传因素等作用,均可引发内质网应激[10]。内质网应激主要包括由3个膜通道蛋白介导的信号通路,即IREl通路、PERK通路、ATF6通路,在无应激的状态下,上述3个膜通道蛋白与GRP78蛋白处于紧密结合状态[11]。在受到各种因素刺激下,它们与GRP78发生分离而被激活,进而引发一系列细胞因子的表达,在转录与表达水平抑制细胞凋亡。RANJAN等[12]研究表明CHOP在内质网应激反应中扮演重要角色,内质网应激反应参与脑缺血后的病理生理反应,而且CHOP在细胞凋亡的过程中起重要作用。CHOP作为内质网应激介导凋亡的特异转录因子,在大鼠SAH后,当CHOP表达升高时,GRP78的表达会同样升高,表明CHOP可与GRP78同时表达作为保护机制而诱导神经细胞凋亡。这与本研究结果一致。因此,亚低温的保护作用可能和内质网应激存在一定的关系。但是内质网应激是通过何种途径来实现神经保护作用的,目前尚无定论。
本研究发现,亚低温干预后自噬蛋白表达含量明显升高,而使用内质网抑制剂后自噬蛋白表达明显降低;自噬蛋白表达水平与内质网应激程度呈正相关。这提示内质网应激可能与神经细胞自噬存在一定的关系,可能通过自噬来发挥其保护作用。自噬是一个自我分解代谢过程,通过溶酶体来降解细胞成分[13]。适度自噬的激活可以抑制神经细胞的凋亡,减少神经细胞的丢失[14]。酵母细胞的内质网应激能够刺激前自噬体的形成和转运。当错误折叠或未折叠蛋白超过了蛋白酶体调节的降解系统,自噬将被触发,以移除这些蛋白[15]。目前学者[16]认为内质网应激介导自噬的发生主要依赖于PERK、ATF6和IRE-1增加产生的Ca2+。内质网应激产生Ca2+从内质网向细胞质释放,反过来也可激活各种激酶和蛋白酶,可能参与自噬信号转导[17]。HCYER-HANSEN等[18]研究结果证实Ca2+介导的自噬依赖于钙调蛋白激酶激酶β,活化蛋白激酶,最终抑制roTOR复合体l而激活自噬。
因此,内质网应激可以激活自噬,自噬又可以通过降解错误折叠或未折叠蛋白减轻内质网的负荷,抑制内质网的过度激活[19],同时产生的降解产物也为机体细胞新蛋白质的合成、细胞结构的重建以及ATP的生成提供原料,从而减少SAH后早期脑损伤,起到一定的保护作用。
综上所述,本研究发现通过调控内质网应激激活神经细胞自噬,可能是亚低温疗法治疗的神经保护机制。
| [1] |
徐宁, 王宏磊, 罗祺, 等. 蛛网膜下腔出血506例临床分析[J]. 吉林大学学报(医学版), 2004, 30(1): 138-140. DOI:10.3969/j.issn.1671-587X.2004.01.044 |
| [2] |
THOUDAM T, JEON JH, HA CM, et al. Role of mitochondria-associated endoplasmic reticulum membrane in inflammation-mediated metabolic diseases[J]. Mediators Inflamm, 2016, 2016: 1851420. DOI:10.1155/2016/1851420 |
| [3] |
SMITH MD, HARLEY ME, KEMP AJ, et al. CCPG1 is a non-canonical autophagy cargo receptor essential for ER-phagy and pancreatic ER proteostasis[J]. Dev Cell, 2018, 44(2): 217-232. DOI:10.1016/j.devcel.2017.11.024 |
| [4] |
ANTONUCCI L, FAGMAN JB, KIM JY, et al. Basal autophagy maintains pancreatic acinar cell homeostasis and protein synthesis and prevents ER stress[J]. Proc Natl Acad Sci USA, 2015, 112(45): E6166-E6174. DOI:10.1073/pnas.1519384112 |
| [5] |
VELÁZQUEZ AP, GRAEF M. Autophagy regulation depends on ER homeostasis controlled by lipid droplets[J]. Autophagy, 2016, 12(8): 1409-1410. DOI:10.1080/15548627.2016.1190074 |
| [6] |
赵军苍, 杨华堂, 苏钰清, 等. 全身和头部亚低温治疗脑出血所致脑水肿的疗效观察[J]. 中国实用神经疾病杂志, 2015, 9(1): 31-32. DOI:10.3969/j.issn.1673-5110.2015.09.019 |
| [7] |
张建军, 王东, 王琳, 等. 亚低温干预并神经干细胞蛛网膜下腔移植修复大鼠脊髓损伤[J]. 中国组织工程研究, 2018, 5(22): 686-691. DOI:10.3969/j.issn.2095-4344.0436 |
| [8] |
陈建时, 郭蕾, 潘利伟, 等. 长时程亚低温疗法对急性重型颅脑损伤患者免疫功能的影响[J]. 中华神经外科杂志, 2016, 6(32): 574-578. DOI:10.3760/cma.j.issn.1001-2346.2016.06.010 |
| [9] |
魏红艳, 廖晓星, 尹美娴, 等. 亚低温促进神经元自噬减轻小鼠脑缺血-再灌注损伤[J]. 中华急诊医学杂志, 2017, 9(26): 1037-1042. DOI:10.3760/cma.j.issn.1671-0282.2017.09.012 |
| [10] |
GRUMATI P, MOROZZI G, HÖLPER S, et al. Full length RTN3 regulates turnover of tubular endoplasmic reticulum via selective autophagy[J]. Elife, 2017, 6: e25555. DOI:10.7554/eLife.25555 |
| [11] |
BRAUNGER K, PFEFFER S, SHRIMAL S, et al. Structural basis for coupling protein transport and N-glycosylation at the mammalian endoplasmic reticulum[J]. Science, 2018, 360(6385): 215-219. DOI:10.1126/science.aar7899 |
| [12] |
RANJAN A, GERMAN N, MIKELIS C, et al. Penfluridol induces endoplasmic reticulum stress leading to autophagy in pancreatic cancer[J]. Tumour Biol, 2017, 39(6): 1010428317705517. DOI:10.1177/1010428317705517 |
| [13] |
GUO J, YANG Z, YANG X, et al. miR-346 functions as a pro-survival factor under ER stress by activating mitophagy[J]. Cancer Lett, 2018, 413: 69-81. DOI:10.1016/j.canlet.2017.10.030 |
| [14] |
MORETTI J, ROY S, BOZEC D, et al. STING senses microbial viability to orchestrate stress-mediated autophagy of the endoplasmic reticulum[J]. Cell, 2017, 171(4): 809-823. DOI:10.1016/j.cell.2017.09.034 |
| [15] |
CYBULSKY AV. Endoplasmic reticulum stress, the unfolded protein response and autophagy in kidney diseases[J]. Nat Rev Nephrol, 2017, 13(11): 681-696. DOI:10.1038/nrneph.2017.129 |
| [16] |
YU SN, KIM SH, KIM KY, et al. Salinomycin induces endoplasmic reticulum stress-mediated autophagy and apoptosis through generation of reactive oxygen species in human glioma U87MG cells[J]. Oncol Rep, 2017, 37(6): 3321-3328. DOI:10.3892/or.2017.5615 |
| [17] |
SMITH M, WILKINSON S. ER homeostasis and autophagy[J]. Essays Biochem, 2017, 61(6): 625-635. DOI:10.1042/EBC20170092 |
| [18] |
HOYER-HANSEN M, BASTHOLM L, SZYNIAROWSKI P, et al. Control of macroautophagy by calcium, calmodulin-dependent kinase kinase-β, and Bcl-2[J]. Mol Cell, 2007, 25(2): 193-205. DOI:10.1016/j.molcel.2006.12.009 |
| [19] |
XU D, FANG D, ZHAO C, et al. Effect of tributyltin chloride(TBTCl) exposure on expression of HSP90β1 in the river pufferfish(Takifugu obscurus):evidences for its immunologic function involving in exploring process[J]. Gene, 2018, 666: 9-17. DOI:10.1016/j.gene.2018.04.083 |
 2018, Vol. 47
2018, Vol. 47