文章信息
- 张真真, 戴姝艳
- ZHANG Zhenzhen, DAI Shuyan
- 血管紧张素Ⅱ2型受体对大鼠子宫内膜异位症血管生成的影响
- The Role of AngiotensinⅡType 2 Receptor on Angiogenesis in Rats with Endometriosis
- 中国医科大学学报, 2018, 47(9): 792-796
- Journal of China Medical University, 2018, 47(9): 792-796
-
文章历史
- 收稿日期:2017-11-16
- 网络出版时间:2018-08-28 8:56
子宫内膜异位症(endometriosis,EMs)是育龄期妇女的常见疾病,指子宫内膜出现在宫腔以外的身体其他组织而引起的一种疾病,其发病率呈明显上升趋势,可达10%~15%。EMs所引起的痛经、下腹痛和性交痛等,严重影响妇女的健康和生活质量[1],EMs虽为良性病变,但具有类似恶性肿瘤的远处转移和种植侵袭能力[2-3],其病因及发病机制尚未完全明确。近年来对EMs发病机制的研究[4]表明,异位病灶的发生与发展必须有新生血管的建立才能得以维持。血管紧张素被证实是促进生理性及病理性血管生成的重要因子,主要通过与AT1、AT2结合,发挥生理作用。研究[5-6]发现,激动血管紧张素Ⅱ2型受体(angiotensinⅡtype 2 receptor,AT2R)对高血压、类风湿性关节炎及肿瘤等疾病的发生发展有抑制作用,提示AT2R可能在疾病病程中发挥保护性作用,但目前AT2R在EMs中的作用未见报道。本研究通过分析AT2R对大鼠子宫内膜异位结节血管形成的影响,来探讨AT2R在EMs发生发展中的作用。
1 材料与方法 1.1 实验动物与试剂SPF级雌性、清洁、性成熟、未孕SD大鼠45只,体质量(180±20)g,购自北京华阜康生物科技股份有限公司,许可证编号:SCXK(京)2014-0004,伦理编号:2016PS320K,饲养于中国医科大学附属盛京医院本溪实验基地动物实验中心,室温20%~25%,湿度50%~70%,照明周期为12/12 h,自由食水,保持垫料干燥,适应性饲养1周后进行实验。
CGP42112A购自美国Sigma公司;氯沙坦购自大连美仑生物技术公司;大鼠血管内皮生长因子(vascular endothelial growth factor,VEGF)ELISA试剂盒、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)ELISA试剂盒、微血管染色所用的兔抗鼠CD34多克隆抗体均购自武汉博士德公司。
1.2 实验方法及步骤 1.2.1 大鼠EMs模型的建立Vernon自体移植法[7]建立大鼠EMs模型,4周后开腹,造模成功大鼠可见移植物内出现液体积聚(积液高度≥2 mm),呈隆起透亮的小囊泡,被结缔组织或大网膜覆盖并有血管形成,清晰可见,通常与周围组织粘连紧密,故视为造模成功[8]。
1.2.2 模型组大鼠分组选取建模成功的30只模型大鼠,随机分为AT2R激动剂CGP42112A低剂量组(5 μg·kg-1·d-1)、中剂量组(15 μg·kg-1·d-1)、高剂量组(30 μg·kg-1·d-1)、AT1R阻滞剂氯沙坦组(10 mg·kg-1·d-1),安慰剂对照组(无菌注射用水),每组6只成模大鼠。各组按剂量每天腹腔注射给药1次(氯沙坦灌胃),连续4周。
1.2.3 标本的收集各组相应处理4周后,麻醉大鼠开腹,取腹主动脉血,以3 000 r/min离心15 min,取血清分装,于-80 ℃保存。分离周围粘连组织,观察异位结节大体形态并记录,用游标卡尺测量异位结节大小,根据公式体积(mm3)=0.52×长×宽×高[9],记录各组处理后异位结节体积。同时留取异位结节,置于10%中性甲醛溶液中固定,常温固定24 h后常规石蜡包埋,4 μm厚度连续切片。
1.2.4 标本检测 1.2.4.1 病灶体积取下病灶组织,游标卡尺测量移植物的长、宽、高,计算移植物体积,体积(mm3)=0.52×长×宽×高,并再次记录。
1.2.4.2 免疫组化法计数微血管密度(microvessel density,MVD)采用免疫组织化学链霉亲和素-生物素复合物(strept avidin-biotin complex,SABC)法测定,以兔抗鼠CD34多克隆抗体染色的细胞质出现棕褐色颗粒为阳性细胞,参照Weidner微血管计数方法,在低倍镜视野(10倍)下选取微血管密集度区,然后在高倍镜视野下(40倍)计数所有的微血管,选取最大3个数值的平均数作为该例的MVD。
1.2.4.3 ELISA法检测血清中VEGF及TNF-α的含量采用双抗体夹心ELISA法检测,操作方法参照ELISA试剂盒说明书,利用酶标仪得到吸光度OD值,再运用CVXPT 32软件包计算出浓度值,得到大鼠血清VEGF和TNF-α的浓度。
1.3 统计学分析采用SPSS 22.0统计软件对数据进行分析。计量资料以x±s描述,多组间两两比较采用LSD检验,P < 0.05为差异有统计学意义。
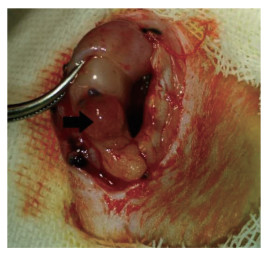
2 结果 2.1 EMs模型建立情况45只大鼠造模成功34只(成功率75%),成模大鼠可见异位结节,个别大网膜粘连,腹壁可见异位病灶,呈充满透明液体的透亮小囊泡,表面可见丰富血管走行,见图 1。
|
| The arrow represents the ectopic foci. 图 1 大鼠EMs模型 Fig.1 The model of rat endometriosis |
2.2 成模大鼠分组用药后病灶体积比较
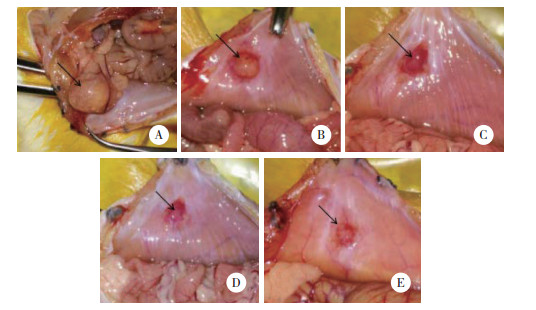
肉眼见实验组大鼠用药后异位结节体积出现不同程度缩小,表面新生血管明显减少,见图 2。高剂量组有2只大鼠异位结节萎缩,移植处仅见灰白色瘢痕组织。对照组异位灶体积无明显改变。处理后中、高剂量组及氯沙坦组异位结节体积较安慰剂对照组明显缩小(P < 0.01),低剂量组和安慰剂对照组间比较无明显改变(P > 0.05)。中、高剂量组与氯沙坦组异位结节体积无统计学差异(P > 0.05),表明ATR2对异位结节体积的影响呈剂量依赖性改变,见表 1。
|
| A, control group; B, CGP42112A low-dose group; C, CGP42112A middle-dose group; D, CGP42112A high-dose group; E, losartan group. Arrows represent the ectopic foci. 图 2 各组用药处理后异位结节体积比较 Fig.2 Representative images of endometriotic lesions in each group |
| Parameter | Control group | Losartan group | CGP42112A group | ||
| Low-dose | Middle-dose | High-dose | |||
| Volume | 64.03±9.40 | 8.01±1.33 | 43.68±6.50 | 9.02±1.421) | 8.82±1.391) |
| MVD | 33.66±1.23 | 11.94±0.75 | 27.27±1.99 | 14.83±0.612) | 11.61±0.802) |
| 1) P < 0.05 vs control group;2) P < 0.01 vs control group. | |||||
2.3 AT2R对异位组织MVD值的影响
实验各组MVD较对照组明显降低(P < 0.01),低剂量组和对照组间比较无明显差异(P > 0.05)。中、高剂量组与低剂量组及对照组比较差异有统计学意义(P < 0.01);高剂量组与中剂量组比较差异也有统计学意义(P < 0.05);高剂量组及氯沙坦组MVD无明显改变(P > 0.05),表明ATR2对MVD的影响呈剂量依赖性改变,见表 1。
2.4 AT2R对血清VEGF、TNF-α表达的影响处理后中、高剂量组治疗后大鼠血清VEGF、TNF-α平均浓度较对照组明显降低,差异有统计学意义(P < 0.05)。高剂量组与中剂量组比较差异也有统计学意义(P < 0.05),表明ATR2对VEGF、TNF-α的影响在一定程度上也呈剂量依赖性改变,见表 2。
| Parameter | Control group | Losartan group | CGP42112A group | ||
| Low-dose | Middle-dose | High-dose | |||
| TNF-α | 122.51±9.98 | 15.95±2.15 | 101.36±5.90 | 88.38±9.631) | 38.53±5.052) |
| VEGF | 10.53±10.00 | 8.76±1.35 | 52.68±4.11 | 40.44±8.452) | 17.33±1.881) |
| 1) P < 0.01 vs control group;2) P < 0.05 vs control group. | |||||
3 讨论
虽然EMs的发病机制仍未完全明确[10],但多个研究[11-12]结果表明其与血管再生及血管生成有密切关系,EMs病灶的种植、侵袭和生长关键在于新生血管生成来维持血液供应[13],从而促成EMs发病且反复发作。异位病灶内部和周围有大量特征性的新生血管,腹腔局部的血管生成活跃,本研究建立的大鼠EMs模型已充分证实这一点。因此通过抑制异位病灶血管生成来治疗EMs已成为此领域的研究热点。
血管紧张素Ⅱ是肾素-血管紧张素系统的主要效应器,是一种调节系统血压以及体液和电解质稳态的调节系统[14],且已被证实存在于子宫内膜组织中[15],参与子宫内膜的周期性变化及生殖功能的调节、维持妊娠期人体子宫稳态等一系列生理过程;并参与功能性子宫内膜出血、EMs、妇科肿瘤等病理生理过程[16]。血管紧张素Ⅱ被证实是促进生理性及病理性血管生成的重要因子[17],主要与AT1R、AT2R结合发挥作用,AT1R广泛表达于血管组织,血管紧张素Ⅱ的大部分作用都是AT1R介导的,而AT2R在成人体内低密度表达,主要表达于内皮、血管平滑肌和神经元细胞等[18],且两者作用在某些方面相反[19],AT1R会提高醛固酮及血管加压素的水平,促进血管生成,增加血管阻力[20],而AT2R的主要功能是血管舒张,抑制细胞增殖,并触发缓激肽和硝酸盐氧化物的释放[21-22]。研究[23]发现,AT1R和AT2R均表达于EMs,且AT1/AT2 mRNA在EMs中的表达显著高于非EMs的正常增生性子宫内膜。进一步研究[24]表明,激活的AT2R能通过与AT1R结合形成异质二聚物来直接对抗AT1R介导的生理及病理效应。自1994年第1个AT1R拮抗剂氯沙坦上市后,越来越多的AT1R拮抗剂被广泛应用于临床,研究[25-26]发现,AT1R阻滞剂如氯沙坦能够通过抑制VEGF的表达抑制血管生成,并且有可能抑制前列腺癌、乳腺癌及子宫内膜癌的生长。替米沙坦能够抑制血管生成,减少免疫细胞数量,抑制大鼠子宫内膜异位结节的生长[27]且氯沙坦也在大鼠EMs试验中证实了这一点[28]。
有研究发现在EMs囊肿中AT2R的表达可以抑制AT1R的表达。换而言之,激动AT2R可能对EMs新生血管的发生发展有抑制作用。为探明AT2R在EMs中对新血管形成的影响及作用,本研究通过Vernon法建立大鼠EMs模型,给予AT2R激动剂CGP42112A,并同时设立AT1R拮抗剂氯沙坦作为阳性对照,观察其对EMs微血管形成的影响。结果显示,AT2R激动剂与生理盐水对照组比较,大鼠异位病灶的体积明显缩小,还能抑制异位灶中MVD的数量和血清中VEGF、TNF-α的表达,且此种效应有明显地剂量依赖性,中高剂量组比低剂量组抑制血管生成的作用更加显著。CGP42112A与AT1R拮抗剂氯沙坦作用一致,均有明显的抑制异位病灶血管生成及缩小病灶体积的作用,且此作用可能与抑制VEGF、TNF-α的表达有关。由此可见,AT2R在EMs的药物治疗中有着广泛的前景。但是参与血管生成的因子很多,且为一个复杂的过程,AT2R是否对其他血管生成因子也有作用以及这些血管生成因子之间的相互关系都有待深入研究。此外,AT2R对于EMs是否具有免疫调节、抗炎、止痛、调节内分泌功能等作用,有待进一步研究,从而为临床治疗EMs提供实验依据和理论支持,为开发治疗药物提供新的靶点。
| [1] |
SIMOENS S, DUNSELMAN G, DIRKSEN C, et al. The burden of endometriosis:costs and quality of life of women with endometriosis and treated in referral centres[J]. Hum Reprod, 2012, 27(5): 1292-1299. DOI:10.1093/humrep/des073 |
| [2] |
NNOAHAM KE, HUMMELSHOJ L, WEBSTER P, et al. Impact of endometriosis on quality of life and work productivity:a multicenter study across ten countries[J]. Fertil Steril, 2011, 96(2): 366-373. DOI:10.1016/j.fertnstert.2011.05.090 |
| [3] |
郎景和. 子宫内膜异位症的研究与设想[J]. 中华妇产科杂志, 2003, 38(8): 478-480. DOI:10.3760/j.issn:0529-567X.2003.08.018 |
| [4] |
TAYLOR RN, YU J, TORRES PB, et al. Mechanistic and therapeutic implications of angiogenesis in endometriosis[J]. Reprod Sci, 2009, 16(2): 140-146. DOI:10.1177/1933719108324893 |
| [5] |
DAI SY, ZHANG Y, PENG W, et al. Central infusion of angiotensinⅡtype 2 teceptor agonist compound 21 attenuates DOCA/NaCl-in-duced hypertension in female rats[J]. Oxid Med Cell Longev, 2016, 2016(1): 3981790. DOI:10.1155/2016/3981790 |
| [6] |
WANG D, HU S, ZHU J, et al. AngiotensinⅡtype 2 receptor correlates with therapeutic effects of losartan in rats with adjuvant-induced arthritis[J]. J Cell Mol Med, 2013, 17(12): 1577-1587. DOI:10.1111/jcmm.12128 |
| [7] |
VERNON MW, WILSON EA. Studies on the surgical induction of endometriosis in the rats[J]. Fertil Steril, 1985, 44(5): 684-694. DOI:10.1016/S0015-0282(16)48988-0 |
| [8] |
BERKLEY KJ, DMITRIEVA N, CURTIS KS, et al. Innervation of ectopic endometrium rat model of endometriosis[J]. Proc Natl Acad Sci USA, 2004, 101(30): 11094-11098. DOI:10.1073/pnas.0403663101 |
| [9] |
YILDIRIM G, ATTAR R, OZKAN F, et al. The effects of letrozole and melatonin on surgically induced endometriosis in a rat model:a preliminary study[J]. Fertil Steril, 2010, 93(6): 1787-1792. DOI:10.1016/j.fertnstert.2009.09.021 |
| [10] |
BURNEY RO, GIUDICE LC. Pathogenesis and pathophysiology of endometriosis[J]. Fertil Steril, 2012, 98(3): 511-519. DOI:10.1016/j.fertnstert.2012.06.029 |
| [11] |
LASCHKE MW, MENGER MD. Anti-angiogenic treatment strategies for the therapy of endometriosis[J]. Hum Reprod Update, 2012, 18(6): 682-702. DOI:10.1093/humupd/dms026 |
| [12] |
LASCHKE MW, GIEBELS C, MENGER MD. Vasculogenesis:a new piece of the endometriosis puzzle[J]. Hum Reprod Update, 2011, 17(5): 628-636. DOI:10.1093/humupd/dmr023 |
| [13] |
LASCHKE M, ELITZSCH A, SCHEUER C, et al. Selective cyclo-oxygenase-2 inhibition induces regression of autologous endometrial grafts by down-regulation of vascular endothelial growth factor-mediated angiogenesis and stimulation of caspase-3-dependent apoptosis[J]. Fertil Steril, 2007, 87(1): 163-171. DOI:10.1016/j.fertnstert.2006.05.068 |
| [14] |
ZIZZO MG, AUTERI M, AMATO A, et al. Angiotensin Ⅱ Type Ⅱ receptors and colonic dysmotility in 2, 4-dinitrofluorobenzenesulfonic acid-induced colitis in rats[J]. Neurogastroenterol Motil, 2017, 29(6): e13019. DOI:10.1111/nmo.13019 |
| [15] |
VAZ-SILVA J, CARNEIRO MM, FERREIRA MC, et al. The vasoactive peptide angiotensin-(1-7), its receptor mas and the angiotensin-converting enzyme type 2 are expressed in the human endometrium[J]. Reprod Sci, 2009, 16(3): 247-256. DOI:10.1177/1933719108327593 |
| [16] |
SHIBATA K, KIKKAWA F, MIZOKAMI Y, et al. Possible involvement of adipocyte-derived leucine aminopeptidase via angiotensin ii in endometrial carcinoma[J]. Tumour Biol, 2005, 26(1): 9-16. DOI:10.1159/000084181 |
| [17] |
MANYI ZM, DAN CHEN M, DONGYE LM, et al. Luteolin inhibits angiotensin ii-induced human umbilical vein endothelial cell proliferation and migration through downregulation of src and akt phosphorylation[J]. Circ J, 2013, 77(3): 772-779. DOI:10.1253/circj.CJ-12-0310 |
| [18] |
CARBAJO-LOZOYA J, LUTZ S, FENG Y, et al. AngiotensinⅡ modulates vegf-driven angiogenesis by opposing effects of type 1 and type 2 receptor stimulation in the microvascular endothelium[J]. Cell Signal, 2012, 24(6): 1261-1269. DOI:10.1016/j.cellsig.2012.02.005 |
| [19] |
KASCHINA E, GRZESIAK A, LI J, et al. AngiotensinⅡ type 2 receptor stimulation:a novel option of therapeutic interference with the renin-angiotensin system in myocardial infarction?[J]. Circulation, 2008, 118(24): 2523-2532. DOI:10.1161/CIRCULATIONAHA.108.784868 |
| [20] |
BURKE SD, BARRETTE VF, GRAVEL J, et al. Uterine NK cells, spiral artery modification and the regulation of blood pressure during mouse pregnancy[J]. Am J Reprod Immunol, 2010, 63(6): 472-481. DOI:10.1111/j.1600-0897.2010.00818.x |
| [21] |
TIMMERMANS PB, CHIU AT, HERBLIN WF. AngiotensinⅡ receptor subtypes[J]. Am J Hypertens, 1992, 5(6Pt1): 406-410. DOI:10.1093/ajh/5.6.406 |
| [22] |
HERRERA M, SILVA GB, GARVIN JL. AngiotensinⅡ stimulates thick ascending limb superoxide production via protein kinase Cα -dependent NADPH oxidase activation[J]. J Biol Chem, 2010, 285(28): 21323-21328. DOI:10.1074/jbc.M110.109157 |
| [23] |
NAKAO T, CHISHIMA F, SUGITANI M, et al. Expression of angiotensin Ⅱ types 1 and 2 receptors in endometriotic lesions[J]. Gynecol Obstet Invest, 2017, 82(3): 294-302. DOI:10.1159/000447591 |
| [24] |
ABDALLA S, LOTHER H, ABDEL-TAWAB AM, et al. The angiotensin ii at2 receptor is an at1 receptor antagonist[J]. J Biol Chem, 2001, 276(43): 39721-39726. DOI:10.1074/jbc.M105253200 |
| [25] |
CHEN X, MENG Q, ZHAO Y, et al. Angiotensin Ⅱ type 1 receptor antagonists inhibit cell proliferation and angiogenesis in breast cancer[J]. Cancer Lett, 2013, 328(2): 318-324. DOI:10.1016/j.canlet.2012.10.006 |
| [26] |
CHOI CH, PARK Y, CHOI J, et al. Angiotensin Ⅱ type ⅰ receptor and mir-155 in endometrial cancers:synergistic antiproliferative effects of anti-mir-155 and losartan on endometrial cancer cells[J]. Gynecol Oncol, 2012, 126(1): 124-131. DOI:10.1016/j.ygyno.2012.04.020 |
| [27] |
NENICU A, KORBEL C, GU Y, et al. Combined blockade of angiotensin ⅱ type 1 receptor and activation of peroxisome proliferator -activated receptor-γby telmisartan effectively inhibits vascularization and growth of murine endometriosis-like lesions[J]. Hum Reprod, 2014, 29(5): 1011-1024. DOI:10.1093/humrep/deu035 |
| [28] |
CAKMAK B, CAVUSOGLU T, ATES U, et al. Regression of experimental endometriotic implants in a rat model with the angiotensin Ⅱ receptor blocker losartan[J]. J Obstet Gynaecol Re, 2015, 41(4): 601-607. DOI:10.1111/jog.12558 |
 2018, Vol. 47
2018, Vol. 47