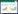文章信息
- 任媛, 苏新明, 陆常玲, 李朋, 李孟露, 康健
- REN Yuan, SU Xinming, LU Changling, LI Peng, LI Menglu, KANG Jian
- 组蛋白去乙酰化酶6在慢性哮喘小鼠肺组织中的表达形态
- Histone Deacetylase 6 Expression Pattern in the Lung Tissue of Chronic Asthmatic Mice
- 中国医科大学学报, 2018, 47(9): 788-791, 802
- Journal of China Medical University, 2018, 47(9): 788-791, 802
-
文章历史
- 收稿日期:2018-03-16
- 网络出版时间:2018-08-28 8:56
哮喘的本质是由多种细胞以及细胞组分参与的气道慢性炎症性疾病[1]。随着哮喘病程的延长,肺组织结构细胞如上皮细胞、平滑肌细胞、成纤维细胞等可发生一系列改变,最终导致基底膜破坏、平滑肌增厚、血管再生、上皮下纤维化等重塑性改变,为哮喘的临床治疗带来了极大的困扰[2-4]。组蛋白去乙酰化酶6(histone deacetylase 6,HDAC6)是Ⅱ类HDAC家族的重要成员,主要表达于细胞质中,参与调控体内炎症反应、细胞增殖分化、平滑肌增殖迁移以及胶原分泌等诸多病理过程[5-8]。近年来越来越多的证据显示,HDAC6很可能在哮喘致病过程中发挥了关键作用,选择性的抑制肺组织中HDAC6的表达有望为哮喘治疗提供新方法。本研究的目的是明确哮喘致病时HDAC6在肺组织中的表达形态,阐明HDAC6与哮喘致病间的关系,为HDAC6特异性抑制剂用于哮喘治疗提供依据。
1 材料与方法 1.1 制备哮喘模型及分组6~8周SPF级雌性BALB/C小鼠购自辽宁长生生物技术有限公司[动物许可证号:SCXK(辽)2010-0001]。采用随机数字表法将BALB/C小鼠分为正常组和哮喘组,每组12只。于实验第0、7、14天,哮喘组小鼠予以卵蛋白(ovalbumin,OVA)(20 μg)和氢氧化铝凝胶(2 mg)混悬液腹腔注射致敏。末次致敏1周后,应用超声雾化装置(3 mL/min)进行OVA(20 mg/mL)雾化激发8周,3次/周,30 min/次。正常组均以等量生理盐水代替OVA处理。
1.2 HE染色评估哮喘建模末次激发实验24 h后,各组小鼠麻醉处死,取左侧肺组织(n = 6),固定,包埋,切片(0.5 μm)后行HE染色。石蜡切片脱蜡水化,苏木素染色5~10 min,自来水冲洗5 min,盐酸乙醇分化3 s,自来水洗返蓝30 min,伊红复染1~2 min,自来水洗去浮色,梯度乙醇脱水,二甲苯透明,中性树胶封片。光镜下观察哮喘组小鼠气道肺组织炎症浸润水平。
1.3 免疫组织化学染色观察HDAC6在肺组织中的表达分布采用SP法行肺组织HDAC6免疫组化染色(n = 6)。石蜡切片脱蜡水化,3% H2O2室温孵育5 min,PBS洗3次,5 min/次;微波炉抗原修复24 min,6 min/次,PBS洗3次,5 min/次;10% BSA室温孵育30 min,HDAC6多克隆抗体(1:100,美国Santa Cruz公司)4 ℃孵育过夜。二抗(1:500)37 ℃孵育60 min,PBS洗3次,5 min/次;DAB法显色5~10 min,自来水充分冲洗,苏木素复染,脱水,透明,封片。光镜下观察HDAC6在各组小鼠肺组织中的表达分布。
1.4 Western blotting检测HDAC6在肺组织中的表达水平取右侧新鲜肺组织(n = 3)30~50 mg加入RIPA裂解液(含10% PMSF),冰上剪碎匀浆,超声粉碎,4 ℃ 12 000 g离心,30 min后取上清。BCA法测蛋白浓度,调整浓度并变性后,采用SDS-聚丙烯酞胺凝胶电泳(80 V,30 min;120 V,90 min)分离。将蛋白转染到PVDF膜上(0.25 mA,60 min),脱脂奶粉封闭液中室温封闭2 h。HDAC6多克隆抗体(1:1 000,美国Santa Cruz公司)4 ℃孵育过夜。二抗室温孵育1 h,ECL法检测蛋白表达,UVP系统成像,Gel-Pro Analyzer凝胶定量分析软件进行结果分析。
1.5 比色法分析检测HDAC6在肺组织中的酶活性取右侧新鲜肺组织(n = 6),采用蛋白抽提试剂盒提取蛋白,BCA法测定蛋白浓度,比色法检测肺组织中HDAC6酶活性,操作方法按试剂盒(EpiQuik HDAC6 Assay Kit,美国Epigentek公司)内附说明书操作。
1.6 统计学分析所有数据均用x±s表示,应用SPSS 19.0统计软件进行统计分析,组间均数的比较采用独立样本t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 哮喘小鼠肺组织中炎症浸润水平正常组小鼠肺组织中各级气道及血管周围未见炎症细胞浸润,基底膜完整,气道上皮细胞排列整齐。与正常组相比,哮喘组小鼠各级气道及血管周围可见大量以嗜酸性粒细胞为主的炎症细胞浸润,基底膜脱落,上皮下纤维化。病理染色结果显示哮喘建模成功。见图 1。
|
| A, control group (×200), with an enlarged image in the square frame (×400);B, asthma group (×200), with an enlarged image in the square frame (×400). 图 1 2组小鼠肺组织病理染色 Fig.1 Pathological staining of lung tissue of mice in the two groups |
2.2 HDAC6在肺组织中的表达分布 2.2.1 HDAC6高表达于哮喘小鼠气道上皮细胞
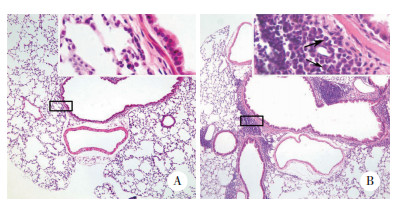
正常组小鼠气道上皮细胞质中可见极少量的HDAC6表达。与正常组小鼠相比,哮喘组小鼠气道上皮细胞细胞核和细胞质中HDAC6表达水平显著升高,尤其在脱落的气道上皮细胞中HDAC6表达水平明显升高。见图 2。
|
| A, control group (×200), with an enlarged image in the square frame (×400);B, asthma group (×200), with an enlarged image in the square frame (×400). 图 2 HDAC6在2组小鼠气道上皮细胞中的表达情况 Fig.2 HDAC6 expression in airway epithelial cells of mice in the two groups |
2.2.2 HDAC6高表达于哮喘小鼠上皮下炎症细胞
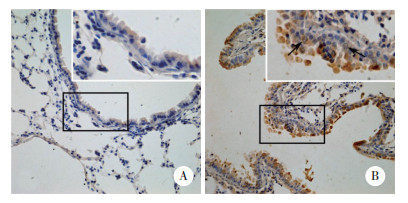
正常组小鼠肺组织气道血管周围未见炎症细胞浸润。与正常组小鼠相比,哮喘组小鼠气道血管周围可见大量炎症细胞浸润,且浸润的炎症细胞中可见HDAC6阳性染色。见图 3。
|
| A, control group (×200), with an enlarged image in the square frame (×400);B, asthma group (×200), with an enlarged image in the square frame (×400). 图 3 HDAC6在2组小鼠上皮下炎症细胞中的表达情况 Fig.3 HDAC6 expression in the subepithelial inflammatory cells of mice in the two groups |
2.2.3 HDAC6表达于哮喘小鼠平滑肌细胞
正常组小鼠气道和血管平滑肌细胞中HDAC6表达极少。OVA雾化8周后,可见哮喘组小鼠气道平滑肌细胞和血管平滑肌细胞细胞质中HDAC6阳性表达,与正常组小鼠相比,HDAC6在平滑肌细胞中表达水平升高。见图 4。
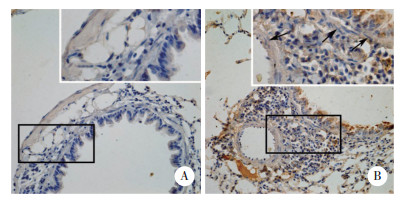
|
| A, control group (×200), with an enlarged image in the square frame (×400);B, asthma group (×200), with an enlarged image in the square frame (×400). 图 4 HDAC6在2组小鼠平滑肌细胞中的表达情况 Fig.4 HDAC6 expression in smooth muscle cells of mice in the two groups |
2.2.4 HDAC6高表达于哮喘小鼠肺泡腔炎症细胞
正常组小鼠肺泡腔中可见少量巨噬细胞,且巨噬细胞中HDAC6表达极少。与正常组小鼠相比,哮喘组小鼠肺泡腔中可见以巨噬细胞和嗜酸性粒细胞为主的炎症细胞浸润,且在这些细胞的细胞核和细胞质中HDAC6表达水平显著升高。见图 5。
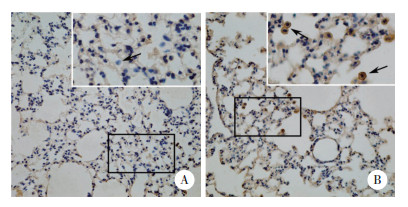
|
| A, control group (×200), with an enlarged image in the square frame (×400);B, asthma group (×200), with an enlarged image in the square frame (×400). 图 5 HDAC6在2组小鼠肺泡腔炎症细胞中的表达情况 Fig.5 HDAC6 expression in alveolar inflammatory cells of mice in the two groups |
2.3 HDAC6在哮喘小鼠肺组织中的表达水平
采用Western blotting进一步检测HDAC6在肺组织中的总体表达水平,正常组为1.00,哮喘组为3.40±0.68。与正常组小鼠相比,哮喘组小鼠肺组织中HDAC6的总体表达水平显著升高,2组间差异有统计学意义(P < 0.05)。见图 6。
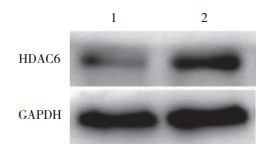
|
| 1, control group; 2, asthma group. 图 6 Western blotting检测HDAC6在2组小鼠肺组织中的表达水平 Fig.6 HDAC6 levels in the lung tissue of mice in the two groups were detected by Western blotting |
2.4 HDAC6在哮喘小鼠肺组织中酶活性的变化
采用比色法检测HDAC6在正常组和哮喘组小鼠肺组织的酶活性,正常组为(0.50±0.07)ng/μg,哮喘组为(1.15±0.18)ng/μg。哮喘致病时肺组织中HDAC6酶活性显著升高,2组间差异有统计学意义(P < 0.05)。
3 讨论HDAC6是HDAC家族的重要成员,不同于其他HDAC成员,HDAC6具有2个高度同源且均含有锌指结构的催化区域,共同调控HDAC6的酶活性[9]。同时,HDAC6作为一个重要的细胞质蛋白,能够穿梭于细胞核和细胞质之间,具有诸多组蛋白和非组蛋白底物,与细胞内错误折叠蛋白反应、细胞黏附和迁移、上皮间充质转化、炎症细胞渗出、自噬反应以及DNA损伤修复等诸多病理过程密切相关[10]。CHOI等[11]发现HDAC6特异性抑制剂Tubastatin A Hcl能够显著抑制转化生长因子β1(transforming growth factor β1,TGF-β1)介导的组蛋白乙酰化,抑制Smad2/3与纤维化相关基因启动子区DNA的结合水平,最终抑制高血压肾病中肾脏纤维化和炎症性改变。最新研究[12-15]表明,HDAC6能够通过调控其底物蛋白热休克蛋白90的乙酰化修饰水平,影响核转录因子κB通路和TGF-β1的激活,进而调控下游通路的炎症反应和纤维化过程。综合现有的研究进展发现,HDAC6不仅在恶性肿瘤及神经退行性疾病中具有重要作用,而且在心血管疾病、炎症性疾病及肾脏纤维化等相关疾病中亦具有重要作用。
本研究结果显示,哮喘致病时肺组织中HDAC6表达水平和酶活性均显著升高,尤其在气道上皮细胞、气道血管周围炎症细胞、肺泡腔巨噬细胞和平滑肌细胞中,可见HDAC6表达水平显著高于正常小鼠。这一异常改变很可能与哮喘致病时嗜酸性粒细胞、肥大细胞、T细胞、中性粒细胞、气道上皮细胞、平滑肌细胞等众多细胞被激活,参与气道炎症和重塑性反应相关。本课题组前期研究[16-17]结果也显示,HDAC6特异性抑制剂(Tubastatin A Hcl)干预能够有效减轻哮喘小鼠肺组织中的炎症水平,缓解哮喘气道重塑和气道高反应的发生,包括抑制支气管肺泡灌洗液中炎症细胞和细胞因子分泌、减轻肺组织气道血管周围炎症细胞浸润、降低气道上皮黏液腺化生、抑制上皮下胶原沉积以及上皮下纤维化、缓解平滑肌增厚等。尤其在抑制哮喘气道重塑和气道高反应方面,HDAC6特异性抑制剂的效果要略优于激素和其他HDAC抑制剂干预[16]。这一作用特点很可能与HDAC6在哮喘相关致病细胞中的作用相关,即HDAC6参与并调控丝裂原活化蛋白激酶、核转录因子κB以及TGF-β1相关通路的激活[18],最终影响哮喘肺组织中的炎症水平和重塑性改变。根据HDAC6在哮喘致病时表达形态的变化以及HDAC6特异性抑制剂对哮喘小鼠的疗效,可以推测选择性地抑制肺组织中HDAC6的表达,能够为哮喘治疗尤其是抑制哮喘肺组织重塑提供新的方法。
| [1] |
中华医学会呼吸病学分会哮喘学组. 支气管哮喘防治指南(2016年版)[J]. 中华结核和呼吸杂志, 2016, 39(9): 675-697. DOI:10.3760/cma.j.issn.1001-0939.2016.09.007 |
| [2] |
Al-MUHSEN S, JOHNSON JR, HAMID Q. Remodeling in asthma[J]. J Allergy Clin Immunol, 2011, 128(3): 451-462. DOI:10.1016/j.jaci.2011.04.047 |
| [3] |
POON AH, EIDELMAN DH, MARTIN JG, et al. Pathogenesis of severe asthma[J]. Clin Exp Allergy, 2012, 42(5): 625-637. DOI:10.1111/j.1365-2222.2012.03983.x |
| [4] |
SU XM, TANIUCHI N, JIN EJ, et al. Spatial and phenotypic characterization of vascular remodeling in a mouse model of asthma[J]. Pathobiology, 2008, 75(1): 42-56. DOI:10.1159/000113794 |
| [5] |
OKAMOTO H, FUJIOKA Y, TAKAHASHI A, et al. Trichostatin A, an inhibitor of histone deacetylase, inhibits smooth muscle cell proliferation via induction of p21(WAF1)[J]. J Atheroscler Thromb, 2006, 13(4): 183-191. DOI:10.5551/jat.13.183 |
| [6] |
YANG IA, CLARKE MS, SIM EH, et al. Inhaled corticosteroids for stable chronic obstructive pulmonary disease[J]. Cochrane Database Syst Rev, 2012(7): CD002991. DOI:10.1002/14651858.CD002991.pub3 |
| [7] |
COSIO BG, IGLESIAS A, RIOS A, et al. Low-dose theophylline enhances the anti-inflammatory effects of steroids during exacerbations of COPD[J]. Thorax, 2009, 64(5): 424-429. DOI:10.1136/thx.2008.103432 |
| [8] |
BARNES PJ. Theophylline[J]. Am J Respir Crit Care Med, 2013, 188(8): 901-906. DOI:10.1164/rccm.201302-0388PP |
| [9] |
VALENZUELA FA, CABRERO JR, SERRADOR JM, et al. HDAC6:a key regulator of eytoskeleton, cell migration and cell-cell interactions[J]. Trends Cell Biol, 2008, 18(6): 291-297. DOI:10.1016/j.tcb.2008.04.003 |
| [10] |
BATCHU SN, BRIJMOHAN AS, ADVANI A. The therapeutic hope for HDAC6 inhibitors in malignancy and chronic disease[J]. Clin Sci (Lond), 2016, 130(12): 987-1003. DOI:10.1042/CS20160084 |
| [11] |
CHOI SY, RYU Y, KEE HJ, et al. A suppresses renal fibrosis via regulation of epigenetic histone modification and Smad3-dependent fibrotic genes[J]. Vascul Pharmacol, 2015, 72: 130-140. DOI:10.1016/j.vph.2015.04.006 |
| [12] |
THANGJAM GS, BIRMPAS C, BARABUTIS N, et al. Hsp90 inhibition suppresses NF-κB transcriptional activation via Sirt-2 in human lung microvascular endothelial cells[J]. Am J Physiol Lung Cell Mol Physiol, 2016, 310(10): L964-L974. DOI:10.1152/ajplung.00054.2016 |
| [13] |
LEE MY, SUN KH, CHIANG CP, et al. Nitric oxide suppresses LPS-induced inflammation in a mouse asthma model by attenuating the interaction of IKK and Hsp90[J]. Exp Biol Med(Maywood), 2015, 240(4): 498-507. DOI:10.1177/1535370214554880 |
| [14] |
GARCIA R, MERINO D, GOMEZ JM, et al. Extracellular heat shock protein 90 binding to TGF-β receptor Ⅰ participates in TGF-β -mediated collagen production in myocardial fibroblasts[J]. Cell Signal, 2016, 28(10): 1563-1579. DOI:10.1016/j.cellsig.2016.07.003 |
| [15] |
DESKIN B, LASKY J, ZHUANG Y, et al. Requirement of HDAC6 for activation of Notch1 by TGF-β1[J]. Sci Rep, 2016, 6: 31086. DOI:10.1038/srep31086 |
| [16] |
REN Y, SU X, KONG L, et al. Therapeutic effects of histone deacetylase inhibitors in a murine asthma model[J]. Inflamm Res, 2016, 65(12): 995-1008. DOI:10.1007/s00011-016-0984-4 |
| [17] |
任媛, 苏新明, 李孟露, 等. Tubastatin A Hcl对慢性支气管哮喘小鼠的治疗作用[J]. 中国医科大学学报, 2017, 46(1): 17-22. DOI:10.12007/j.issn.0258-4646.2017.01.004 |
| [18] |
YOUN GS, LEE KW, CHOI SY, et al. Overexpression of HDAC6 induces pro-inflammatory responses by regulating ROS-MAPK-NF-κB/AP-1 signaling pathways in macrophages[J]. Free Radic Biol Med, 2016, 97: 14-23. DOI:10.1016/j.freeradbiomed.2016.05.014 |
 2018, Vol. 47
2018, Vol. 47