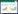文章信息
- 郭镇豪, 吴泽扬, 李琦, 王晓凤, 陶维晨, 王聪, 赵敏
- GUO Zhenhao, WU Zeyang, LI Qi, WANG Xiaofeng, TAO Weichen, WANG Cong, ZHAO Min
- 兔血清对氧磷酶1对敌敌畏中毒大鼠大脑组织的保护作用
- Protective Effect of Serum Paraoxonase 1 on the Brain Tissue of Dichlorvos-poisoned Rats
- 中国医科大学学报, 2018, 47(9): 778-782
- Journal of China Medical University, 2018, 47(9): 778-782
-
文章历史
- 收稿日期:2018-01-15
- 网络出版时间:2018-08-27 17:30
有机磷(organic phosphorus,OP)化合物属于极毒性化学物质,目前治疗方式主要是解毒剂给药(阿托品和肟类),辅助以洗胃、导泻、清洗皮肤及血液净化等。对氧磷酶1(paraoxonase 1,PON1)具有解救OP中毒的作用,可能与抗氧化应激作用有关。本研究通过建立敌敌畏(dichlorvos,DDVP)中毒大鼠脑组织损伤模型,探究PON1对解救DDVP中毒脑组织损伤的保护作用。
1 材料与方法 1.1 材料 1.1.1 实验动物SPF级雄性SD大鼠(250~350 g)30只,购自北京华阜康生物科学技术有限责任公司[合格证号:SCXK(京)2014-0004],由中国医科大学附属盛京医院本溪实验基地动物部饲养。
1.1.2 主要试剂77.5%DDVP乳油(山东大成农化有限公司);胆碱酯酶(cholinesterase,ChE)检测试剂盒(南京建成生物工程研究所);过氧化氢酶(catalase,CAT)测试盒(南京建成生物工程研究所);超氧化物歧化酶1(superoxide dismutase 1,Sod1)抗体(美国BioVision科技公司);PTEN诱导激酶1(PTEN-inducible kinase 1,Pink1)抗体(美国Novus科技公司);过氧化物还原酶6(peroxidase reductase 6,Prdx6)抗体(美国Cell Signaling科技公司);PON1(中国医科大学中心实验室使用层析分离纯化兔血清)。
1.1.3 主要仪器BioTek全光谱酶标仪;Amersham成像仪600;普通光学显微镜CX-41(日本OLYMPUS公司),生物光学显微镜E800型(日本Nikon公司)。
1.2 方法 1.2.1 动物模型制备30只雄性SD大鼠随机分为5组(6只/组)。空白对照组(A组)予大鼠腹腔注射1 mL/kg生理盐水;染毒组(B组)予大鼠15 mg/kg DDVP腹腔注射;PON1干预组(C组)于大鼠造模前30 min尾静脉注射兔血清PON1 9 600 U/kg,30 min后予15 mg/kg DDVP腹腔注射;传统治疗组(D组)予大鼠15 mg/kg DDVP腹腔注射,后立即予阿托品10 mg/kg+碘解磷定45 mg/kg腹腔注射;联合治疗组(E组)于大鼠造模前30 min尾静脉注射兔血清PON1 9 600 U/kg,30 min后予15 mg/kg DDVP腹腔注射,之后立即予阿托品10 mg/kg+碘解磷定45 mg/kg腹腔注射。造模后立即观察大鼠一般状态及症状并记录。
1.2.2 取材各组大鼠造模后8 h处死,室温静置4 h,心脏抽取血液5 mL,3 500 r/min离心10 min后,取上清液(血清),-80 ℃冰箱保存待测。之后每只大鼠以300 mL生理盐水注射心脏灌洗,取脑组织,于冰上冠状面中间处切去3 mm厚度大脑组织,放入标记后于4%多聚甲醛中固定,剩余部分于冰上分离皮层大脑组织及海马区大脑组织,分别放入EP管中,标记后存入-80 ℃冰箱。
1.2.3 生化指标检测从-80 ℃冰箱中取出各组血清,严格按照ChE测试盒说明书配制工作液,以双蒸水为对照,混匀,37 ℃孵育30 s,405 nm波长连续监测40 s,计算△A/min,根据说明书公式计算ChE活力,记录并计算各组活力值。严格按照CAT试剂盒说明书配制4种试剂,在37 ℃温度下按照说明书加样顺序操作,混匀,以双蒸水对比,于波长405 nm,光径0.5 cm,双蒸水调零,测定各管吸光度,按照说明书计算公式计算各组CAT活力。
1.2.4 Western blotting检测Sod1、Pink1及Prdx6在大脑皮层和大脑海马区中的表达大脑皮层和大脑海马区分别经过冰上充分研磨、裂解后4℃ 12 000 r/min离心30 min,取上清液测蛋白浓度,变性后电泳分离蛋白质,转至PVDF膜,封闭3 h,洗膜后孵一抗(Sod1、Pink1、Prdx6、β-actin),4℃冷房摇床上孵育过夜,洗膜,加二抗孵育,再洗膜,发光。
1.3 光镜检查取出各组4%多聚甲醛固定3 d后的大脑组织,过缸脱水、透明、包埋后切片、晾片、烘片后进行HE染色,树脂封片,光镜下分别观察各组大脑皮层和海马区形态并照相。
1.4 统计学分析应用SPSS 22.0软件进行统计学处理,比较各组大鼠血清ChE、CAT,大脑皮层及大脑海马区Sod1、Pink1、Prdx6表达水平,计量资料以x±s表示,每组数据先行方差齐性检验,后进行独立样本t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠临床表现A组大鼠生命体征平稳,未出现任何中毒症状;B组大鼠立即出现流涎、流泪、大小便失禁、咀嚼肌震颤、四肢肌肉震颤、呼吸急促和躁动等中毒症状;C组大鼠立即出现轻微咀嚼肌震颤、呼吸略急促伴有轻微躁动中毒症状;D组大鼠立即出现轻微流涎、咀嚼肌震颤、四肢肌肉震颤、呼吸急促伴有轻微躁动中毒症状;E组大鼠仅出现轻微咀嚼肌震颤,无其他中毒症状。
2.2 各组大鼠血清ChE和CAT以A组为对照,B组ChE和CAT数值下降明显,C组下降程度较B组小,差异有统计学意义(P < 0.05),D组下降程度较B组小、较C组大,差异均有统计学意义(P < 0.05),E组下降程度较A组差异无统计学意义(P > 0.05)。见表 1。
| Group | ChE(U/L) | CAT(U/mL) |
| A | 4 435.68±121.56 | 4.65±0.88 |
| B | 535.5±83.501) | 1.67±0.791) |
| C | 3 004.29±138.901),2) | 3.89±0.581),2) |
| D | 2 046±303.88 | 3.02±0.67 |
| E | 3 970.61±103.72 | 4.50±0.79 |
| 1) P < 0.05 vs group D;2) P < 0.05 vs group B. | ||
2.3 Western blotting结果
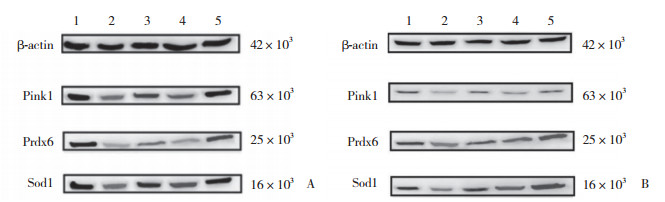
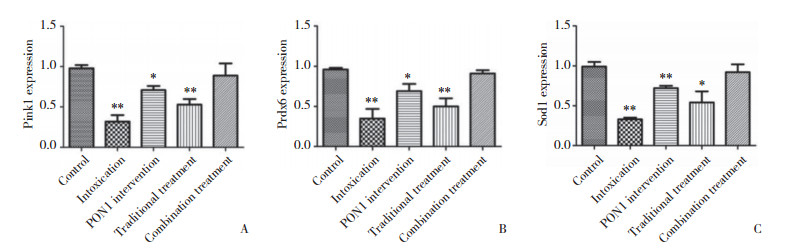
应用“Quantity One”软件分析结果显示,以A组为空白对照组,B组表达量较A组明显减少,差异有统计学意义(P < 0.05);C组表达量较A组少、较B组多,差异有统计学意义(P < 0.05);D组表达量较A组、C组少,较B组多,差异均有统计学意义(P < 0.05);D组较A组表达略少,多于其余3组。大脑皮层和海马区同组之间差距较少,无统计学意义(P > 0.05)。见图 1~3。
|
| 1, control group; 2, intoxication group; 3, PON1 intervention group; 4, traditional treatment group; 5, combination treatment group. A, cerebral cortex; B, hippocampus. 图 1 各组大脑皮层和海马区Sod1、Pink1、Prdx6表达量Western blotting结果 Fig.1 Western blotting of Sod1, Pink1, and Prdx6 proteins in the cerebral cortex and hippocampus |
|
| **P < 0.01, *P < 0.05 vs control group. A, Pink1;B, Prdx6;C, Sod1. 图 2 各组大脑皮层Pink1、Prdx6、Sod1表达柱状图 Fig.2 Histogram of Pink1, Prdx6, and Sod1 expression in the cerebral cortex for each treatment group |
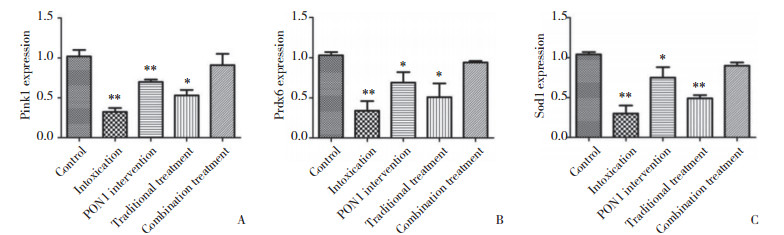
|
| **P < 0.01, *P < 0.05 vs control group. A, Pink1;B, Prdx6;C, Sod1. 图 3 各组海马区Pink1、Prdx6、Sod1表达柱状图 Fig.3 Histogram of Pink1, Prdx6, and Sod1 expression in the hippocampus in each treatment group |
2.4 病理变化
以A组为对照,其余4组均出现不同程度损伤;B组出现严重结构疏松,镜下细胞严重水肿,出现较为严重的核固缩、空泡和脂肪变性,微血管周围空隙增宽,神经细胞也出现较严重水肿;C组出现中度结构疏松,镜下细胞中度水肿,少量细胞出现核固缩、空泡和脂肪变性,神经细胞也出现中度水肿,损伤较B组减轻;D组出现轻度结构疏松,镜下出现少量细胞水肿,偶可见核固缩、空泡和脂肪变性,神经细胞也有轻度水肿,损伤程度轻于C组;E组出现极轻度细胞水肿,未见细胞核改变,神经细胞出现极轻度水肿,损伤程度最轻。同组的大脑皮层和海马区的损伤程度相似。见图 4、5。
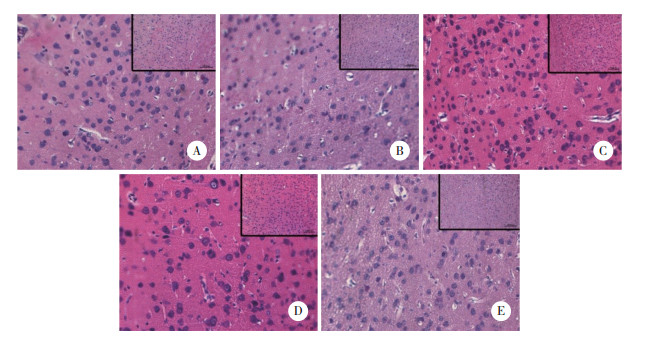
|
| A, control group; B, intoxication group; C, PON1 intervention group; D, traditional treatment group; E, combined treatment group. 图 4 各组大鼠大脑皮层形态学变化 ×400 Fig.4 Morphological changes of the cerebral cortex in each treatment group ×400 |
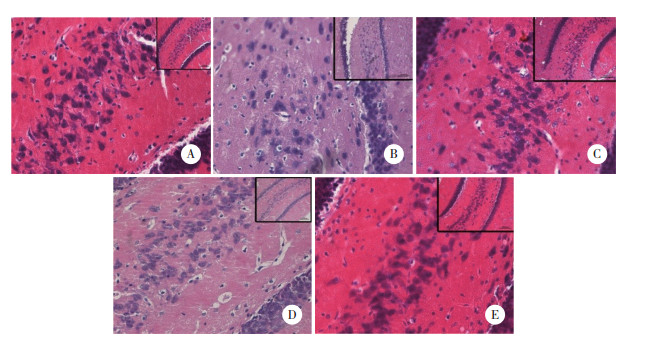
|
| A, control group; B, intoxication group; C, PON1 intervention group; D, traditional treatment group; E, combined treatment group. 图 5 各组大鼠海马区形态学变化 ×400 Fig.5 Morphological changes in the hippocampus of rats in each treatment group ×400 |
3 讨论
PON在人类基因里包含PON1、PON2、PON3 3种,兔血清PON1与人类PON1高度相似[1]。DDVP按照半数致死量属于高毒类。PON1具有抗氧化及解救OP中毒性质,已经发现缺乏PON1的动物与野生型动物相比更易OP中毒,并且已经证明注射兔纯化PON1的各动物模型不易OP中毒[2-3]。
各组大鼠染毒后出现的一般状态,可以判断大鼠中毒严重程度的大小,PON1干预组中毒严重程度较低,优于传统治疗组,但次于联合治疗组。
临床上ChE是评判OP中毒严重程度的一个较为成熟的检测指标,具有出结果快,结果准确等优势。CAT是一种十分重要的抗氧化解毒酶,它将过氧化氢分解成水和分子氧。CAT基因具有持家基因的所有特征,与在物种之间高度保守的核心启动子相关[4-5]。本研究通过测定血清里ChE和CAT活力水平反映大鼠的中毒严重程度,说明PON1干预组损伤轻于传统治疗组。
OP中毒的神经毒性是主要死亡原因之一,其机理尚未明确阐明。有机磷酸酯能抑制乙酰胆碱酯酶,神经毒性主要是大脑不同区域中乙酰胆碱过度活化的结果,也是由于脑中乙酰胆碱酯酶抑制诱导的氧化应激所引起的。在纹状体中观察到高乙酰胆碱酯酶活性,随后是海马,小脑和皮质。中毒造成的延迟周围神经病变、锥体外系症状和神经精神症状在8 h后较明显,因此本研究选取大脑皮层和海马区于造模后8 h后比较其损伤程度[6-7]。
Sod1是经典的抗氧化酶之一,在活性氧清除中发挥重要作用[8-9]。Pink1是一种抗氧化蛋白,Pink1丢失与线粒体Ca2+处理不当、线粒体功能障碍以及神经元的易损性增加有关[10-11]。Pink1蛋白的下调涉及线粒体功能障碍和氧化应激[12]。Prdx6是一种独特的抗氧化酶,具有过氧化物酶和磷脂酶活性[13-14]双重性质。通过Western blotting方法检测各实验组大脑皮层与海马区一种传统抗氧化指标Sod1和2种新型抗氧化指标Pink1和Prdx6的表达量,根据5组之间的对比,说明PON1干预组优于传统治疗组,联合治疗组优于传统治疗和PON1组,大脑皮层和海马区的表达量无统计学差异,说明PON1对于OP中毒大鼠大脑皮层和海马区的损伤均具有保护作用。
光镜下HE染色病理观察显示,细胞发生水肿,出现核固缩、空泡及脂肪变性,也印证了上述结论,染毒组组织损伤程度最严重,PON1干预组损伤程度轻于传统治疗组、重于联合治疗组,其病理结果与之前生化结果相一致。
综上所述,PON1对于OP中毒大鼠大脑皮层和海马区均具有保护作用。进而得出兔血清PON1对DDVP中毒大鼠大脑组织具有保护作用。
| [1] |
CHISTIAKOV DA, MELNICHENKO AA, OREKHOV AN, et al. Paraoxonase and atherosclerosis-related cardiovascular diseases[J]. Biochimie, 2017, 132: 19-27. DOI:10.1016/j.biochi.2016.10.010 |
| [2] |
VALIYAVEETTIL M, ALAMNEH Y, REZK P, et al. Recombinant paraoxonase 1 protects against sarin and soman toxicity following microinstillation inhalation exposure in guinea pigs[J]. Toxicol Lett, 2011, 202(3): 203-208. DOI:10.1016/j.toxlet.2011.02.007 |
| [3] |
CERON JJ, TECLES F, TVARIJONAVICIUTE A. Serum paraoxonase 1(PON1) measurement:an update[J]. BMC Vet Res, 2014, 10(1): 74. DOI:10.1186/1746-6148-10-74 |
| [4] |
GLORIEUX C, ZAMOCKY M, SANDOVAL JM, et al. Regulation of catalase expression in healthy and cancerous cells[J]. Free Radic Biol Med, 2015, 87: 84-97. DOI:10.1016/j.freeradbiomed.2015.06.017 |
| [5] |
WANG L, WU X, GAO W, et al. Differential expression patterns of pleurotus ostreatus catalase genes during developmental stages and under heat stress[J]. Genes, 2017, 8(11): 335. DOI:10.3390/qenes8110335 |
| [6] |
KAZI AI, OOMMEN A. Monocrotophos induced oxidative damage associates with severe acetylcholinesterase inhibition in rat brain[J]. Neurotoxicology, 2007, 28(5): 156-161. DOI:10.1016/j.neuro.2012.01.008 |
| [7] |
PANDA AK, BALA K, BHIRUD L, et al. Extrapyramidal syndrome[J]. BMJ Case Rep, 2014, 2014: bcr2013009752. DOI:10.1136/bcr-2013-009752 |
| [8] |
SAIFY K, SAADAT M. Influence of a 50bp Ins/Del polymorphism at promoter of the superoxide dismutase-1 on gene expression and risk of heroin dependency[J]. Environ Health Prev Med, 2017, 22(1): 4. DOI:10.1186/s12199-017-0617-8 |
| [9] |
MONDOLA P, DAMIANO S, SASSO A, et al. The Cu, Zn superoxide dismutase:not only a dismutase enzyme[J]. Front Physiol, 2016, 7: 594. DOI:10.3389/fphys.2016.00594 |
| [10] |
LIANG C, DU F, CANG J, et al. Pink1 attenuates propofol-induced apoptosis and oxidative stress in developing neurons[J]. J Anesth, 2018, 32(1): 62-69. DOI:10.1007/s00540-017-2431-2 |
| [11] |
HUANG E, QU D, HUANG T, et al. PINK1-mediated phosphorylation of LETM1 regulates mitochondrial calcium transport and protects neurons against mitochondrial stress[J]. Nat Commun, 2017, 8(1): 1399. DOI:10.1038/s41467-017-01435-1 |
| [12] |
CHOI J, RAVIPATI A, NIMMAGADDA V, et al. Potential roles of PINK1 for increased PGC-1α -mediated mitochondrial fatty acid oxidation and their associations with Alzheimer disease and diabetes[J]. Mitochondrion, 2014, 18: 41-48. DOI:10.1016/j.mito.2014.09.005 |
| [13] |
FISHER AB, VASQUEZMEDINA JP, DODIA C, et al. Peroxiredoxin 6 phospholipid hydroperoxidase activity in the repair of peroxidized cell membranes[J]. Redox Biol, 2018, 14: 41-46. DOI:10.1016/j.redox.2017.08.008 |
| [14] |
FISHER AB. Peroxiredoxin 6 in the repair of peroxidized cell membranes and cell signaling[J]. Arch Biochem Biophys, 2017, 617: 68-83. DOI:10.1016/j.abb.2016.12.003 |
 2018, Vol. 47
2018, Vol. 47