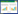文章信息
- 王倩文, 徐振华, 王志静, 苏荣健, 陈学军, 谷艳娇
- WANG Qianwen, XU Zhenhua, WANG Zhijing, SU Rongjian, CHEN Xuejun, GU Yanjiao
- 葡萄糖调节蛋白78对L858R突变的非小细胞肺癌erlotinib敏感性的影响
- Effects of Glucose-regulated Protein 78 on the Sensitivity of Non-small Cell Lung Cancer Cells Harboring the L858R Mutation to Erlotinib
- 中国医科大学学报, 2018, 47(8): 701-704
- Journal of China Medical University, 2018, 47(8): 701-704
-
文章历史
- 收稿日期:2017-12-01
- 网络出版时间:2018-07-12 11:02
2. 锦州医科大学基础医学院细胞生物学教研室, 辽宁 锦州 121001;
3. 锦州医科大学生命科学研究院, 辽宁 锦州 121001
2. Department of Cell Biology, College of Basic Medical Science, Jinzhou Medical University, Jinzhou 121001, China;
3. Institution of Life Science, Jinzhou Medical University, Jinzhou 121001, China
非小细胞肺癌占肺癌发病总数的50%以上,病死率高,严重威胁人们的健康。表皮生长因子受体(epidermal growth factor receptor,EGFR)突变在非小细胞肺癌中发生频率较高,约为20%。第19号外显子缺失(del19)和第21号外显子L858R突变是最为常见的2种突变形式,这2种突变导致EGFR信号通路过度激活,是EGFR抑制物erlotinib治疗的合适人群[1-2]。然而临床研究的结果显示,携带EGFR del19和L858R突变的非小细胞肺癌患者尽管初期对erlotinib治疗非常敏感,但随着治疗的进行,很多患者会发生获得性耐药。
获得性耐药严重制约了表皮生长因子受体抑制物(EGFR-TKI)在临床上的应用,关于获得性耐药的分子机制非常复杂,涉及到基因突变和信号通路异常激活等各个方面,如T790M继发性突变目前被认为是获得性耐药的重要机制。葡萄糖调节蛋白78 (glucose-regulated protein 78,GRP78)在恶性肿瘤细胞中过表达,而在正常细胞中低表达甚至不表达。GRP78由ATPase结构域和多肽结合结构域(protein/peptide-binding domain,PBD) 2个结构域组成[3]。目前的研究[4]显示GRP78过表达可以导致肿瘤细胞对多种化疗药物耐药,但其是否与非小细胞肺癌细胞对erlotinib的获得性耐药有关目前尚未见报道。本研究应用真核表达载体,在EGFR L858R突变的非小细胞肺癌细胞系H3255中过表达GRP78及其ATPase和PBD结构域删除突变体,观察其对erlotinib反应性的影响。
1 材料与方法 1.1 材料EGFR L858R突变的非小细胞肺癌细胞系H3255由北京生命科学研究院陈良研究员惠赠。Flag-GRP78、Flag-GRP78 delATPase及Flag-GRP78 delPBD真核表达载体为本实验室在pcDNA3.1 (+) -GRP78载体的基础上构建(图 1)。Lipofectamine2000购于中国Invitrogen公司。FITC-tunel试剂盒购于中国Biotools公司。anti-Flag、EGFR、p-EGFR、ERK及p-ERK抗体购于德国CST公司。HRP标记的二抗购自中山公司。ECL发光试剂购于上海碧云天生物技术有限公司。

|
| 图 1 GRP78及其结构域删除突变体结构图 Fig.1 Structure of GRP78 and its structural domain deletion mutant |
1.2 方法 1.2.1 细胞培养
H3255细胞培养于含10% FBS和1%青霉素/链霉素的DMEM培养液中,培养条件为37 ℃,5% CO2。每2~3 d更换培养液1次。
1.2.2 细胞转染转染按中国Invitrogen公司的实验指南进行。将细胞接种于6孔细胞培养板中,当细胞密度达到80%时开始转染。于转染前12 h更换培养液,将细胞培养于不含抗生素的完全培养液中。转染体系为500 μL,质粒DNA与转染试剂的比例为1: 4,其中质粒4 μg,Lifectamine2000体积为16 μL,转染后48 h应用免疫印迹技术检测转染效率。
1.2.3 MTT实验MTT实验操作严格按实验指南进行。转染后48 h将细胞重新接种于96孔细胞培养板中,每孔10 000个。12 h后用含有erlotinib的0.5%血清的培养液处理细胞,继续培养48 h,加入MTT试剂继续培养3~4 h后,DMSO溶解沉淀,于490 nm测定吸光度值。
1.2.4 流式细胞术分析于转染后48 h将细胞重新接种于6孔细胞培养板中。12 h后用含有erlotinib的0.5%血清的培养液处理细胞,继续培养48 h,AV/PI染色,流式细胞术分析细胞凋亡情况。
1.2.5 FITC-Tunel分析FITC-Tunel按中国Bio tools公司的操作指南进行。将细胞应用PBS漂洗3次,FITC-Tunel试剂染色30 min,染色时注意避光,荧光显微镜观察结果。
1.2.6 免疫印迹分析将处理后的细胞用RIPA缓冲液(1% NP-40、0.5%脱氧胆酸钠、1% SDS、0.1% PMSF)裂解,BCA法定量,SDS-PAGE电泳,转膜,1% BSA封闭,一抗(1: 1 000稀释) 4 ℃杂交过夜,PBST洗膜后加入HRP标记的二抗室温温育1 h,ECL显色。
1.3 统计学分析应用SPSS 17.0统计软件进行分析,多组间样品的比较采用单因素方差分析,2组样品间的比较采用t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 erlotinib在H3255细胞中诱导GRP78的表达为了探讨GRP78是否与获得性耐药有关,首先应用erlotinib (10 nmol/L)处理H3255细胞,观察其对GRP78表达的影响。免疫印迹实验结果显示,erlotinib处理24 h后GRP78表达明显升高(图 2)。
|
| 图 2 Erlotinib处理在H3255细胞中诱导GRP78的表达 Fig.2 Erlotinib treatment induces expression of GRP78 in H3255 cells |
2.2 过表达GRP78降低erlotinib导致的生长抑制
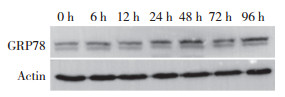
为了探讨GRP78过表达对H3255细胞对erlotinib反应性的影响,在H3255细胞中转染GRP78及其结构域删除突变体,并应用免疫印迹实验对转染效率进行鉴定。结果显示,转染后48 h,GRP78及其结构域突变体在H3255细胞中均高水平表达(图 3A)。MTT实验结果显示,与空载体转染细胞相比,转染Flag-GRP78可以显著增加H3255细胞在erlotinib处理条件下的生存能力,转染Flag-GRP78 delPBD得到的实验结果与转染Flag-GRP78类似(P < 0.05)。而转染Flag-GRP78 delATPase对H3255细胞的生存能力与对照组相比差异无统计学意义(P > 0.05) (图 3B)。
|
| A, immunoblotting for determining the efficiency of transfection of H3255 cells with Flag-GRP78, Flag-GRP78 delATPase, and Flag-GRP78 delPBD; B, effects of transfection with Flag-GRP78, Flag-GRP78 delATPae, and Flag-GRP78 delPBD on the sensitivity of H3255 cells to erlotinib. 图 3 过表达GRP78及其结构域删除突变体对H3255细胞活力的影响 Fig.3 Effects of the overexpression of GRP78 and its structural domain deletion mutant on H3255 cell vitality |
2.3 过表达GRP78抑制erlotinib诱导的细胞凋亡
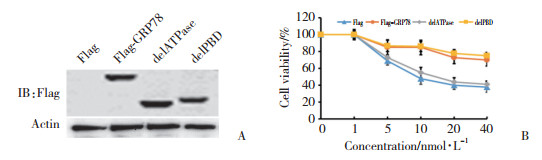
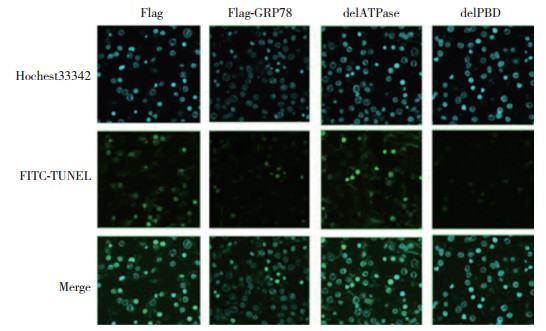
流式细胞术结果显示,与对照组(Flag空载体)相比(图 4A),转染Flag-GRP78 (图 4B)和Flag-GRP78 delPBD (图 4D)可以明显抑制erlotinib诱导的H3255细胞凋亡(P < 0.05),而转染Flag-GRP78 delATPase对erlotinib诱导的细胞凋亡影响不大(图 4C) (P > 0.05)。FITC-Tunel实验结果显示,在erlotinib处理条件下,转染Flag-GRP78可以降低FITC阳性细胞数,转染Flag-GRP78 delPBD得到的实验结果与转染Flag-GRP78类似(P < 0.05),而转染Flag-GRP78 delATPase对erlotinib诱导的细胞凋亡与对照组相比差异无统计学意义(P > 0.05) (图 5)。
|
| A, control cells (Flag); B, Flag-GRP78;C, Flag-GRP78 delATPase; D, Flag-GRP78 delPBD. 图 4 流式细胞术检测过表达GRP78及其突变体对erlotinib诱导的细胞凋亡的影响 Fig.4 Effects of the expression of GRP78 and its mutants on apoptosis induced by erlotinib, as detected by flow cytometry |
|
| 图 5 FITC-tunel检测过表达GRP78及其突变体对erlotinib诱导的细胞凋亡的影响 ×40 Fig.5 FITC-TUNEL to detect the effects of the expression of GRP78 and mutants on erlotinib-induced apoptosis ×40 |
2.4 过表达GRP78促进EGFR的磷酸化
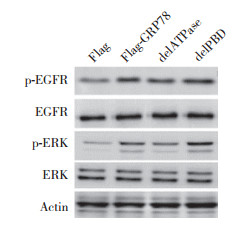
免疫印迹实验结果显示,与对照组相比,转染Flag-GRP78和Flag-GRP78 delPBD均可以促进EGFR的磷酸化,增加p-ERK的表达。而转染Flag-GRP78 delATPase对EGFR和ERK的磷酸化影响差别不明显(图 6)。
|
| 图 6 过表达GRP78及其突变体对EGFR和ERK表达及磷酸化的影响 Fig.6 Effects of the overexpression of GRP78 and its mutants on EGFR and ERK expression and phosphorylation |
3 讨论
EGFR在包括非小细胞肺癌在内的多种肿瘤细胞中存在较高频率的突变及过表达,导致EGFR信号通路的异常激活。针对EGFR的靶向治疗是非小细胞肺癌治疗的有效手段之一,特别是对于EGFR del19突变和EGFR L858R突变的非小细胞肺癌患者。然而获得性耐药极大制约了EGFR-TKI的临床应用,是EGFR靶向治疗效果不佳的重要原因[5-6]。
GRP78是一种多功能蛋白质,属于热休克蛋白70家族。GRP78在肿瘤细胞过表达,对肿瘤细胞的增殖、侵袭和转移等生物学特性具有重要的调节作用。研究[7-8]表明,GRP78在多种肿瘤中可以导致肿瘤细胞对化学药物治疗抵抗,如在肝细胞癌细胞中过表达GRP78可以导致肿瘤细胞对5-氟尿嘧啶等药物获得性耐药的发生。
本研究首先发现erlotinib可以在EGFR L858R突变的非小细胞肺癌细胞H3255中诱导GRP78的表达,这提示GRP78过表达可能与EGFR L858R突变的非小细胞肺癌对erlotinib的耐药性有关。进一步在H3255细胞中过表达GRP78,观察其对erlotinib敏感性的影响,结果发现GRP78可以有效促进细胞存活,抑制erlotinib诱导的细胞凋亡,这提示GRP78过表达可以降低EGFR L858R突变的非小细胞肺癌对erlotinib的反应性。本研究结果还表明,GRP78的ATPase结构域在该过程中发挥重要作用,而PBD结构域对该过程的影响不大,这提示GRP78过表达导致对erlotinib获得性耐药主要是通过其ATPase结构域实现的。本研究还发现,GRP78可以促进EGFR的磷酸化,而删除ATPase结构域后其对EGFR磷酸化的促进作用明显降低,这提示GRP78可以通过其ATPase结构域促进EGFR的磷酸化,导致EGFR L858R突变的非小细胞肺癌对erlotinib耐药。
| [1] |
YANG W, GAO Y, LI X, et al. Postoperative survival of EGFR-TKI-targeted therapy in non-small cell lung cancer patients with EGFR 19 or 21 mutations:a retrospective study[J]. World J Surg Oncol, 2017, 15(1): 197-204. DOI:10.1186/s12957-017-1251-z |
| [2] |
LI T, KUNG HJ, MACK PC, et al. Genotyping and genomic profiling of non-small-cell lung cancer:implications for current and future therapies[J]. J Clin Oncol, 2013, 31(8): 1039-1049. DOI:10.1200/JCO.2012.45.3753 |
| [3] |
LEE AS. Glucose-regulated proteins in cancer:molecular mechanisms and therapeutic potential[J]. Nat Rev Cancer, 2014, 14(4): 263-726. DOI:10.1038/nrc3701 |
| [4] |
NI M, ZHANG Y, LEE AS. Beyond the endoplasmic reticulum:atypical GRP78 in cell viability, signalling and therapeutic targeting[J]. Biochem J, 2011, 434(2): 181-188. DOI:10.1042/BJ20101569 |
| [5] |
LEE CK, DAVIES L, WU YL, et al. Gefitinib or erlotinib vs chemotherapy for egfr mutation-positive lung cancer:individual patient data meta-analysis of overall survival[J]. J Natl Cancer Inst, 2017, 109(6): djw279. DOI:10.1093/jnci/djw279 |
| [6] |
CATALDO VD, GIBBONS DL, PEREZ-SOLER R, et al. Treatment of non-small-cell lung cancer with erlotinib or gefitinib[J]. N Engl J Med, 2011, 364(10): 947-955. DOI:10.1056/NEJMct0807960 |
| [7] |
GIFFORD JB, HUANG W, ZELENIAK AE, et al. Expression of GRP78, master regulator of the unfolded protein response, increases chemoresistance in pancreatic ductal adenocarcinoma[J]. Mol Cancer Ther, 2016, 15(5): 1043-1052. DOI:10.1158/1535-7163.MCT-15-0774 |
| [8] |
GU YJ, LI HD, ZHAO L, et al. GRP78 confers the resistance to 5-FU by activating the c-Src/LSF/TS axis in hepatocellular carcinoma[J]. Oncotarget, 2015, 6(32): 33658-33674. DOI:10.18632/oncotarget.5603 |
 2018, Vol. 47
2018, Vol. 47