文章信息
- 赵崇如, 郭澍, 吕梦竹, 陈欣, 王婷, 朱梦茹
- ZHAO Chongru, GUO Shu, LÜ Mengzhu, CHEN Xin, WANG Ting, ZHU Mengru
- 锶对脂肪干细胞成骨分化中血管内皮生长因子及Notch1信号通路相关蛋白表达的影响
- Effects of Strontium on the Expression of VEGF and Notch1 Signaling Pathway in Osteogenic Differentiation of Adipose-derived Stem Cells
- 中国医科大学学报, 2018, 47(8): 696-700
- Journal of China Medical University, 2018, 47(8): 696-700
-
文章历史
- 收稿日期:2018-01-05
- 网络出版时间:2018-07-12 13:33
创伤、感染等原因导致的不能自愈的骨缺损是临床医生面临的一大难题。组织工程技术的发展为修复骨缺损提供了有效的解决策略[1]。然而,组织工程骨移植后的血管生成缓慢,很难达到大块移植物的高度血管化,诱导骨缺损修复过程的血管生成仍然是临床上所面临的一大挑战。
锶(strontium,Sr)是人体内重要的微量元素之一[2],不仅可以促进干细胞成骨,还可以刺激血管内皮生长因子(vascular endothelial growth factor,VEGF)表达,进而促进成骨过程中的血管生成[3],为实现骨组织工程血管化提供新方法。Notch信号通路在血管生成过程中起着重要的调控作用。研究[4]发现,不同于其在其他器官及肿瘤细胞血管生成过程中的负向调节作用,Notch信号通路可以促进长骨内皮细胞增殖以及血管生成。
目前对于Sr促组织工程骨血管化的研究,主要集中于证明Sr可上调种子细胞释放血管生成因子进而促进血管生成,而缺乏这一过程相关机制的研究。本研究应用Sr对健康女性的脂肪干细胞(adipose-derived stem cells,ADSCs)进行干预,运用DAPT阻断Notch1信号通路,探究在Sr上调成骨分化ADSCs表达VEGF的过程中是否有Notch1信号通路参与,为构建血管化组织工程骨奠定基础。
1 材料与方法 1.1 材料皮下脂肪组织来源于中国医科大学附属第一医院整形外科行吸脂术的28岁健康女性患者(无内分泌及免疫系统疾病病史、无家族遗传病及其他传染病病史,手术近期未服用激素类药物)。本研究已获得患者知情同意及中国医科大学附属第一医院伦理委员会的许可。Ⅰ型胶原酶、胎牛血清、成脂诱导培养基(美国Gibco公司);DMEM/F12 (1: 1)、青-链霉素、PBS (美国Hyclone公司);成骨诱导培养基(中国广州赛业生物技术有限公司);氯化锶(中国上海国药集团化学试剂有限公司);DAPT (美国Selleck公司);BCA蛋白定量试剂盒、SDS-PAGE凝胶配制试剂盒(中国碧云天生物技术公司);抗VEGF抗体、抗NICD抗体(美国Abcam公司)。
1.2 方法 1.2.1 ADSCs的体外提取及培养采用I型胶原酶对脂肪组织进行消化[5],简要步骤为取双侧大腿皮下吸出的约150 mL脂肪组织以无菌NaCl溶液反复洗涤,同时清除大部分血细胞,可见血管及大块纤维组织,剪碎清洗后的脂肪组织形成1 mm3组织块,加入终浓度为0.1%Ⅰ型胶原酶,并在37 ℃水浴条件下震荡消化45 min。等量加入已配好的含10%FBS的DMEM/F12中和停止消化,1 200 r/min、25 ℃下离心5 min。弃去油脂、脂肪组织及上清,加入含10%FBS的DMEM/F12重悬细胞后,1 200 r/min、25℃离心5 min弃上清,反复2遍以洗去残留的红细胞及油脂。加入含15%FBS和1%青-链霉素的DMEM/F12基础培养基重悬细胞,接种于75 cm2培养瓶内。置于37 ℃,5%CO2孵箱内培养,72 h后更换基础培养基去除未贴壁血细胞,每3 d换1次液,至ADSCs融合约80%时用含EDTA胰酶消化传代,至P3备用。
1.2.2 ADSCs成脂向分化诱导及鉴定取细胞融合度达80%的第3代ADSCs,以2×104/cm2的细胞密度接种于6孔板中,改用成脂诱导培养基进行培养,每3 d换1次液,诱导14 d进行油红O染色;PBS冲洗后加入多聚甲醛固定15 min,再用PBS冲洗1次,加入2%油红O染液,室温下染色30 min,PBS冲洗1次,倒置相差显微镜下观察染色情况。
1.2.3 ADSCs成骨向分化诱导及鉴定取细胞融合度达80%的第3代ADSCs,以2×104/cm2的细胞密度接种于6孔板中,改用成骨诱导培养基进行培养,每3 d换1次液,诱导20 d后进行茜素红染色;PBS冲洗后加入多聚甲醛固定15 min,再用PBS冲洗1次,加入1%茜素红染液,室温下染色5 min,PBS冲洗1次,倒置相差显微镜下观察钙化结节行成情况。
1.2.4 分组处理研究[6]表明,ADSCs在Sr浓度为100 μmol/L的条件下诱导6 d时的成骨效应最显著。DAPT在终浓度为10 μmol/L,持续诱导条件下抑制Notch1信号通路作用较强[7]。本研究实验组分别给予氯化锶(终浓度为100 μmol/L)、DAPT (终浓度为10 μmol/L),同时设空白立对照组。具体分组如下:(1)空白对照组,成骨诱导液;(2) Sr组,成骨诱导液+100 μmol/L氯化锶;(3) Sr+DAPT组,成骨诱导液+100 μmol/L氯化锶+10 μmol/L DAPT;(4) DAPT组,成骨诱导液+10 μmol/L DAPT。
1.2.5 Western blotting检测Notch1信号通路因子(Notch 1 intracellular domain,NICD)及VEGF蛋白表达水平P3代的ADSCs在含10%FBS的DMEM/F12基础培养基中培养融合至80%左右时,将培养基更换为成骨诱导培养基进行成骨分化诱导。培养6 d后,上述各组细胞加入细胞裂解液,采用BCA试剂盒法进行蛋白定量,100 ℃金属浴10 min使蛋白变性,取各组蛋白样品各20 μg等质量上样,10%SDS-PAGE电泳,转膜至PVDF膜,5%脱脂奶粉室温下封闭2 h后,抗NICD抗体(1: 500稀释),抗VEGF抗体(1: 1 000稀释),β-actin (1: 1 000稀释)室温摇床孵育90 min,4 ℃过夜。加入辣根过氧化酶标记抗体(1: 20 000稀释,二抗),室温摇床孵育1 h。将PVDF膜均匀浸入ECL发光液中,置入凝胶成像系统中进行曝光。
1.3 统计学分析Western blotting条带结果用Image-J图像分析软件进行灰度扫描后,以β-actin为内参进行半定量分析。各组结果数据均以x±s表示。采用GraphPad Prism 5.0及SPSS 24.0统计软件对组间差异进行独立样本t检验分析,P < 0.05为差异有统计学意义。
2 结果 2.1 ADSCs形态学观察原代ADSCs分离提取接种后24 h,于倒置相差显微镜下可见大多数ADSCs已贴壁,形态呈圆形。48 h观察可见ADSCs基本贴壁,形态逐渐变成短梭形或多角形,72 h观察可见ADSCs分裂增殖呈长梭形并成簇生长,7 d时观察可见ADSCs长满培养瓶底部,呈集落样生长,方向性明显(图 1A)。待细胞融合至80%~90%,进行传代培养,传代后的ADSCs分裂增殖速度加快,可在5 d时融合至80%,生长状态良好,细胞形态均一,呈明显方向性(图 1B)。

|
| A, P0 ADSCs (7 d); B, P3 ADSCs. 图 1 ADSCs形态学观察 Fig.1 Morphological observation of ADSCs |
2.2 ADSCs鉴定
ADSCs成脂化诱导后,细胞体积逐渐变大,胞体逐渐变圆,胞质内出现明显的脂滴并逐渐增多,14 d油红O染色倒置相差显微镜下观察结果显示,所培养细胞胞浆内脂滴被染成红色(图 2A),证明ADSCs具有成脂向分化潜能。ADSCs成骨化诱导后,细胞体积逐渐增大,胞体由长梭形变成椭圆形和多角形,细胞外基质内出现钙结晶,20 d茜素红染色倒置显微镜下观察结果显示,细胞外基质内钙结节被染成红色(图 2B),证明ADSCs具有成骨向分化潜能。

|
| A, oil red O staining (14 d); B, alizarin red staining (20 d). 图 2 ADSCs鉴定 Fig.2 Identification of ADSCs |
2.3 Western blotting检测NICD及VEGF蛋白表达结果
与空白对照组的NICD (0.671 5±0.050 5)和VEGF (0.688 9±0.039 4)相比,Sr组的NICD (1.187 7±0.089 2)和VEGF (1.320 0±0.075 5)蛋白表达水平显著提高(P < 0.01,P < 0.001),DAPT组的NICD (0.348 3±0.026 2)和VEGF (0.465 6±0.026 6)蛋白表达显著降低,差异有统计学意义(P < 0.01);与Sr组相比,Sr+DAPT组的NICD (0.386 7±0.029 1)和VEGF (1.057 5±0.060 5)蛋白表达显著降低,差异有统计学意义(P < 0.001,P < 0.01),见图 3。
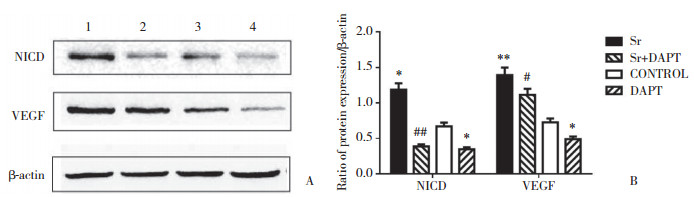
|
| A, results of western blotting; B, relative protein expression of NICD and VEGF. * P < 0.01, **P < 0.001 vs control group; #P < 0.01, ##P < 0.001 vs Sr group. 1, Sr group; 2, Sr+DAPT group; 3, control group; 4, DAPT group. 图 3 Western blotting检测NICD及VEGF蛋白表达水平 Fig.3 Detection of protein expressions by Western blotting analysis of NICD and VEGF in osteogenically induced ADSCs |
3 讨论
近数十年,作为间充质干细胞的丰富来源,ADSCs已成为再生组织工程技术的研究热点。与其他种类的间充质干细胞相比,ADSCs因其来源广,取材易,增殖能力强等优点具有潜在的优势[8]。目前存在多种提高ADSCs多向分化潜能的方法,其中Sr已被证实具有促进ADSCs增殖和增强其成骨分化能力的作用。此外,Sr还可以通过上调VEGF的表达促进成骨过程的血管生成[3]。在本研究中,相对于空白对照组而言,Sr组VEGF表达上调,再次证实了Sr上调ADSCs成骨分化过程中VEGF表达的作用。
VEGF是调控血管发生及形成的最重要的生长因子之一,参与血管新生及内皮细胞增殖过程,其在骨的发生发展过程中也起着重要的作用[9]。有研究[10]表明,成骨细胞分化过程中释放的VEGF可促进血管生成。KIM等[11]发现在褐藻糖胶成骨分化诱导下,间充质干细胞的VEGF分泌增加,作用于内皮细胞产生成血管作用并可加快骨缺损修复。因此,调节骨组织中的VEGF水平为修复骨愈合不良和促进骨再生提供了潜在的治疗策略。目前,大多数研究的内容主要是关于VEGF局部表达水平变化对于骨缺损修复结果的影响,对于其作用机制的详细研究较少。本研究发现在Sr上调成骨诱导的ADSCs表达VEGF的过程中,NICD表达明显提升。由此推测,Notch1信号通路参与了Sr促成骨诱导ADSCs表达VEGF这一过程。
Notch信号通路在调节胚胎及成体器官细胞增殖分化及决定细胞命运过程中起到了重要作用[12]。RAMASAMY等[4]的研究证实,Notch信号通路可正向调控骨组织内的血管生成,这一作用与DLL4/Notch信通路所介导的抑制其他器官内皮细胞增殖作用明显相反。本研究为证实Notch1信号通路参与了Sr上调成骨诱导ADSCs表达VEGF这一推测,采用DAPT干预成骨诱导的ADSCs,发现NICD显著下降,证明DAPT发挥了其阻断Notch1信通路的作用。同时,与对照组相比DAPT干预组的VEGF表达量显著降低,与LIAO等[13]的研究结论相一致,提示干细胞成骨分化过程中VEGF的表达受Notch1信号通路调控。采用氯化锶干预后,VEGF表达显著上调的同时NICD表达显著增加;为排除其他信号通路的干扰作用,采用氯化锶和DAPT共同干预成骨诱导的ADSCs,发现VEGF及NICD表达较Sr组均显著下降,进一步证实Notch1信号通路作用有效。以上结果说明ADSCs成骨过程中VEGF表达受Notch1信号通路调控,Sr可通过调控Notch1信号通路的传导作用,上调成骨分化的ADSCs表达VEGF。
综上所述,本研究证实了Sr能上调ADSCs成骨过程中表达VEGF。在Sr促ADSCs成骨分化过程中,Notch1信号通路被激活,并对VEGF的表达起正向调控作用。为Sr促ADSCs修复骨缺损过程中血管形成机制的进一步研究鉴定了基础。
| [1] |
ALMUBARAK S, NETHERCOTT H, FREEBERG M, et al. Tissue engineering strategies for promoting vascularized bone regeneration[J]. Bone, 2016, 83: 197-209. DOI:10.1016/j.bone.2015.11.011 |
| [2] |
PILMANE M, SALMA-ANCANE K, LOCA D, et al. Strontium and strontium ranelate:historical review of some of their functions[J]. Mater Sci Eng C Mater Biol Appl, 2017, 78: 1222-1230. DOI:10.1016/j.msec.2017.05.042 |
| [3] |
WANG G, ROOHANI-ESFAHANI SI, ZHANG W, et al. Effects of SrHT-gahnite on osteogenesis and angiogenesis by adipose derived stem cells for critical-sized calvarial defect repair[J]. Sci Rep, 2017, 7: 41135. DOI:10.1038/srep41135 |
| [4] |
RAMASAMY SK, KUSUMBE AP, WANG L, et al. Endothelial Notch activity promotes angiogenesis and osteogenesis in bone[J]. Nature, 2014, 507(7492): 376-380. DOI:10.1038/nature13146 |
| [5] |
WANG T, GUO S, LIU X, et al. Protective effects of adipose-derived stem cells secretome on human dermal fibroblasts from ageing damages[J]. Int J Clin Exp Pathol, 2015, 8(12): 15739-15748. |
| [6] |
NARDONE V, ZONEFRATI R, MAVILIA C, et al. In vitro effects of strontium on proliferation and osteoinduction of human preadipocytes[J]. Stem Cells Int, 2015, 2015: 871863. DOI:10.1155/2015/871863 |
| [7] |
KOC A, FINKENZELLER G, ELCIN AE, et al. Evaluation of adenoviral vascular endothelial growth factor-activated chitosan/hydroxyapatite scaffold for engineering vascularized bone tissue using human osteoblasts:in vitro and in vivo studies[J]. J Biomater Appl, 2014, 29(5): 748-760. DOI:10.1177/0885328214544769 |
| [8] |
XIE Q, WEI W, RUAN J, et al. Effects of miR-146a on the osteogenesis of adipose-derived mesenchymal stem cells and bone regeneration[J]. Sci Rep, 2017, 7: 42840. DOI:10.1038/srep42840 |
| [9] |
HU K, OLSEN B R. Vascular endothelial growth factor control mechanisms in skeletal growth and repair[J]. Dev Dyn, 2017, 246(4): 227-234. DOI:10.1002/dvdy.24463 |
| [10] |
HU K, OLSEN BR. Osteoblast-derived VEGF regulates osteoblast differentiation and bone formation during bone repair[J]. J Clin Invest, 2016, 126(2): 509-526. DOI:10.1172/JCI82585 |
| [11] |
KIM BS, YANG SS, YOU HK, et al. Fucoidan-induced osteogenic differentiation promotes angiogenesis by inducing vascular endothelial growth factor secretion and accelerates bone repair[J]. J Tissue Eng Regen Med, 2018, 12(3): e1311-e1324. DOI:10.1002/term.2509 |
| [12] |
SIEBEL C, LENDAHL U. Notch signaling in development, tissue homeostasis, and disease[J]. Physiol Rev, 2017, 97(4): 1235-1294. DOI:10.1152/physrev.00005.2017 |
| [13] |
LIAO J, WEI Q, ZOU Y, et al. Notch signaling augments BMP9-induced bone formation by promoting the osteogenesis-angiogenesis coupling process in mesenchymal stem cells(MSCs)[J]. Cell Physiol Biochem, 2017, 41(5): 1905-1923. DOI:10.1159/000471945 |
 2018, Vol. 47
2018, Vol. 47