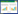文章信息
- 张怡, 林冰, 陈剑锋
- ZHANG Yi, LIN Bing, CHEN Jianfeng
- 人脐带干细胞治疗重度烧伤大鼠急性肝损伤的实验研究
- Effects of Human Umbilical Cord Stem Cells on Alleviating Acute Hepatic Injury in Severely Burned Rats
- 中国医科大学学报, 2018, 47(8): 687-691
- Journal of China Medical University, 2018, 47(8): 687-691
-
文章历史
- 收稿日期:2017-06-19
- 网络出版时间:2018-07-12 13:33
2. 大连医科大学附属第一医院口腔科, 辽宁 大连 116011
2. Department of Prosthodontics, The First Affiliated Hospital of Dalian Medical University, Dalian 116011, China
据文献[1-2]报道,大面积重度烧伤患者在伤后数小时即出现了黄疸、转氨酶升高等肝损害表现,严重者还可诱发急性肝功能衰竭、甚至是多器官功能衰竭,影响烧伤患者的存活和预后。因此,在大面积重度烧伤后早期积极救治患者的同时,注意保护肝功能也是非常关键的。近年来,有关人脐带干细胞移植治疗肝损伤以及严重性肝脏疾病的研究[3-5]已经大量涌现。王福生团队的系列研究[6-7]显示,人脐带干细胞的输注可有效逆转小鼠爆发性的肝功能衰竭并显著改善终末期肝病患者的肝功能,且证实该干细胞的临床应用安全有效,可作为乙型肝炎病毒相关失代偿肝硬化患者新型的治疗方案。此外,XUE等[8]通过体内外的研究证实,人脐带干细胞在进行肝损伤的微环境中,可通过分化为肝细胞而修复重建损伤的肝细胞样细胞。但多数新近的研究[9-10]认为,移植的干细胞在急性损伤的修复过程中,是通过旁分泌多种细胞因子和生长因子调控局部组织微环境,从而发挥修复损伤组织器官的功能。因此,本研究拟在这些前期研究的基础上,继续深入研究人脐带干细胞的移植对大面积重度烧伤大鼠早期急性肝损伤的治疗作用及相关机制。
1 材料与方法 1.1 材料 1.1.1 实验动物健康清洁级雄性SD大鼠30只,体质量(200±15) g,由大连医科大学实验动物中心提供,动物购进后在大连医科大学附属第一医院动物实验室适应性饲养1周以上,室温维持在22~25 ℃。
1.1.2 仪器与试剂电热恒温水浴锅(中国金坛市城西春兰实验仪器厂),戊巴比妥钠(美国Sigma公司),乳酸钠林格氏液(石家庄四药有限公司),碘伏消毒液(北京四环卫生药械厂),75 %医用乙醇(北京市远弘药用酒精厂);人脐带干细胞和培养基(美国Sciencell公司),胎牛血清、胰蛋白酶-乙二胺四乙酸、青霉素-链霉素双抗(中国碧云天生物科技研究所);小鼠抗人的CD105抗体的单克隆抗体(美国LSBio公司),TUNEL细胞凋亡检测试剂盒(瑞士ROCHE公司),促炎症细胞因子肿瘤坏死因子α (tumor necrosis factor α,TNF-α)、白介素1β (interleukin 1β,IL-1β)和白介素6 (interleukin 6,IL-6)的ELISA检测试剂盒(美国eBioscience公司),CO2培养箱(美国Thermo公司),倒置荧光显微镜(德国Leica公司),血生化自动分析仪(美国Beckman公司)。
1.2 方法 1.2.1 人脐带干细胞的准备将前期购置且冻存的人脐带干细胞进行复苏培养,使用第4~5代的人脐带干细胞进行本实验。
1.2.2 模型的制备及实验分组将适应性饲养的大鼠随机分为假伤组、烧伤组和干细胞组。实验致伤前12 h大鼠禁食水,1%戊巴比妥钠(40 mg/kg)腹腔内注射麻醉,背、颈、头部电推剃毛后,使用脱毛剂进行脱毛,98 ℃处理,10 s造成大鼠头、颈、背部35%总体表面积(total body surface area,TBSA) Ⅲ度烫伤(经病理切片证实,以下均称烧伤)。假伤组大鼠则使用37 ℃处理10 s。伤后3组大鼠均行腹腔注射乳酸钠林格氏液(40 mg/kg)抗休克治疗。烫伤部位使用1 %碘伏处理,2次/d,保持创面干燥,防止感染。此外,伤后干细胞组即刻给予干细胞5×106/mL PBS经大鼠尾静脉移植;烧伤组和假伤组则经尾静脉移植注射1 mL PBS。
1.2.3 标本采集于干细胞移植后24 h,采用1 %戊巴比妥钠(40 mg/kg)腹腔内注射麻醉各组大鼠,抽取腹主动脉血液10 mL,室温静置15 min后,3 000 r/min离心20 min,收集血清行肝功能指标的检测分析。采血后,收集各组大鼠的肝组织,4%多聚甲醛固定,待检测。
1.2.4 指标检测 1.2.4.1 免疫组织化学染色检测人脐带干细胞在肝组织中的分布情况4%多聚甲醛固定肾组织1周后,制备组织切片。按照组织化学染色步骤进行染色,各组切片分别滴加100 µL小鼠抗人CD105的单克隆抗体,4 ℃孵育过夜,DAB显色和苏木素复染封片。使用正置显微镜观察并拍照记录CD105+表达的细胞,即人脐带干细胞(CD105是人脐带干细胞重要的表面标志物)在肝组织中的分布情况。
1.2.4.2 ELISA法检测肝组织中TNF-α、IL-1β和IL-6水平将采集的各组大鼠肝组织标本,在4 ℃下进行组织匀浆,按照ELISA试剂盒的说明测定匀浆上清中TNF-α、IL-1β和IL-6的水平。
1.2.4.3 TUNEL染色检测肝细胞的凋亡情况方法同1.2.4.1制备和染色切片,但各组切片按照TUNEL试剂盒的染色步骤进行染色,中性树胶封片。使用正置显微镜观察并拍照记录各组肝细胞的凋亡情况。
1.2.4.4 HE染色检测肾组织的病理学变化方法同1.2.4.1制备切片,但各组切片按照HE的染色步骤进行染色,中性树胶封片。使用正置显微镜观察并拍照记录各组肝组织的病理学改变情况。
1.2.4.5 血生化自动分析仪检测肾功能学指标使用血生化自动分析仪进行检测分析各组大鼠血清标本,各组大鼠谷丙转氨酶(alanine transaminase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)以及乳酸脱氢酶(lactate dehydrogenase,LHD)的水平。
1.3 统计学分析采用SPSS 18.0统计软件对数据进行单因素方差分析。所有数据均为计量数据,以x±s表示,两两比较采用LSD-t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 人脐带干细胞在大面积重度烧伤大鼠肝脏组织中的分布情况免疫组织化学染色的结果显示,假伤组和烧伤组大鼠的肝脏组织中未见到CD105阳性染色的细胞(也即人脐带干细胞),但干细胞组中则有较多人脐带干细胞分布在肝脏组织中,且集中分布在肝组织的小血管内,见图 1。
|
| A, sham group; B, burn group; C, stem cells group. 图 1 3组大鼠肝脏组织中人脐带干细胞的分布情况 ×400 Fig.1 The distribution patterns of human umbilical cord stem cells in hepatic tissue from the three groups of rats ×400 |
2.2 人脐带干细胞对大面积重度烧伤大鼠肝脏组织促炎症细胞因子的影响
烧伤组中TNF-α、IL-1β和IL-6的水平均较假伤组显著升高,但干细胞组中这些促炎因子的水平则较烧伤组显著下降,仍高于假伤组,差异有统计学意义(P < 0.05),见表 1。
| Group | TNF-α(pg/mL) | IL-1β(pg/mL) | IL-6(pg/mL) |
| Sham | 993.17±64.92 | 218.19±73.92 | 711.51±89.91 |
| Burn | 4 813.24±371.991) | 1 053.49±45.591) | 3 461.26±248.221) |
| Stem cells | 2 596.53±232.081),2) | 699.15±65.591),2) | 2 415.24±309.131),2) |
| Compared with sham group,1) P < 0.05;compared with burn group,2) P < 0.05. | |||
2.3 人脐带干细胞对大面积重度烧伤大鼠肝细胞凋亡的影响
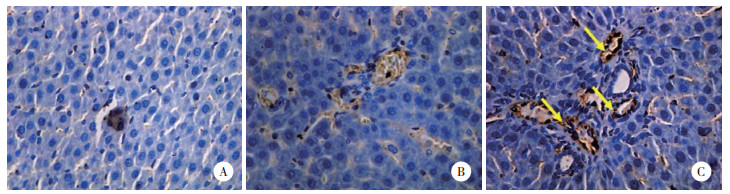
TUNEL染色的结果显示,假伤组仅有少量阳性染色的凋亡细胞,烧伤组中凋亡细胞的数量显著高于假伤组,而干细胞组中凋亡细胞的数量则显著低于烧伤组,见图 2。
|
| A, sham group; B, burn group; C, stem cells group. 图 2 3组大鼠肝细胞的凋亡情况 ×400 Fig.2 The apoptosis of the liver cells in the three groups of rats ×400 |
2.4 人脐带干细胞对大面积重度烧伤大鼠肝脏组织病理学改变的影响
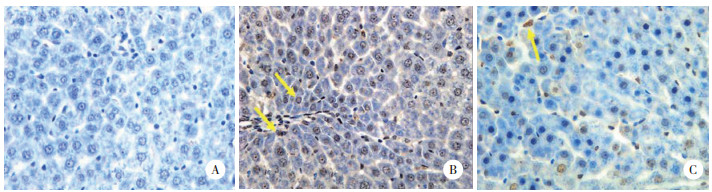
HE染色检测3组大鼠肝组织的病理学改变,假伤组肝细胞呈正常结构,肝索排列整齐,肝窦无狭窄。但烧伤组肝小叶结构不清,肝索排列紊乱,肝细胞浊肿、胞质疏松、脂肪变性,部分肝板结构及血窦消失,散在淋巴细胞浸润,偶见小灶性聚集。而干细胞组大鼠肝组织的病理学改变则较烧伤组显著减轻。见图 3。
|
| A, sham group; B, burn group; C, stem cells group. 图 3 3组大鼠的肝组织的病理学变化 ×400 Fig.3 The pathologic changes in the liver tissue in the three groups of rats ×400 |
2.5 人脐带干细胞对大面积重度烧伤大鼠肝功能的影响
与假伤组相比,烧伤组中AST、ALT以及LDH水平显著升高,而干细胞中这些指标的水平则较烧伤组显著下降,但仍高于假伤组,差异有统计学意义(P < 0.05),见表 2。
| Group | AST (U/L) | ALT (U/L) | LDH (U/L) |
| Sham | 115.26±28.36 | 51.22±8.84 | 1 009.63±150.42 |
| Burn | 527.19±29.371) | 172.43±23.901) | 2 253.14±142.351) |
| Stem cells | 299.31±15.581),2) | 89.31±15.251),2) | 1 628.29±25.01),2) |
| 1) compared with sham group,P < 0.05;2) compared with burn group,P < 0.05. | |||
3 讨论
如前所述,大面积重度烧伤后早期即可出现严重的肝损伤并呈进行性加重,因此对这类重度烧伤患者早期积极救治的同时进行肝组织结构和功能的保护是十分有意义的。大量的文献[11-13]显示,干细胞可通过多重机制对肝脏损伤以及肝纤维化等肝脏疾病进行有效的修复和治疗,但相关的机制仍不十分明确。本研究结果显示,人脐带干细胞迁移定植于肝组织,可以有效降低局部组织促炎因子水平和肝细胞凋亡数量,改善和保护肝组织的结构和功能,从而为干细胞移植治疗急性肝损伤患者提供理论依据。
本研究结果显示,大面积重度烧伤大鼠受损肝脏组织局部的TNF-α、IL-1β和IL-6等主要的促炎症细胞因子水平均显著增高,由于这些促炎症细胞因子具有广泛的生物学效应,因此在介导大面积重度烧伤后急性肝损伤的发生发展中具有重要作用;而移植的人脐带干细胞迁移定植于受损的肝组织后,可通过显著降低肝脏组织的促炎症细胞因子水平发挥显著减轻肝细胞凋亡的作用。在干细胞发挥修复治疗损伤和疾病的过程中,有关干细胞迁移归巢的机制,GIORDANO等[14]和KHATUN等[15]的研究均认为与损伤组织局部上调表达的一些细胞因子/趋化因子,如单核细胞趋化蛋白1和巨噬细胞炎性蛋白1等密切相关,干细胞被诱导趋化入局部的损伤组织,发挥了有效保护、修复和治疗的作用。而有关干细胞通过减轻炎症发挥抑制细胞凋亡的机制,一些研究[16-17]则认为,干细胞是通过强大的旁分泌机制调节了重要脏器组织中炎症细胞的活性、抑制促炎症细胞因子的合成释放、增加抗炎症细胞因子的含量等,改善和调控局部组织的炎症微环境,进而减轻局部组织细胞结构和功能的损伤。
此外,本研究结果显示,大面积重度烧伤后早期肝脏组织结构的病理变化也是加重肝功能障碍的原因之一,而人脐带干细胞的移植可显著减轻此重度烧伤诱导肝组织的病理学改变,进而保护和治疗肝功能。这与JIN等[18]的研究结果比较相似,即将骨髓干细胞移植入化学性肝损伤小鼠的体内,显著减轻了肝组织的病理学改变,进而显著改善了损伤的肝功能,提高了小鼠的存活率。
| [1] |
BORTOLIN JA, QUINTANA HT, TOM TDE C, et al. Burn injury induces histopathological changes and cell proliferation in liver of rats[J]. World J Hepatol, 2016, 8(6): 322-330. DOI:10.4254/wjh.v8.i6.322 |
| [2] |
LIU LY, LI X, YANG J, et al. Comparison of systemic inflammation response and vital organ damage induced by severe burns in different area[J]. Int J Clin Exp Pathol, 2015, 8(6): 6367-6376. |
| [3] |
XUAN J, FENG W, AN ZT, et al. Anti-TGFβ-1 receptor inhibitor mediates the efficacy of the human umbilical cord mesenchymal stem cells against liver fibrosis through TGFβ-1/Smad pathway[J]. Mol Cell Biochem, 2017, 429(1/2): 113-122. |
| [4] |
CUI H, LIU Z, WANG L, et al. Icariin-treated human umbilical cord mesenchymal stem cells decrease chronic liver injury in mice[J]. Cytotechnology, 2017, 69(1): 19-29. DOI:10.1007/s10616-016-0034-7 |
| [5] |
HUANG S, FU X. Stem cell therapies and regenerative medicine in China[J]. Sci China Life Sci, 2014, 57(2): 157-161. DOI:10.1007/s11427-014-4608-3 |
| [6] |
SHI M, ZHANG Z, XU R, et al. Human mesenchymal stem cell transfusion is safe and improves liver function in acute-on-chronic liver failure patients[J]. Stem Cells Transl Med, 2012, 1(10): 725-731. DOI:10.5966/sctm.2012-0034 |
| [7] |
于双杰, 陈黎明, 吕飒, 等. 人脐带间充质干细胞治疗失代偿性乙型肝炎肝硬化的安全性与疗效[J]. 中华肝脏病杂志, 2016, 24(1): 51-55. |
| [8] |
XUE G, HAN X, MA X, et al. Effect of microenvironment on differentiation of human umbilical cord mesenchymal stem cells into hepatocytes in vitro and in vivo[J]. Biomed Res Int, 2016, 2016: 8916534. DOI:10.1155/2016/8916534 |
| [9] |
GAMA KB, SANTOS DS, EVANGELISTA AF, et al. Conditioned medium of bone marrow-derived mesenchymal stromal cells as a therapeutic approach to neuropathic pain:a preclinical evaluation[J]. Stem Cells Int, 2018, 2018: 8179013. DOI:10.1155/2018/8179013 |
| [10] |
ZHU H, XIONG Y, XIA Y, et al. Therapeutic effects of human umbilical cord-derived mesenchymal stem cells in acute lung injury mice[J]. Sci Rep, 2017, 7(4): 39889. DOI:10.1038/srep39889 |
| [11] |
CHEN Y, CHEN S, LIU LY, et al. Mesenchymal stem cells ameliorate experimental autoimmune hepatitis by activation of the programmed death 1 pathway[J]. Immunol Lett, 2014, 162(2 Pt B): 222-228. DOI:10.1016/j.imlet.2014.10.021 |
| [12] |
XUAN J, FENG W, AN ZT, et al. Anti-TGFβ-1 receptor inhibitor mediates the efficacy of the human umbilical cord mesenchymal stem cells against liver fibrosis through TGFβ-1/Smad pathway[J]. Mol Cell Biochem, 2017, 429(1/2): 113-122. DOI:10.1007/s11010-017-2940-1 |
| [13] |
RYU KH, KIM SY, KIM YR, et al. Tonsil-derived mesenchymal stem cells alleviate concanavalin A-induced acute liver injury[J]. Exp Cell Res, 2014, 326(1): 143-154. DOI:10.1016/j.yexcr.2014.06.007 |
| [14] |
GIORDANO S, ZHAO X, CHEN YF, et al. Induced pluripotent stem cell-derived endothelial cells overexpressing interleukin-8 receptors A/B and/or C-C chemokine receptors 2/5 inhibit vascular injury response[J]. Stem Cells Transl Med, 2017, 6(4): 1168-1177. DOI:10.1002/sctm.16-0316 |
| [15] |
KHAUN M, SORJAMAA A, KANGASNIEMI M, et al. Niche matters:the comparison between bone marrow stem cells and endometrial stem cells and stromal fibroblasts reveal distinct migration and cytokine profiles in response to inflammatory stimulus[J]. PLoS One, 2017, 12(4): e0175986. DOI:10.1371/journal.pone.0175986 |
| [16] |
ZHANG ZH, ZHU W, REN HZ, et al. Mesenchymal stem cells increase expression of heme oxygenase-1 leading to anti-inflammatory activity in treatment of acute liver failure[J]. Stem Cell Res Ther, 2017, 8(1): 70. DOI:10.1186/s13287-017-0524-3 |
| [17] |
PAPANIKOLAOU IG, KATSELIS C, APOSTOLOU K, et al. Mesenchymal stem cells transplantation following partial hepatectomy:a new concept to promote liver regeneration-systematic review of the literature focused on experimental studies in rodent models[J]. Stem Cells Int, 2017, 2017: 7567958. DOI:10.1155/2017/7567958 |
| [18] |
JIN SZ, LIU BR, XU J, et al. Ex vivo-expanded bone marrow stem cells home to the liver and ameliorate functional recovery in a mouse model of acute hepatic injury[J]. Hepatobiliary Pancreat Dis Int, 2012, 11(1): 66-73. DOI:10.1016/S1499-3872(11)60127-6 |
 2018, Vol. 47
2018, Vol. 47