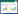文章信息
- 彭华童, 吴文艺, 张丽婷, 林建清, 余艺煌, 吴春林, 黄种心, 邱建龙
- PENG Huatong, WU Wenyi, ZHANG Liting, LIN Jianqing, YU Yihuang, WU Chunlin, HUANG Zhongxin, QIU Jianlong
- SIRT1沉默对人甲状腺乳头状癌细胞株TPC-1生物学功能的影响
- Effect of Silencing SIRT1 on the Biological Behavior of the Human Thyroid Papillary Carcinoma Cell Line TPC-1
- 中国医科大学学报, 2018, 47(4): 321-328
- Journal of China Medical University, 2018, 47(4): 321-328
-
文章历史
- 收稿日期:2017-09-28
- 网络出版时间:2018-04-09 11:15
2. 解放军第一八零医院内分泌科, 福建 泉州 362000;
3. 解放军第一八零医院病理科, 福建 泉州 362000
2. Department of Endocrinology, The 180 th Military Hospital of Chinese People's Liberation Army, Quanzhou 362000, China;
3. Department of Pathology, The 180 th Military Hospital of Chinese People's Liberation Army, Quanzhou 362000, China
甲状腺癌是最常见的内分泌系统恶性肿瘤,其中甲状腺乳头状癌(thyroid papillary carcinoma,TPC)是最常见的一种类型,占所有甲状腺癌的80%~85%。虽然TPC的总体预后较好,但仍有约10%的患者可能死于该病[1]。近年来,国内外的调查结果显示甲状腺癌的发病率呈显著增加趋势。然而,肿瘤的发生、发展是一个多环节、多因素、多阶段的复杂过程,甲状腺癌发生的原因及机制目前尚不清楚,绝大多数观点认为基因突变或表达异常在TPC的发生中起重要作用。
沉默信息调节因子2相关酶1 (silent information regulator 2 homolog 1,SIRT1)是Sirtuins家族中的一种依赖烟酰胺腺嘌呤二核苷酸(NAD+)的Ⅲ类组蛋白去乙酰化酶[2],它可使多种蛋白质的赖氨酸残基发生去乙酰化,在肿瘤的发生发展中有着广泛的生物学功能[3]。HERRANZ等[4]研究发现,在磷酸酶和张力蛋白同源物(phosphatase and tensin homolog,PTEN)基因缺乏的小鼠甲状腺癌中,SIRT1蛋白异常升高,原癌基因c-MYC被激活,c-MYC蛋白表达上调。吴文艺等[5-6]研究证实,SIRT1在TPC组织中高表达,可能与TPC的发生、发展及淋巴结转移有关。
本研究利用脂质体法使SIRT1siRNA转染体外培养的人TPC细胞株TPC-1,用qRT-PCR方法检测siRNA的干扰效率,筛选出干扰效率最强的siRNA,并用Western blotting验证SIRT1蛋白的表达,利用CCK8法、Hoechst染色法、流式细胞仪及β-半乳糖苷酶染色法检测转染细胞的增殖抑制率、凋亡、周期与衰老的变化,旨在探讨SIRT1沉默对人TPC细胞株TPC-1生物学功能的影响。
1 材料与方法 1.1 材料人TPC细胞株TPC-1购自广州吉妮欧生物科技有限公司;SIRT1siRNA由Sigma公司设计合成(表 1);胎牛血清、RPMI-1640培养基、青链霉素、PBS磷酸钾缓冲液购自美国Hyclone公司;Trizol、SYBR GREEN qPCR Super Mix购自美国Invitrogen公司;ImProm-ⅡTM Reverse Transcription System、dNTP、Ramdom Primer、M-MLV、DNase、RNasin Ribonuclease Inhibitor购自美国Promega公司;HRP标记的GAPDH内参购自上海康成生物公司;SIRT1一抗购自美国Cell Signaling公司;二抗山羊抗兔IgG (H+L),Mouse/Human ads-HRP、兔抗鼠IgG (H+L) -HRP购自美国Southern Biotech公司;磷酸酶抑制剂、BCA法蛋白含量检测试剂盒、Annexin V-FITC细胞凋亡检测试剂盒、细胞周期检测试剂盒购自江苏Keygen公司;RIPA裂解液、一抗稀释液、细胞衰老β-半乳糖苷酶染色试剂盒、Hoechst 33258染色液、CCK-8溶液购自上海Beyotime Biotechnology公司;其他材料由福建医科大学附属第二医院中心实验室提供。
| Name[line] | Sequence (5’to 3’) | Size(bp) | Epsilon(1/mMcm) | MW(g/mole) | Qty/tube | |
| OD | nmoles | |||||
| SASI_Hs01_00153666 | GUGUCAUGGUUCCUUUGCAdTdT | 21 | 197.9 | 6 631 | ||
| SASI_Hs01_00153666_AS | UGCAAAGGAACCAUGACACdTdT | 21 | 207.8 | 6 681 | ||
| Duplex of above | 13 312 | 2 | 5 | |||
| SASI_Hs01_00153667 | CUGUGAAGCUGUACGAGGAdTdT | 21 | 208 | 6 779 | ||
| SASI_Hs01_00153667_AS | UCCUCGUACAGCUUCACAGdTdT | 21 | 193.8 | 6 628 | ||
| Duplex of above | 13 407 | 2 | 5 | |||
| SASI_Hs01_00153668 | CAACUAUACCCAGAACAUAdTdT | 21 | 210.1 | 6 634 | ||
| SASI_Hs01_00153668_AS | UAUGUUCUGGGUAUAGUUGdTdT | 21 | 208.9 | 6 728 | ||
| Duplex of above | 13 362 | 2 | 5 | |||
| NC | UUCUCCGAACGUGUCACGUTT | 21 | 196.2 | 6 563 | ||
| NC_AS | ACGUGACACGUUCGGAGAATT | 21 | 213.6 | 6 712 | ||
| Duplex of above | 13 275 | 1 | 2.5 | |||
1.2 方法 1.2.1 细胞培养
复苏细胞后加入含10%胎牛血清的RPMI-1640培养基,置入饱和湿度、37 ℃、5% CO2培养箱中,待细胞贴壁生长融合度达到80%后,进行传代培养。
1.2.2 siRNA筛选均匀地接种并培养细胞(5×104/孔),次日待细胞融合度约40%时分别用浓度为25、50、100 nmol/L的NCsiRNA、SIRT1_66siRNA (SASI_Hs01_00153666)、SIRT1_67siRNA (SASI_Hs01_00153667)、SIRT1_68siRNA (SASI_Hs01_00153668)进行转染,转染24 h后弃培养基并收集细胞,用于PCR及Western blotting检测并验证siRNA干扰效率。
1.2.3 qRT-PCRTrizol溶液充分裂解收集的细胞,提取细胞总RNA,检测其纯度及完整性。内参片段18srRNA-112 bp;目的片段SIRT1-205 bp。SIRT1的上游引物序列为5’-AAGATGACGTCTTATCCTCT-3’,下游引物序列为5’-GCTTCATTAATTGCCTCTTG-3’,18srRNA的上游引物序列为5’-CCTGGATACCGCAG CTAGGA-3’,下游引物序列为5’-GCGGCGCAATAC GAATGCCCC-3’。反应体系总体积20 µL,其中cDNA (1︰20稀释) 5.0 µL、上游引物0.5 µL、下游引物0.5 µL、2×SYBR Green qPCR SuperMix 10 µL、dH2O 4.0 µL。反应条件为50 ℃ 2 min;95 ℃ 2 min;95 ℃ 15 s,60 ℃ 32 s,40个循环。分析融解曲线,计算结果。
1.2.4 Western blotting提取细胞总蛋白,用BCA法测量蛋白质浓度;取待测蛋白样品行SDS-PAGE电泳至溴酚蓝刚出胶底部止;冰水浴中电转移至PVDF膜上,TBST洗膜;5%脱脂奶粉溶液4 ℃封闭过夜;TBST洗膜,加入SIRT1一抗(1︰1 000稀释),4 ℃孵育过夜;TBST洗膜,加入相应的二抗(1 ︰10 000稀释),37 ℃孵育1 h,洗膜后均匀涂抹荧光发光底物,曝光显影。
1.2.5 细胞爬片裁剪合适大小的爬片,消毒后备用。无菌条件下,将细胞传代到玻片上,培养24 h,使细胞适当扩增,取出玻片进行固定。
1.2.6 CCK-8法检测细胞增殖实验分3组,即空白(TPC-1)组、阴性对照(NCsiRNA)组及实验(SIRT1 siRNA)组。取对数生长期细胞,调整各组细胞浓度,接种至96孔板(1×104/孔);每组设置3个复孔。细胞贴壁后收集0、1、2、3 d的细胞,加入10 µL CCK-8溶液(1︰10);孵育4 h后,酶标仪测定各孔吸光度值,采集OD450 nm数据。依据公式计算增殖率(同一样品) = (其他时间点OD值均值/0时OD值均值-1) ×100%。
1.2.7 β-半乳糖苷酶染色法检测细胞衰老向6孔板中培养的细胞加入染色固定液(1 mL/孔),固定15 min后弃染色固定液,加入染色工作液(1 mL/孔),37 ℃孵育过夜。普通光学显微镜下观察。
1.2.8 Hoechst染色法检测细胞凋亡向6孔板中的细胞加入Hoechst 33258染色液(1 mL/孔),充分覆盖并在适宜温度下培养20~30 min,弃染色液,用PBS洗涤2~3次后进行荧光检测。
1.2.9 流式检测细胞凋亡及细胞周期(1)细胞凋亡检测。将含5×105个细胞的培养液移至干净的离心管内,加入1.25 μL Annexin V-FITC,室温避光孵育15 min后1 000 g离心5 min,弃上清,加入0.5 mL预冷的1×结合缓冲液轻轻重悬,加入10 μL溴化丙啶染色液,置于冰上避光保存。立即用流式细胞仪检测分析。(2)细胞周期检测。转染48 h后取1×106细胞加入预冷的70%乙醇,4 ℃固定过夜,离心收集细胞,加入50 μg/mL碘化丙啶,100 μg/mL RNase A,0.2% Triton X-100,4 ℃避光孵育30 min后用流式细胞仪检测分析。
1.3 统计学分析采用SPSS 22.0统计软件进行分析。实验均重复3次,数据采用x±s表示,2组数据的比较采用Student’s t检验。P < 0.05为差异有统计学意义。
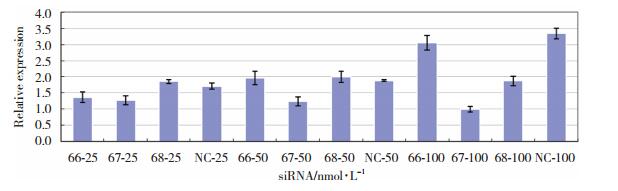
2 结果 2.1 转染TPC-1的SIRT1siRNA筛选及转染效果的验证通过qRT-PCR检测对比不同序列、不同浓度的SIRT1siRNA对TPC-1细胞转染后SIRT1mRNA表达水平的影响结果,最终选择序列SASI_Hs01_00153667进行后续实验,浓度为100 nmol/L。同时,Western blotting结果证实,转染该序列、该浓度SIRT1siRNA组(实验组)的细胞较TPC-1组(空白组)及NCsiRNA组(阴性对照组)的细胞中SIRT1蛋白均呈低表达(P < 0.05),见图 1~2。
|
| 66-25, 25 nmol/L SIRT1_66siRNA; 67-25, 25 nmol/L SIRT1_67siRNA; 68-25, 25 nmol/L SIRT1_68siRNA; NC-25, 25 nmol/L NCsiRNA; 66-50, 50 nmol/L SIRT1_66siRNA; 67-50, 50 nmol/L SIRT1_67siRNA; 68-50, 50 nmol/L SIRT1_68siRNA; NC-50, 50 nmol/L NCsiRNA; 66-100, 100 nmol/L SIRT1_66siRNA; 67-100, 100 nmol/L SIRT1_67siRNA; 68-100, 100 nmol/L SIRT1_68siRNA; NC-100, 100 nmol/L NCsiRNA. 图 1 qRT-PCR检测SIRT1在经过不同干扰转染处理后的表达水平 Fig.1 Relative expression of SIRT1 determined by qRT-PCR after siRNA interference |
|
| 1, TPC-1 group; 2, NCsiRNA group; 3, SIRT1siRNA group. 图 2 Western blotting检测SIRT1蛋白的表达 Fig.2 SIRT1 protein expression detected by Western blotting |
2.2 转染SIRT1siRNA的TPC-1细胞增殖变化
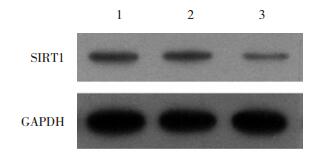
CCK-8法检测结果如图 3所示,与TPC-1组及NCsiRNA组相比,SIRT1siRNA组的细胞增殖能力减弱,24、48、72 h SIRT1siRNA组细胞增殖率下降,细胞增殖受到抑制(均P < 0.05)。
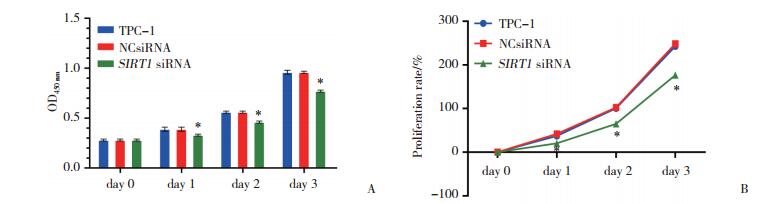
|
| A, effect of TPC-1 cell proliferation after SIRT1 interfered; B, effect of TPC-1 cell growth curve after SIRT1 interfered. *P < 0.05 vs TPC-1 or NCsiRNA group. 图 3 CCK-8法检测细胞增殖 Fig.3 Cell proliferation determined by the CCK-8 method |
2.3 转染组TPC-1细胞的细胞衰老变化
β-半乳糖苷酶染色结果如图 4所示,SIRT1siRNA组衰老细胞比例(54.6%±2.7%)较TPC-1组细胞衰老比例(26.4%±2.2%)及NCsiRNA组细胞衰老比例(29.8%±3.4%)明显升高,差异有统计学意义(P < 0.05)。提示转染SIRT1siRNA可诱导TPC-1细胞衰老。
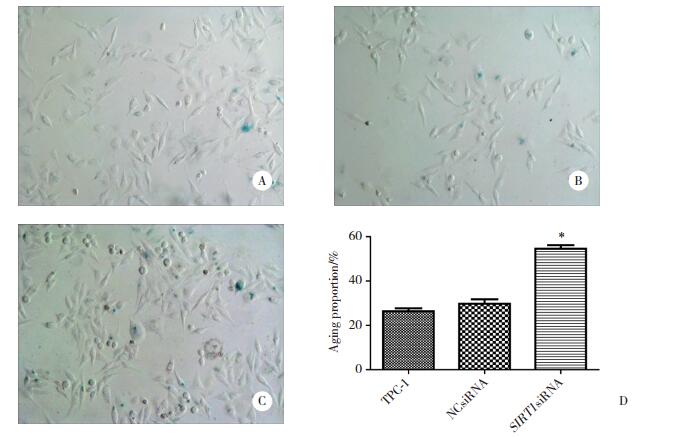
|
| A, TPC-1 cells (×100);B, cells treated with NCsiRNA (×100); C, cells treated with SIRT1 siRNA (×100);D, aging proportion of TPC-1 cell after SIRT1 interfered. *P < 0.05 vs TPC-1 or NCsiRNA group. 图 4 β-半乳糖苷酶染色检测细胞衰老 Fig.4 Cell aging detected viaβ-galactosidase staining |
2.4 转染组TPC-1细胞的凋亡变化
Hoechst染色结果如图 5所示,TPC-1组凋亡细胞比例为0.03±0.01 (图 5A),NCsiRNA组凋亡细胞比例为0.03±0.02 (图 5B),SIRT1siRNA组凋亡细胞比例为0.09±0.01 (图 5C),SIRT1siRNA组凋亡细胞比例明显高于TPC-1组及NCsiRNA组(P < 0.05,图 5D)。
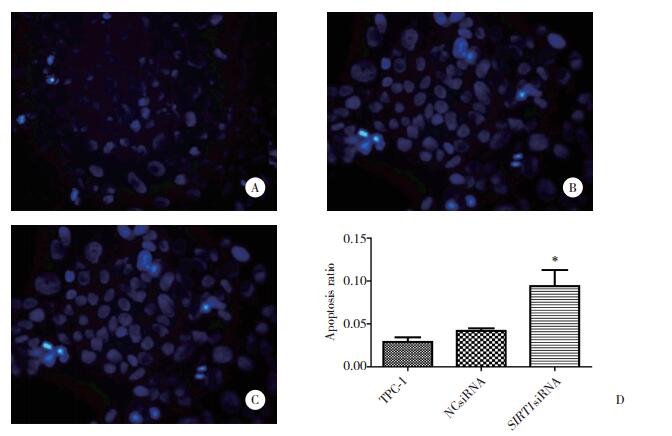
|
| A, TPC-1 cells (×400);B, cells treated with NCsiRNA (×400);C, cells treated with SIRT1 siRNA (×400);D, apoptosis ratio of TPC-1 cell after SIRT1 interfered. *P < 0.05 vs TPC-1 or NCsiRNA group. 图 5 Hoechst染色法检测细胞凋亡 Fig.5 Cell apoptosis detected via Hoechst staining |
2.5 流式细胞仪检测转染组TPC细胞凋亡及周期变化
流式细胞技术检测结果显示,SIRT1siRNA处理组的总凋亡细胞比例(65.22%±0.41%,图 6C)较TPC-1组(5.84%±0.16%,图 6A)及NCsiRNA组(5.53%±0.05%,图 6B)明显升高(P < 0.05,图 6D)。细胞周期变化检测结果显示,SIRT1siRNA处理组的G1期细胞比例(67.99%±0.87%,图 7C)较TPC-1组(64.39%±0.77%,图 7A)及NCsiRNA组(64.08%± 0.53%,图 7B)明显升高(P < 0.05,图 7D),提示SIRT1 siRNA处理组TPC细胞出现了G1期阻滞。
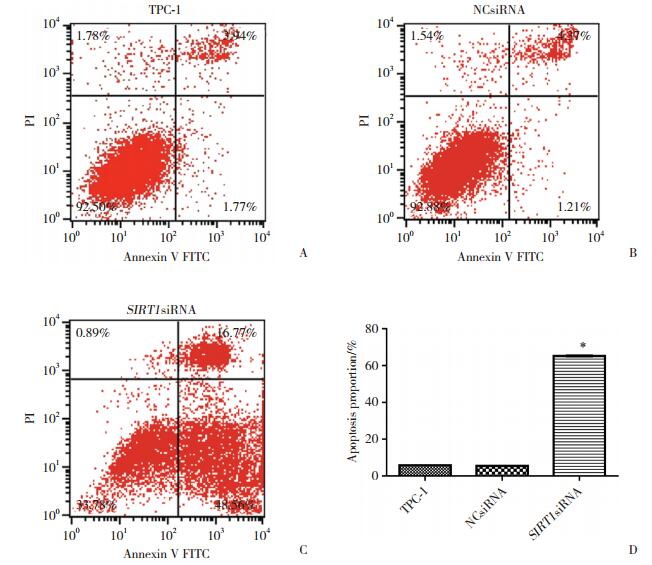
|
| A, TPC-1 cells; B, cells treated with NCsiRNA; C, cells treated with SIRT1 siRNA; D, apoptosis proportion of TPC-1 cells after SIRT1 interfered. *P < 0.05 vs TPC-1 or NCsiRNA group. 图 6 流式细胞技术检测细胞凋亡 Fig.6 Cell apoptosis detected using flow cytometry |
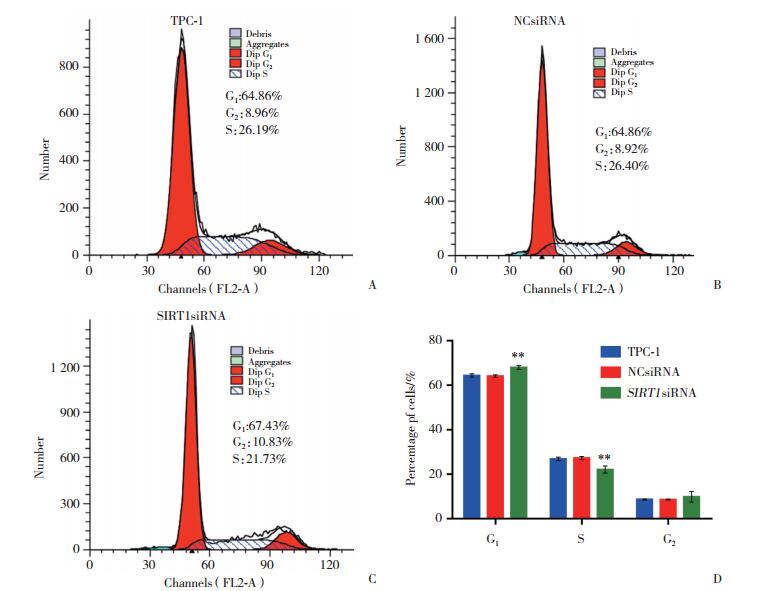
|
| A, TPC-1 cells; B, cells treated with NCsiRNA; C, cells treated with SIRT1 siRNA; D, cell cycle of TPC-1 cell after SIRT1 interfered. *P < 0.05 vs TPC-1 or NCsiRNA. 图 7 流式细胞技术检测细胞周期结果 Fig.7 Cell cycle analyzed using flow cytometry |
3 讨论
SIR2是一种首先在酵母中被发现的依赖NAD+组蛋白/非组蛋白去乙酰化酶。Sirtuins家族是一类与SIR2同源蛋白质的总称,哺乳动物的Sirtuins家族包含了SIRT1~SIRT7的7个成员,其中SIRT1与SIR2的同源性最高[7],亦是研究较为深入的1个成员。
SIRT1基因位于人类第10号染色体长臂上(10q22.1),包含8个内含子和9个外显子,全长约33 000 bp,编码747个氨基酸。SIRT1蛋白位于细胞核内,其相对分子质量约为120 000 [7]。SIRT1蛋白中心含有大、小2个主要的结构域,NAD+分子与这2个结构域表面结合形成酶复合体,同时,底物通过NAD+分子的协同作用在这2个结构域的裂隙中结合并发生催化反应[8]。SIRT1对诸多底物有强大的去乙酰化作用,它在正常的胚胎发育、分化及维持自身平衡中扮演着多元化的角色,是一系列生命活动不可或缺的[9]。研究发现,SIRT1通过与不同的组蛋白和非组蛋白(如H3[10]、p53[11-12]、p21[13]、FOXOs[14-16]、Ku70[17-18]、p300[19-20]、PGC-1α[21-22]、NF-κB[23-24])相互作用,在肿瘤发生、基因沉默、DNA损伤修复、延长寿命、调控细胞分化与凋亡、调节细胞周期、调节糖脂能量代谢等[25]方面发挥不同的重要功能。通过这些不同功能的相互作用,使SIRT1在作用于不同系统、组织、器官、细胞中产生多元化的结果。研究[26-28]表明,在乳腺癌、肺癌、结肠癌中,SIRT1表达水平显著升高,它不但能加快细胞增殖,而且能抑制细胞衰老、凋亡,还可以促进细胞迁移,有肿瘤促进因子的作用。但SIMIC等[29]和SUN等[30]发现在乳腺癌及肺癌细胞中SIRT1亦能负向调节癌组织上皮细胞间质转型,从而促进癌细胞的衰老、凋亡,抑制癌细胞扩散、转移,故认为SIRT1在乳腺癌、肺癌的发生发展中起着肿瘤抑制因子的作用,而非肿瘤促进因子的作用。
本研究通过沉默体外培养人TPC细胞株TPC-1中SIRT1基因的表达,发现该细胞中SIRT1的表达水平与细胞增殖、衰老、凋亡及周期有关。本研究发现,在转染了SIRT1siRNA的TPC-1细胞中,SIRT1mRNA及蛋白的表达减少,细胞增殖明显受限,衰老细胞比例增多,凋亡细胞比例明显升高,细胞周期停滞于G1期,差异有统计学意义(P < 0.05)。
综上所述,本研究揭示了SIRT1基因沉默对人TPC细胞株TPC-1生物学功能的影响,发现转染SIRT1siRNA可降低TPC-1细胞SIRT1表达水平,使细胞周期停滞,抑制细胞增殖,并诱导癌细胞衰老及凋亡。
| [1] |
LIVOLSI VA. Papillary thyroid carcinoma:an update[J]. Mod Pathol, 2011, 24: S1-S9. DOI:10.1038/modpathol.2010.129 |
| [2] |
HATTORI Y, IHARA M. SIRT1[J]. Nihon Rinsho, 2016, 74(4): 589-594. |
| [3] |
VIKRAM A, LEWARCHIK CM, YOON JY, et al. Sirtuin 1 regulates cardiac electrical activity by deacetylating the cardiac sodium channel[J]. Nat Med, 2017, 23(3): 361-367. DOI:10.1038/nm.4284 |
| [4] |
HERRANZ D, MARAVER A, CANAMERO M, et al. SIRT1 promotes thyroid carcinogenesis driven by PTEN deficiency[J]. Oncogene, 2013, 32(34): 4052-4056. DOI:10.1038/onc.2012.407 |
| [5] |
吴文艺, 张丽婷, 傅德强, 等. 沉默信息调节因子2相关酶1在甲状腺乳头状癌组织中的表达及其意义[J]. 中华实验外科杂志, 2015, 32(4): 877-880. DOI:10.3760/cma.j.issn.1001-9030.2015.04.072 |
| [6] |
WU W, ZHANG L, LIN J, et al. Hypermethylation of the HIC1 promoter and aberrant expression of HIC1/SIRT1 contribute to the development of thyroid papillary carcinoma[J]. Oncotarget, 2016, 7(51): 84416-84427. DOI:10.18632/oncotarget.12936 |
| [7] |
HAIGIS MC, GUARENTE LP. Mammalian sirtuins——emerging roles in physiology, aging, and calorie restriction[J]. Genes Dev, 2006, 20(21): 2913-2921. DOI:10.1101/gad.1467506 |
| [8] |
MIN J, LANDRY J, STERNGLANZ R, et al. Crystal structure of a sir2 homolog-nad complex[J]. Cell, 2001, 105(2): 269-279. DOI:10.1016/S0092-8674(01)00317-8 |
| [9] |
AQUILANO K, VIGILANZA P, BALDELLI S, et al. Peroxisome proliferator-activated receptor gamma co-activator 1alpha (pgc-1alpha) and sirtuin 1(sirt1) reside in mitochondria:possible direct function in mitochondrial biogenesis[J]. J Biol Chem, 2010, 285(28): 21590-21599. DOI:10.1074/jbc.M109.070169 |
| [10] |
BENDALE DS, KARPE PA, CHHABRA R, et al. 17-beta Oestradiol prevents cardiovascular dysfunction in post-menopausal metabolic syndrome by affecting SIRT1/AMPK/H3 acetylation[J]. Br J Phar macol, 2013, 170(4): 779-795. DOI:10.1111/bph.12290 |
| [11] |
LI L, WANG L, LI L, et al. Activation of p53 by sirt1 inhibition enhances elimination of cml leukemia stem cells in combination with imatinib[J]. Cancer Cell, 2012, 21(2): 266-281. DOI:10.1016/j.ccr.2011.12.020 |
| [12] |
GONFLONI S, IANNIZZOTTO V, MAIANI E, et al. P53 and Sirt1:routes of metabolism and genome stability[J]. Biochem Pharmacol, 2014, 92(1): 149-156. DOI:10.1016/j.bcp.2014.08.034 |
| [13] |
ZHOU N, LIN X, DONG W, et al. SIRT1 alleviates senescence of degenerative human intervertebral disc cartilage endo-plate cells via the p53/p21 pathway[J]. Sci Rep, 2016, 6: 22628. DOI:10.1038/srep22628 |
| [14] |
HORI YS, KUNO A, HOSODA R, et al. Regulation of FOXOs and p53 by SIRT1 modulators under oxidative stress[J]. PLoS One, 2013, 8(9): e73875. DOI:10.1371/journal.pone.0073875 |
| [15] |
LEE D, GOLDBERG AL. SIRT1 protein, by blocking the activities of transcription factors FoxO1 and FoxO3, inhibits muscle atrophy and promotes muscle growth[J]. J Biol Chem, 2013, 288(42): 30515-30526. DOI:10.1074/jbc.M113.489716 |
| [16] |
GU X, HAN D, CHEN W, et al. SIRT1-mediated FoxOs pathways protect against apoptosis by promoting autophagy in osteoblast-like MC3T3-E1 cells exposed to sodium fluoride[J]. Oncotarget, 2016, 7(40): 65218-65230. DOI:10.18632/oncotarget.11573 |
| [17] |
KIM MJ, HONG KS, KIM HB, et al. Ku70 acetylation and modulation of c-Myc/ATF4/CHOP signaling axis by SIRT1 inhibition lead to sensitization of HepG2 cells to TRAIL through induction of DR5 and down-regulation of c-FLIP[J]. Int J Biochem Cell Biol, 2013, 45(3): 711-723. DOI:10.1016/j.biocel.2012.12.005 |
| [18] |
ROTH M, WANG Z, CHEN WY. SIRT1 and LSD1 competitively regulate KU70 functions in DNA repair and mutation acquisition in cancer cells[J]. Oncotarget, 2016, 7(31): 50195-50214. DOI:10.18632/oncotarget.10328 |
| [19] |
KUNO A, HORI YS, HOSODA R, et al. Resveratrol improves cardiomyopathy in dystrophin-deficient mice through SIRT1 protein-mediated modulation of p300 protein[J]. J Biol Chem, 2013, 288(8): 5963-5672. DOI:10.1074/jbc.M112.392050 |
| [20] |
ZENG Z, CHENG S, CHEN H, et al. Activation and overexpression of Sirt1 attenuates lung fibrosis via P300[J]. Biochem Biophys Res Commun, 2017, 486(4): 1021-1026. DOI:10.1016/j.bbrc.2017.03.155 |
| [21] |
CURTIL C, ENACHE LS, RADREAU P, et al. The metabolic sensors FXRalpha, PGC-1alpha, and SIRT1 cooperatively regulate hepatitis B virus transcription[J]. FASEB J, 2014, 28(3): 1454-1463. DOI:10.1096/fj.13-236372 |
| [22] |
TRABOULSI H, DAVOLI S, CATEZ P, et al. Dynamic partnership between TFⅡH, PGC-1alpha and SIRT1 is impaired in trichothiodystrophy[J]. PLoS Genet, 2014, 10(10): e1004732. DOI:10.1371/journal.pgen.1004732 |
| [23] |
KAUPPINEN A, SUURONEN T, OJALA J, et al. Antagonistic crosstalk between NF-kappaB and SIRT1 in the regulation of inflammation and metabolic disorders[J]. Cell Signal, 2013, 25(10): 1939-1948. DOI:10.1016/j.cellsig.2013.06.007 |
| [24] |
CHEN Y, LIU H, ZHANG H, et al. The sirt1/NF-kB signaling pathway is involved in regulation of endothelin type B receptors mediated by homocysteine in vascular smooth muscle cells[J]. Biomed Pharmacother, 2016, 84: 1979-1985. DOI:10.1016/j.biopha.2016.11.011 |
| [25] |
邓向群. SIRT1表达对大鼠胰岛β细胞凋亡及非酒精性脂肪肝病形成的影响[D]. 华中科技大学, 2007.
|
| [26] |
HOLLOWAY KR, BARBIERI A, MALYARCHUK S, et al. SIRT1 positively regulates breast cancer associated human aromatase (CYP19A1) expression[J]. Mol Endocrinol, 2013, 27(3): 480-490. DOI:10.1210/me.2012-1347 |
| [27] |
NOH SJ, BAEK HA, PARK HS, et al. Expression of SIRT1 and cortactin is associated with progression of non-small cell lung cancer[J]. Pathol Res Pract, 2013, 209(6): 365-370. DOI:10.1016/j.prp.2013.03.011 |
| [28] |
KRIEGL L, VIETH M, KIRCHNER T, et al. Up-regulation of c-myc and sirt1 expression correlates with malignant transformation in the serrated route to colorectal cancer[J]. Oncotarget, 2012, 3(10): 1182-1193. DOI:10.18632/oncotarget.628 |
| [29] |
SIMIC P, WILLIAMS EO, BELL EL, et al. SIRT1 suppresses the epithelial-to-mesenchymal transition in cancer metastasis and organ fibrosis[J]. Cell Rep, 2013, 3(4): 1175-1186. DOI:10.1016/j.celrep.2013.03.019 |
| [30] |
SUN L, LI H, CHEN J, et al. A SUMOylation-dependent pathway regulates SIRT1 transcription and lung cancer metastasis[J]. J Natl Cancer Inst, 2013, 105(12): 887-898. DOI:10.1093/jnci/djt118 |
 2018, Vol. 47
2018, Vol. 47