文章信息
- 解丽丽, 吕洪涛, 许瑞雪
- XIE Lili, LÜ Hongtao, XU Ruixue
- 磷酸化P38在神经病理性疼痛大鼠背根神经节中的作用机制
- Mechanism of Action of Phosphorylated P38 in Neuropathic Pain Due to Chronic Dorsal Root Ganglion Compression in Rats
- 中国医科大学学报, 2018, 47(4): 308-311
- Journal of China Medical University, 2018, 47(4): 308-311
-
文章历史
- 收稿日期:2017-09-01
- 网络出版时间:2018-04-09 11:15
2. 大连医科大学附属第一医院神经外科, 辽宁 大连 116011
2. Department of Neurosurgery, The First Affiliated Hospital of Dalian Medical University, Dalian 116011, China
丝裂素活化蛋白激酶(mitogen activated protein kinase,MAPKs)存在于细胞中,是在细胞信号转导通路中发挥重要作用的丝/苏氨酸蛋白激酶。P38蛋白是MAPKs家族中重要的一员,许多生理性与化学性刺激都能激活P38的磷酸化。JOHNSON等[1]研究发现,ERK、JNK、磷酸化P38(phosphorylated P38,p-P38)蛋白激酶所参与的细胞内信号转导通路在细胞增殖、分化、凋亡、神经元可塑性等多种生理病理过程中发挥重要作用。许力等[2]研究发现,脊髓中的P38与TNF-α活化,抑制P38磷酸化可以减少TNF-α,提示P38可能参与疼痛的中枢敏化。P38广泛存在于脊髓和背根神经节(dorsal root ganglion,DRG),并在炎症反应中发挥着抗炎作用[3-4]。
慢性背根神经节压迫(chronic compression of dorsal root ganglion,CCD)模型是一种外周神经病理性疼痛模型,是研究外周神经不完全性损伤的常用动物模型,本研究检测CCD大鼠DRG中p-P38表达情况,探讨p-P38在神经病理性疼痛大鼠DRG中的作用机制。
1 材料与方法 1.1 动物及分组18只SD大鼠(160~180 g,雌性)由大连医科大学附属第一医院动物实验中心提供。室温饲养,12 h照明/12 h黑暗,水与鼠粮自由食用。实验前大鼠要适应实验室环境1 h。动物使用遵照大连医科大学动物管理委员会要求。大鼠随机均分为3组:假手术组(sham组)、CCD组、CCD模型SB203580给药组(治疗组),每组6只。分别于术后14 d测完行为学取材。
1.2 试剂P38抑制剂,4-(4-氟苯) -2-(4-甲磺酰苯) -5-(4-吡啶基) -1氢-咪唑(SB203580,美国Sigma公司);内参β-actin抗体、p-P38抗体与P38抗体(美国Cell Signaling公司)。
1.3 CCD模型制备大鼠腹腔注射l%戊巴比妥钠(40 mg/kg)麻醉后,用剃毛刀将腰背部的毛剃光,铺上纸巾暴露出手术野,沿着右侧脊椎从L2-5切开皮肤、分离肌肉。将“L型” (长3 mm、直径0.6 mm)的不锈钢棒,与背部正中线成30°角,与脊柱侧面水平线成15°。分别插入L3和L4椎间孔,观察到大鼠右后肢抽动即为插入成功。术后腹腔注射青霉素预防感染。鞘内置管在CCD手术前实施,打开L6的硬脑膜,将导管置入大鼠的蛛网膜下腔,大约位于L3-4,缝合后固定导管,等待大鼠恢复24 h后再进行CCD手术。
1.4 大鼠机械疼痛阈值测试检测大鼠后足对Von Frey丝(直径200 μm)刺激的缩足反应,使用机械缩足阈值(paw withdrawal mechanical threshold,PWMT)衡量机械疼痛的程度。大鼠放置在1个10 cm×10 cm×15 cm的透明玻璃盒中,底部放置金属网(0.5 cm×0.5 cm)。使用Von Frey丝垂直扎大鼠的足底,当大鼠后足突然扬足、缩足或舔足反应为阳性,每次刺激间隔10 min,每只大鼠重复测量5次,取平均值。
1.5 大鼠热痛阈值测试通过检测大鼠后足底对热刺激产生的缩腿动作时间(paw withdrawal thermal latency,PWTL)来衡量热痛阈值。把待检测的大鼠单独放置于底部厚为0.22 mm的透明玻璃笼(20 cm×20 cm×40 cm)中,在安静环境下适应30 min后,使用热辐射疼痛刺激器(BME-410C,天津伯尔尼科技有限公司)在玻璃板下固定距离聚焦大鼠后足底,当大鼠产生缩足或舔足停止照射,记录照射起止的间隔时间。每只大鼠重复测量5次,间隔时间 > 5 min,取平均值作为PWTL。为避免给大鼠足底皮肤造成损伤,设置最高阈值为20 s。
1.6 Western blotting检测大鼠DRG神经元中p-P38的表达所有蛋白取自实验大鼠L3和L4的DRG。每个样品总蛋白25 μg,使用10%的SDS-PAGE进行电泳,在4 ℃转膜1 h到PVDF上,使用TBST (20 mmol/L Tris-Cl,pH7.5,0.15 mol/L NaCl,0.05% Tween-20)冲洗,共洗3次,每次10 min;接着用含10%脱脂牛奶的TBST室温封闭1 h,然后用一抗p-P38抗体(1:500) 4 ℃孵育过夜,第2天用TBST洗3次,每次10 min,之后应用二抗(1:1 000)室温孵育1 h,使用发光试剂盒(英国ECL kit公司)检测发光信号。所有实验使用等量蛋白进行P38 (1:1 000)和β-actin抗体(1:2 000)检测。p-P38和P38的蛋白条带灰度值用Image J软件(美国NIH公司)分析。
1.7 统计学分析使用统计软件SPSS 12.0进行数据处理。实验数据用x±s表示,组内比较采用配对t检验,组间比较采用单因素方差分析。P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠机械疼痛行为学结果比较大鼠机械疼痛行为学结果显示,大鼠在进行CCD手术前对机械刺激的缩腿反应的基础阈值是20.5 g。与sham组比较,CCD组大鼠的机械缩腿阈值明显降低(P < 0.01),并表现为时间依赖性,手术后1、3、5、7 d后持续降低,但手术后14 d大鼠的机械缩腿阈值增加,恢复近正常。与CCD组比较,治疗组大鼠除第1天外,其他时间点的机械缩腿阈值明显升高(P < 0.05)。3组大鼠在手术后14 d,机械缩腿阈值都恢复至正常,没有统计学差异(P > 0.05)。见表 1。
| Group | Mechanical withdrawal threshold (g) | Heat withdrawal latency(s) | ||||||||
| 1 d | 3 d | 5 d | 7 d | 14 d | 1 d | 3 d | 5 d | 7 d | 14 d | |
| Sham | 20.5±2.0 | 19.0±1.8 | 19.5±1.9 | 19.5±1.8 | 20.0±1.9 | 12.5±1.5 | 12.0±1.7 | 12.5±2.0 | 12.0±2.0 | 13.0±2.3 |
| CCD | 12.0±2.11) | 10.0±1.51) | 9.0±1.41) | 8.5±1.21) | 18.0±2.3 | 7.0±1.21) | 6.5±1.01) | 5.0±0.81) | 7.5±1.01) | 10.0±1.3 |
| Treatment | 14.0±1.51) | 17.0±1.62) | 17.5±1.72) | 18.0±2.02) | 19.5±2.0 | 7.0±1.11) | 6.0±0.91) | 5.0±1.01) | 7.0±1.31) | 10.0±1.5 |
| 1)P < 0.01 vs sham group;2)P < 0.01 vs CCD group. | ||||||||||
2.2 各组大鼠热疼痛行为学结果比较
热刺激反应结果显示,大鼠在进行CCD手术前对热刺激缩腿反射基础阈值是13 s。与sham组比较,CCD组、治疗组大鼠对热刺激的缩腿反射时间明显缩短(均P < 0.01)。鞘内注射SB203580不能改变CCD引起的热痛觉过敏,见表 1。
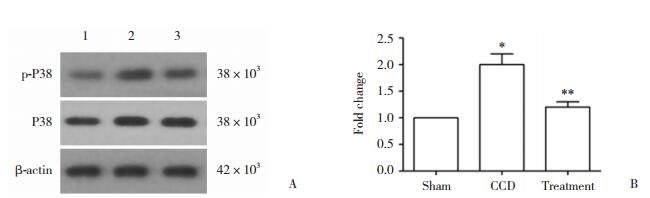
2.3 各组大鼠DRG中p-P38的表达Western blotting结果显示,sham组大鼠DRG仅有少量p-P38蛋白表达。与sham组比较,CCD组大鼠手术14 d后DRG中p-P38蛋白表达明显增加(P < 0.01)。与CCD组比较,治疗组大鼠手术14 d后DRG中p-P38蛋白表达明显减少(P < 0.01)。各组大鼠P38蛋白表达没有变化。见图 1。
|
| A, p-P38 and P38 protein expression levels in the DRG of rats; B, p-P38 protein expression changes in the DRG of rats. 1, sham group; 2, CCD group; 3, treatment group. *P < 0.01 vs sham group; **P < 0.01 vs CCD group. 图 1 各组大鼠DRG中p-P38和P38蛋白表达比较 Fig.1 p-P38 and P38 protein expression levels in the DRG of rats |
3 讨论
p-P38抑制剂是吡啶咪唑衍生物,主要有第一代SB202190、SB203580、SB220025,第二代SB239063等。其中,SB203580是可以通过细胞的分子,与ATP竞争性结合P38上的位点而发挥抑制作用。SB203580抑制P38磷酸化,减少脊髓中TNF-α合成,从而缓解神经病理性疼痛[2]。
本实验结果发现,CCD能引起大鼠对机械与温度刺激的痛觉异常。提前鞘内注射SB203580能够抑制机械刺激引起的痛觉异常,对热刺激引起的痛觉异常没有作用。PIAO等[6]研究发现,CCD引起三叉神经节损伤,激活胶质细胞与小胶质细胞中的p-P38,引起痛觉过敏。因此,SB203580可能在DRG的神经元细胞中具有相似功能,通过抑制P38的磷酸化来保护DRG中的神经元细胞,防止神经病理性疼痛的发生。
胡建雷等[7]报道,脊髓背角中P38磷酸化,能够引起CCD大鼠的神经病理性疼痛。韩光等[8]报道,高压氧可能通过活化脊髓中的P2X4受体,激活p38 MAPK信号通路,进而缓解CCI大鼠的机械痛与热痛。近年有学者[9-10]报道,MAPK信号通路中的P38在炎症细胞、应激、凋亡和神经病理性疼痛中发挥着重要作用。本研究结果显示,SB203580注射可以引起大鼠DRG中p-P38蛋白表达增加。P38只是MAPK信号通路中的作用蛋白,还需要对该信号通路的上下游进行深入研究,探讨其他蛋白的表达变化情况。SB203580有可能通过增加p-P38蛋白表达,从而调控下游信号通路,引起ERK-κBp65磷酸化,发挥缓解神经病理性疼痛的作用。
综上所述,SB203580能够减轻CCD所引起的机械痛,但对CCD所引起的热痛没有作用。p-P38蛋白可能是神经病理性疼痛的作用靶点,今后有可能指导临床用于缓解慢性疼痛。
| [1] |
JOHNSON GL, LAPADAT R. Mitogen-activated protein kinase pathways mediated by ERK, JNK, and p38 protein kinases[J]. Science, 2002, 298(5600): 1911-1912. DOI:10.1126/science.1072682 |
| [2] |
许力, 虞雪融, 黄宇光. P38 MAPK抑制剂对神经病理性疼痛大鼠脊髓TNF-α合成的影响[J]. 基础医学与临床, 2012, 32(10): 1126-1131. |
| [3] |
BORDERS AS, DE ALMEIDA L, VAN ELDIK LJ, et al. The p38 alpha mitogen activated protein kinase as a central nervous system drug discovery target[J]. BMC Neurosci, 2008, 9(S2): S12. DOI:10.1186/147-2202-9-s2-s12 |
| [4] |
KONDO T, SAKURAI J, MIWA H, et al. Activation of p38 MAPK through transient receptor potential A1 in a rat model of gastric distension induced visceral pain[J]. Neuroreport, 2013, 24(2): 68-72. DOI:10.1097/WNR.0b013e32835c7df2 |
| [5] |
HU SJ, XING JL. An experimental model for chronic compression of dorsal root ganglion produced by intervertebral foramen stenosis in the rat[J]. Pain, 1998, 77(1): 15-23. DOI:10.1016/S0304-3959(98)00067-0 |
| [6] |
PIAO ZG, CHO IH, PARK CK, et al. Activation of glia and microglial p38 MAPK in medullary dorsal horn contributes to tactile hypersensitivity following trigeminal sensory nerve injury[J]. Pain, 2006, 12(3): 219-231. DOI:10.1016/j.pain.2005.12.023 |
| [7] |
胡建雷, 申文, 曾因明. 脊髓p38MAPK在大鼠背根节慢性压迫神经病理性疼痛中的作用[J]. 中国药理学通报, 2008, 24(4): 530-533. |
| [8] |
韩光, 李璐, 赵平. 高压氧对神经病理性疼痛大鼠p38MAPK信号通路的影响[J]. 中国医科大学学报, 2016, 45(8): 723-727. DOI:10.12007/j.issn.0258-4646.2016.08.013 |
| [9] |
张涛, 杨承祥, 王汉兵. p38MAPK信号通路与疼痛的关系[J]. 中国疼痛医学杂志, 2012, 18(3): 177-180. |
| [10] |
王依慰, 李伟彦. P38促分裂原活化蛋白激酶在神经病理性疼痛中的作用[J]. 中国临床神经科学, 2015, 23(4): 454-458. |
 2018, Vol. 47
2018, Vol. 47