文章信息
- 孙洪利
- SUN Hongli
- 小鼠肝硬化-肝癌上皮间质转化的研究
- Study of the Epithelial Mesenchymal Transition between Liver Cirrhosis and Liver Cancer in Mice
- 中国医科大学学报, 2018, 47(2): 157-161
- Journal of China Medical University, 2018, 47(2): 157-161
-
文章历史
- 收稿日期:2017-03-27
- 网络出版时间:2018-01-08 10:54
原发性肝癌是常见恶性肿瘤,由于起病隐匿,早期无症状或症状不明显。病情进展迅速,确诊时大多数患者已经达到局部晚期或发生远处转移,治疗困难,预后很差,严重威胁身体健康和生命安全。由于肝癌的早期诊断对于有效治疗和长期生存至关重要,因此应十分重视肝癌的早期筛查和早期监测。上皮间质转化(epithelial mesenchymal transition,EMT)是将具有极性的上皮细胞转换成为具有移行能力的间质细胞并获得侵袭和迁移能力的过程,它存在于人体多个生理和病理过程中。EMT在恶性肿瘤的侵袭转移过程中起关键作用[1-2]。研究EMT的始发因素及其下游通路在肿瘤生长、侵袭、转移中的作用,阻断这一机制的发生发展,对恶性肿瘤侵袭转移前的早期诊断、早期治疗有着非常重要的意义。本研究的目的是探索在肝癌发病过程中调节EMT过程的相关因子表达情况,通过相关因子的表达谱,对E-钙黏蛋白、β3整联蛋白、波形蛋白和纤维连接蛋白等的表达水平进行检测,从分子水平判定患者的肝硬化—肝癌发病过程,从而早期发现肝硬化、检测肝癌发生,早期治疗,改善患者预后生存。
1 材料与方法 1.1 实验动物及分组选用雄性小鼠90只,体质量60~90 g,购自长春高新医学动物实验研究中心,随机分为肝硬化组(40只)、肝癌组(40只)和正常对照组(10只)。肝硬化组:6周龄健康雄性小鼠40只,20%四氯化碳油溶液(四氯化碳:橄榄油为1:4),剂量为2.5 mL/kg,腹腔注射,1次/周,注射2周,标准饲料喂养。肝癌组:在肝硬化组基础上加5%乙醇饮水,10周后改为正常饮水,标准饲料喂养[3-4]。正常对照组:普通饮用水和标准饲料喂养。
1.2 建立动物模型小鼠肝脏组织在诱导后8、10、12、14、16、18、20周开腹获取肝组织,观察腹水情况,每个时间点处死4只小鼠。各时间点肝组织一部分液氮冷冻保存,一部分逐级乙醇脱水、石蜡包埋,4 μm切片,HE染色进行病理学检查。
1.3 免疫组化采用免疫组化方法,测定E-钙黏蛋白、β3整联蛋白、波形蛋白和纤维连接蛋白的表达水平。
1.4 HE染色及免疫组化观察高倍显微镜(×400)下观察细胞着色情况,对每张切片的阳性细胞率及阳性细胞着色强度分别进行分级计分,然后根据2项之和确定其阳性表达强度。每张切片任意选5个视野,观察其细胞着色强度,无表达为阴性(0分),阳性颗粒呈浅黄色为可疑阳性(1分),浅棕色为弱阳性(2分),棕黄色为阳性(3分),棕褐色为强阳性(4分)。计算阳性细胞率(5个视野的平均数),无表达为阴性(0分),1%~15%为可疑阳性(1分),16%~50%为弱阳性(2分),51%~85%为阳性(3分),86%~100%为强阳性(4分)。计算标本的表达强度指数,表达强度指数(%)=阳性细胞表达强度×阳性细胞率。
1.5 统计学分析应用SPSS 11.0统计软件进行统计学分析。分类资料率的比较采用χ2检验。P < 0.05为差异有统计学意义。
2 结果 2.1 小鼠肝硬化和肝癌模型的建立与鉴定肝硬化组小鼠药物诱导8周后,90%小鼠逐渐出现毛杂乱、无光泽,活动差,消瘦,腹水;存活小鼠肝硬化诱导成功率100%,病死率30%。肝癌组小鼠药物诱导14周后,85%小鼠毛色欠佳,并伴有厌食、消瘦、体质量减轻,10%小鼠出现消化道出血,10%出现血性腹水;存活小鼠肝癌诱导成功率100%,病死率40%。
2.2 肝组织病理小鼠肝硬化诱导过程中18周出现肝脏细胞变性,硬化肝脏表面颗粒结节,质硬,镜下肝纤维化,假小叶形成,汇管区炎症,典型肝硬化病理表现。小鼠肝癌诱导过程中8周肝脏出现肝细胞变性、坏死和纤维化,肝细胞变大,18周时肝细胞结构紊乱,肿瘤位于肝脏多个肝叶,肿瘤灰白色,表面有肿瘤滋养血管;核仁异型性明显,肝癌形成;病理性核分裂,核仁变大变红,典型肝癌病理表现。见图 1。
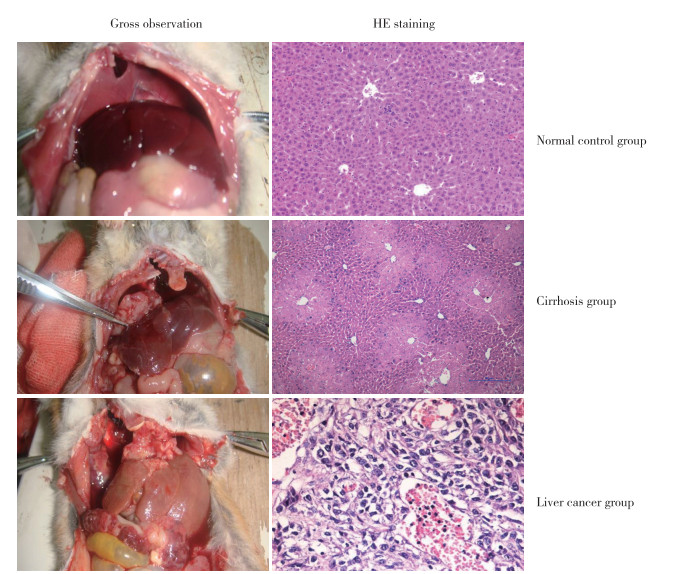
|
| 图 1 3组小鼠肝脏大体组织和HE染色×400 Fig.1 Gross observation and HE staining of liver tissues in three groups ×400 |
2.3 免疫组化结果
本研究共对90只小鼠模型中的52只进行了取材,获得正常对照组4例、肝硬化组15例、肝癌组14例的肝组织样本。
2.3.1 E-钙黏蛋白的表达E-钙黏蛋白在正常肝组织中阳性表达,多呈棕黄色颗粒,主要定位于上皮细胞及细胞膜上,尤其是细胞与细胞交界处,少数在细胞质中亦可着色。E-钙黏蛋白在肝硬化及肝癌组织中呈异常表达,多数癌组织中E-钙黏蛋白仅少量表达于细胞质,而在细胞膜上的染色减少或消失。肝硬化组织与肝癌组织比较,E-钙黏蛋白染色增强(图 2)。正常对照组中3例E-钙黏蛋白阳性表达,阳性表达率为75.0%(3/4),而肝硬化组和肝癌组中分别有7例和1例E-钙黏蛋白阳性表达,阳性表达率分别为46.7%(7/15)和7.1%(1/14)。肝硬化组、肝癌组与正常对照组比较,E-钙黏蛋白阳性表达率降低。肝硬化组和肝癌组比较,E-钙黏蛋白阳性表达率的差异有统计学意义(P < 0.05)。见表 1。
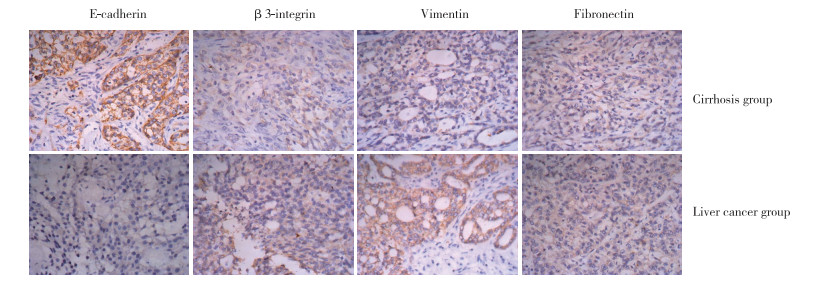
|
| 图 2 肝纤维化组和肝癌组中E-钙黏蛋白、β3整联蛋白、波形蛋白和纤维连接蛋表达的变化×400 Fig.2 Comparison of the E-cadherin, β3-integrin, vimentin, and fibronectin expression patterns between the cirrhosis and liver cancer models ×400 |
| Protein | Normal control group(n = 4) | Cirrhosis group(n = 15) | Liver cancer group(n = 14) |
| E-cadherin | |||
| + | 3 | 7 | 1 |
| - | 1 | 8 | 13 |
| β3-integrin | |||
| + | 3 | 6 | 1 |
| - | 1 | 9 | 13 |
| Vimentin | |||
| + | 0 | 2 | 8 |
| - | 4 | 13 | 6 |
| Fibronectin | |||
| + | 1 | 3 | 8 |
| - | 3 | 12 | 6 |
2.3.2 β3整联蛋白的表达
β3整联蛋白在正常肝组织中阳性表达,多呈棕黄色颗粒,主要定位于上皮细胞及细胞膜上。β3整联蛋白在肝硬化及肝癌组织中呈异常表达,多数癌组织中β3整联蛋白仅少量表达于细胞质。肝硬化组织与肝癌组织比较,β3整联蛋白染色增强(图 2)。正常对照组中3例β3整联蛋白阳性表达,阳性表达率为75.0%(3/4),而在肝硬化组和肝癌组中分别有6例和1例β3整联蛋白阳性表达,阳性表达率分别为40.0%(6/15)和7.1%(1/14)。肝硬化组、肝癌组与正常对照组比较,β3整联蛋白阳性表达率降低。肝硬化组和肝癌组比较,β3整联蛋白阳性表达率的差异有统计学意义(P < 0.05)。见表 1。
2.3.3 波形蛋白的表达波形蛋白染色后细胞质呈棕黄色,正常肝组织的上皮结构中一般检测不到其表达。肝硬化组织与肝癌组织比较,波形蛋白染色减弱(图 2)。正常对照组中无波形蛋白阳性表达,肝硬化组和肝癌组中分别有3和6例波形蛋白阳性表达,阳性表达率分别为13.6%(3/15)和40.0%(8/14)。肝硬化组、肝癌组与正常对照组比较,波形蛋白阳性表达率增高。肝硬化组与肝癌组比较,波形蛋白阳性表达率的差异有统计学意义(P < 0.05)。见表 1。
2.3.4 纤维连接蛋白的表达纤维连接蛋白表达产物定位于细胞质,部分细胞核也有着色,呈棕黄色至深褐色弥散性分布。肝硬化组织与肝癌组织比较,纤维连接蛋白染色减弱(图 2)。正常对照组中有1例纤维连接蛋白阳性表达,阳性表达率为25.0%(1/4),肝硬化组和肝癌组中分别有3和8例纤维连接蛋白阳性表达,阳性表达率分别为20.0%(3/15)和57.1%(8/14)。肝癌组与正常对照组比较,纤维连接蛋白蛋白阳性表达率增高。肝硬化组与肝癌组比较,纤维连接蛋白阳性表达率的差异有统计学意义(P < 0.05)。见表 1。
3 讨论EMT过程中存在具有重要作用的生物分子标志物。在肝癌形成的理论研究中,EMT过程是目前最主要的一个研究方向。通过挑选若干生物分子标志物作为肝癌进展过程中的监测指标,能够对肝癌的发生、发展及时提出警报,从而提高患者的健康意识,增大肝癌的检出率,尽早为患者提供合适的治疗手段,延长患者生命。
钙黏蛋白是一种同亲型结合、Ca2+依赖的细胞黏着糖蛋白,对胚胎发育中的细胞识别、迁移和组织分化以及成体组织器官构成具有重要作用。研究[5-8]表明钙黏蛋白下调与胰腺癌、胃癌、食管鳞癌、前列腺癌相关。整联蛋白又称整合素,整联蛋白属整合蛋白家族,具有联系细胞外部作用与细胞内部结构的作用。整联蛋白下调强烈影响胶质细胞迁移的速度和方向[9]。波形蛋白负责控制从溶酶体传送由低密度脂蛋白衍生的胆固醇至酯化位点,它还能维持细胞的形状、细胞质的完整性及稳定细胞骨架内的相互作用。BALASUNDARAM和MENKO等[10-11]研究发现波形蛋白上调和人类乳腺癌EMT密切相关,并且这个过程和细胞转移有协同作用,波形蛋白有助于人类乳腺上皮细胞迁移。HANDRA-LUCA等[12]在胰腺导管腺癌肿瘤上皮细胞观察到波形蛋白表达上调。
细胞纤维连接蛋白是一种细胞外糖蛋白,在许多重要的生理过程中起着关键性作用,如胚胎生成、伤口愈合、止血和血栓形成。纤维连接蛋白表达的改变、降解以及组合与大量的病理发生密切相关,包括癌症[13]。纤维连接蛋白参与体内众多生理作用和功能,如各种细胞间的吸附和迁移、细胞骨架组装、酪氨酸磷酸化和肿瘤转移等。SCHITTENHELM等[14]研究显示在胃肠道癌症、膀胱癌中,纤维连接蛋白上调表达。SHARMA等[15]研究显示纤维连接蛋白通过细胞外信号调节激酶和ρ激酶的信号刺激人类肺癌细胞增殖,抑制p21的表达。
本研究成功制备小鼠肝硬化、肝癌动物模型,免疫组化结果显示,小鼠肝硬化组织与肝癌组织比较,E-钙黏蛋白、β3整联蛋白低表达,波形蛋白、纤维连接蛋白高表达,差异有统计学意义(P < 0.05)。进一步说明E-钙黏蛋白、β3整联蛋白的低表达以及波形蛋白、纤维连接蛋白的高表达与肝硬化向肝癌转化有关。检测E-钙黏蛋白、β3整联蛋白、波形蛋白和纤维连接蛋白的表达对判断及预测肝硬化是否转化为肝癌有重要意义,有助于从分子水平判定患者的肝硬化—肝癌发病过程,对肝硬化患者早期发现和检测肝癌的发生,早期治疗,提高预后生存具有重要意义。
| [1] |
MICALIZZI DS, FARABAUGH SM, FORD HL. Epithelial mesenchymal transition in cancer:parallels between normal development and tumor progression[J]. Mammary Gland Biol Neoplasia, 2010, 15(2): 117-134. DOI:10.1007/s10911-010-9178-9 |
| [2] |
ZENG Q, LI W, LU D, et al. CD146, an epithelial-mesenchymal transition inducer, is associated with triple-negative breast cancer[J]. Proc Natl Acad Sci U S A, 2012, 109(4): 1127-1132. DOI:10.1073/pnas.1111053108 |
| [3] |
叶燕丽, 周听熙, 王莲桂. 小鼠的繁殖及在肿瘤学中的应用[J]. 实验动物科学与管理, 2005, 22(1): 6-8. DOI:10.3969/j.issn.1006-6179.2005.01.004 |
| [4] |
阎丽, 柳婧美, 乔伟, 等. 肝硬化基础上大鼠肝癌模型的建立[J]. 第四军医大学学报, 2007, 28(13): 45-46. DOI:10.3321/j.issn:1000-2790.2007.13.010 |
| [5] |
LEWIS-TUFFIN LJ, RODRIGUEZ F, GIANNINI C, et al. Misregulated E-cadherin expression associated with an aggressive brain tumorphenotype[J]. PLoS One, 2010, 5(10): e13665. DOI:10.1371/journal.pone.0013665 |
| [6] |
SUN NX, YE C, ZHAO Q, et al. Long noncoding RNA-EBIC promotes tumor cell invasion by binding to EZH2 and repressing E-cadherin in cervical cancer[J]. PLoS One, 2014, 9(7): e100340. DOI:10.1371/journal.pone.0100340 |
| [7] |
KHARE V, LANG M, DAMMANN K, et al. Modulation of N-glycosylation by mesalamine facilitates membranous E-cadherin expression in colon epithelial cells[J]. Biochem Pharmacol, 2014, 87(2): 312-320. DOI:10.1016/j.bcp.2013.10.021 |
| [8] |
JUSTIN M, DAVID, AYYAPPAN K, et al. . Dishonorable discharge:the oncogenic roles of cleaved E-cadherin fragments[J]. Cancer Res, 2012, 72(12): 2917-2923. DOI:10.1158/0008-5472.CAN-11-3498 |
| [9] |
PGLION F, ETIENNE-MANNEVILLE S. N-cadherin expression level as a critical indicator of invasion in non-epithelial tumors[J]. Cell Adh Migr, 2012, 6(4): 327-332. DOI:10.4161/cam.20855 |
| [10] |
BALASUNDARAM P, SINGH MK, DINDA AK, et al. Study of β-catenin, E-cadherin and vimentin in oral squamous cell carcinoma with and without lymph node metastases[J]. Diagn Pathol, 2014, 9: 145. DOI:10.1186/1746-1596-9-145 |
| [11] |
MENKO AS, BLEAKEN BM, LIBOWITZ AA, et al. A central role for vimentin in regulating repair function during healing of the lens epithelium[J]. Mol Biol Cell, 2014, 25(6): 776-790. DOI:10.1091/mbc.E12-12-0900 |
| [12] |
HANDRA-LUCA A, HONG SM, WALTER K, et al. Tumour epithelial vimentin expression and outcome of pancreatic ductal adenocarcinomas[J]. Br J Cancer, 2011, 104(8): 1296-1302. DOI:10.1038/bjc.2011.93 |
| [13] |
JING Y, JIA D, WONG CM, et al. SERPINA5 inhibits tumor cell migration by modulating the fibronectin-integrin β1 signaling pathway in hepatocellular carcinoma[J]. Mol Oncol, 2014, 8(2): 366-377. DOI:10.1016/j.molonc.2013.12.003 |
| [14] |
SCHITTENHELM J, KLEIN A, TATAGIBA MS, et al. Comparing the expression of integrins αvβ3, αvβ5, αvβ6, αvβ8, fibronectin and fibrinogen in human brain metastases and their corresponding primary tumors[J]. Int J Clin Exp Pathol, 2013, 6(12): 2719-2732. |
| [15] |
SHARMA M, TIWARI A, SHARMA S, et al. Fibrotic remodeling of the extracellular matrix through a novel (engineered, dual-function) antibody reactive to a cryptic epitope on the N-terminal 30 kDa fragment of fibronectin[J]. PLoS One, 2013, 8(7): e69343. DOI:10.1371/journal.pone.0069343 |
 2018, Vol. 47
2018, Vol. 47