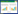文章信息
- 谢俐萍, 金幼虹, 叶芳, 罗玉, 杨娟霞, 陈霞
- XIE Liping, JIN Youhong, YE Fang, LUO Yu, YANG Juanxia, CHEN Xia
- 离子型及Ⅰ型代谢型谷氨酸受体对大鼠温度过敏的调节作用
- Regulatory Effects of Ionotropic and GroupⅠ Metabotropic Glutamate Receptors on Temperature Hypersensitivity in Rats
- 中国医科大学学报, 2018, 47(2): 145-150
- Journal of China Medical University, 2018, 47(2): 145-150
-
文章历史
- 收稿日期:2017-07-11
- 网络出版时间:2018-01-08 10:54
谷氨酸(glutamate,Glu)是脊椎动物主要的兴奋性神经递质,广泛存在于感觉神经末梢和中枢神经系统中,通过激活2种位于突触后脊髓背角神经元及突触前末梢传入纤维内的离子型和代谢型Glu受体起作用。离子型Glu受体包括N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受体、α-氨基-3羟基-5甲基-4异恶唑[(RS)-α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid hydrobromide,AMPA]受体,它们与离子通道耦联形成受体通道复合物,介导快信号传递;代谢型Glu受体与膜内G-蛋白耦联,这些受体被激活后通过G-蛋白效应酶、脑内第二信使等组成的信号转导系统起作用,产生较缓慢的生理反应[1-2]。
本研究将离子型Glu受体作用药Glu、NMDA、AMPA、Ⅰ型代谢型Glu受体作用药[(S)3,5-dihydroxyphenylglycine,(S)-DNPG]、非竞争性NMDA受体拮抗剂[(+)-MK801 maleate,MK-801]、竞争性AMPA受体拮抗剂(6-cyano-7-nitroquinoxaline-2,3-dione,CNQX)和选择性Ⅰ型代谢型Glu受体拮抗剂(7-hydroyiminocyclopropan[b]chromen-1a-carboxylic acid ethyl ester,cpccoEt)分别注射入假手术和脊髓神经结扎大鼠的左侧足底皮下,观察动物对辐射热的反应。
1 材料与方法 1.1 实验动物与试剂选取132只健康成年雄性SD大鼠,6月龄,体质量200~300 g,由南昌大学动物科学部提供。Glu、NMDA、AMPA、(S)-DHPG、MK801、CNQX、cpccoEt和戊巴比妥钠均购自日本大阪Wako Pure化学公司;Hamilton syringe购自美国Reno公司;Plantar Test Model 7370购自意大利Ugo Basile公司。
1.2 方法 1.2.1 动物分组132只大鼠均自由活动,自主摄取食物和水,所有实验步骤都被记录并且经过南昌大学动物保护和使用委员会同意,遵守国际组织对疼痛研究的指南[3]。将60只大鼠进行L5~6脊神经结扎术,随机分成10组,分别为生理盐水组、Glu 1.5 μmol组、Glu 5 μmol组、NMDA 1.5 μmol组、NMDA 5 μmol组、AMPA 1.5 μmol组、(S)-DHPG 1.5 μmol组、MK-801 50 nmol组、CNQX 250 nmol组及cpccoEt 100 nmol组;余下的72只进行假手术,随机分成12组,除了上述10组,增加AMPA 5 μmol组和(S)-DHPG 5 μmol组,术后第14天注射生理盐水及上述药物于假手术和脊神经结扎动物足底部皮下组织中,并于15 min、1 h、2 h、3 h、4 h、5 h和6 h行足底逃避阈值测试。
1.2.2 建立脊神经结扎组和假手术组动物模型手术过程参照KIM等[4]的方法。所有大鼠用戊巴比妥钠麻醉(40 mg/kg,腹腔注射),L4~S2部位皮肤下做小型切口,掀开脊柱旁的肌肉露出脊椎横突。脊神经结扎组大鼠去掉部分横突暴露左侧的L5和L6脊神经,然后用6号丝线在每根神经背根神经节末端紧紧结扎,伤口分层缝合,假手术组大鼠除不结扎脊神经外其余手术过程相同。药物注射方法:将大鼠预先放在一个小盒子内,在无麻醉的情况下,从大鼠左侧后足中点的近心端刺入,将药物或生理盐水注入皮下组织。在检测之前,大鼠至少有14 d愈合时间,术后观察大鼠的精神状态、进食、饮水、伤口愈合情况和大鼠安静时的运动能力。
1.2.3 热痛阈测定观察逃避反应及逃避阈值的情况。逃避阈值比按下列公式计算。逃避阈值比=(药物给予侧的逃避阈值/对照侧的逃避阈值)×100%。参照文献[5-6]方法,通过足底实验检查大鼠对辐射热的敏感性。具体方法为将动物放置于小玻璃盒子内,可以自由活动,一束辐射热照射于足底表面,控制辐射热的强度在能够引起逃避反射的范围(1~24 s),且不会导致足底损伤。
1.3 统计学分析应用SPSS 17.0统计软件包行单向方差分析,结果用x± s表示,P < 0.05为差异有统计学意义。
2 结果 2.1 手术后2组大鼠一般行为学比较假手术组大鼠术后行为学表现较术前无明显改变,而脊神经结扎组大鼠术后随时间进展逐渐出现术侧后肢足趾并拢、足外翻以及反复舔舐术侧后肢等症状;当注射Glu、NMDA、AMPA和(S)-DHPG后,假手术组大鼠出现反复舔舐注射侧后肢的症状,而脊神经结扎组大鼠无明显改变;当注射MK-801、CNQX和cpccoEt后,假手术组大鼠行为学表现无明显改变,而脊神经结扎组大鼠反复舔舐术侧后肢的症状消失。
2.2 手术后2组大鼠对辐射热变化的比较假手术组大鼠左右后足的热逃避阈值无明显差别,左足(11.7±0.29)s,右足(11.5±0.4)s,但是在脊神经结扎大鼠组,术后9~28 d,热逃避阈值显著下降(P < 0.05),术后32~63 d,热逃避阈值恢复至手术前的水平,见图 1A。术后14 d,在6 h内的反复热刺激中,假手术组大鼠左后足的热逃避阈值始终保持在100%,而脊神经结扎大鼠组则保持65.1%±1.6%(P < 0.05),证明造模成功,见图 1B。
|
| A, time after operation; B, 14 d after operation. *P < 0.05 compared with sham-operated rats. 图 1 2组大鼠手术后逃避阈值的比较(n = 6) Fig.1 Comparison of rats' paw withdrawal latency between the two groups after the operation (n = 6) |
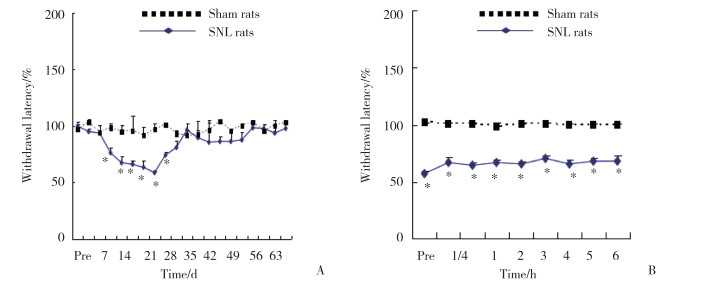
2.3 足底注射谷氨酸后动物对辐射热反应变化的比较
在假手术组,与生理盐水相比,Glu导致热逃避阈值下降,最大下降值发生在注射后15~120 min(P < 0.05),见图 2A。在脊神经结扎大鼠组,与生理盐水相比,无论是1.5 μmol还是5 μmol的Glu均没有导致热逃避阈值的继续降低,见图 2B。
|
| A, sham-operated rats treated with glutamate; B, SNL rats treated with glutamate. *P < 0.05 compared with saline. 图 2 2组大鼠谷氨酸注射后逃避阈值的比较(n = 6) Fig.2 Comparison of rats' paw withdrawal latency between the two groups treated with glutamate (n = 6) |
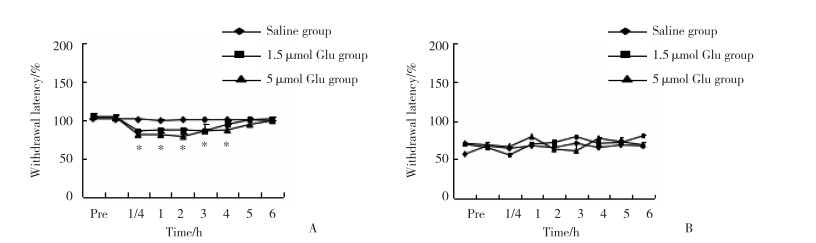
2.4 足底注射NMDA受体作用剂和拮抗剂后动物对辐射热反应变化的比较
在假手术组,与生理盐水相比,NMDA 1.5 μmol组和5 μmol组均导致热逃避阈值下降,最大下降值发生在注射后15~60 min,见图 3A;在脊神经结扎大鼠组,与生理盐水相比,无论是1.5 μmol还是5 μmol的NMDA均没有导致热逃避阈值的继续降低,见图 3B。在假手术组,与生理盐水相比,MK-801(50 nmol)热逃避阈值没有变化,见图 3C;在脊神经结扎大鼠组,与生理盐水相比,MK-801(50 nmol)热逃避阈值显著增加,注射后15 min开始增加,持续时间超过6 h(P < 0.05),见图 3D。
|
| A, sham-operated rats treated with NMDA; B, SNL rats treated with NMDA; C, sham-operated rats treated with MK801; D, SNL rats treated with MK801. *P < 0.05 compared with saline. 图 3 2组大鼠NMDA和MK801注射后逃避阈值的比较(n = 6) Fig.3 Comparison of rats' paw withdraw latency between the two groups treated with NMDA and MK801 (n = 6) |
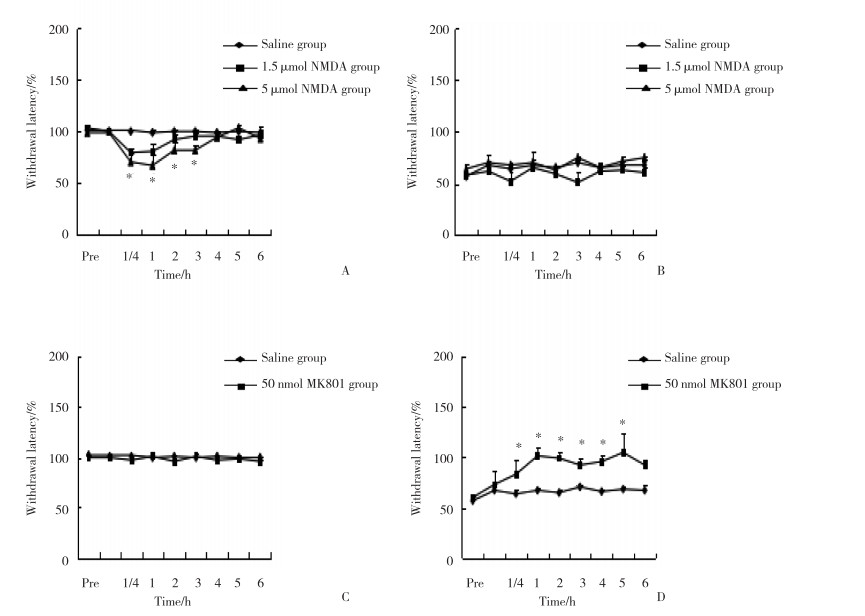
2.5 足底注射AMPA受体作用剂和拮抗剂后动物对辐射热反应变化的比较
在假手术组,与生理盐水相比,AMPA 1.5 μmol组和5 μmol组均导致热逃避阈值下降,最大下降值发生在注射后15~180 min,见图 4A;在脊神经结扎大鼠组,与生理盐水相比,1.5 μmol的AMPA没有导致热逃避阈值的继续降低,见图 4B。在假手术组,与生理盐水相比,CNQX(250 nmol)热逃避阈值没有变化,见图 4C;在脊神经结扎大鼠组,与生理盐水相比,CNQX(250 nmol)热逃避阈值显著增加,注射后15 min开始增加,持续时间超过4 h(P < 0.05),见图 4D。
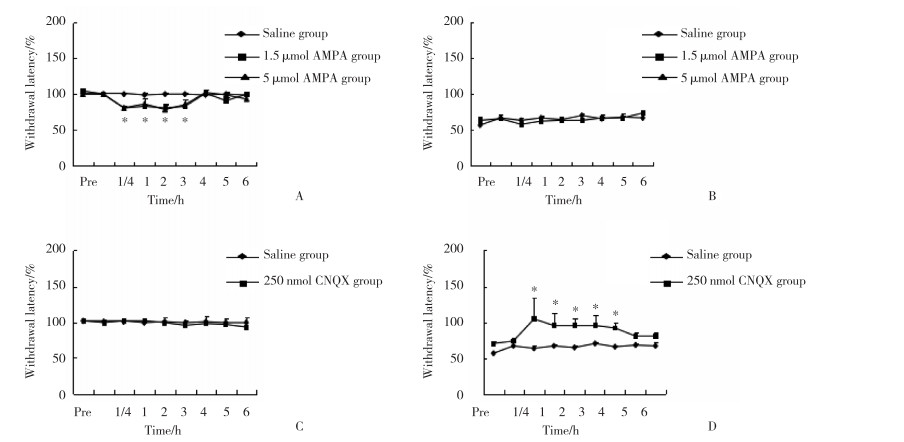
|
| A, sham-operated rats treated with AMPA; B, SNL rats treated with AMPA; C, sham-operated rats treated with CNQX; D, SNL rats treated with CNQX. *P < 0.05 compared with saline. 图 4 2组大鼠AMPA和CNQX注射后逃避阈值的比较(n = 6) Fig.4 Comparison of rats' paw withdraw latency between the two groups treated with AMPA and CNQX (n = 6) |
2.6 足底分别注射Ⅰ型代谢性谷氨酸受体作用剂和拮抗剂后动物对辐射热反应变化的比较
在假手术组,与生理盐水相比,(s)-DHPG 1.5 μmol组和5 μmol组均导致热逃避阈值下降,从注射15 min后开始降低,持续时间超过6 h(P < 0.05),见图 5A;在脊神经结扎大鼠组,与生理盐水相比,1.5 μmol的(s)-DHPG没有导致热逃避阈值的继续降低,见图 5B。在假手术组,与生理盐水相比,cpccoEt(100 nmol)热逃避阈值没有变化,见图 5C;在脊神经结扎大鼠组,与生理盐水相比,注射cpccoEt(100 nmol)后的15~60 min热逃避阈值显著增加(P < 0.05),见图 5D。
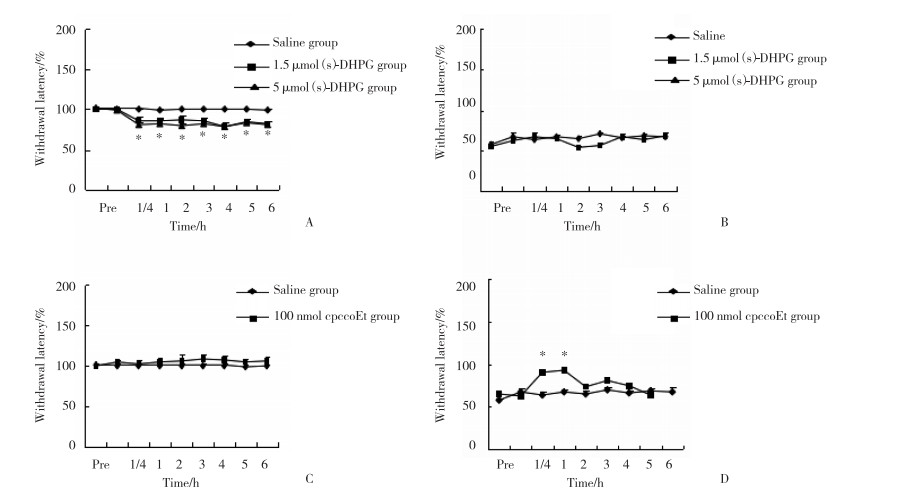
|
| A, sham-operated rats treated with (s) -DHPG; B, SNL rats treated with (s) -DHPG; C, sham-operated rats treated with cpccoEt; D, SNL rats treated with cpccoEt. *P < 0.05 compared with saline. 图 5 2组大鼠(S) -DHPG和cpccoEt注射后逃避阈值的比较(n = 6) Fig.5 Comparison of rats' paw withdraw latency between the two groups treated with (S) -DHPG and cpccoEt (n = 6) |
3 讨论
Glu作为重要的神经递质参与疼痛发生,外源性给予Glu可使正常动物产生疼痛行为,而由其诱导出现的痛觉过敏现象可被NMDA受体拮抗剂阻止[7]。研究[8-10]证实,许多慢性痛动物模型内,由伤害性感受器释放的Glu通过激活离子型Glu和与G蛋白偶联的代谢型谷氨酸受体介导痛觉过敏。
假手术组大鼠术后一般行为学表现较术前无明显改变,而脊神经结扎组大鼠术后随时间进展逐渐出现术侧后肢足趾并拢、足外翻以及反复舔舐术侧后肢等症状,这一研究结果与李晓倩等[11]的坐骨神经结扎术后所观察到的一般行为学相似。注射Glu、NMDA、AMPA和(S)-DHPG后,假手术组大鼠出现反复舔舐注射侧后肢的症状,说明所注射药物引起了大鼠明显的疼痛反应。注射MK-801、CNQX和cpccoEt后,脊神经结扎组大鼠反复舔舐术侧后肢的症状消失,表明MK-801、CNQX和cpccoEt发挥了镇痛作用。
因为体外微渗析显示一侧坐骨神经结扎的小鼠大脑皮质层S1区细胞外Glu含量明显增加[12],坐骨神经部分结扎模型中的大鼠脑脊液中的Glu含量持续增加[13],所以推测本研究脊神经结扎组大鼠神经末梢Glu含量也会持续增加,增加的Glu激活了位于神经末梢的Glu受体,从而导致热敏感性的上升,足底注射离子型Glu受体拮抗剂(MK-801,CNQX)和Ⅰ型代谢型Glu拮抗剂(cpccoEt)后明显抑制了脊神经结扎组大鼠的热敏感行为,有力地说明了外周Glu受体参与和维持了动物的神经病理性疼痛行为。但是外源性的Glu受体作用剂Glu,NMDA,AMPA和(s)-DHPG可以增加假手术组大鼠的温度敏感,却不能再次加大脊神经结扎大鼠的温度敏感,推测可能是由于脊神经结扎大鼠神经末梢游离的Glu已经与其受体达到了饱和结合状态,没有多余的Glu受体再与外源性的Glu作用剂相结合。
本研究的结果显示,Glu受体作用剂Glu、NMDA、AMPA和(s)-DHPG增加了假手术组大鼠的温度敏感,但不能改变脊神经结扎组大鼠的热逃避阈值。另一方面,Glu受体拮抗剂MK-801、CNQX和cpccoEt则可以明显抑制脊神经结扎组大鼠的热敏感,但对假手术组大鼠无效,表明外周Glu受体在疼痛的产生和发展中发挥了重要的调节作用。
| [1] |
JANG JH, NAM TS, JAEBEOM JUN J, et al. Peripheral NMDA receptors mediate antidromic nerve stimulation-induced tactile hypersensitivity in the rat[J]. Mediators Inflamm, 2015, 2015(515): 793624. DOI:10.1155/2015/793624 |
| [2] |
MONTANA MC, GEREAU RW. Metabotropic glutamate receptors as targets for analgesia:antagonism, activation, and allosteric modulation[J]. Curr Pharm Biotechnol, 2011, 12(10): 1681-1688. DOI:10.2174/138920111798357438 |
| [3] |
ZIMMERMANN M. Ethical guidelines for investigations of experimental pain in conscious animals[J]. Pain, 1983, 16(2): 109-110. DOI:10.1016/0304-3959(83)90201-4 |
| [4] |
KIM SH, CHUNG JM. An experimental model for peripheral neuropathy produced by segmental spinal nerve ligation in the rat[J]. Pain, 1992, 50(3): 355-363. DOI:10.1016/0304-3959(92)90041-9 |
| [5] |
JIN YH, YAMAKI F, TAKEMURA M, et al. Capsaicin-induced glutamate release is implicated in nociceptive processing through activation of ionotropic glutamate receptors and group Ⅰ metabotropic glutamate receptor in primary afferent fibers[J]. J Pharmacol Sci, 2009, 109(2): 233-241. DOI:10.1254/jphs.08262FP |
| [6] |
LI J, LI XN, JIANG X, et al. Microvesicles shed from microglia activated by the P2X7-p38 pathway are involved in neuropathic pain induced by spinal nerve ligation in rats[J]. Purinergic Signal, 2017, 13(1): 13-26. DOI:10.1007/s11302-016-9537-0 |
| [7] |
MILLER KE, HOFFMAN EM, SUTHARSHAN M, et al. Glutamate pharmacology and metabolism in peripheral primary afferents:physiological and pathophysiological mechanisms[J]. Pharmacol Ther, 2011, 130(3): 283-309. DOI:10.1016/j.pharmthera.2011.01.005 |
| [8] |
CHEN WL, WALWYN W, ENNES HS, et al. BDNF released during neuropathic pain potentiates NMDA receptors in primary afferent terminals[J]. Eur J Neurosci, 2014, 39(9): 1439-1454. DOI:10.1111/ejn.12516 |
| [9] |
KUNG LH, GONG K, ADEDOYIN M, et al. Evidence for glutamate as a neuroglial transmitter within sensory ganglia[J]. PLoS One, 2013, 8(7): e68312. DOI:10.1371/journal.pone.0068312 |
| [10] |
YASUKUNI KI, WATARU T, MASAMICHI O, et al. Leukotriene enhances NMDA-induced inward currents in dorsal horn neurons of the rat spinal cord after peripheral nerve injury[J]. Mol Pain, 2015, 11(1): 53. DOI:10.1186/s12990-015-0059-5 |
| [11] |
李晓倩, 包娜仁, 张再莉. 大麻素受体1对坐骨神经结扎大鼠神经病理性疼痛的影响及机制[J]. 中国医科大学学报, 2017, 46(3): 205-209. DOI:10.12007/j.issn.0258-4646.2017.03.004 |
| [12] |
KIM SK, HAYASHI H, ISHIKAWA T, et al. Cortical astrocytes rewire somatosensory cortical circuits for peripheral neuropathic pain[J]. J Clin Invest, 2016, 126(5): 1983-1997. DOI:10.1172/JCI828-59 |
| [13] |
INQUIMBERT P, BARTELS K, BABANIYI OB, et al. Peripheral nerve injury produces a sustained shift in the balance between glutamate release and uptake in the dorsal horn of the spinal cord[J]. Pain, 2012, 153(12): 2422-2431. DOI:10.1016/j.pain.2012.08.011 |
 2018, Vol. 47
2018, Vol. 47