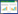文章信息
- 韩方, 姜飞, 张宇华, 张成武
- Han Fang, Jiang Fei, Zhang Yuhua, Zhang Chengwu
- 胃硬癌细胞通过抑制成纤维细胞自噬诱导其衰老的机制
- Scirrhous Gastric Cancer Cell Induces Senescence by Inhibiting Autophagy of Fibroblasts
- 中国医科大学学报, 2018, 47(11): 985-988, 998
- Journal of China Medical University, 2018, 47(11): 985-988, 998
-
文章历史
- 收稿日期:2018-09-08
- 网络出版时间:2018-11-01 16:38
2. 杭州医学院附属浙江省人民医院检验中心, 杭州 310014
2. Clinical Laboratory Center, Zhejiang Provincial People's Hospital, Hangzhou Medical College, Hangzhou 310014, China
胃硬癌也称作弥漫性浸润性胃癌,表现为快速增殖未分化的肿瘤细胞、大量的结缔组织和早期转移的特性[1],预后极差[2]。肿瘤相关成纤维细胞在胃硬癌的转移中参与了肿瘤转移、血管的侵入破坏、远处定植的过程[3]。研究[4]发现,干扰成纤维细胞正常自噬的功能,可以导致其过早衰老。然而,作为衰老影响因素之一的自噬,在胃硬癌对肿瘤相关成纤维细胞中的作用目前仍不十分清楚。本研究以胃硬癌细胞对成纤维细胞的作用为切入点,观察胃硬癌细胞条件培养基(conditioned medium,CM)对正常成纤维细胞的影响,并探讨胃硬癌对肿瘤成纤维细胞的作用机制,为进一步研究肿瘤与肿瘤相关成纤维细胞的相互作用机制提供理论依据。
1 材料与方法 1.1 材料人类转移性胃硬癌细胞系KATOⅢ、胃印戒细胞癌细胞NUGC4、人类成纤维细胞FEF3和WI38,购自美国ATCC公司。FEF3-GFP由FEF3转染荧光素酶质粒后构建筛选获得。细胞培养使用DMEM培养基和胎牛血清,购自美国Inventrogen公司。Western blotting所使用抗体,购自英国Abcam公司或美国Inventrogen公司。mTOR抑制剂雷帕霉素,购自美国Sigma公司。细胞衰老检测使用C0602 Cellular Senescence Detection Kit SA-β-Gal Staining,购自上海Beyotime公司。CCK-8试剂盒,购自日本Dojindo公司。以上试剂盒配置和使用均按照说明书进行操作。
1.2 方法 1.2.1 CM的制备和成纤维细胞的处理将对数生长期的KATOⅢ和NUGC4肿瘤细胞系种于6孔板上,10%血清稳定24 h,换无血清培养基1 mL培养48 h,培养基离心取上清。后使用NaHCO3或HCl调节至pH=7.3,经滤网过滤后,CM制备成功。FEF3/FEF3-GFP和WI38细胞稳定24 h后,更换为CM,每24 h拍照观察。
1.2.2 CCK-8增殖实验将FEF3按照1×104/孔铺于96孔板中,10%胎牛血清稳定24 h后,首次计数。实验分组:FEF3细胞株分别使用为KATOⅢ-CM、NUGC4-CM处理,并设置无血清组为对照组,每组8个复孔。每孔加入100 μL CM。每24 h取出1组进行实验,剩余更换CM。CCK-8增殖实验按照说明书操作进行。按照上述处理方案一共处理5 d,绘制增殖曲线。
1.2.3 SA-β-Gal染色移除并冲洗待染色的成纤维细胞。固定液固定15 min。加入染色剂。37 ℃过夜。次日拍照。以上染色步骤均按照说明书操作进行[5]。
1.2.4 雷帕霉素处理细胞按照说明书配置工作液,处理细胞使用量为10 nmol,加入CM中与成纤维细胞共培养。共培养72 h后提取成纤维细胞蛋白,96 h后光镜下染色观察。
1.2.5 Western blotting提取成纤维细胞系样本总蛋白,根据蛋白浓度定量。配置蛋白上样液,点样,电泳,转膜,4 ℃过夜孵育一抗,37 ℃孵育二抗45 min,发光,抗体剥脱,封闭。GAPDH为内参,凝胶图像处理系统分析目的条带的光密度值。
1.3 统计学分析采用SPSS 20.0统计软件,组间比较采用单因素方差分析和t检验。P < 0.05为差异有统计学意义。所有结果均重复3次。
2 结果 2.1 CM处理后成纤维细胞形态学发生改变KATOⅢ-CM处理48 h后的FEF3、WI38细胞,出现大量细胞死亡。FEF3-GFP荧光显微镜镜下观察,发现成纤维细胞出现胞质空泡化、细胞核固缩、细胞皱缩等特征性表现。见图 1。
|
| Light microscopy, original magnification ×40;fluorescence microscopy, original magnification ×100. SF, serum free. 图 1 KATOⅢ-CM处理48 h后成纤维细胞的形态学改变 Fig.1 Morphological changes of fibroblasts treated with KATOⅢ-CM for 48 h |
2.2 胃硬癌CM导致成纤维细胞死亡
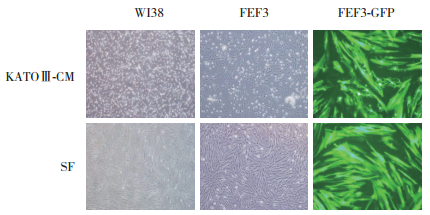
使用KATOⅢ-CM和NUGC4-CM处理FEF3细胞后,CM培养下的成纤维细胞系出现死亡,随着时间的推移,CM对成纤维细胞的毒性逐渐增大,细胞死亡增多。而对照组基本维持一定水平。第2天开始,KATOⅢ-CM组和NUGC4-CM组细胞数均少于对照组,差异有统计学意义(P < 0.05)。见图 2。
|
| * P < 0.05 vs SF; ** P < 0.01 vs SF; *** P < 0.001 vs SF. SF, serum free. 图 2 不同CM处理组和对照组FEF3细胞的增殖曲线 Fig.2 Proliferation activity curves of FEF3 cells in CM-treated and control groups |
2.3 CM抑制自噬的发生
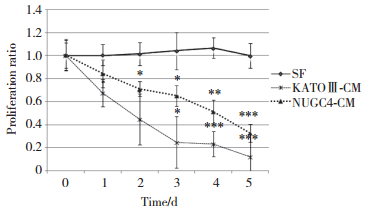
KATOⅢ-CM作用于FEF3和WI38细胞后,2种细胞中p62、LC3逐渐累积,而LC3-Ⅰ到LC3-Ⅱ的诱导在FEF3和WI38中均未见明显升高。说明CM处理后,成纤维细胞的自噬受到不同程度的抑制。除此之外,PARP表达上调,表明CM对成纤维细胞DNA有损伤,并引起凋亡增加。这与之前光镜所见的形态学变化结果一致。此外,衰老相关的p21蛋白表达上调。见图 3A、3B。
|
| A, protein expressions in FEF3 cells; B, protein expressions in WI38 cells; C, protein expressions in FEF3 cells after treatment with CM + rapamycin. 1, SF;2, NUGC4-CM; 3, KATOⅢ-CM; 4, SF + rapamycin; 5, NUGC4-CM + rapamycin; 6, KATOⅢ-CM + rapamycin. SF, serum free. 图 3 Western blotting检测CM处理48 h后成纤维细胞蛋白表达水平 Fig.3 Expressions of proteins in fibroblasts treated with CM after 48 hours, detected using Western blotting |
2.4 细胞出现过早衰老
对KATOⅢ-CM和NUGC4-CM处理96 h后的FEF3和WI38细胞进行SA-β-Gal染色[6],结果发现,CM作用于成纤维细胞后,诱导了细胞的衰老。在CM作用条件下,大量细胞被染色。表明CM可以使成纤维细胞提前衰老。见图 4。
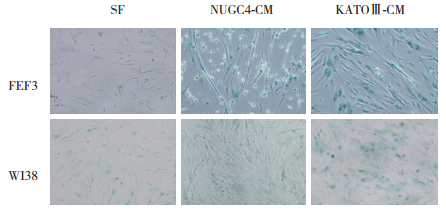
|
| 图 4 CM培养FEF3和WI38细胞96 h后SA-β-Gal染色结果×100 Fig.4 SA-β-galactosidase staining of FEF3 and WI38 cells after cultivation with CM for 96 hours ×100 |
2.5 雷帕霉素抑制CM作用下成纤维细胞的衰老
雷帕霉素作为mTOR通路抑制剂,可以诱导自噬。使用雷帕霉素处理KATOⅢ-CM和NUGC4-CM作用下的FEF3和WI38细胞,结果发现,雷帕霉素处理后的成纤维细胞,LC3-Ⅰ到LC3-Ⅱ的变化增加,p62轻微上调,表明自噬被激活。p21表达下调,SA-β-Gal染色变浅,衰老被抑制。见图 3C、图 5。
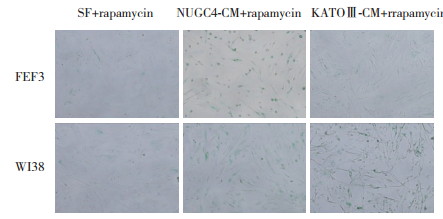
|
| 图 5 雷帕霉素与CM培养FEF3和WI38细胞96 h后SA-β-Gal染色结果×100 Fig.5 SA-β-galactosidase staining of FEF3 and WI38 cells after cultivation with CM and rapamycin for 96 hours ×100 |
3 讨论
肿瘤微环境是肿瘤赖以生存的组织环境,其中成纤维细胞是细胞外基质中的重要细胞[7]。肿瘤发生和转移的过程中,成纤维细胞必须激活成为肿瘤成纤维细胞后才能为肿瘤的恶性行为提供帮助[8-9]。目前认为,肿瘤细胞可以分泌某些细胞因子,作用于周围的组织细胞[10]。然而,具体作用机制仍不十分明了。
本研究使用胃硬癌CM对成纤维细胞进行处理。研究发现,随着作用时间的推移,细胞出现了细胞核固缩、细胞质空泡化等特征性形态学改变。此外,CM对正常成纤维细胞的致死性存在时间效应关系。在该类胃癌患者病理组织中,肿瘤间质中可见大量胶原蛋白、细胞外基质等成分,其中散在少量的异型成纤维细胞[11]。因此推断,肿瘤细胞对周围正常成纤维细胞产生毒性,促使成纤维细胞发生改变,从而适应其肿瘤生物学需求。
当机体或细胞发生应激状态时,自噬作为机体防御机制被加强,为细胞适应环境起到了重要作用[12]。本研究使用KATOⅢ-CM作用于2种不同种类的成纤维细胞,结果发现,经过CM处理后的成纤维细胞自噬相关蛋白的累积、自噬受到抑制。此外,DNA损伤相关的重要蛋白PARP在CM处理后表达上调,这证明CM通过减少自噬,导致部分成纤维细胞死亡。然而经过CM处理后的成纤维细胞,除了部分凋亡,还有部分可以长期存活。而这些残存的成纤维细胞与原始细胞形态学差别很大,表现出明显的异型性。据此猜测,在体内条件下,这些成纤维细胞通过胃硬癌细胞的作用可能也发生了类似的改变。
由于肿瘤的发生发展必须绕过衰老的发生[13],然而衰老的成纤维细胞可以促进肿瘤的生物学行为[14]。因此,本研究检测了在CM作用下成纤维细胞的衰老情况。结果发现,在CM培养下成纤维细胞发生衰老、形态学改变。在使用雷帕霉素与CM共同作用成纤维细胞后发现,成纤维细胞的凋亡减少、自噬诱导、衰老被抑制。根据以上结果推测,胃硬癌细胞可能通过抑制自噬,从而促使成纤维细胞凋亡和过早衰老,衰老的成纤维细胞起到促进肿瘤生物学行为的作用。成纤维细胞可能通过启动这样的自我保护机制,使肿瘤细胞对成纤维细胞的毒性作用降低,这可能是一种成纤维细胞的自我保护机制。但另一方面,这种机制可能使成纤维细胞转变为肿瘤相关成纤维细胞,反过来促进胃硬癌的早期转移[15]。
综上所述,胃硬癌CM通过抑制成纤维细胞自噬,诱导其早期衰老。成纤维细胞可能通过这样的方式转变为肿瘤相关成纤维细胞,并最终参与了该类胃癌的早期转移。然而胃硬癌通过何种方式、分泌何种细胞因子进入细胞基质使得成纤维细胞发生这种改变,还有待深入研究。本研究结果显示,胃硬癌细胞CM可以作用于成纤维细胞,使成纤维细胞凋亡增加、自噬阻断、并诱导细胞的早期衰老。本研究结果为深入研究二者相互作用机制,提供了实验依据。
| [1] |
JAPANESE GASTRIC CANCER ASSOCIATION. Japanese classification of gastric carcinoma:3rd English edition[J]. Gastric Cancer, 2011, 14(2): 101-112. DOI:10.1007/s10120-011-0041-5 |
| [2] |
IKEGUCHI M, MIYAKE T, MATSUNAGA T, et al. Recent results of therapy for scirrhous gastric cancer[J]. Surg Today, 2009, 39(4): 290-294. DOI:10.1007/s00595-008-3860-1 |
| [3] |
PISTORE C, GIANNONI E, COLANGELO T, et al. DNA methylation variations are required for epithelial-to-mesenchymal transition induced by cancer-associated fibroblasts in prostate cancer cells[J]. Oncogene, 2017, 36(40): 5551-5566. DOI:10.1038/onc.2017.159 |
| [4] |
KANG HT, LEE KB, KIM SY, et al. Autophagy impairment induces premature senescence in primary human fibroblasts[J]. PLoS One, 2011, 6(8): e23367. DOI:10.1371/journal.pone.0023367 |
| [5] |
DIMRI GP, LEE X, BASILE G, et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo[J]. Proc Natl Acad Sci U S A, 1995, 92(20): 9363-9367. DOI:10.1073/pnas.92.20.9363 |
| [6] |
KRTOLICA A, PARRINELLO S, LOCKETT S, et al. Senescent fibroblasts promote epithelial cell growth and tumorigenesis:a link between cancer and aging[J]. Proc Natl Acad Sci USA, 2001, 98(21): 12072-12077. DOI:10.1073/pnas.211053698 |
| [7] |
LI W, NG JM, WONG CC, et al. Molecular alterations of cancer cell and tumour microenvironment in metastatic gastric cancer[J]. Oncogene, 2018, 37(36): 4903-4920. DOI:10.1038/s41388-018-0341-x |
| [8] |
冯仁鑫, 陈升, 刘娇, 等. 肿瘤相关成纤维细胞对肝癌干细胞的影响[J]. 胃肠病学, 2016, 21(9): 517-522. DOI:10.3969/j.issn.1008-7125.2016.09.002 |
| [9] |
SHIGA K, HARA M, NAGASAKI T, et al. Cancer-associated fibroblasts:their characteristics and their roles in tumor growth[J]. Cancers (Basel), 2015, 7(4): 2443-2458. DOI:10.3390/cancers7040902 |
| [10] |
HASEGAWA T, YASHIRO M, NISHII T M, et al. Cancer-associated fibroblasts might sustain the stemness of scirrhous gastric cancer cells via transforming growth factor-beta signaling[J]. Int J Cancer, 2014, 134(8): 1785-1795. DOI:10.1002/ijc.28520 |
| [11] |
刘大千, 杨昭婷, 倪卫东, 等. 癌相关成纤维细胞标志物在食管鳞癌中的临床病理学意义[J]. 广东医学, 2018, 39(7): 1004-1007. DOI:10.13820/j.cnki.gdyx.20180424.006 |
| [12] |
YANG Z, KLIONSKY DJ. Eaten alive:a history of macroautophagy[J]. Nat Cell Biol, 2010, 12(9): 814-822. DOI:10.1038/ncb0910-814 |
| [13] |
REDDEL RR. The role of senescence and immortalization in carcinogenesis[J]. Carcinogenesis, 2000, 21(3): 477-484. DOI:10.1093/carcin/21.3.477 |
| [14] |
RUHLAND MK, LOZA AJ, CAPIETTO AH, et al. Stromal senescence establishes an immunosuppressive microenvironment that drives tumorigenesis[J]. Nat Commun, 2016, 7: 11762. DOI:10.1038/ncomms11762 |
| [15] |
DENTON AE, ROBERTS EW, FEARON DT. Stromal cells in the tumor microenvironment[J]. Adv Exp Med Biol, 2018, 1060: 99-114. DOI:10.1007/978-3-319-78127-3_6 |
 2018, Vol. 47
2018, Vol. 47