文章信息
- 王笑楠, 汪旭, 孙明军, 王颖, 刘梦园, 宋顺喆, 李妍霞, 褚旭芳
- 超声内镜诊断肠道子宫内膜异位症的临床价值
- Endoscopic Ultrasonography for the Diagnosis of Intestinal Endometriosis
- 中国医科大学学报, 2018, 47(11): 1036-1038
- Journal of China Medical University, 2018, 47(11): 1036-1038
-
文章历史
- 收稿日期:2018-03-05
- 网络出版时间:2018-11-01 14:07
肠道子宫内膜异位症是子宫内膜异位症的一个组成部分,因其非特异性消化道症状,临床诊断困难,极易误诊。本文对4例肠道子宫内膜异位症患者的临床资料进行回顾分析,将超声内镜检查结果与手术探查和(或)患者的临床过程进行比较,结合国内外相关文献总结分析超声内镜诊断该病的价值。
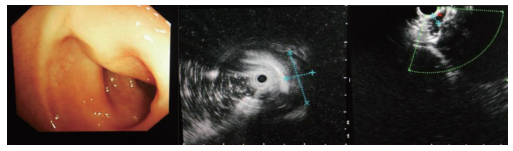
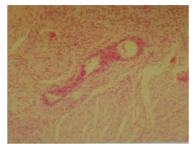
1 临床资料 1.1 病例1患者,女,42岁,因便血3个月入院。入院后完善肠镜检查:距肛缘10~12 cm直肠前壁见一广基隆起,范围约2.0 cm×2.0 cm,表面黏膜尚光滑,针对直肠隆起,建议进一步行超声内镜检查。内镜所见:距肛缘约10~12 cm处一隆起,隆起位于直肠前壁方向,质地韧,表面光滑,未见糜烂及溃疡形成。超声所见:隆起处肠壁第1、2层回声带未见异常,第3层高回声带略增厚,第4层低回声带明显增厚,并向壁外延伸,呈弥漫低回声,回声尚均匀。低回声区外界临近子宫(图 1)。直肠隆起,结合内镜及超声所见,考虑子宫内膜异位症可能性大(低回声区与固有肌层关系密切,且向壁外延伸)。追问妇科病史,患者既往左侧附件切除术后8年、右侧卵巢巧克力囊肿核除术后6年,患者结婚10年,未避孕,未怀孕,平素月经规律,有经期下腹痛病史。后患者转入妇科手术治疗,术中可见子宫后壁下1/2与直肠前壁粘连。术后病理回报:符合子宫内膜异位症(图 2)。
|
| 图 1 肠道子宫内膜异位症超声内镜所见 |
|
| 图 2 肠道子宫内膜异位症术后子宫直肠窝子宫内膜异位结节病理图片×100 |
1.2 病例2
患者,女,42岁,因经期下腹痛1年入院。外院结肠镜检查提示:距肛缘10 cm黏膜改变。为明确直肠病变,于我院行超声内镜检查。内镜所见:距肛缘约10 cm可见局部黏膜充血、水肿、色潮红,并可见黏膜鱼鳞样改变,水肿导致黏膜脆性增加,探头轻触即可见少量渗血。超声所见:于黏膜改变处可见局部肠管壁第4层低回声带增厚,并向管腔外突出,增厚肠壁第4层低回声带厚度约11.3 mm。该低回声带向直肠管壁外延续,弥漫成片,无明显边界。彩色多普勒显示,增厚直肠管壁处血供较丰富。直肠黏膜改变,结合超声图像,考虑子宫内膜异位症可能性大(异常黏膜处直肠固有肌层增厚)。后患者转入妇科手术治疗,术后病理回报:符合子宫内膜异位症诊断。
1.3 病例3患者,女,48岁,因经期下腹痛半年入院。肠镜检查提示:距肛缘10 cm可见隆起,约2.5 cm×2.5 cm,表面光滑,色泽与周围黏膜一致,可见桥型皱襞,针对其直肠隆起,建议完善超声内镜。内镜所见:于直肠距肛缘约10 cm前壁方向可见一隆起,表面光滑,色泽与周围黏膜一致,隆起质地韧,触之无活动。超声所见:于隆起处观察,可见该处呈低回声,切面大小约1.5 cm×1.5 cm,内部以低回声为主,可见点状无回声。隆起边缘与肠壁第4层低回声带延续。略移动探头,可见该低回声区向壁外延伸,并与壁外子宫边缘相连。彩色多普勒示,低回声区内部可见条状血流信号。直肠隆起,结合内镜及超声所见,考虑子宫内膜异位症可能性大。后患者转入妇科手术治疗,术后病理符合子宫内膜异位症。
1.4 病例4患者,女,48岁,因排便不成形2年入院。肠镜检查提示:距肛缘8 cm可见纵长约2.5 cm、约环1/3周黏膜水肿样改变,结节状。病变处管壁略僵硬感。进一步完善超声内镜检查。内镜所见:于直肠左前壁方向可见局部黏膜凹凸不平,色泽略红。该处肠壁僵硬感,表面未见糜烂及溃疡形成。黏膜改变处距肛缘约8 cm。其旁后壁方向可见白色瘢痕,表面光滑。超声所见:于隆起处观察,可见直肠前壁壁外子宫结构,相当于隆起处,可见肠壁第4层低回声带增厚,约9.5 cm,层次欠清晰,且低回声区直肠管腔外延续,壁外呈不均匀混杂回声,且低回声区局部与子宫低回声分界欠清楚。彩色多普勒显示,增厚肠壁低回声范围内可见点状血流信号。考虑肠道子宫内膜异位症,后患者于妇科就诊,给予激素治疗。在1年的随访中,患者症状已经缓解,复查肠镜病变缩小。
2 讨论 2.1 疾病一般情况子宫内膜异位症是一种常见的妇科疾病,发病率逐年升高。子宫内膜异位症是指有功能的子宫内膜组织位于子宫腔以外的部位引起的疾病[1]。肠道子宫内膜异位症是子宫内膜异位症的一个组成部分,12%~37%的子宫内膜异位症累及肠道,最常见的是乙状结肠与直肠受累,约占85%,从而引发腹痛、排便习惯改变或周期性便血等非特异性消化道症状[2]。本病在形态学上虽呈良性表现,但在临床行为学上具有种植、侵袭及远处转移等类似恶性肿瘤的特点。异位病灶可随每次月经周期不断增大并向周围浸润生长,对药物治疗反应差,多需手术治疗,因此术前诊断很重要。但术前肠镜、钡剂灌肠、电子计算机X线断层扫描技术或核磁共振成像检查常难以准确判断肠道是否受累。
近年来内镜诊断技术逐渐发展,超声内镜已经成为消化道疾病的重要诊断及治疗手段。超声内镜综合内镜和超声功能于一体,随着设备的不断进步,超声扫查频率的不断增大,使消化道管壁的结构层次显示的更加清晰,对消化道黏膜下的病变有独特的诊断优势。
2.2 症状肠道子宫内膜异位病变的肠壁可有不同大小和深度的浸润。一般来说,只达到浆膜下脂肪组织的小的子宫内膜异位病灶不会引起症状。浸润肠肌层的较大结节引起多种症状,包括排便困难、便秘、腹泻、腹胀、排便疼痛和周期性直肠出血等。因其症状多样,无特异表现,因此很难与肠易激综合征、结直肠炎性病变、结直肠肿瘤等鉴别。
2.3 诊断常用于明确肠道子宫内膜异位症诊断的检查主要有经阴道超声检查、钡剂灌肠、结肠镜检查、磁共振影像学和直肠超声内镜检查等。经阴道超声检查的局限性在于不能判定直肠病灶距肛缘的准确距离,不能精确测定直肠壁受浸润的深度,对于较小的病灶也不易诊断。钡剂灌肠造影不能评估病灶浸润肠壁的深度,敏感性低。因该病典型病灶位于黏膜下层,因而一般在结肠镜检查过程中观察不到。磁共振用于诊断肠道子宫内膜异位症时,由于出血性小的结节具有非常接近于周围肌肉结构的信号强度,所以通过磁共振诊断困难[3]。相比之下,超声内镜是一种非侵入性技术,具有高敏感性和特异性(分别为97%~100%和97%~100%)[4-6],该检查可以估计肠壁内子宫内膜异位症(特别是固有肌层浸润)的浸润深度、病变的最大直径和病变距肛缘的距离,是诊断肠道子宫内膜异位症的敏感技术。
2.4 治疗一旦确诊后,可以采取药物治疗或手术切除。药物治疗可显著改善肠道狭窄 < 60%患者的疼痛和肠道症状。然而,研究表明药物疗法不能阻止子宫内膜异位症的进展,因此应定期监测接受长期治疗的患者。肠道狭窄大于60%的症状性患者应行肠道子宫内膜异位症手术切除[7]。因本病具有侵袭性生长的特点,并有恶变的潜能,因此明确诊断、尽早治疗很重要。
综上所述,肠道子宫内膜异位症的症状并不是特异的。因此,有消化道症状的女性患者就诊时,消化科医生应考虑肠道子宫内膜异位症的可能。肠道子宫内膜异位症是常见而复杂的疾病,明确的诊断是制订正确治疗策略的前提。超声内镜检查是评估胃肠道病变的敏感方法,可以评估病变大小、起源层和回声纹理,并区分壁内和外膜之间的损伤[8-9],是诊断肠道子宫内膜异位症的非侵入性敏感技术,并为术前提供更多的信息与指导。
| [1] |
BADIPATLA KR, VUPPUTUR A, NIAZI M, et al. Colonic endometriosis:dig deeper for diagnosis[J]. Gastroenterology Res, 2017, 10(1): 59-62. DOI:10.14740/gr760e |
| [2] |
BACALBASA N, BALESCU I, FILIPESCU A. Ileocecal obstruction due to endometriosis——a case report and literature review[J]. In Vivo, 2017, 31(5): 999-1002. DOI:10.21873/invivo.11160 |
| [3] |
姚书忠, 梁炎春. 肠道子宫内膜异位症诊断及治疗[J]. 中国实用妇科与产科杂志, 2013, 29(1): 14-17. |
| [4] |
ROSEAU G, DUMONTIER I, PALAZZO L, et al. Rectosigmoid endometriosis:endoscopic ultrasound features and clinical implications[J]. Endoscopy, 2000, 32(7): 525-530. DOI:10.1055/s-2000-9008 |
| [5] |
DONIEC JM, KAHLKE V, PEETZ F, et al. Rectal endometriosis:high sensitivity and specificity of endorectal ultrasound with an impact for the operative management[J]. Dis Colon Rectum, 2003, 46(12): 1667-1673. DOI:10.1097/01.DCR.0000093605.32384.07 |
| [6] |
DUMONTIER I, CHAPRON C, CHAUSSADE S, et al. Utility of rectal endoscopic ultrasonography for digestive involvement of pelvic endometriosis. Technique and results[J]. Gynecol Obstet Fertil, 2002, 30(12): 979-984. DOI:10.1016/S1297-9589(02)00492-7 |
| [7] |
FERRERO, CAMERINI, MAGGIORE ULR, et al. Bowel endometriosis:recent insights and unsolved problem[J]. World J Gastrointest Surg, 2011, 3(3): 31-38. DOI:10.4240/wjgs.v3.i3.31 |
| [8] |
MEZZI G, FERRARI S, ARCIDIACONO PG, et al. Endoscopic rectal ultrasound and elastosonography are useful in flow chart for the diagnosis of deep pelvic endometriosis with rectal involvement[J]. J Obste Gynaecol Res, 2011, 37(6): 586-590. DOI:10.1111/j.1447-0756.2010.01413.x |
| [9] |
ROSEAU G. Recto-sigmoid endoscopic-ultrasonography in the staging of deep infiltrating endometriosis[J]. World J Gastrointest Endosc, 2014, 6(11): 525-533. DOI:10.4253/wjge.v6.i11.525 |
 2018, Vol. 47
2018, Vol. 47