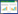文章信息
- 郭冰玉, 回蔷, 常鹏, 陶凯
- GUO Bingyu, HUI Qiang, CHANG Peng, TAO Kai
- miR-489抑制黑色素瘤细胞的增殖
- miR-489 Inhibits the Proliferation of Melanoma Cells
- 中国医科大学学报, 2018, 47(11): 1029-1031, 1042
- Journal of China Medical University, 2018, 47(11): 1029-1031, 1042
-
文章历史
- 收稿日期:2017-04-18
- 网络出版时间:2018-11-01 14:02
随着分子生物学的深入研究,人们认识到肿瘤是一种基因相关疾病,肿瘤患者体内往往存在着癌基因的激活以及抑癌基因的失活现象。各种基因的异常表达导致细胞逃避正常机体生理调控功能,出现增殖异常和凋亡失控等现象。恶性黑色素瘤是一种常见的恶性肿瘤,早期手术切除及联合放化疗的综合治疗手段可以使黑色素瘤患者获得较好的治疗效果,但是黑色素瘤通常极易发生转移,一旦发生转移患者的预后通常较差。目前已有研究[1-2]表明,黑色素瘤中异常表达的微小RNA(microRNA,miRNA)多达数十种,miR-194、miR-204、miR-34和miR-216等在黑色素瘤中的表达和作用机制已经有了较为深入的研究,它们通过调控各种与细胞增殖、侵袭、凋亡等相关的基因发挥抑癌或促癌的作用。miR-489已经被报道在膀胱癌、前列腺癌、胃癌等多种肿瘤中发挥抑制肿瘤生长和抑制肿瘤迁移的作用[3-4],但是在黑色素瘤中未见报道。本研究以人黑色素瘤A375细胞作为研究对象,探讨miR-489对黑色素瘤细胞增殖的抑制作用,并进一步检测miR-489对其增殖相关蛋白的调节作用,为临床上黑色素瘤的诊疗提供新的方案。
1 材料与方法 1.1 材料人成纤维细胞细胞系、黑色素瘤细胞系A375和A875(实验室冻存),DMEM培养基(美国HyClone公司),胎牛血清(天津灏洋生物制品科技有限责任公司),miR-489 mimic/control、miR-489 inhibitor/control(广州锐博生物科技有限公司),四甲基偶氮唑蓝、DMSO(上海碧云天生物技术有限公司)。
1.2 方法 1.2.1 细胞培养使用含体积分数10%胎牛血清的DMEM培养基培养A375细胞,置5% CO2培养箱中培养。
1.2.2 MTT实验消化培养至对数生长期的细胞,以1×104/孔的数量接种于96孔培养板中,24 h后分别在A375细胞内转染miR-489 mimic/control或者miR-489 inhibitor/control。转染后于0、12、24、36和48 h分别加入10 μL的5 mg/mL MTT,继续培养4 h后使用1 mL注射器吸去上清,每孔中使用200 μL DMSO溶解结晶,随后在490 nm处记录吸光值。
1.2.3 Western blotting不同因素处理细胞24 h后,收集细胞,使用RIPA(上海碧云天)裂解细胞提取蛋白。30 μg蛋白进行SDS-PAGE电泳(80~120 V)、100 V转膜1 h后,室温封闭2 h。一抗孵育过夜,二抗室温1 h。CDK2、cyclin E和GAPDH抗体以及相关二抗均购置于美国SANTA公司。
1.2.4 实时PCR不同因素处理细胞24 h后,通过TRIZOL法提取细胞总RNA,反转录成cDNA,进行实时PCR。所用引物为CDK2,正向5’-GCCATTCTCATC GGGTCCTC-3’,反向5’-ATTTGCAGCCCAGGAGGAT T-3’;cyclin E,正向5’-CCATCATGCCGAGGGAGC-3’,反向5’-AAGGCCGAAGCAGCAAGTAT-3’;GAPDH,正向5’-CTCTGCTCCTCCTGTTCGAC-3’,反向5’-GC GCCCAATACGACCAAATC-3’。获取细胞中miRNA后,用miR-489特异性茎环引物进行miR-489的逆转录反应。序列如下:5’-CTCATACGGTGTCGTGGA GTCGCATCATGTGAGGCTGCGTT-3’。在miR-489逆转录后,使用SYBR试剂盒(日本TaKaRa公司),根据说明书进行PCR反应,检测miR-489的表达。用U6作为对照。
1.3 统计学分析采用SPSS 17.0软件进行统计学分析,应用成组设计t检验分析MTT中不同因素作用于细胞后的吸光度值与对照组的差异以及不同处理因素作用细胞后蛋白和mRNA水平与对照组的差异,P < 0.05为差异有统计学意义。
2 结果 2.1 miR-489在细胞中的表达情况分别检测miR-489在成纤维细胞、A375细胞与A875细胞中的表达情况,结果发现miR-489在黑色素瘤细胞(A375和A875)中的表达显著低于成纤维细胞。见图 1。
|
| * P < 0.05 vs fibroblasts. 图 1 miR-489在细胞中的表达情况 Fig.1 Expression of miR-489 in cells |
2.2 miR-489对A375细胞增殖的影响
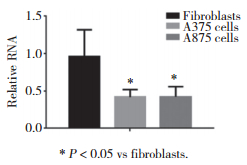
在A375细胞中过表达miR-489或者将miR-489表达下调后,采用MTT检测miR-489对A375细胞的增殖影响。结果发现,miR-489过表达后可以显著抑制A375细胞的增殖作用,反之,当miR-489下调后,A375细胞的增殖作用受到促进。见图 2。
|
| A, proliferation of A375 cells was inhibited by miR-489; B, proliferation of A375 cells was promoted after miR-489 was inhibited. n = 3. 图 2 miR-489对A375细胞增殖的影响 Fig.2 Effect of miR-489 on proliferation of A375 cells |
2.3 miR-489对增殖相关蛋白的影响
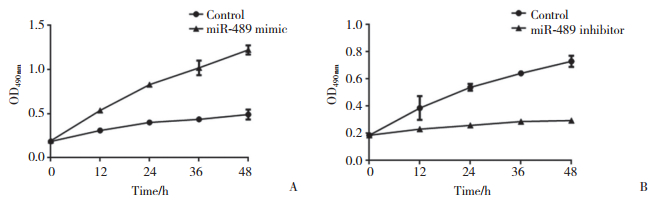
在A375细胞中分别将miR-489过表达或者抑制miR-489表达24 h后,Western blotting检测发现,miR-489过表达可以显著抑制A375细胞中CDK2和cyclin E的表达,反之,miR-489受到抑制后,CDK2和cyclin E的表达上升。见图 3。
|
| A, expression of CDK2 and cyclin E protein was inhibited by miR-489; B, expression of CDK2 and cyclin E protein was promoted after miR-489 was inhibited. 图 3 Western blotting检测miR-489对A375细胞CDK2和cyclin E蛋白水平的影响 Fig.3 CDK2 and cyclin E protein in A375 cells detected by Western blotting after treatment with miR-489 mimic/inhibitor |
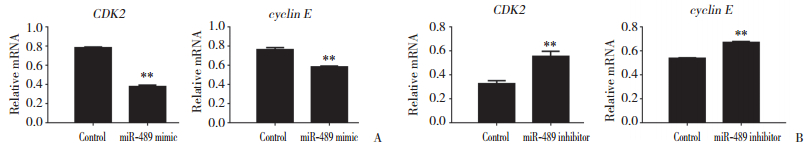
之后采用实时PCR检测miR-489过表达或受到抑制后CDK2和cyclin E mRNA水平的变化情况。结果发现,miR-489过表达可以显著抑制CDK2和cyclin E mRNA的表达,反之,miR-489受到抑制后,CDK2和cyclin E mRNA的表达上升。见图 4。
|
| A, expression of CDK2 and cyclin E mRNA was inhibited by miR-489; B, expression of CDK2 and cyclin E mRNA was promoted after miR-489 was inhibited. ** P < 0.05 vs control. 图 4 实时PCR检测miR-489对A375细胞CDK2和cyclin E mRNA水平的影响 Fig.4 CDK2 and cyclin E mRNA in A375 cells detected by real-time PCR after treatment with miR-489 mimic/inhibitor |
3 讨论
miRNA是长度为18~24个核苷酸的内源性非编码单链RNA。miRNA可以与靶mRNA的3’端非编码区域发生特异性结合,促使靶蛋白的mRNA发生降解,或者通过抑制靶蛋白mRNA的翻译过程来调节靶基因的表达。目前许多恶性肿瘤中均发现有miRNA异常表达的现象,研究者认为miRNA在肿瘤的发生发展中发挥重要作用。
黑色素瘤中miR-204-5p可以抑制细胞增殖、迁移、促进黑色素瘤细胞凋亡,同时miR-204-5p可以增加5-氟尿嘧啶和顺铂对恶性黑色素瘤细胞的化疗敏感性;miR-216b可以通过打靶FOXM1抑制黑色素瘤细胞的增殖和迁移能力;miR-625可以显著抑制恶性黑色素瘤裸鼠成瘤[2]。以上均说明很多miRNA可能参与黑色素瘤的进程。
miR-489已经被报道在多种肿瘤中发挥抑制肿瘤发生发展的作用。在膀胱癌中miR-489可以通过打靶JAG1来抑制膀胱癌细胞的生长和迁移作用;miR-489也可以参与调节胰腺导管腺癌中的KRAS通路,来发挥抑制肿瘤的作用;胃癌研究发现,miR-489可以通过打靶PROX1来发挥抑癌作用;在乳腺癌中miR-489也通过影响上皮-间充质转化的过程来调节乳腺癌的侵袭作用[4-10]。
本研究将黑色素瘤细胞作为研究对象,通过体外实验检测了miR-489对黑色素瘤的调节作用。在证明了miR-489在黑色素瘤细胞中表达较低后,检测了miR-489对细胞的增殖的影响,结果发现,miR-489过表达后可以显著抑制A375细胞的增殖水平(P < 0.05)。随后的蛋白水平和mRNA水平的检测发现,miR-489可以通过抑制CDK2和cyclin E的表达来实现对A375细胞增殖的抑制作用。为了进一步明确研究观点,在A375细胞中抑制miR-489后进行了重复实验,结果证明miR-489被抑制后,A375细胞中的CDK2和cyclin E的表达有所上升,同时促进了细胞的增殖。
本研究发现,miR-489可以通过抑制一系列细胞周期蛋白的表达来实现抑制黑色素瘤细胞增殖的作用,这可能为黑色素瘤的治疗提供了新的方向。
| [1] |
LUAN W, QIAN Y, NI X, et al. miR-204-5p acts as a tumor suppressor by targeting matrix metalloproteinases-9 and B-cell lymphoma-2 in malignant melanoma[J]. Oncol Targets Ther, 2017, 27(10): 1237-1246. DOI:10.2147/OTT.S128819 |
| [2] |
LI J, QU W, JIANG Y, et al. miR-489 suppresses proliferation and invasion of human bladder cancer cells[J]. Oncol Res, 2016, 24(6): 391-398. DOI:10.3727/096504016X14666990347518 |
| [3] |
LU E, SU J, ZHOU Y, et al. CCL20/CCR6 promotes cell proliferation and metastasis in laryngeal cancer by activating p38 pathway[J]. Biomed Pharmacother, 2017, 85: 486-492. DOI:10.1016/j.biopha.2016.11.055 |
| [4] |
YUAN P, HE XH, RONG YF, et al. KRAS/NF-κB/YY1/miR-489 signaling axis controls pancreatic cancer metastasis[J]. Cancer Res, 2017, 77(1): 100-111. DOI:10.1158/0008-5472.CAN-16-1898 |
| [5] |
PATEL Y, LEE JS, CHEN H. Clinicopathological analysis of miRNA expression in breast cancer tissues by using miRNA in situ hybridization[J]. J Vis Exp, 2016(112). DOI:10.3791/53928 |
| [6] |
CHEN X, WANG YW, XING AY, et al. Suppression of SPIN1-mediated PI3K-Akt pathway by miR-489 increases chemosensitivity in breast cancer[J]. J Pathol, 2016, 239(4): 459-472. DOI:10.1002/path.4743 |
| [7] |
PATEL Y, SHAH N, LEE JS, et al. A novel double-negative feedback loop between miR-489 and the HER2-SHP2-MAPK signaling axis regulates breast cancer cell proliferation and tumor growth[J]. Oncotarget, 2016, 7(14): 18295-18308. DOI:10.18632/oncotarget.7577 |
| [8] |
CHAI P, TIAN J, ZHAO D, et al. GSE1 negative regulation by miR-489-5p promotes breast cancer cell proliferation and invasion[J]. Biochem Biophys Res Commun, 2016, 471(1): 123-128. DOI:10.1016/j.bbrc.2016.01.168 |
| [9] |
XIE Z, CAI L, LI R, et al. Down-regulation of miR-489 contributes into NSCLC cell invasion through targeting SUZ12[J]. Tumour Biol, 2015, 36(8): 6497-6505. DOI:10.1007/s13277-015-3340-3 |
| [10] |
JIANG L, HE D, YANG D, et al. MiR-489 regulates chemoresistance in breast cancer via epithelial mesenchymal transition pathway[J]. FEBS Lett, 2014, 588(11): 2009-2015. DOI:10.1016/j.febslet.2014.04.024 |
 2018, Vol. 47
2018, Vol. 47