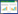文章信息
- 王生贵
- WANG Shenggui
- 力量训练对绝经女性骨骼肌mRNA表达谱的影响
- Differential Expression and Functional Analysis of mRNAs in Skeletal Muscles Induced by Power Training in Postmenopausal Women
- 中国医科大学学报, 2018, 47(11): 1003-1007
- Journal of China Medical University, 2018, 47(11): 1003-1007
-
文章历史
- 收稿日期:2018-06-20
- 网络出版时间:2018-11-01 14:00
围绝经与绝经期卵巢激素水平的快速降低加速了女性的衰老过程,可能引起肌肉萎缩、肌力减退和骨质疏松等改变,最终导致骨折、残废等严重后果[1]。因此,有必要早期采取预防措施,以尽可能维持绝经女性的肌肉性能和生活质量[2]。常用的早期预防策略包括激素补充治疗和身体锻炼。然而,激素补充治疗存在增加妇科肿瘤、卒中和血栓形成等多种疾病发病率的缺点,其应用受到限制[3]。身体锻炼则被认为是预防肌肉衰老的最佳策略。
已有多项研究[4]显示,强度、耐力和力量训练可以改善绝经女性的肌肉力量和身体机能。一般认为,与强度训练相比较,力量训练更强调以较小的负荷进行快速的肌肉收缩。力量训练可以显著提高锻炼者的肌肉状态和爆发力相关的神经肌肉功能,使得老年锻炼者更好的完成爬楼梯、从沙发起坐等动作,并减少跌倒风险。然而,尽管国内外多位研究者均观察到了力量训练对绝经女性肌肉状态的改善,但目前仍欠缺基于基因组学角度对于该现象的解释。
本研究基于基因数据集GSE16907,探讨力量训练1年后锻炼者骨骼肌mRNA表达谱的改变,利用生物信息学方法分析上述改变潜在的分子机制。
1 材料与方法 1.1 数据收集及分组情况从NCBI的基因表达汇编(gene expression omnibu,GEO)数据库(http://www.ncbi.nlm.nih.gov/geo)下载绝经妇女骨骼肌基因表达数据集GSE16907数据。本研究纳入该数据集所包含的8例规律身体锻炼者(锻炼组)以及7例50~57岁芬兰绝经女性受试者相关信息(对照组),临床试验登记号:ISRCTN49902272。锻炼组接受的具体体能锻炼计划为期1年,包括每周2次的监督巡回锻炼课程和每周4天家庭锻炼。受监督课程包括5个训练周期,每周期包括8~11周训练课程。各周期之间进行有氧舞蹈(2周)或夏休(5周)。每次课程以10 min热身为开始,以伸展活动结束。前2个周期课程包括3次跳绳(30 s)、障碍跳(13~16 cm)、跳深(10~15 cm)和单足跳(每侧10次,第2周期起加入)。后3个周期课程包括4次跑跳(19~25 cm)、跳深(20~25 cm)、单足跳(每腿10次)和弹跳(10次)。所有周期训练课程包括3个或4个上身抗阻力训练:胸部飞鸟运动、背阔肌下拉、推举、坐姿划船和二头肌弯举。家庭锻炼包括3次跳绳(30 s)、单足跳跃(每侧10次)和跳深(15 cm)。此外,还包括腹部和腰背部位的锻炼。详细信息参见文献[5-6]。对照组无研究者设定的身体锻炼计划。
1.2 基因数据的统计与功能分析该数据集收集受试者入组时(month0)以及锻炼1年后(month12)的股外侧肌标本。基因检测应用Sentrix Human-6 Expression BeadChip芯片。本研究应用该数据集的series matrix数据。以基因为基本单位进行后续分析。若同一基因对应多个探针,则选取方差最大的探针作为该基因的表达值。
应用bioconductor/limma(Ver.3.34.9)函数包对锻炼组或对照组配对样本(同一受试者入组时和1年后的样本为一对)分别进行差异表达基因分析[7]。以log倍数变化(logFC) > 0.5且P < 0.05为差异表达基因(differential expression genes,DEG)。应用bioconductor/clusterProfiler(Ver.3.6.0)函数包对表达上调或下调的基因所涉及的生物过程分别进行基因本体分析(gene ontology-biological process,GO-BP)[8]。P < 0.05且FDR q < 0.05为差异有统计学意义。
应用Gene Set Enrichment analysis 3.0版软件以month0、month12为表型,以MSigDB在线基因集数据库的C5.bp.v6.0.symbols.gml为参考基因集,对对照组基因表达谱进行基因集富集分析(gene set enrichment analysis,GSEA)[9]。设置随机组合次数为1 000次。P < 0.05且FDR q < 0.25为差异有统计学意义。
2 结果 2.1 2组DEGs分析经选择方差最大的探针作为代表,本研究共纳入21 424个基因进行后续的配对样本差异表达基因分析。锻炼组共有50个DEGs,其中表达上调的基因有35个,表达下调的基因有15个(图 1A)。对照组共有80个DEGs,其中表达上调者47个,表达下调者33个(图 1B)。
|
| A, training group; B, control group. 图 1 力量训练或观察1年后绝经女性骨骼肌的DEGs Fig.1 DEGs in skeletal muscles of postmenopausal women undergoing 1 year of power training or observation |
2.2 2组GO-BP分析
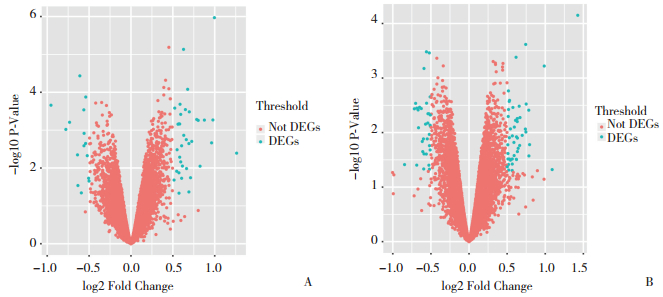
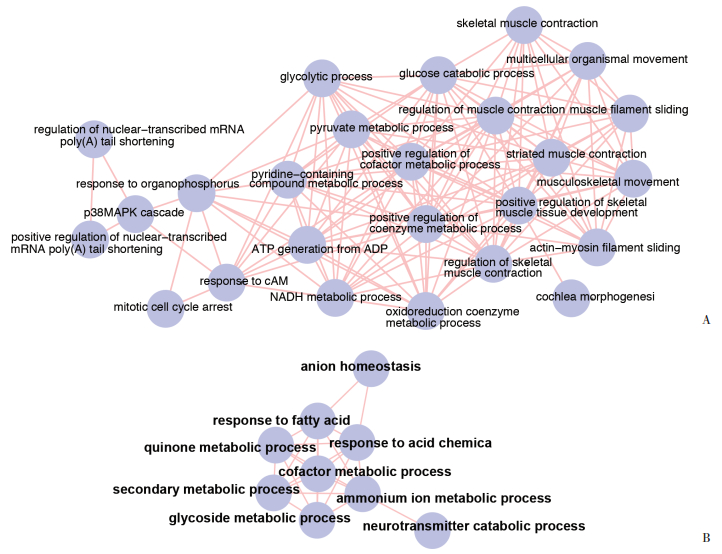
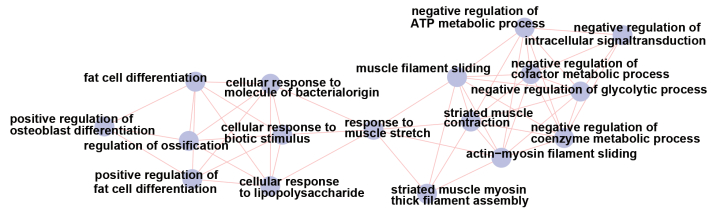
在锻炼组中,与入组时相比,锻炼1年后表达上调的DEGs主要参与了骨骼肌收缩、丙酮酸、NADH代谢、ATP产生、糖酵解、正向调节辅因子代谢等生物过程(图 2A)。表达下调的DEGs主要参与了铵代谢和脂肪酸相关反应等生物过程(图 2B)。在对照组中,与入组时相比,1年后表达上调的DEGs主要参与了促进脂肪细胞分化,调节成骨细胞分化,负向调节ATP代谢,负向调节辅因子代谢等生物过程(图 3)。表达下调的DEGs在GO-BP分析中未能显示与任何生物过程有关。
|
| A, biological processes enriched for the up-regulated DEGs; B, biological processes enriched for the down-regulated DEGs. 图 2 力量训练1年后绝经女性骨骼肌中DEGs的GO-BP分析 Fig.2 GO-BP analysis of the DEGs in skeletal muscles of postmenopausal women undergoing 1 year of power training |
|
| 图 3 对照组绝经女性1年后骨骼肌中DEGs的GO-BP分析 Fig.3 GO-BP analysis of the DEGs in skeletal muscles of postmenopausal women undergoing 1 year of observation |
2.3 对照组的GSEA
在对照组中,与入组时相比,入组1年后的标本富集了调节端粒帽相关通路(图 4A)。其中领头亚群基因包括MAPK3、ATM、MEK2、TERF2和PNKP等(图 4B)。
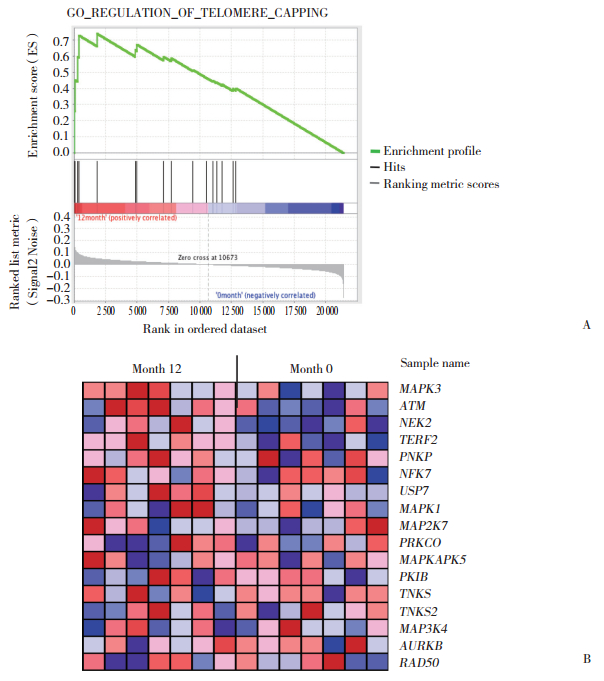
|
| A, enriched gene sets; B, leading-edge genes. 图 4 对照组绝经女性1年后骨骼肌的DEGs的GSEA结果 Fig.4 GSEA for the DEGs in skeletal muscles of postmenopausal women undergoing 1 year of observation |
3 讨论
本研究发现,在对照组,间隔1年后,绝经女性骨骼肌细胞富集了“调节端粒帽”相关通路。ATM、TERF2等基因表达升高。与1年前相比,表达上调的DEGs参与了促进脂肪细胞分化,调节成骨细胞分化,负向调节ATP代谢,负向调节辅因子代谢等生物过程。而在锻炼组中,未发现上述改变。而且,其表达上调的DEGs参与了骨骼肌收缩、糖酵解等生物过程。
端粒是真核细胞染色体末端的DNA重复序列。DNA复制过程中,因DNA聚合酶无法复制染色体末端,所以可能造成相应信息丢失。端粒可以给染色体末端加帽,从而保护染色体的完整。衰老过程与端粒帽功能衰退关系密切[10]:当端粒帽受损时,染色体末端改变的速率增加,甚至发生广泛的基因组不稳定性,增加恶性肿瘤的发病风险以及加速衰老[11-12]。现有研究[13]证实,端粒处ATM激酶的活化可以导致端粒的脱帽,从而引起细胞衰老或者死亡。上述过程接受TERF2和TP53等调控。本研究结果发现,对照组绝经1年的女性,在基因转录水平已经可以看到端粒受损的证据。相反在训练组,未得到类似结果。因此,端粒受损可能是不参加锻炼的绝经女性衰老的重要机制。
本研究的GO-BP分析显示,与1年前相比,对照组表达上调的DEGs参与了促进脂肪细胞分化,调节成骨细胞分化,负向调节ATP代谢,负向调节辅因子代谢等生物过程。结合先前文献,绝经女性随着雌激素水平的显著下降,骨骼肌脂肪含量明显上升,肌肉成分受到影响[14]。另外,雌激素可以减少成骨细胞凋亡。在雌激素下降的早期阶段,骨原细胞和破骨细胞祖细胞增加,导致骨重构增加[15]。这些生物过程与本研究对照组转录组学数据分析的结果一致。
本研究中,锻炼组的数据主要富集骨骼肌和合成代谢相关通路,未观察到上述这些衰老/退行性改变。这提示锻炼可以逆转绝经后骨骼肌的损失。有观点认为,锻炼可以使干细胞群体更多地向肌肉发生而非脂肪形成的方向分化,并可以减少脂肪形成基因的表达。
综上,本研究基于在线数据GSE16907,利用生物信息学方法,从基因组学角度出发,解读了力量训练对绝经女性骨骼肌功能的影响。目前,国内外关于绝经女性接受哪一种身体锻炼的研究有很多,但关于“哪种锻炼方式会带来更大的好处”这一问题,欠缺好的评价方法。本研究从新的角度出发,为这一问题的解决探索一个新的思路,具有一定的社会意义和科学意义。
| [1] |
STRARGHT CR, WARD-RITACCO CL, EVANS EM. Association between accelerometer-measured physical activity and muscle capacity in middle-aged postmenopausal women[J]. Menopause, 2015, 22(11): 1204-1211. DOI:10.1097/GME.0000000000000447 |
| [2] |
FRIEDENREICH CM, PIALOUX V, WANG Q, et al. Effects of exercise on markers of oxidative stress:an ancillary analysis of the alberta physical activity and breast cancer prevention trial[J]. BMJ Open Sport Exerc Med, 2016, 2(1): e000171. DOI:10.1136/bmjsem-2016-000171 |
| [3] |
TOFFOL E, HEIKINHEIMO O, PARTONEN T. Hormone therapy and mood in perimenopausal and postmenopausal women:a narrative review[J]. Menopause, 2015, 22(5): 564-578. DOI:10.1097/GME.0000000000000323 |
| [4] |
MISZKO TA, CRESS ME, SLADE JM, et al. Effect of strength and power training on physical function in community-dwelling older adults[J]. J Gerontol A Biol Sci Med Sci, 2003, 58(2): 171-175. DOI:10.1093/gerona/58.2.M171 |
| [5] |
POLLANEN E, FEY V, TORMAKANGAS T, et al. Power training and postmenopausal hormone therapy affect transcriptional control of specific co-regulated gene clusters in skeletal muscle[J]. Age (Dordr), 2010, 32(3): 347-363. DOI:10.1007/s11357-010-9140-1 |
| [6] |
SLIPILA S, TAAFFE DR, CHENG S, et al. Effects of hormone replacement therapy and high-impact physical exercise on skeletal muscle in post-menopausal women:a randomized placebo-controlled study[J]. Clin Sci (Lond), 2001, 101(2): 147-157. DOI:10.1042/cs1010147 |
| [7] |
RITCHIE ME, PHIPSON B, WU D, et al. Limma powers differential expression analyses for RNA-sequencing and microarray studies[J]. Nucleic Acids Res, 2015, 43(7): e47. DOI:10.1093/nar/gkv007 |
| [8] |
YU G, WANG LG, HAN Y, et al. clusterProfiler:an R package for comparing biological themes among gene clusters[J]. OMICS, 2012, 16(5): 284-287. DOI:10.1089/omi.2011.0118 |
| [9] |
SUBRAMANIAN A, TAMAYO P, MOOTHA VK, et al. Gene set enrichment analysis:a knowledge-based approach for interpreting genome-wide expression profiles[J]. Proc Natl Acad Sci USA, 2005, 102(43): 15545-15550. DOI:10.1073/pnas.0506580102 |
| [10] |
SAHIN E, DEPINHO RA. Linking functional decline of telomeres, mitochondria and stem cells during ageing[J]. Nature, 2010, 464(7288): 520-528. DOI:10.1038/nature08982 |
| [11] |
MEENA J, RUDOLPH KL, GUNES C. Telomere dysfunction, chromosomal instability and cancer[J]. Recent Results Cancer Res, 2015, 200: 61-79. DOI:10.1007/978-3-319-20291-4_3 |
| [12] |
AUBERT G. Telomere dynamics and aging[J]. Prog Mol Biol Transl Sci, 2014, 125: 89-111. DOI:10.1016/B978-0-12-397898-1.00004-9 |
| [13] |
MARTINEZ P, FERRARA-ROMEO I, FLORES JM, et al. Essential role for the TRF2 telomere protein in adult skin homeostasis[J]. Aging Cell, 2014, 13(4): 656-668. DOI:10.1111/acel.12221 |
| [14] |
FRECHETTE DM, KRISHNAMOORTHY D, ADLER BJ, et al. Diminished satellite cells and elevated adipogenic gene expression in muscle as caused by ovariectomy are averted by low-magnitude mechanical signals[J]. J Appl Physiol (1985), 2015, 119(1): 27-36. DOI:10.1152/japplphysiol.01020.2014 |
| [15] |
MACKIEWICZ Z, NIKLINSKA WE, KOWALAWSKA J, et al. Bone as a source of organism vitality and regeneration[J]. Folia Histochem Cytobiol, 2011, 49(4): 558-569. |
 2018, Vol. 47
2018, Vol. 47