文章信息
- 陈巧真, 孙敏
- CHEN Qiaozhen, SUN Min
- 替诺福韦对子代大鼠认知功能的影响及其机制
- Effect and Mechanism of Action of Tenofovir on Cognitive Function in Rats
- 中国医科大学学报, 2018, 47(10): 909-913
- Journal of China Medical University, 2018, 47(10): 909-913
-
文章历史
- 收稿日期:2018-03-26
- 网络出版时间:2018-09-27 10:25
病毒性肝炎、艾滋病等病毒性疾病是严重的全球性公共卫生问题,也是孕妇黄疸和妊娠并发症的常见原因[1]。此外,受感染的母亲可以将病毒传染给胎儿或新生儿,这可能增加疾病负担并且降低生活质量。孕妇接受抗逆转录病毒疗法可以迅速和完全抑制母体病毒的RNA水平,以防止病毒通过母婴传播给胎儿和新生儿,并可以维持产妇的健康[2-4]。
核苷类逆转录酶抑制剂替诺福韦,因其良好的有效性和安全性,多年来已成为病毒感染者最常用的抗病毒药物之一[5]。然而到目前为止,还没有关于孕中期大鼠应用替诺福韦对子代鼠认知功能影响的相关报道。认知功能障碍的发生可能是由于神经发生过程受到抑制。孕中期胎鼠的脑内神经干细胞数量较多,暴露于药物下很可能引起神经干细胞的损伤,药物可能通过参与调节神经干细胞的增殖来影响神经系统发育[6-8]。Wnt信号通路被激活后,可以抑制GSK-3β的活性,使β-catenin在细胞质内大量积累,从而促进神经干细胞的增殖[9]。因此,本研究的目的是研究替诺福韦作用孕中期大鼠后对子代鼠认知功能以及Wnt信号通路的影响。
1 材料与方法 1.1 材料 1.1.1 动物模型的建立将24只Wistar大鼠(山东省济宁市传染病医院实验动物中心提供)按随机数字表随机分成3组,每组8只。在大鼠妊娠12~21 d时给予处置。对照组给予生理盐水肌注10 d,低浓度替诺福韦组按照2.25 mg·kg-1·d-1注射替诺福韦,高浓度替诺福韦组按照4.5 mg·kg-1·d-1注射替诺福韦。实验经动物伦理委员会同意,实验过程中对动物处理符合动物伦理学标准。
1.1.2 主要试剂替诺福韦(石家庄以岭药业股份有限公司),戊巴比妥钠(上海西唐生物公司),生理盐水、RIPA、Trizol、氯仿、异丙醇、乙醇(国药制药)。GSK-3β、β-catenin、nestin和GAPDH抗体(美国Santa公司),二抗(北京中杉金桥生物技术有限公司)。引物合成于金斯瑞生物公司。反转录试剂盒、SYBR试剂盒(日本Takara公司)。
1.2 方法 1.2.1 血气分析妊娠第22天,取大鼠动脉血做血气分析。
1.2.2 Morris水迷宫实验子代鼠出生4周后,从每只孕鼠的子代鼠中随机取出4只雄鼠,进行水迷宫测试。测试期间需保持实验室内灯光昏暗、环境安静、杜绝带入食物及饮料,以避免气味对实验的干扰作用。实验开始时间均为上午8:00,每次实验结束后将大鼠擦干放回笼子,注意保暖。测试包括定位航行测试以及空间探索测试。
定位航行测试:分5 d进行,每日每只大鼠进行4轮测试,每轮测试时间设定为90 s,每轮测试间隔不小于30 min,以保证大鼠有充分的休息。每只大鼠随机从每个象限的中点面壁投放入水桶,分析软件自动记录大鼠自投放入水到找到平台并逗留于平台上的时间,即逃避潜伏期。如果大鼠在规定的90 s内找不到平台,计算机自动停止记录,测试者将大鼠轻柔地引导至平台,保证大鼠在平台上停留30 s。
空间探索测试:第5天完成定位航行实验后,移去水下平台,选定和原平台区域对应的象限中点为入水点,将大鼠面壁投放入水桶,分析系统自动记录90 s内大鼠穿越原平台所在区域的次数。
1.2.3 Western blotting子代鼠出生4周后,颈椎脱位法处死子代鼠,取海马组织0.1 g,加大约10倍湿重的RIPA裂解缓冲液,粉碎匀浆后,冰上裂解30 min,低温高速离心,保留上清。定量后每个样本取10 μg进行SDS-聚丙烯酰胺胶电泳、转膜、脱脂奶粉室温封闭1 h,TBST洗膜3次、一抗孵育4 ℃过夜、洗膜后二抗室温震荡孵育2 h,TBST洗膜后ECL发光。
1.2.4 实时PCR实验子代鼠出生4周后,颈椎脱位法处死子代鼠,取海马组织0.1 g,加入1 mL Trizol裂解液裂解后,分别通过氯仿、异丙醇、乙醇等处理提取总RNA,反转录后进行实时PCR实验,所用引物为GSK-3β,正义链5’-CCTTAACCTGGTGCTGGACT-3’,反义链5’-AGCTCTGGTGCCCTGTAGTA-3’;β-catenin,正义链5’-CTACTTGTTCTGAGTGAA-3’,反义链5’-TGGAACCAGACAGAAAAGC-3’;nestin,正义链5’-GCCCTGACCACTCCAGTTTA-3’,反义链5’-GGAGTCCTGGATTTCCTTCC-3’;GAPDH,正义链5’- AGAAGGCTGGGGCTCATTTG-3’,反义链5’-AGGGGCCATCCACAGTCTTC-3’。
1.3 统计学分析采用SPSS 17.0软件进行统计学分析,实验组与对照组的比较采用完全随机设计t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 替诺福韦对孕鼠及子代大鼠体质量的影响各组孕鼠在孕期第22天进行颈内动脉抽血监测血气分析,结果发现,低浓度替诺福韦组、高浓度替诺福韦组与对照组相比,pH、pO2、pCO2无统计学差异,见表 1。对照组、低浓度替诺福韦组、高浓度替诺福韦组新生大鼠体质量分别为(23.31±2.98)、(24.32±1.61)、(25.01±1.23)g,低浓度替诺福韦组、高浓度替诺福韦组与对照组相比,体质量无统计学差异。
| Group | pH | pO2(mmHg) | pCO2(mmHg) |
| Control | 4.18±0.23 | 38.27±1.48 | 40.27±0.69 |
| Low-concentration tenofovir | 4.21±0.16 | 38.22±2.46 | 41.08±1.25 |
| High-concentration tenofovir | 4.14±0.27 | 39.01±1.76 | 40.56±1.33 |
2.2 替诺福韦对子代大鼠认知功能的影响
定位航行测试结果显示,与对照组相比,低浓度替诺福韦组子代大鼠各时间点逃避潜伏期时间的差异无统计学意义(P > 0.05),而高浓度替诺福韦组子代大鼠逃避潜伏期较对照组明显延长,到达平台前路程明显增加,差异有统计学意义(P < 0.05),见表 2。
| Item | Control group(n = 4) | Low-concentration tenofovir group(n = 4) | High-concentration tenofovir group(n = 4) |
| Escape latency(s) | |||
| Day 1 | 67.83±2.50 | 70.16±1.63 | 76.62±0.341),2) |
| Day 2 | 40.76±1.25 | 43.63±0.82 | 50.44±1.631),2) |
| Day 3 | 35.98±2.36 | 37.17±2.49 | 42.41±0.361),2) |
| Day 4 | 23.34±1.18 | 26.02±4.99 | 45.36±0.171),2) |
| Day 5 | 14.80±3.53 | 17.18±4.78 | 40.32±0.241),2) |
| Platform crossing times | 4.79±0.21 | 5.14±0.12 | 1.87±0.241),2) |
| Residence time(s) | 42.70±0.94 | 40.86±1.25 | 26.09±1.631),2) |
| 1)P < 0.05 vs control group;2)P < 0.05 vs low-concentration tenofovir group. | |||
空间探索测试结果发现,与对照组相比,低浓度替诺福韦组子代大鼠平台穿越次数以及停留时间的差异无统计学意义(P > 0.05),而高浓度替诺福韦组子代大鼠平台穿越次数及时间明显减少,差异有统计学意义(P < 0.05),见表 2。
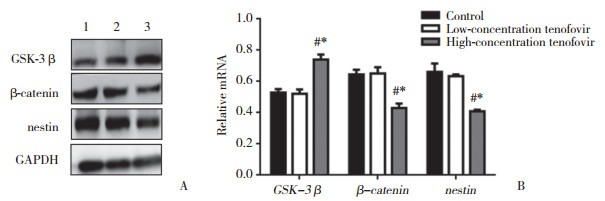
2.3 替诺福韦对子代大鼠Wnt通路蛋白的影响Wnt通路可以影响神经干细胞的增殖,也是与学习和记忆密切相关的通路。本研究应用Western blotting和实时PCR检测GSK-3β、β-catenin及nestin蛋白和mRNA水平的变化,结果发现低浓度替诺福韦组子代大鼠海马组织内GSK-3β、β-catenin及nestin含量与对照组比较差异均无统计学意义(P > 0.05),高浓度替诺福韦组子代大鼠海马组织内GSK-3β含量明显高于对照组和低浓度替诺福韦组,β-catenin及nestin含量明显低于对照组和低浓度替诺福韦组,差异均有统计学意义(P < 0.05)。见图 1。
|
| A, results of Western blotting; B, results of real-time PCR. 1, control group; 2, low-concentration tenofovir group; 3, high-concentration tenofovir group. * P < 0.05 vs control group; # P < 0.05 vs low-concentration tenofovir group. 图 1 替诺福韦作用后GSK-3β、β-catenin及nestin蛋白和mRNA的表达水平 Fig.1 Protein and mRNA expressions of GSK-3β, β-catenin, and nestin after treatment with tenofovir |
3 讨论
母婴传播是各种病毒性疾病(乙型肝炎、人类免疫缺陷病毒等)患者或者病毒携带状态的母亲将病毒传播给婴儿的传播方式。有统计学数据指出,我国人群中有近50%的HBsAg携带者可能是由母婴传播所致[8]。母婴传播分为3个阶段:宫内传播,怀孕时母体血液中的病毒经胎盘传递给婴儿;产程传播,分娩时、婴儿出生过程中皮肤损伤或病毒通过破裂胎盘传递给婴儿以及分娩后母亲与胎儿亲密接触传播;哺乳传播。各种核苷酸逆转录酶(西多福韦、阿德福韦、替诺福韦等)的应用可以在备孕期及孕期降低病毒的含量,减少病毒母婴传播的机会[9]。
替诺福韦是指南推荐的备孕期及孕期的抗病毒治疗的药物。使用替诺福韦可以大大地降低体内病毒量,使得宫内感染的可能性下降。研究[10-12]指出,替诺福韦的生物安全性高,肝肾毒性较小,但是目前国内针对替诺福韦在孕期应用安全性的研究较少。
有研究指出,孕鼠长期使用2.25 mg·kg-1·d-1的替诺福韦并不会影响母体及子代鼠P糖蛋白和乳腺癌耐药蛋白等的表达,即其在孕期的应用相对安全。但是也有研究[13]指出替诺福韦会增加胎盘与子代鼠体质量的比值,可能会对子代鼠的健康情况造成影响。一项对17例HIV感染孕妇应用替诺福韦进行的调查研究[14]发现,应用12周替诺福韦可以在一定程度上改善患者的认知能力和神经心理测验评估分数。在美国,一项有230名参与者的双盲研究[15]结果也指出,替诺福韦的应用可以在不损伤患者神经功能、不影响患者认知能力的前提下,降低病毒的含量,减少病毒带来的损伤。
本研究是首次在体应用孕-胎鼠模型,观察孕中期相关剂量的替诺福韦暴露对子代鼠学习记忆功能以及神经干细胞增殖相关信号通路的影响。本研究结果显示,孕中期接受低浓度替诺福韦并不会损害子代鼠的学习记忆功能。但在孕中期接受高浓度替诺福韦则明显影响子代鼠的学习记忆功能,表现为水迷宫实验中潜伏期延长、平台活动时间以及穿越平台次数减少。
许多研究[15]提示,齿状回神经的发生在海马相关学习记忆形成中至关重要。Wnt信号通路在发育期神经发生过程中扮演重要角色。β-catenin是Wnt信号通路的核心分子,在Wnt信号通路中处于中心位置。GSK-3β在整个中枢神经系统中都有表达,特别在海马表达水平更高[16]。GSK-3β可磷酸化β-catenin,介导β-catenin的降解。Wnt信号通路被激活后,可以抑制GSK-3β的活性,使胞内β-catenin在细胞质内大量积累,从而促进神经干细胞的增殖。Wnt通路的激活也可以促进nestin蛋白这一神经干细胞特征性标志物的表达[17]。
本研究发现高浓度替诺福韦可以影响子代鼠的认知功能后,对Wnt通路的相关蛋白进行了检测,结果发现孕期高浓度的替诺福韦很可能引起了子代鼠脑内GSK-3β水平升高,β-catenin水平降低,进而通过抑制Wnt/β-catenin通路抑制了神经干细胞的增殖,抑制了nestin的表达,从而损害了子代鼠的学习记忆功能。
虽然本研究对机制的探讨较为浅显,需要进一步的功能学实验或者细胞水平的实验进行验证,但是仍然在一定程度上证明高浓度的替诺福韦可以抑制子代鼠的认知功能。
综上所述,低浓度替诺福韦使用较为安全,但是高浓度的替诺福韦可以通过影响Wnt信号通路的激活抑制子代大鼠的认知功能。
| [1] |
COLBERS AP, HAWKINS DA, GINGELMAIER A, et al. The pharmacokinetics, safety and efficacy of tenofovir and emtricitabine in HIV-1-infected pregnant women[J]. AIDS, 2013, 27(5): 739-748. DOI:10.1097/QAD.0b013e32835c208b |
| [2] |
GREENUP AJ, TAN PK, NGUYEN V, et al. Efficacy and safety of tenofovir disoproxil fumarate in pregnancy to prevent perinatal transmission of hepatitis B virus[J]. J Hepatol, 2014, 61(3): 502-507. DOI:10.1016/j.jhep.2014.04.038 |
| [3] |
BEST BM, BURCHETT S, LI H, et al. Pharmacokinetics of tenofovir during pregnancy and postpartum[J]. HIV Med, 2015, 16(8): 502-511. DOI:10.1111/hiv.12252 |
| [4] |
CHETTY T, THORME C, COUTSOUDIS A. Preterm delivery and small-for-gestation outcomes in HIV-infected pregnant women on antiretroviral therapy in rural South Africa:results from a cohort study, 2010-2015[J]. PLoS One, 2018, 13(2): e0192805. DOI:10.1371/journal.pone.0192805.eCollection2018 |
| [5] |
FLORIDIA M, PINNETTI C, RAVIZZA M, et al. Brief report:abacavir/lamivudine and tenofovir/emtricitabine in pregnant women with HIV:laboratory and clinical outcomes in an observational national study[J]. J Acquir Immune Defic Syndr, 2018, 78(1): 99-104. DOI:10.1097/QAI.0000000000001640 |
| [6] |
HSU CW, CHEN YC, CHANG ML, et al. Durability of telbivudine-associated improvement of renal function following withdrawal or switching of antivirals in chronic hepatitis B patients[J]. Open Forum Infect Dis, 2017, 5(1): ofx271. DOI:10.1093/ofid/ofx271 |
| [7] |
WILSON P, PARR JB, JHAVERI R, et al. Call to action:prevention of mother-to-child transmission of hepatitis B in Africa[J]. J Infect Dis, 2018, 217(8): 1180-1183. DOI:10.1093/infdis/jiy028 |
| [8] |
HIRASEN K, EVANS D, MASKEW M, et al. The right combination-treatment outcomes among HIV-positive patients initiating firstline fixed-dose antiretroviral therapy in a public sector HIV clinic in Johannesburg, South Africa[J]. Clin Epidemiol, 2017, 18(10): 17-29. DOI:10.2147/CLEP.S145983 |
| [9] |
BENHAMMOU V, TUBIANA R, MATHERON S, et al. HBV or HCV coinfection in HIV-1-infected pregnant women in france:prevalence and pregnancy outcomes[J]. J Acquir Immune Defic Syndr, 2018, 77(5): 439-450. DOI:10.1097/QAI.0000000000001618 |
| [10] |
WAKANO Y, SUGIURA T, ENDO T, et al. Antiviral therapy for hepatitis B virus during second pregnancies[J]. J Obstet Gynaecol Res, 2018, 44(3): 566-569. DOI:10.1111/jog.13540 |
| [11] |
GOIS PH, CANALE D, LUCHI WM, et al. Tenofovir during pregnancy in rats:a novel pathway for programmed hypertension in the offspring[J]. J Antimicrob Chemother, 2015, 70(4): 1094-1105. DOI:10.1093/jac/dku483 |
| [12] |
VAN ROMPAY KK, DURAND-GASSELIN L, et al. Chronic administration of tenofovir to rhesus macaques from infancy through adulthood and pregnancy:summary of pharmacokinetics and biological and virological effects[J]. Antimicrob Agents Chemother, 2008, 52(9): 3144-3160. DOI:10.1128/AAC.00350-08 |
| [13] |
FOSTER C, LYALL H, OLMSCHEID B, et al. Tenofovir disoproxil fumarate in pregnancy and prevention of mother-to-child transmission of HIV-1:is it time to move on from zidovudine?[J]. HIV Med, 2009, 10(7): 397-406. DOI:10.1111/j.1468-1293.2009.00709.x |
| [14] |
DECLOEDT EH, LESOSKY M, MAARTENS G, et al. Renal safety of lithium in HIV-infected patients established on tenofovir disoproxil fumarate containing antiretroviral therapy:analysis from a randomized placebo-controlled trial[J]. AIDS Res Ther, 2017, 14(1): 6. DOI:10.1186/s12981-017-0134-2 |
| [15] |
王宇恒, 成永霞, 焦晶华, 等. 大鼠妊娠前后吸入异氟烷或七氟烷对子代脑发育的影响[J]. 中国医科大学学报, 2015, 44(2): 143-147. DOI:10.3969/j.issn.0258-4646.2015.02.012 |
| [16] |
HE A, ZHANG Y, YANG Y, et al. Prenatal high sucrose intake affected learning and memory of aged rat offspring with abnormal oxidative stress and NMDARs/Wnt signaling in the hippocampus[J]. Brain Res, 2017, 15(1669): 114-121. DOI:10.1016/j.brainres.2017.05.022 |
| [17] |
WEI B, LI L, HE A, et al. Hippocampal NMDAR-Wnt-Catenin signaling disrupted with cognitive deficits in adolescent offspring exposed to prenatal hypoxia[J]. Brain Res, 2016, 15(1631): 157-164. DOI:10.1016/j.brainres.2015 |
 2018, Vol. 47
2018, Vol. 47