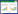文章信息
- 柴芳, 李岩, 刘克毅, 李强
- CHAI Fang, LI Yan, LIU Keyi, LI Qiang
- 长链非编码RNA XIST对肝癌细胞增殖及侵袭的影响
- Effects of Long Non-coding RNA XIST on Proliferation and Invasion of the Hepatocellular Carcinoma
- 中国医科大学学报, 2018, 47(10): 895-899
- Journal of China Medical University, 2018, 47(10): 895-899
-
文章历史
- 收稿日期:2018-01-04
- 网络出版时间:2018-09-27 9:41
我国因肝炎高发导致肝癌发病率居高不下,进而成为世界上肝癌发病率最高的国家[1]。目前肝癌的治疗方式仍以手术治疗为主,术后的高复发转移一直是制约患者5年生存率的重要因素[2]。因此,揭示肝癌转移的机制,找寻有效的治疗手段是目前改善肝癌预后的关键。
长链非编码RNA(long non-coding RNA,lncRNA)是长度 > 200个核苷酸的非编码RNA,可以在转录、转录后及翻译水平调控基因表达,进而参与多种病理生理过程[3]。伴随对lncRNA认识的深入,越来越多的证据显示lncRNA在肿瘤相关基因调控过程中扮演重要作用,MEG3、HULC、HOTAIR等基因相继被证实在肝癌的发生、发展以及诊断、治疗中的作用,说明lncRNA在肝癌进展过程中发挥重要的调控作用[4-6]。X染色体失活特异转录本(X inactive specific transcript,XIST)被证实与多种肿瘤发生发展密切相关,而且XIST在不同肿瘤中发挥着不同作用,在肝癌中的作用尚未完全阐释清楚[7-8]。本研究通过实时PCR检测XIST在肝癌细胞与正常肝细胞中的表达,并进一步通过细胞检测探讨XIST在肝癌细胞中的作用。
1 材料与方法 1.1 材料肝癌细胞系HepG2、BEL-7402、SMMC-7721、Huh-7以及正常肝细胞均购于中国科学院上海细胞生物研究所细胞库。DMEM培养基、血清购于逍鹏生物公司,转染试剂Lipofectamine®3000购于美国Invitrogen公司,过表达质粒购于吉凯公司,siRNA购于美国Sigma公司。
1.2 方法 1.2.1 实时PCR按说明书提取细胞总RNA。反转录反应为20 μL反应体系,反应条件为25 ℃ 5 min,42 ℃ 30 min,85 ℃ 5 min,4 ℃保存。以18 S作为内参,实时PCR反应采用20 μL反应体系,反应条件为95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,40个循环。所有反应均设3个复孔,实验重复3次。
1.2.2 细胞培养肝癌细胞系HepG2、BEL-7402、SMMC-7721、Huh-7以及正常肝细胞置于含10%胎牛血清的DMEM培养液中,37 ℃,5% CO2培养,胰酶消化传代。
1.2.3 细胞转染按照试剂说明书,取处于对数生长期细胞,待细胞生长密度约为60%时用于转染,经LipofectamineTM3000介导转染。转染后孵箱内继续常规培养48 h,收集细胞用于实验检测。
1.2.4 Transwell小室迁移实验取对数生长期的细胞,每个Transwell小室的上室加入5×104细胞,下室加入500 μL含10%胎牛血清的培养液,加入时避免气泡的产生。置于孵箱内继续培养24 h,弃上室中培养液,PBS洗3次,4%多聚甲醛固定20 min。用棉签吸去上室内液体,1%结晶紫染液室温下染色10 min,PBS洗3次,显微镜下每孔随机取5个视野拍照。每组细胞均设3个复孔,实验重复3次。
1.2.5 Transwell小室侵袭实验将预冷的Matrigel胶与无血清培养基按1: 8比例稀释,将胶铺于Transwell小室上下室之间,每孔80 μL均匀包被于Transwell小室底部膜内,置培养箱60 min使之成胶。其余步骤同迁移实验。
1.2.6 CCK-8法检测细胞增殖活性常规胰酶消化细胞,按照每孔3 000个细胞将细胞转接到96孔板中,每组5个复孔。96孔板置入培养箱中继续培养,分别于24、48、72 h在每孔加入10 μL CCK-8溶液后在孵箱内继续孵育约2 h。酶标仪测量各孔的吸光度值。
1.3 统计学分析采用SPSS 14.0软件进行统计分析,数据以x±s表示,组间比较采用方差分析及t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 XIST在肝细胞以及肝癌细胞中的表达实时PCR检测XIST在正常肝细胞(LO2)和肝癌细胞系(HepG2、BEL-7402、SMMC-7721、Huh-7)中的表达,结果显示,与正常肝细胞比较,XIST在肝癌细胞系中的表达高于正常肝细胞,其中SMMC-7721细胞中XIST表达升高最明显,HepG2细胞中XIST表达较低,故选择此2种细胞系作为实验对象,见图 1。
|
| 图 1 XIST在正常肝细胞与肝癌细胞系中的表达 Fig.1 Expression of XIST in normal and hepatoma cell lines |
2.2 过表达与RNA干扰技术对XIST在肝癌细胞中表达的影响
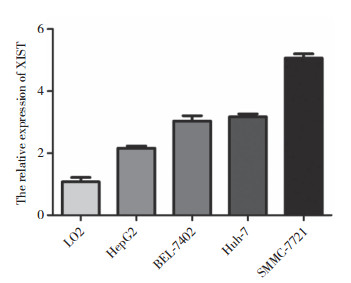
通过过表达质粒以及siRNA在细胞中过表达或敲低XIST的表达来验证XIST在肝癌中的作用,实时PCR结果显示转染过表达XIST质粒能够显著增加XIST在肝癌细胞HepG2中的表达(图 2A)。转染了si-XIST后SMMC-7721细胞中XIST的表达明显降低,与对照组比较差异有统计学意义(P < 0.05)(图 2B)。以上结果提示过表达与敲除技术可用于后续实验对XIST的敲除与过表达。
|
| A, over expression of XIST increased the expression level of XIST; B, after transfection of si-XIST, the expression of XIST was inhibited. *** P < 0.001 vs control group; ** P < 0.01 vs NC group. 图 2 过表达与RNA干扰技术对XIST表达的影响 Fig.2 Effects of overexpression and RNA interference on XIST expression |
2.3 XIST对肝癌细胞增殖的影响
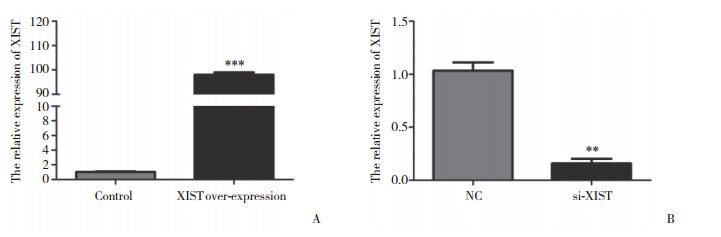
既往研究[9-11]提示XIST在不同肿瘤中既可以发挥癌基因作用,又可以充当抑癌基因作用。CCK-8实验结果提示HepG2细胞中过表达XIST后细胞增殖活力显著增强,SMMC-7721细胞中敲低XIST表达后细胞增殖活力显著受到抑制,与对照组比较差异具有统计学意义(P < 0.05),见图 3。
|
| A, the proliferation vitality was significantly increased after XIST over-expression in HepG 2 cells. * P < 0.05 vs control group; B, the proliferation vitality was significantly reduced after si-XIST transfection in SMMC-7721 cells. P < 0.05 vs NC group. 图 3 XIST对肝癌细胞增殖的影响 Fig.3 Effects of XIST on the proliferation of the hepatocellular carcinoma |
2.4 XIST对肝癌细胞侵袭转移的影响
通过Transwell实验检测XIST对肝癌细胞侵袭转移的影响,结果发现HepG2细胞过表达XIST后侵袭与转移能力均增强,与对照组比较差异具有统计学意义(P < 0.05)。SMMC-7721细胞中敲低XIST表达后肝癌细胞侵袭转移能力明显抑制,与对照组比较差异有统计学意义(P < 0.05),见图 4。
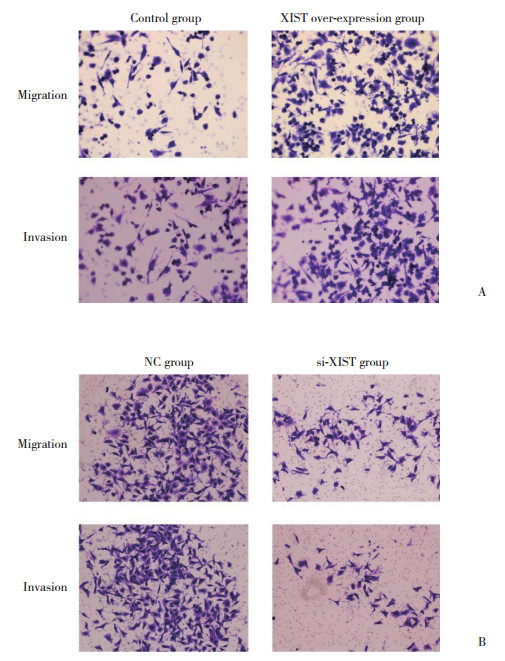
|
| A, overexpression of XIST promoted migration and invasion of HepG2 cells; B, migration and invasion were inhibited after si-XIST transfection. 图 4 XIST对肝癌细胞侵袭转移的影响×100 Fig.4 Effects of XIST on the invasion and metastasis of the hepatocellular carcinoma ×100 |
3 讨论
肝癌是世界范围内致死率极高的疾病,近年发病率持续增加[1]。虽然近年放疗、化疗以及分子靶向治疗取得了长足的进展,但是治疗效果仍不理想,其主要原因与就诊时已属晚期,以及术后转移、复发密切相关,因此,寻找有效的干预手段是目前研究的重点。
随着对肿瘤认识的深入,机体内大量的非编码RNA(miRNA、lncRNA、circular RNA、snRNA等)在肿瘤进展中的重要作用渐渐被人们认识,尤其是lncRNA在肿瘤中的作用受到越来越多的关注[3]。XIST是哺乳动物体内X染色体失活的主要调节基因,大量研究证实XIST在分化、增殖等多方面均发挥重要的调控作用。尤其是XIST的表达与肿瘤之间的关系日益受到关注[8]。CHEN等[13]研究发现XIST在胃癌组织中高表达,同时抑制XIST的表达后胃癌细胞的增殖,侵袭转移能力受到抑制。WANG等[14]研究证实在肺癌中XIST缺失能够抑制肺癌细胞增殖与侵袭。YILDIRIM等[15]研究却证实XIST在小鼠血液肿瘤中发挥抑癌作用。那么,XIST在肝癌中的作用值得进一步探讨。
本研究实时PCR检测XIST在正常肝细胞以及肝癌细胞系中的表达情况,结果提示XIST在肝癌细胞系中的表达较正常肝细胞中明显升高,提示XIST可能参与了肝癌的发生。同时,结果还提示在肝癌细胞系SMMC-7721中表达最为显著,在肝癌细胞系HepG2中的表达不显著,因此选择这两种细胞系作为研究对象。为了验证XIST对肝癌细胞增殖、侵袭的影响,本研究通过在肝癌细胞中过表达XIST与敲低XIST的表达以验证其功能。本研究显示在肝癌细胞HepG2过表达XIST后细胞的增殖活力显著增强,而在肝癌细胞SMMC-7721细胞中敲低XIST的表达后肝癌细胞的增殖活力受到明显抑制,说明XIST能够调控肝癌细胞增殖,参与了肝癌的进展。同时通过Transwell实验检测XIST对肝癌细胞增殖、侵袭的影响,结果发现肝癌细胞HepG2过表达XIST后细胞的侵袭与迁移能力显著增强,在肝癌细胞SMMC-7721细胞中敲低XIST表达后,细胞侵袭与迁移能力受到抑制,与对照组比较差异有统计学意义(P < 0.05),提示XIST能够促进肝癌细胞的侵袭与转移,参与了肝癌细胞的远处转移。
综上所述,XIST能够促进肝癌细胞增殖、侵袭与转移,提示XIST作为肝癌治疗的有效靶点有望减缓肝癌的进展,减少肝癌的远处转移。本研究基于细胞水平,更多XIST发挥作用的确切机制以及在临床上的进一步应用还需要更多的实验来证实。
| [1] |
SIEGEL RL, MILLER KD, JEMAL A. Cancer statistics, 2016[J]. CA Cancer J Clin, 2016, 66(1): 7-30. DOI:10.3322/caac.21332 |
| [2] |
SCHULZE K, IMBEAUD S, LETOUZE E, et al. Exome sequencing of hepatocellular carcinomas identifies new mutational signatures and potential therapeutic targets[J]. Nat Genet, 2015, 47(5): 505-511. DOI:10.1038/ng.3252 |
| [3] |
YANG G, LU X, YUAN L. LncRNA:a link between RNA and cancer[J]. Bioch Biophy Acta, 2014, 1839(11): 1097-1109. DOI:10.1016/j.bbagrm.2014.08.012 |
| [4] |
DONG Z, ZHANG A, LIU S, et al. Aberrant methylation-mediated silencing of lncrna meg3 functions as a cerna in esophageal cancer[J]. Mol Cancer Res, 2017, 15(7): 800-810. DOI:10.1158/1541-7786.MCR-16-0385 |
| [5] |
LI Z, DOU P, LIU T, et al. Application of long noncoding rnas in osteosarcoma:biomarkers and therapeutic targets[J]. Cell Physiol Biochem, 2017, 42(4): 1407-1419. DOI:10.1159/000479205 |
| [6] |
WEI S, FAN Q, YANG L, et al. Promotion of glycolysis by HOTAIR through GLUT1 upregulation via mTOR signaling[J]. Oncol Reports, 2017, 38(3): 1902-1908. DOI:10.3892/or.2017.5840 |
| [7] |
SONG H, HE P, SHAO T, et al. Long non-coding RNA XIST functions as an oncogene in human colorectal cancer by targeting miR-132-3p[J]. J BUON, 2017, 22(3): 696-703. |
| [8] |
WEAKLEY SM, WANG H, YAO Q, et al. Expression and function of a large non-coding RNA gene XIST in human cancer[J]. World J Surg, 2011, 35(8): 1751-1756. DOI:10.1007/s00268-010-0951-0 |
| [9] |
FANG J, SUN CC, GONG C. Long noncoding RNA XIST acts as an oncogene in non-small cell lung cancer by epigenetically repressing KLF2 expression[J]. Biochem Biophy Res Commun, 2016, 478(2): 811-817. DOI:10.1016/j.bbrc.2016.08.030 |
| [10] |
ZHUANG LK, YANG YT, MA X, et al. MicroRNA-92b promotes hepatocellular carcinoma progression by targeting Smad7 and is mediated by long non-coding RNA XIST[J]. Cell Death Dis, 2016, 7: e2203. DOI:10.1038/cddis.2016.100 |
| [11] |
MA L, ZHOU Y, LUO X, et al. Long non-coding RNA XIST promotes cell growth and invasion through regulating miR-497/MACC1 axis in gastric cancer[J]. Oncotarget, 2017, 8(3): 4125-4135. DOI:10.18632/oncotarget.13670 |
| [12] |
GALUN D, SRDIC-RAJIC T, BOGDANOVIC A, et al. Targeted therapy and personalized medicine in hepatocellular carcinoma:drug resistance, mechanisms, and treatment strategies[J]. J Hepatocell Carcinoma, 2017, 4: 93-103. DOI:10.2147/JHC.S106529 |
| [13] |
CHEN DL, JU HQ, LU YX, et al. Long non-coding RNA XIST regulates gastric cancer progression by acting as a molecular sponge of miR-101 to modulate EZH2 expression[J]. J Exp Clin Cancer Res, 2016, 35(1): 142. DOI:10.1186/s13046-016-0420-1 |
| [14] |
WANG H, SHEN Q, ZHANG X, et al. The long non-coding RNA XIST controls non-small cell lung cancer proliferation and invasion by modulating miR-186-5p[J]. Cell Physiol Biochem, 2017, 41(6): 2221-2229. DOI:10.1159/000475637 |
| [15] |
YILDIRIM E, KIRBY JE, BROWN DE, et al. Xist RNA is a potent suppressor of hematologic cancer in mice[J]. Cell, 2013, 152(4): 727-742. DOI:10.1016/j.cell.2013.01.034 |
 2018, Vol. 47
2018, Vol. 47