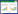文章信息
- 李冬阳, 李智, 曲晶磊, 曲秀娟, 刘云鹏
- LI Dongyang, LI Zhi, QU Jinglei, QU Xiujuan, LIU Yunpeng
- NFκB活化受体因子在胃癌中的表达及临床意义
- Expression and Clinical Significance of Receptor Activator of NF-κB in Gastric Carcinoma
- 中国医科大学学报, 2018, 47(10): 881-885, 890
- Journal of China Medical University, 2018, 47(10): 881-885, 890
-
文章历史
- 收稿日期:2018-02-23
- 网络出版时间:2018-09-27 16:20
胃癌是我国常见的恶性肿瘤之一,临床病例多以进展期为主[1],局部及远处转移是胃癌患者生存率低的主要原因。胃癌的侵袭转移是一个涉及肿瘤生物学行为、转移途径、转移器官特征等多重因素的复杂过程。
NF-κB活化受体因子(receptor activator of NF-κB,RANK)是肿瘤坏死因子受体超家族(tumor necrosis factor receptor superfamily,TNFRS)的成员。RANK最初从树突状细胞中克隆出来,被发现和证实在溶骨过程以及淋巴结发育中有重要作用,属于Ⅰ类跨膜蛋白[2-3]。既往研究[4-5]证明,RANK在乳腺癌、肺癌、前列腺癌、恶性黑色素瘤、肾癌等肿瘤细胞表面均有表达。
RANK主要通过RANK/RANKL/OPG通路发挥作用。近年来的研究[6-9]发现,此通路可诱导RANK阳性肿瘤细胞的迁移转移。而RANK在胃癌细胞的表达以及RANK/RANKL/OPG通路能否诱导胃癌细胞迁移在国内外报道较少。
本研究应用免疫组化S-P法,检测RANK蛋白在胃癌中的表达情况,并分析其与胃癌临床病理特征的关系以及对生存的影响,旨在探讨RANK在胃癌中的表达及临床意义。
1 材料与方法 1.1 临床资料选取中国医科大学附属第一医院2006年4月至2011年12月手术切除的胃癌组织标本232例,术前均未行放疗、化疗及免疫治疗。其中,男166例,女66例。年龄29~80岁,中位年龄60岁。组织学类型均为腺癌,按分化程度分为:中高分化癌110例,低分化癌100例(将印戒细胞癌、黏液细胞癌划入低分化腺癌组),混合型22例。其中有淋巴结转移者180例,无淋巴结转移者52例。浸润深度根据美国癌症联合委员会(AJCC)第7版胃癌TNM分期标准分期,T1 2例,T2 18例,T3 38例,T4 174例。232例患者全部完成随访。中位随访时间为2年。
1.2 试剂鼠抗人RANK单克隆抗体购自美国R&D systems公司;S-P检测试剂盒及DAB显色液均购自福州迈新生物技术开发有限公司。
1.3 检测方法免疫组化染色采用链霉素抗生物素蛋白-过氧化物酶(S-P)法,操作方法按试剂盒说明书进行。均经DAB显色,苏木素复染。用已知阳性对照片作为阳性对照,PBS代替一抗作为阴性对照。
1.4 免疫组化检测结果判定RANK均以胞膜和(或)胞质出现棕黄色颗粒为阳性染色,于400倍视野下随机选取5个不同视野,每个视野得分由阳性细胞比例和显色强度决定。阳性细胞比例:≤5%为0分、> 5%~25%为1分,> 25%~50%为2分,> 50%~75%为3分,> 75%为4分;显色强度:未着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。2项分数乘积为该视野得分,5个视野分数的平均值为最后得分。最后按得分划分等级:0~1分(-),2~4分(+),5~7分(++),≥8分(+++)。(-)和(+)为阴性,(++)和(+++)为阳性。
1.5 统计学分析应用SPSS 18.0软件进行统计分析,RANK的表达与临床病理因素之间的关系采用Spearman等级相关性分析;RANK的表达与生存时间的关系采用Kaplan-Meier生存曲线及log-rank检验。P < 0.05为差异有统计学意义。
2 结果 2.1 RANK在胃癌组织中的表达RANK的阳性染色位于细胞质和(或)胞膜,为均匀一致的棕黄色颗粒。在232例胃癌标本中有123例RANK高表达,阳性率为53%;亚组分析中,胃癌肠型患者91例标本中有64例RANK高表达,阳性率为70.3%。见图 1。
|
| A, positive; B, negative. 图 1 RANK在胃癌组织中的表达×100 Fig.1 RANK expression in gastric carcinoma original magnification ×100 |
2.2 RANK的表达与胃癌临床病理特征的关系
RANK的表达与性别、年龄、分化程度、浸润深度、临床分期以及淋巴结转移等病理因素无显著相关性(P > 0.05),Lauren分型相关(P = 0.000 1),见表 1。
| Clinicopathological characteristics | n | RANK expression | ||
| Positive [n(%)] | Negative [n(%)] | P | ||
| Total | 232 | 123(53.0) | 109(47.0) | |
| Sex | 0.246 | |||
| Male | 166 | 92(55.4) | 74(44.6) | |
| Female | 66 | 31(47.0) | 35(53.0) | |
| Age(year) | 0.482 | |||
| ≤60 | 107 | 50(46.7) | 57(53.3) | |
| > 60 | 125 | 73(58.4) | 52(41.6) | |
| Lauren grade | 0.001 | |||
| Intestinal | 91 | 64(70.3) | 27(29.7) | |
| Diffuse | 119 | 45(37.8) | 74(62.2) | |
| Mixed | 22 | 14(63.6) | 8(36.4) | |
| Depth of invasion | 0.778 | |||
| T1+T2 | 20 | 10(50.0) | 10(50.0) | |
| T3+T4 | 212 | 113(53.3) | 99(46.7) | |
| LN metastasis | 0.782 | |||
| N0 | 52 | 27(51.9) | 25(48.1) | |
| N1+N2 | 84 | 47(56.0) | 37(44.0) | |
| N3 | 96 | 49(51.0) | 47(49.0) | |
| LN metastasis grade | 0.482 | |||
| ≤0.25 | 146 | 80(54.8) | 66(45.2) | |
| > 0.25 | 86 | 43(50.0) | 43(50.0) | |
| TNM staging | 0.778 | |||
| Ⅰ+Ⅱ | 56 | 31(55.4) | 25(44.6) | |
| Ⅲ+Ⅳ | 176 | 92(52.3) | 84(47.7) | |
在亚组分析中,胃癌肠型91例中,RANK的表达与性别、年龄、浸润深度、临床分期以及淋巴结转移等病理因素无显著相关性(P > 0.05),与淋巴结转移度相关(P = 0.032),见表 2。
| Clinicopathological characteristics | n | RANK expression | ||
| Positive [n(%)] | Negative [n(%)] | P | ||
| Total | 91 | 64(70.3) | 27(29.7) | |
| Sex | 0.847 | |||
| Male | 73 | 51(69.9) | 22(30.1) | |
| Female | 18 | 13(72.2) | 5(27.8) | |
| Age(year) | 0.032 | |||
| ≤60 | 39 | 23(59.0) | 16(41.0) | |
| > 60 | 52 | 41(78.8) | 11(21.2) | |
| Depth of invasion | 0.631 | |||
| T1+T2 | 5 | 4(80.0) | 1(20.0) | |
| T3+T4 | 86 | 60(69.8) | 26(30.2) | |
| LN metastasis | 0.161 | |||
| N0 | 19 | 11(57.9) | 8(42.1) | |
| N1+N2 | 41 | 29(70.7) | 12(29.3) | |
| N3 | 31 | 24(77.4) | 7(22.6) | |
| LN metastasis grade | 0.032 | |||
| ≤0.25 | 63 | 40(63.5) | 23(36.5) | |
| > 0.25 | 28 | 24(85.7) | 4(14.3) | |
| TNM staging | 0.631 | |||
| Ⅰ+Ⅱ | 23 | 14(60.9) | 9(39.1) | |
| Ⅲ+Ⅳ | 68 | 50(73.5) | 18(26.5) | |
2.3 RANK的表达与胃癌患者生存期的关系
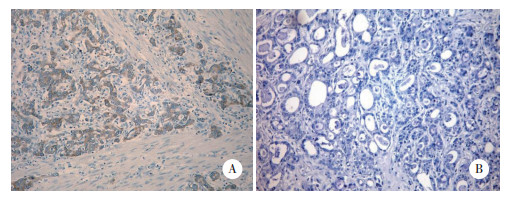
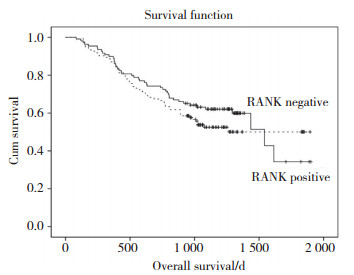
RANK阳性组患者生存率为52.8%,阴性组患者生存率为58.7%,差异无统计学意义(P = 0.306),见图 2。亚组分析中,肠型胃癌RANK阳性组患者生存率高于阴性组,分别为46.9%和74.1%,两者有统计学意义(P = 0.016),见图 3。弥漫型胃癌RANK阳性组与阴性组生存率无统计学差异(P = 0.664),见图 4。
|
| 图 2 胃癌组织中RANK的表达与患者生存期之间的关系 Fig.2 The relationship of the RANK expression in gastric cancer with overall survival |
|
| 图 3 肠型胃癌组织中RANK的表达与患者生存期之间的关系 Fig.3 The relationship of the RANK expression in intestinal-type gastric cancer with overall survival |
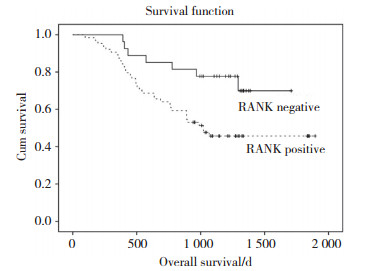
|
| 图 4 弥漫型胃癌组织中RANK的表达与患者生存之间的关系 Fig.4 The relationship of the RANK expression in diffuse-type gastric cancer with overall survival |
3 讨论
胃癌中肿瘤的侵袭转移是一个涉及多因素的复杂过程,多种基因在此过程中起重要作用。
RANK是TNFRS的成员。RANK最初被发现在溶骨过程以及淋巴结发育中有重要作用[10]。既往研究表明,RANK在肿瘤组织中高表达,如骨肉瘤[11-12]、软骨肉瘤[13]、乳腺癌[14]、前列腺癌[15-16]、肾癌[17]、口腔鳞癌[18]、肺癌[8]、甲状腺癌[19]以及黑色素瘤[20]等。本研究结果显示,胃癌中RANK高表达,在细胞膜、细胞质均有表达,阳性率为53%,肠型胃癌中阳性率为71.7%。
RANK与Lauren分型相关(P = 0.001),提示RANK在肠型及弥漫型胃癌中存在差异性表达。国内外无类似报道。相关研究提示,肠型胃癌起源于胃黏膜的肠上皮化生,弥漫型胃癌起源于胃固有黏膜,与肠化生无关。RANK是否能影响肿瘤细胞发生过程中进一步向肠型分化,需要进一步研究验证。
RANK/RANKL/OPG是近年来研究较多的信号通路,RANKL和RANK结合后,可诱导RANK阳性的胃癌细胞侵袭转移,在乳腺癌,前列腺癌中也有类似报道[21-23]。考虑RANK可能是肿瘤细胞侵袭转移通路的重要受体。此外,在乳腺癌和前列腺癌和肺癌的研究[24]中,研究者提示RANK/RANKL/OPG系统有可引起肿瘤细胞定向骨转移,在胃癌中相关研究较少,有文献[25]报道,胃癌骨转移不依靠RANK/RANKL/OPG通路。本研究结果显示,RANK通路在肠型胃癌高表达与淋巴结转移度相关(P = 0.032)。由此推测,RANK在肠型胃癌中对肿瘤细胞的迁移可能与局部侵袭及淋巴结转移相关。JONES等[6]在乳腺癌患者转移淋巴结中发现RANK表达。DANIELE等[26]在对93例浸润性导管癌及小叶乳腺癌研究发现,RANK与淋巴结转移相关(P < 0.05)。在既往胃癌中研究[27]中存在类似报道,提示RANK通路在胃癌肿瘤的发生及诱导淋巴结和脏器转移中起一定作用。
RANK高表达对患者生存的影响既往研究例数较少,DANIELE等[26]对93例浸润性导管癌及小叶乳腺癌的研究发现,RANK阳性的患者存在生存劣势,且有统计学意义(P = 0.034)。本研究中,RANK在弥漫型胃癌中与总生存无关,而在肠型胃癌中RANK阳性的患者存在生存劣势(P = 0.016)。考虑肠型胃癌中对生存的影响可能与RANK阳性引起肿瘤细胞局部及淋巴结侵袭转移相关。
综上所述,RANK在胃癌中与Lauren分型相关,且在亚组分析中,肠型胃癌患者的RANK表达与淋巴结转移及生存预后相关。RANK可能是一个胃癌发生发展相关的有价值的分子标记物,可以成为肠型胃癌诊断和治疗的一个新的作用靶点,其具体机制需要进一步研究证实。
| [1] |
孙秀娣, 牧人, 周有尚, 等. 中国胃癌死亡率20年变化情况分析及其发展趋势预测[J]. 中华肿瘤杂志, 2004, 26(1): 4-9. DOI:10.3760/j.issn:0253-3766.2004.01.002 |
| [2] |
DOUGALL WC, GLACCUM M, CHARRIER K, et al. RANK is essential for osteoclast and lymph node development[J]. Genes Dev, 1999, 13(18): 2412-2424. DOI:10.1101/gad.13.18.2412 |
| [3] |
LI J, SAROSI I, YAN XQ, et al. RANK is the intrinsic hematopoietic cell surface receptor that controls osteoclastogenesis and regulation of bone mass and calcium metabolism[J]. Proc Natl Acad Sci USA, 2000, 97(4): 1566-1571. DOI:10.1073/pnas.97.4.1566 |
| [4] |
TAT ST, PELLETIER JP, VELASCO CR, et al. New perspective in osteoarthritis:the OPG and RANKL system as a potential therapeutic target?[J]. Keio J Med, 2009, 58: 29-40. DOI:10.2302/kjm.58.29 |
| [5] |
BOYCE BF, XING L. Functions of RANKL/RANK/OPG in bone modeling and remodeling. Archives of biochemistry and biophysics[J]. Arch Biochem Biophys, 2008, 473: 139-146. DOI:10.1016/j.abb.2008.03.018 |
| [6] |
JONES D H, NAKASHIMA T, SANCHEZ OH, et al. Regulation of cancer cell migration and bone metastasis by RANKL[J]. Nature, 2006, 440(7084): 692-696. DOI:10.1038/nature04524 |
| [7] |
SANTINI D, PERRONE G, ROATO I, et al. Expression pattern of receptor activator of NFκB(RANK)in a series of primary solid tumor and related bone metastases[J]. J Cell Physiol, 2011, 226(3): 780-784. DOI:10.1002/jcp.22402 |
| [8] |
CHEN LM, KUO CH, LAI TY, et al. RANKL increases migration of human lung cancer cells through intercellular adhesion molecule-1 up-regulation[J]. J Cell Biochem, 2011, 112(3): 933-941. DOI:10.1002/jcb.23009 |
| [9] |
BHANSEN MF. Expression of receptor activator of nuclear factor -kappaB is inversely correlated with metastasis phenotype in breast carcinoma[J]. Clin Cancer Res, 2005, 11(1): 162-165. |
| [10] |
BOYCE BF, XING L. Biology of RANK, RANKL, and osteoprotegerin[J]. Arthritis Res Ther, 2007, 9(Suppl 1): S1. DOI:10.1186/ar2165 |
| [11] |
WITTRANT Y, LAMOUREUX F, MORI K, et al. RANKL directly induces bone morphogenetic protein-2 expression in RANK-expressing POS-1 osteosarcoma cells[J]. Int J Oncol, 2006, 28(1): 261-269. DOI:10.3892/ijo.28.1.261 |
| [12] |
MORI K, BERREUR M, BLANCHARD F, et al. Receptor activator of nuclear factor-kappaB ligand(RANKL)directly modulates the gene expression profile of RANK-positive Saos-2 human osteosarcoma cells[J]. Oncol Rep, 2007, 18(6): 1365-1371. DOI:10.3892/or.18.6.1365 |
| [13] |
HSU CJ, LIN TY, KUO CC, et al. Involvement of integrin up-regulation in RANKL/RANK pathway of chondrosarcomas migration[J]. J Cell Biochem, 2010, 111(1): 138-147. DOI:10.1002/jcb.22677 |
| [14] |
THOMAS RJ, GUISE TA, YIN JJ, et al. Breast cancer cells interact with osteoblasts to support osteoclast formation[J]. Endocrinology, 1999, 140(10): 4451-4458. DOI:10.1210/endo.140.10.7037 |
| [15] |
MORI K, LE GOFF B, CHARRIER C, et al. DU145 human prostate cancer cells express functional receptor activator of NF-kappaB:new insights in the prostate cancer bone metastasis process[J]. Bone, 2007, 40(4): 981-990. DOI:10.1016/j.bone.2006.11.006 |
| [16] |
ARMSTRONG AP, MILLER RE, JONES JC, et al. RANKL acts directly on RANK-expressing prostate tumor cells and mediates migration and expression of tumor metastasis genes[J]. Prostate, 2008, 68(1): 92-104. DOI:10.1002/pros.20678 |
| [17] |
MIKAMI S, KATSUBE K, OYA M, et al. Increased RANKL expression is related to tumour migration and metastasis of renal cell carcinomas[J]. J Pathol, 2009, 218(4): 530-539. DOI:10.1002/path.2567 |
| [18] |
CHUANG FH, HSUE SS, WU CW, et al. Immunohistochemical expression of RANKL, RANK, and OPG in human oral squamous cell carcinoma[J]. J Oral Pathol Med, 2009, 38(10): 753-758. DOI:10.1111/j.1600-0714.2009.00793.x |
| [19] |
HEYMANN MF, RIET A, LE GOFF B, et al. OPG, RANK and RANK ligand expression in thyroid lesions[J]. Regul Pept, 2008, 148(1/3): 46-53. DOI:10.1016/j.regpep.2008.02.004 |
| [20] |
KUPAS V, WEISHAUPT C, SIEPMANN D, et al. RANK is expressed in metastatic melanoma and highly upregulated on melanoma-initiating cells[J]. J Invest Dermatol, 2011, 131(4): 944-955. DOI:10.1038/jid.2010.377 |
| [21] |
MORI K, ANDO K, HEYMANN D, et al. Receptor activator of nuclear factor-kappa B ligand(RANKL)stimulates bone-associated tumors through functional RANK expressed on bone-associated cancer cells?[J]. Histol Histopathol, 2009, 24(2): 235-242. DOI:10.14670/HH-24.235 |
| [22] |
KONG YY, YOSHIDA H, SAROSI I, et al. OPGL is a key regulator of osteoclastogenesis, lymphocyte development and lymphnode organogenesis[J]. Nature, 1999, 397(6717): 315-323. DOI:10.1038/16852 |
| [23] |
KIM N, ODGREN PR, KIM DK, et al. Diverse roles of the tumor necrosis factor family member TRANCE in skeletal physiology revealed by TRANCE deficiency and partial rescue by a lymphocyte-expressed TRANCE transgene[J]. Proc Natl Acad Sci USA, 2000, 97(20): 10905-10910. DOI:10.1073/pnas.200294797 |
| [24] |
KUSUMOTO H, HARAGUCHI M, NOZUKA Y, et al. Characteristic features of disseminated carcinomatosis of the bone marrow due to gastric cancer:the pathogenesis of bone destruction[J]. Oncol Rep, 2006, 16(4): 735-740. DOI:10.3892/or.16.4.735 |
| [25] |
D'AMICO L, SATOLLI MA, MECCA C, et al. Bone metastases in gastric cancer follow a RANKL-independent mechanism[J]. Oncol Rep, 2013, 29(4): 1453-1458. DOI:10.3892/or.2013.2280 |
| [26] |
SANTINI D, SCHIAVON G, VINCENZI B, et al. Receptor activator of NF-kB(RANK)expression in primary tumors associates with bone metastasis occurrence in breast cancer patients[J]. PLoS One, 2011, 29, 6(4): e19234. DOI:10.1371/journal.pone.0019234 |
| [27] |
ITO R, NAKAYAMA H, YOSHIDA K, et al. Expression of osteoprotegerin correlates with aggressiveness and poor prognosis of gastric carcinoma[J]. Virchows Arch, 2003, 443(2): 146-151. DOI:10.1007/s00428-003-0845-8 |
 2018, Vol. 47
2018, Vol. 47