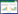文章信息
- 李丹妮, 刘云鹏
- LI Danni, LIU Yunpeng
- GATA1不同激酶活性突变体质粒的构建及蛋白表达和亚细胞定位
- Construction, Protein Expression, and Subcellular Localization of Various Kinase Mutant Plasmids of GATA1
- 中国医科大学学报, 2018, 47(1): 22-26
- Journal of China Medical University, 2018, 47(1): 22-26
-
文章历史
- 收稿日期:2017-05-16
- 网络出版时间:2017-12-20 14:26
PAK5作为丝氨酸/苏氨酸蛋白激酶(p21-activated kinases,PAKs)的一员,可以磷酸化底物GATA1的Ser161和Ser187位点,并协同GATA1发挥重要的转录调控功能。目前研究[1]发现,GATA1在实体瘤中高表达,如乳腺癌等。GATA1同家族成员GATA3可上调E-Ca的表达,进而抑制乳腺癌的侵袭转移[2-3]。
本研究利用大引物PCR法构建不同激酶活性GATA1突变体GATA1 S161A S187A (死型)和GATA1 S161D S187D (激活型)真核表达载体。并证实其融合蛋白在细胞内的表达及定位,旨在为进一步探讨其生物学功能奠定基础。
1 材料与方法 1.1 材料大肠杆菌DH5感受态为中国医科大学分子细胞生物学教研室制备;真核表达载体pEGFP-C1购自美国Clontech公司,工具细胞HEK-293为中国医科大学分子细胞生物学教研室保存。PryobestTM DNA polymerase、dNTP、DNA电泳凝胶回收试剂盒、限制性核酸内切酶EcoRⅠ和XhoⅠ均购自日本TaKaRa公司;DNA marker和Protein marker购自美国GenScript公司;T4 DNA连接酶购自NEB公司;anti-GFP抗体购自美国Genscript公司;引物合成、DNA序列测定由深圳华大有限公司完成;ECL发光试剂盒购自美国Pharmacia公司;其他试剂均为国产分析纯。
1.2 大引物PCR法对GATA1不同激酶活性的全长突变体的扩增 1.2.1 点突变引物设计设计GATA1 S161A及GATA1 S161D扩增的PCR引物,包括GATA1上下游引物及Ser161突变点插入引物,并在上下游引物中分别加入EcoRⅠ、XhoⅠ限制性酶切位点,A,GFP-GATA1-s primer序列为5’-TGGAAGCTCGAGAATGGAGTTCCCA-3’;B,GFP-GATA1-a primer序列为5’-GCCCTCTATGAATTCGTCATGAGCTGA-3’;C,GATA1S161A-a primer序列为5’-CCCCCATAAGCAGCATTGGGGACAG-3’;D,GATA1 S161D-a primer序列为5’-CCCCCATAAGCATCATTGGGGACAG-3’。反应条件为95 ℃ 5 min;95 ℃ 1 min,58 ℃ 1 min,72 ℃ 1 min,30个循环;72 ℃ 10 min。
1.2.2 PCR扩增点突变大引物以GFP-GATA1 WT为模板,由上游引物A和下游引物C引发第1轮PCR扩增GATA1 S161A的单突变序列大引物。以GFP-GATA1 WT为模板,由上游引物A和下游引物D引发第1轮PCR扩增GATA1 S161D的单突变序列大引物。
1.2.3 利用大引物PCR扩增全长突变体分别以扩增出的GATA1 S161A和GATA1 S161D的单突变序列作为引物,与另一外侧引物B用于第2轮PCR反应,共同扩增GATA1 S161A和GATA1 S161D全长突变体。
1.2.4 设计点突变引物设计GATA1 S187A及GATA1 S187D扩增的PCR引物。引物E,GATA1 S187A-a primer序列为5’-GCTTGGGAGCGGAATAGG-3’;F,GATA1 S187D-a primer序列为5’-GCTTGGGATCGGAATAGG-3’。再分别以GATA1 S161A和GATA1 S161D全长突变体为模板,采用相同的大引物PCR法最后扩增出含双突变位点的终产物GATA1 S187A S161A和GATA1 S187D S161D。用大引物PCR法扩增GATA1 S161A S187A和GATA1 S161D S187D的全长突变体,并将其克隆至pEGFP-C1表达载体中。将构建的重组质粒测序并转染到工具细胞HEK-293中,提取细胞蛋白进行Western blotting检测。利用共聚焦激光扫描显微镜分别观察pEGFP-GATA1 S161A S187A和pEGFP-GATA1 S161D S187D在工具细胞HEK-293的细胞内定位。
1.3 电泳及载体回收PCR产物含双突变位点的终产物GATA1 S187A S161A和GATA1 S187D S161D,即目的片段的纯化。1%琼脂糖凝胶电泳(90 V,30 min),紫外灯下根据DNA分子量标准选取目的片断并切下,按照TaKaRa琼脂糖凝胶DNA回收试剂盒的操作步骤回收目的片段。回收后电泳确定浓度。回收pEGFP载体以及PCR含双突变位点的终产物GATA1 S187A S161A和GATA1 S187D S161D。37 ℃酶切过夜,电泳。反应体系包括EGFP,PCR产物24 μL,10×H缓冲液3 μL,EcoRⅠ1.5 μL,XhoⅠ 1.5 μL。
1.4 连接和转化上述双酶切产物经过纯化(其中载体酶切产物割胶回收,PCR片段酶切后纯化步骤与上述PCR产物纯化步骤相同),在T4 DNA连接酶作用下,室温2 h或16 ℃连接过夜。连接体系为载体1.5 μL,GATA1 S187A S161A/S161D 7 μL,10×T4 DNA连接酶缓冲液1 μL,T4 DNA连接酶0.5 μL。取上述连接液5 μL转化到预先制备的DH5α化学感受态细胞中,冰浴30 min,42 ℃水浴60 s,冰中放置2~3 min,加入250 μL 37 ℃预温的无抗LB培养基,37 ℃摇床振荡培养1 h,最后均匀涂于平板,37 ℃温箱培养12~16 h。挑选单菌落接种到3 mL相关抗性的LB培养基中,于37 ℃ 225 r/min摇菌过夜。
1.5 制备质粒将菌液倒入1.5 mL EP管中,4 ℃ 12 000 r/min离心1 min。离心结束尽可能吸干培养液。将细菌沉淀重悬于100 μL冰预冷的溶液Ⅰ中,涡旋使沉淀充分溶解。向EP管中加入200 μL新配制的溶液Ⅱ,快速颠倒2次,然后置于冰上。用150 μL预冷的溶液Ⅲ,盖紧瓶口,反复颠倒数次,冰上放置5 min。4 ℃ 12 000 r/min离心10 min,上清转移至新EP管中。加入与上清等体积的酚/氯仿,涡旋15 s,4 ℃ 12 000 r/min离心10 min。小心吸取上层水相于新管中,加入2倍体积(约700 μL)无水乙醇,30 μL 3M NaAC于室温沉淀核酸,振荡混合,室温5 min。4℃ 12 000 r/min离心10 min。弃上清,加入1 mL 70%乙醇洗涤沉淀,4℃ 12 000 r/min离心5 min。弃上清,室温干燥5~10 min,用30 μL RNAse水重新溶解沉淀,温和振荡,-20 ℃保存。
1.6 酶切鉴定及测序利用EcoRⅠ和XhoⅠ对所提取的质粒进行双酶切,酶切后电泳,根据片断的大小来确定是否连接正确。送基因检测公司进行测序。
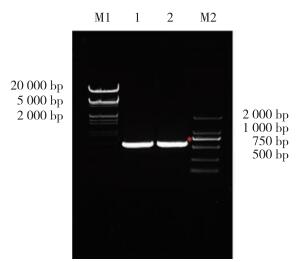
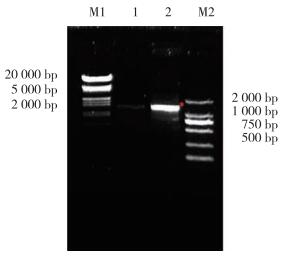
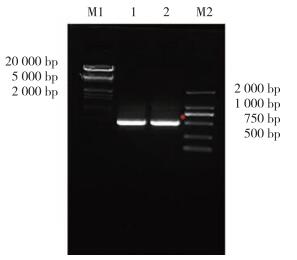
2 结果 2.1 大引物法扩增GATA1 S161A S187A和GATA1 S161D S187D双突变全长片段使用大引物PCR法对GATA1 S161A S187A和GATA1 S161D S187D双突变全长突变体进行扩增。首先以GFP-GATA1 WT为模板,进行第1轮大引物PCR,PCR扩增GATA1 (1-161aa) S161A/D大引物片段,得到长度约500 bp的2条带(图 1)。应用PCR产物GATA1 (1-161aa) S161A/D作为上游大引物与GATA1下游引物进行PCR,PCR扩增GATA1 S161A/D单突变点全长片段,得到长度1 200 bp的全长产物(图 2)。以GATA1 S161A/D为模板,进行第2轮大引物PCR,PCR扩增GATA1 S161A/D (1-187aa) S187A/D大引物片段,得到长度约500 bp的2条带(图 3),应用PCR产物GATA1 (1-161aa) S161A/D作为上游大引物与GATA1下游引物进行PCR,PCR扩增GATA1 S161A/D S187A/D双突变点全长片段,得到长度1 200 bp的全长产物(图 4)。
|
| M1, λ marker; 1, SA mutant; 2, SD mutant; M2, DL2000 marker. *, 561 bp. 图 1 PCR扩增hGATA1 S161A/D上游大引物 Fig.1 PCR amplification of the hGATA1 S161A/D upstream primers |
|
| M1, λ marker; 1, SA mutant; 2, SD mutant; M2, DL2000 marker. *, 1 242 bp. 图 2 PCR扩增hGATA1 S161A/D全长突变体 Fig.2 PCR amplification of the hGATA1 S161A/D full-length mutant |
|
| M1, λ marker; 1, SA mutant; 2, SD mutant; M2, DL2000 marker. *, 483 bp. 图 3 PCR扩增hGATA1 S161A/D S187A/D上游大引物 Fig.3 PCR amplification of the hGATA1 S161A/D S187A/D upstream primers |
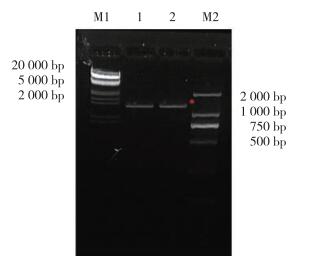
|
| M1, λ marker; 1, SA mutant; 2, SD mutant; M2, DL2000 marker. *, 1 242 bp. 图 4 PCR扩增hGATA1 S161A/D S187A/D全长突变体 Fig.4 PCR amplification of the hGATA1 S187A/D full-length mutant |
2.2 GATA1不同激酶活性突变体的真核表达载体的构建和鉴定
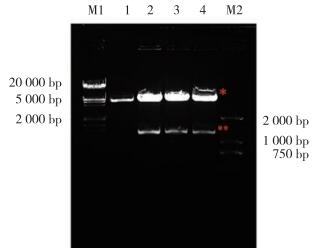
将重组质粒pEGFP-C1-GATA1 S161A/D S187A/D双突变点全长经EcoRI/ XhoI双酶切后得到了约4 700 b和1 200 bp左右的2条带(图 5)。经过测序分析,外源序列在NCBI-Blast比对结果证实双点突变成功。
|
| M1, λmarker; 1, vector; 2, wild type; 3, S161 D S187 D; 4, S161A S187A;M2, DL2000 marker. *, 4 700 bp; **, 1 242 bp. 图 5 重组质粒hGATA1 S161A/D S187A/D酶切结果 Fig.5 Identification of hGATA1 S161A/D S187A/D using restriction enzymes |
2.3 真核表达载体的蛋白表达
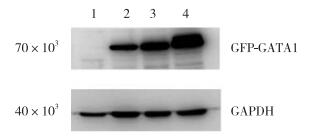
将构建的真核表达质粒pEGFP-C1-GATA1 S161A/D S187A/D双突变点全长转染到HEK-293细胞系中,48 h以后将提取的蛋白经10% SDS-PAGE凝胶电泳,Western blotting检测到了融合pEGFP-C1-GATA1 S161A/D S187A/D蛋白的表达(图 6)。分子量约为70×103,为质粒本身的GFP标签分子量(24×103~26×103)和GATA1 S161A/D S187A/D分子量(42×103)之和,说明融合蛋白表达。
|
| 1, vector; 2, wild type; 3, S161 D S187 D; 4, S161A S187A. 图 6 融合蛋白GFP-GATA1 S161A/D S187A/D的表达 Fig.6 Expression of GFP-GATA1 S161A/D S187A/D |
2.4 pEGFP-GATA1 S161A S187A和pEGFP-GATA1 S161D S187D在细胞内的定位
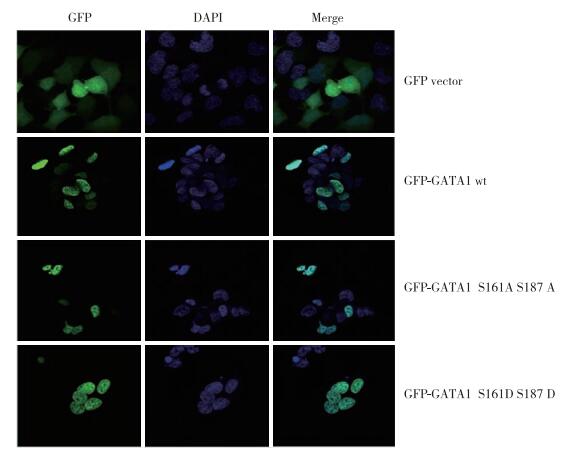
共聚焦激光显微镜技术显示pEGFP-GATA1 S161A S187A和pEGFP-GATA1 S161D S187D蛋白主要定位于细胞核内。见图 7。
|
| 图 7 pEGFP-GATA1 S161A/D S187A/D在HEK293细胞内的定位 ×40 Fig.7 Localization of pEGFP-GATA1 S161A/D S187A/D in HEK293 cells ×40 |
3 讨论
PAKs是一类保守的丝氨酸/苏氨酸蛋白激酶,通过其下游众多的激酶底物和结合蛋白参与众多的生物学功能,如细胞运动、细胞生存、细胞周期、血管生成、基因转录调节和癌细胞的侵袭转移[4-7],在多种恶性肿瘤,如乳腺癌、卵巢癌、胃癌、结肠癌、前列腺癌、甲状腺癌和胰腺癌中呈现过表达或高活性[8-10]。是肿瘤细胞信号网络的关键调节因子。PAK5作为丝氨酸/苏氨酸蛋白激酶,可以磷酸化底物GATA1的Ser161和Ser187位点。本研究利用高效精准的大引物法构建了pEGFP-GATA1 S161A S187A (死型)和pEGFP-GATA1 S161D S187D (激活型) 2种不同激酶活性的突变体质粒,而前期研究[11]也已发现磷酸化的GATA1可以招募更多的HDAC3/4至E-钙黏蛋白启动子区,抑制其转录进而下调E-钙黏蛋白,导致乳腺癌细胞发生上皮间质化,表明GATA1依赖PAK5的磷酸化在乳腺癌侵袭转移中发挥重要作用。
目前已建立的多种以PCR为基础的定点突变及产生重组体的方法体系中,应用较普遍的是重叠延伸PCR、大引物PCR和重组PCR法。其中,大引物PCR法由KAMMANN等[12]于1989年提出,随后经SARKAR等[13]加以改进。大引物PCR定点突变技术因简便实用而应用广泛。改进后的整个过程只需要3种扩增引物进行2次PCR反应。大引物为PCR扩增的产物,因长度远长于普通意义的引物而得名。大引物PCR突变法以第1次PCR扩增纯化产物作为第2次PCR扩增的大引物,第1轮PCR反应由诱变引物和相应的外侧引物共同引起扩增,这一轮PCR扩增所得到的突变体经纯化后作为大引物又与另一外侧引物用于第2轮PCR反应,最后扩增出含突变位点的终产物。
本研究通过大引物法,经过双轮PCR,成功构建了位置相距较远的双点突变hGATA1 S161A/D S187A/D突变体质粒。并进一步将重组质粒pEGFP-C1-GATA1 S161A/D S187A/D双突变点全长经EcoRⅠ/XhoⅠ双酶切后得到了约4 700 bp和1 200 bp左右的2条带,获取GATA1不同激酶活性突变体的真核表达载体并验证。成功印证其表达后,利用共聚焦激光显微镜技术阐释出pEGFP-GATA1 S161A S187A和pEGFP-GATA1 S161D S187D蛋白主要定位于细胞核内。有利于进一步深入分析GATA1与其他蛋白的相互作用的磷酸化位点以及生物学行为的阐释。而大引物PCR法对于全长突变体质粒的构建,以及进一步研究具体磷酸化位点的重要意义和生物学功能的阐明则至关重要。
| [1] |
SCHRANTZN, DA SILVA CORREIA J, FOWLER B, et al. Mechanism of p21-activated kinase 6-mediated inhibition of androgen receptor signaling[J]. J Biol Chem, 2004, 279(3): 1922-1931. DOI:10.1074/jbc.M311145200 |
| [2] |
KEXIN X, HERMELA S. Regulation of androgen receptor transcriptional activity and specificity by RNF6-induced ubiquitination[J]. Cancer Cell, 2009, 15(4): 270-282. DOI:10.1016/j.ccr.2009.02.021 |
| [3] |
KATSUMURA KR, BRESNICK EH, GATA FACTOR MECHANISM GROUP. The GATA factor revolution in hematology[J]. Blood, 2017, 129(15): 2092-2102. DOI:10.1182/blood-2016-09-687871 |
| [4] |
WELLS CM, JONES GE. The emerging importantce of group Ⅱ PAKs[J]. Biochem J, 2010, 425(3): 465-473. DOI:10.1042/BJ20091173 |
| [5] |
POONAM RM, LI DQ, MURRAY B, et al. PAK signaling in oncogenesis[J]. Oncogene, 2009, 28(28): 2545-2555. DOI:10.1038/onc |
| [6] |
DUMMLER B, OHSHIRO K, KUAMR R, et al. Pak protein kinases and their role in cancer[J]. Cancer Metast Rev, 2009, 28(1/2): 51-63. DOI:10.1007/s10555-008-9168-1 |
| [7] |
YE DZ, FIELD J. PAK signaling in cancer[J]. Cell Logist, 2012, 2(2): 105-116. DOI:10.4161/cl.21882 |
| [8] |
ISSACS JT, ISAACS WB. Androgen receptor outwits prostate cancer drugs[J]. Nat Med, 2004, 10(1): 26-27. DOI:10.1038/nm0104-26 |
| [9] |
YANG F, LI X, SHARMA M, et al. Androgen receptor specifically interacts with a novel p21-activated kinase PAK6[J]. J Biol Chem, 2001, 276(18): 15345-15353. DOI:10.1074/jbc.M010311200 |
| [10] |
LEE SR, RAMOS SM, KO A. AR and ER interaction with a p21-activated kinase (PAK6)[J]. Mol Endocrinol, 2002, 16(6): 85-99. DOI:10.1210/mend.16.1.0753 |
| [11] |
YANG LI, QIANG KE. GATA1 induces epithelial-mesenchymal transition in breast cancer cells through PAK5 oncogenic signaling[J]. Oncotarget, 2015, 6(6): 4345-4356. DOI:10.18632/oncotarget.2999 |
| [12] |
KAMMANN M, LAUFS J, GRONENBORN B. Rapid insertional mutagenesis of DNA by polymerase chain reaction (PCR)[J]. Nucleic Acids Res, 1989, 17(13): 5404. DOI:10.1093/nar/17.13.5404 |
| [13] |
SARKAR G, SOMMER SS. The "megaprimer" method of site-directed mutagenesis[J]. Biol Techniques, 1990, 8(4): 404-407. |
 2018, Vol. 47
2018, Vol. 47