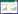文章信息
- 尹建国, 张社兵, 彭道泉
- Yin Jianguo, Zhang Shebing, Peng Daoquan
- 载脂蛋白AⅠ通过诱导自噬抑制泡沫细胞脂质沉积和凋亡
- Apolipoprotein AⅠ Inhibits Lipid Retention and Apoptosis in Foam Cells via Induction of Autophagy
- 中国医科大学学报, 2018, 47(1): 17-21
- Journal of China Medical University, 2018, 47(1): 17-21
-
文章历史
- 收稿日期:2017-06-01
- 网络出版时间:2017-12-20 14:26
2. 中南大学湘雅二医院心血管内科, 长沙 410011
2. Department of Cardiology, The Second Xiangya Hospital of Central South University, Changsha 410011 China
单核巨噬细胞在动脉粥样硬化(atherosclerosis,AS)的发生、发展过程中起重要作用,单核细胞迁移至内皮下分化为巨噬细胞,吞噬脂质成为泡沫细胞,泡沫细胞的形成是AS的标志事件,泡沫细胞凋亡后能使斑块坏死核心扩大,进一步促进斑块并发症的出现。同时,泡沫细胞中的脂质也能水解及自噬溶酶体系统的分解,促进脂质分解为游离的胆固醇,通过受体介导的胆固醇流出,运输至肝脏经代谢或排泄清除而发挥抗AS作用。自噬是细胞的细胞质成分和细胞器在溶酶体介导下降解的过程,巨噬细胞自噬活性的减弱,能促进细胞中脂质沉积及巨噬细胞泡沫化,促进斑块的体积增大同时变得不稳定。载脂蛋白AⅠ(apolipoprotein AⅠ,apoAⅠ)是高密度脂蛋白(high density lipoprotein,HDL)的主要蛋白成分,以往的研究认为其主要作为三磷酸腺苷结合盒转运体A1(ATP binding cassette transporter A1,ABCA1)的受体介导胆固醇流出,发挥抗AS作用。但现在有研究[1]发现apoAⅠ可调控细胞的自噬。本研究旨在探讨apoAⅠ对泡沫细胞自噬的影响以及与泡沫细胞脂质沉积及凋亡的关系。
1 材料与方法 1.1 材料THP-1细胞为中南大学湘雅二医院心内科实验室所保存,RPMI1640培养基购自美国Gibco公司,氧化型低密度脂蛋白(Oxidized low-density lipoprotein,Ox-LDL)购自北京协生生物科技公司,佛波酯(phorbol-12-myristate acetate,PMA)和3-MA购自日本Sigma公司;AnnexinV-FITC、PI购自美国BioLegend公司,微管相关蛋白1轻链3 (light chain 3,LC3)一抗、Beclin-1一抗购自英国Abcam公司,胆固醇检测试剂盒购自美国Bio Vision公司,apoAⅠ用质粒在体外表达纯化取得,纯度 > 99%,由湖南远泰生物技术公司协助完成。其余试剂均为湘雅二医院心血管内科实验室提供。
1.2 实验方案与干预THP-1细胞复苏后用含10%胎牛血清,100 Ku/L青霉素和链霉素的RPMI1640培养基置于含5% CO2、37 ℃,湿度100%的无菌培养箱中培养,细胞状态良好后计数分组,每组1.5×106细胞,先用160 nmol/L PMA孵育12 h诱导分化成巨噬细胞,随机分为3组。对照组在含Ox-LDL (50 mg/L)无血清培养基培养36 h;apoAⅠ组在含Ox-LDL (50 mg/L)的无血清培养基的基础上加入apoAⅠ (10 mg/L)培养36 h;3-MA+apoAⅠ组预先予以含3-MA (10 mmol/L)的培养基培养2 h,再加入含Ox-LDL (50 mg/L)及apoAⅠ (10 mg/L)的无血清培养基培养36 h。
1.3 细胞中脂滴油红O染色观察各组细胞用50%异丙醇固定,油红O工作液染色15 min,冲洗5 min,苏木素染核10 min,冲洗分色,氨水返蓝后,显微镜下观察拍照,红色颗粒为蓄积脂质。
1.4 细胞中胆固醇含量的检测各组干预后的细胞用细胞裂解液裂解,离心收集液相部分,吸出30 μL上清液用于检测细胞蛋白浓度,其余干燥后按胆固醇检测试剂盒操作,检测样品中的胆固醇浓度,最后细胞中的总胆固醇含量(mg/g) =胆固醇浓度/蛋白浓度。
1.5 细胞自噬小体的观察收集分组干预后的细胞用2.5%戊二醛固定,再进行固定、包埋、超薄切片、电子染色,日立HT7700型透射电镜观察、拍照。
1.6 Western blotting检测LC3和Beclin-1的表达分组干预的细胞裂解高速离心后取上清液,BCA法测蛋白浓度,取50 μg上样,经SDS-PAGE电泳后蛋白转移至PVDF膜上,用含5%脱脂牛奶的TBST溶液浸泡封闭2 h,分别加入1: 1 000的LC3、Beclin-1一抗,4 ℃孵育过夜,次日PBST液漂洗3次,相应稀释后二抗室温孵育2 h,再PBST液漂洗3次,ECL化学发光显影,在柯达化学发光成像仪中自动显影。用图像分析软件进行灰度值分析,所测得的各目的蛋白的灰度值与相应内参蛋白条带灰度值的比值即为该蛋白的相对表达量。
1.7 流式细胞仪检测泡沫细胞凋亡按流式细胞抗体说明书进行操作,每管加入AnnexinV-FITC、PI溶液,避光孵育后行流式细胞仪检测。
1.8 统计学分析采用SPSS 13.0统计软件包进行数据统计分析,数据均进行正态性分析。采用单因素方差分析,如组间存在统计学差异(P < 0. 05),则使用最小显著差数法进行组间的两两比较,P < 0.05为差异有统计学意义。
2 结果 2.1 泡沫细胞中脂滴油红O染色观察不同组巨噬细胞予以含Ox-LDL的培基培养后,细胞中有脂质沉积,油红O染色显示为红色,观察不同组脂质沉积情况,见图 1。
|
| A, control group; B, 3-MA+apoAⅠgroup; C, apoAⅠgroup. 图 1 油红O染色观察细胞中脂质沉积 ×400 Fig.1 Lipid deposition in foam cells visualized with oil red O staining ×400 |
2.2 细胞中胆固醇含量的测定
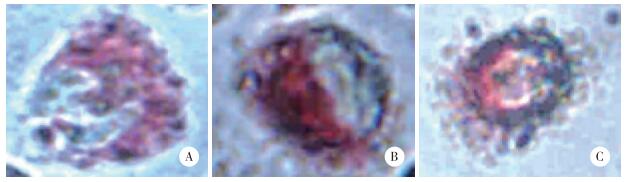
与对照组比较,apoAⅠ组、3-MA+apoAⅠ组泡沫细胞中胆固醇含量明显下降(P < 0.05);与3-MA+apoAⅠ组比较,apoAⅠ组泡沫细胞中胆固醇含量明显降低(P < 0.05),见图 2。
|
| * P < 0.05, compared with control group; # P < 0.05, compared with 3-MA+apoAⅠgroup. 图 2 不同干预组泡沫细胞中胆固醇含量的变化 Fig.2 Changes in foam cell cholesterol content following different experimental treatments |
2.3 不同干预对泡沫细胞自噬小体形成的影响
各组细胞超薄切片染色后透射电镜下观察自噬小体,与对照组及3-MA+apoAⅠ组比较,apoAⅠ组泡沫细胞中自噬小体较多,见图 3。

|
| A, control group; B, 3-MA+apoAⅠgroup; C, apoAⅠgroup.The boxes were autophagosomes. 图 3 各组泡沫细胞中自噬小体的观察 Fig.3 Autophagosomes of foam cells in each experimental group |
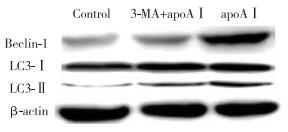
2.4 不同干预对LC3和Beclin-1表达的影响
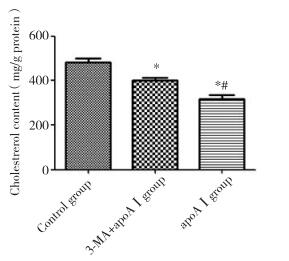
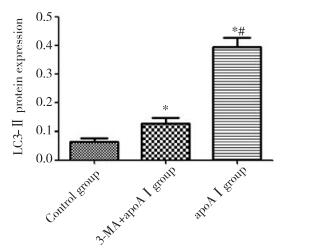
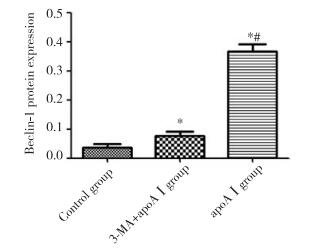
与对照组相比,apoAⅠ能明显上调LC3、Beclin-1的表达,LC3-Ⅱ的表达明显上调(P < 0.05),见图 4~6;与apoAⅠ组比较,予以3-MA预先干预后能明显抑制LC3、Beclin-1的表达,尤其是LC3-Ⅱ的表达(P < 0.01),见图 4~6。
|
| 图 4 各组泡沫细胞中LC3和Beclin-1表达 Fig.4 LC3 and Beclin-1 expression in foam cells from each experimental group |
|
| * P < 0.05, compared with control group; # P < 0.01, compared with 3-MA+apoAⅠgroup. 图 5 各组泡沫细胞LC3-Ⅱ表达比较(x±s,n = 3) Fig.5 LC3-Ⅱ expression in foam cells from each experimental group(x±s, n = 3) |
|
| * P < 0.05, compared with control group; # P < 0.01, compared with 3-MA+apoAⅠgroup. 图 6 各组泡沫细胞Beclin-1表达比较(x±s,n = 3) Fig.6 Beclin-1 expression in foam cells from each experimental group(x±s, n = 3) |
2.5 不同干预对泡沫细胞凋亡的影响
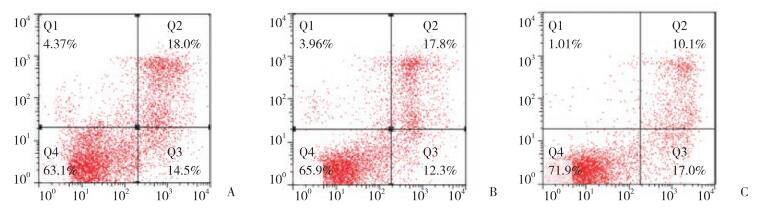
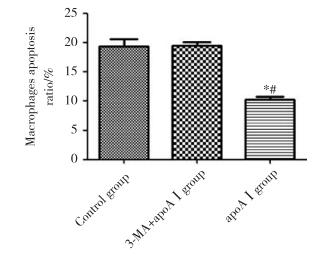
与对照组相比,apoAⅠ能明显抑制泡沫细胞的凋亡(P < 0.01),见图 7、8,但予以3-MA预先干预后,apoAⅠ抑制泡沫细胞凋亡的作用减弱(P < 0.01),见图 7、8。
|
| A, control group; B, 3-MA+apoAⅠgroup; C, apoAⅠgroup. 图 7 各组泡沫细胞流式细胞检测散点图 Fig.7 Apoptosis in foam cells from each experimental group, detected by flow cytometry |
|
| * P < 0.01, compared with control group; # P < 0.01, compared with 3-MA+apoAⅠgroup. 图 8 各组泡沫细胞凋亡的比较(n = 3) Fig.8 Apoptosis ratio in foam cells from each experimental group(n = 3) |
3 讨论
自噬是细胞的细胞质成分和细胞器被包裹形成自噬小体通过微管系统转运至溶酶体,在溶酶体降解的过程。自噬可降解受损的细胞器及大分子物质,维持细胞的稳态。在自噬过程中,LC3及Beclin-1在自噬小体形成的过程中起重要作用,是自噬的标志蛋白。LC3最初是以前体的形式合成,随即被Atg4B剪切形成定位于胞质内的亚型LC3-Ⅰ,LC3-Ⅰ在Agt7和Agt3作用下,与磷脂酰乙醇胺结合生成LC3-Ⅱ,LC3-Ⅱ定位于自噬小体的膜上,与Beclin-1一起是自噬活性的标志。近年来研究[4-5]表明,自噬在AS过程中起双重作用,参与并调控AS的发生及发展,适度自噬可抑制AS的发生、发展,自噬可促进巨噬泡沫细胞中的脂质降解,降解为游离胆固醇,促进胆固醇流出,起到抗AS的作用。因此有学者[2]提出通过调节自噬活性稳定斑块的策略。研究[3]表明白藜芦有抗AS作用,其机制与上调内皮细胞的自噬活性、抑制炎症有关。姜黄素抗AS的机制主要是通过诱导巨噬细胞自噬、抑制脂质聚集及细胞凋亡实现的。辛伐他汀有抗AS的作用,其作用机制也是通过上调巨噬细胞自噬活性,抑制巨噬细胞中脂质沉积实现的[6]。
巨噬细胞在AS的形成、发生、发展中起关键作用,单核细胞迁移至内皮下分化成巨噬细胞吞噬Ox-LDL,形成泡沫细胞是AS的标志事件。泡沫细胞坏死凋亡释放的炎性细胞因子及水解酶,进一步促进斑块的不稳定及破裂。因此抑制斑块中泡沫细胞的凋亡,稳定斑块是防治急性冠状动脉综合征的关键环节。而且已有研究[7]表明,木樨草素抗AS的机制就是通过上调巨噬细胞的自噬活性、抑制巨噬细胞的泡沫化及凋亡实现的。上调巨噬细胞的自噬活性有抗AS的作用[8]。
ApoAⅠ是HDL的主要蛋白成分,在体内主要与ABCA1结合,介导胆固醇流出从而起到抗AS的作用,但近年的研究[1]表明,apoAⅠ对细胞自噬还有调控作用。本研究表明apoAⅠ可促进巨噬细胞的自噬活性,上调Beclin-1的表达及LC3-Ⅱ/LC3-Ⅰ的比例,促进胆固醇的流出,减少细胞中脂质负荷,抑制巨噬细胞/泡沫细胞的凋亡;予以自噬抑制剂3-MA后,泡沫细胞中胆固醇含量明显增加,表明抑制自噬可促进巨噬细胞细胞中脂质沉积,促进泡沫细胞的形成。
总之,本研究发现,apoAⅠ可通过上调泡沫细胞的自噬活性,抑制泡沫细胞中的脂质聚集及细胞凋亡,发挥抗AS的作用,这为更进一步探索apoAⅠ的抗AS机制提供理论基础。
| [1] |
WANG S, PENG D. Regulation of adipocyte autophagy——the potential anti-obesity mechanism of high density lipoprotein and ApolipoproteinA-Ⅰ[J]. Lipids Health Dis, 2012, 11(1): 131. DOI:10.1186/1476-511X-11-131 |
| [2] |
MARTINET W, DE LOOF H, DE MEYER GR. mTOR inhibition:a promising strategy for stabilization of atherosclerotic plaques[J]. Atherosclerosis, 2014, 233(2): 601-607. DOI:10.1016/j.atherosclerosis.2014.01.040 |
| [3] |
CHEN M L, YI L, JIN X, et al. Resveratrol attenuates vascular endothelial inflammation by inducing autophagy through the cAMP signaling pathway[J]. Autophagy, 2013, 9(12): 2033-2045. DOI:10.4161/auto.26336 |
| [4] |
ZHENG L, LI Y, LI X, et al. Combination of hydroxyl acetylated curcumin and ultrasound induces macrophage autophagy with anti-apoptotic and anti-lipid aggregation effects[J]. Cell Physiol Biochem, 2016, 39(5): 1746-1760. DOI:10.1159/000447875 |
| [5] |
GU H F, LI HZ, TANG YL, et al. Nicotinate-curcumin impedes foam cell formation from thp-1 cells through restoring autophagy flux[J]. PLoS One, 2016, 11(4): e154820. DOI:10.1371/journal.pone.0154820 |
| [6] |
HUANG B, JIN M, YAN H, et al. Simvastatin enhances oxidizedlow density lipoproteininduced macrophage autophagy and attenuates lipid aggregation[J]. Mol Med Rep, 2015, 11(2): 1093-1098. DOI:10.3892/mmr.2014.2790 |
| [7] |
ZHANG BC, ZHANG CW, WANG C, et al. Luteolin attenuates foam cell formation and apoptosis in Ox-LDL-stimulated macrophages by enhancing autophagy[J]. Cell Physiol Biochem, 2016, 39(5): 2065-2076. DOI:10.1159/000447902 |
| [8] |
LIU X, TANG Y, CUI Y, et al. Autophagy is associated with cell fate in the process of macrophage-derived foam cells formation and progress[J]. J Biomed Sci, 2016, 23(1): 57. DOI:10.1186/s12929-016-0274-z |
 2018, Vol. 47
2018, Vol. 47