| 稀土材料的制备与高端应用 |
b. 昆明理工大学云南省有色金属真空冶金重点实验室,昆明 650093;
c. 昆明理工大学省部共建复杂有色金属资源清洁利用国家重点实验室,昆明 650093
b. Key Laboratory for Nonferrous Vacuum Metallurgy of Yunnan Province, Kunming University of Science and Technology, Kunming 650093, China;
c. State Key Laboratory of Complex Nonferrous Metal Resources ClearUtilization, Kunming University of Science and Technology, Kunming 650093, China
稀土元素在1794年被发现于瑞典的矿物中,它一共包括17种元素,分别为镧(La)、铈(Ce)、镨(Pr)、钕(Nd)、钷(Pm)、钐(Sm)、铕(Eu)、钆(Gd)、铽(Tb)、镝(Dy)、钬(Ho)、铒(Er)、铥(Tm)、镱(Yb)、镥(Lu) 以及钪(Sc)和钇(Y)。由于稀土元素的4f层电子被完全填满的外层(5s和5p) 电子所屏蔽,导致4f层电子运动方式不同,从而使稀土元素具有不同于其它元素的光、电、磁性能,因此,稀土元素在不同的领域均有特殊的应用。而且,当稀土元素与其它元素形成稀土化合物时,其配位数可在3~12之间变化,这也导致了稀土化合物晶体结构的多元化。
随着社会经济的蓬勃发展,现代工业对稀土的需求量日益增长,国际社会对稀土资源极其重视,各国都加大了对稀土开发研究的力度。对于稀土企业来说,应该充分利用相关政策、积极开展技术创新、增加稀土产品附加值、提升产品质量,以推动我国稀土产业链向高端发展[1]。目前稀土材料的主要制备方法有离子交换法[2-3]、热分解法[4-5]、水热/溶剂热法[6-7]、共沉淀法[8-9]、溶胶-凝胶法[10-11]等,其制备方法对材料形貌、尺寸和结构等起着决定性作用,这些方法已经基本成熟,且在商业上得到了很好的应用。但是材料科学的快速发展使得这些技术方法已经不能满足当前的需求,主要是因为这些方法存在设备要求高、工作时间长、操作环境差、技术难度大、安全性低等问题。
稀土独特的热、力、光、电、磁性能,使其无论是在传统领域还是在新技术领域都有广泛的应用[12-14]。目前,国内外对稀土应用领域的研究主要在永磁材料、发光材料、催化材料、储氢材料和高纯靶材等方面,特别是稀土催化、储氢、高纯材料在新能源汽车、航空、军事等领域有很好的应用,其中稀土基高纯靶材的制备是我国久未解决的难题。本文综述了稀土的基本性质、稀土材料的制备方法及高端应用,主要介绍了离子交换法、热分解法、水热/溶剂热法、共沉淀法、溶胶-凝胶法等几种制备稀土材料的方法,分析了几种方法的优缺点并指出了解决的方向。此外,还重点叙述了稀土在永磁、催化、储氢等高端领域的应用,总结了稀土在高端领域的优势及价值。因此,我们需要不断开发稀土新材料、优化或开发稀土生产工艺,以满足材料科学新发展的需求。
1 稀土的性质稀土金属呈铁灰色或银白色,具有金属光泽,其单质活性很强,当稀土和氧反应时会生成稳定的RE2O3型氧化物(RE表示稀土元素),Ce,Pr,Tb还会生成CeO2,Pr6O11,PrO2,Tb4O7,TbO2型氧化物。稀土元素的磁性质主要与4f电子层有关,使其表现出特殊的磁热效应、磁制冷和磁光效应,这为稀土的应用开发打开了大门。另外,稀土元素4f层电子与其他元素外层电子相互作用形成了性能各异的稀土材料,图 1所示为精选的几个稀土特殊性质及相应的应用领域[15]。
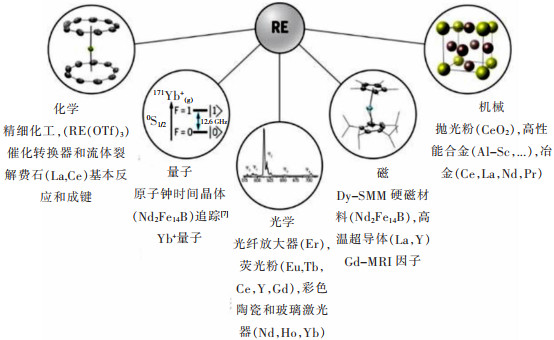 |
| 图 1 稀土的典型特性。插图:线性铥三明治复合体;171Yb+离子的分能图;Eu3+离子的发光光谱;Dy单分子磁体;在高性能合金中发现的Al3Sc单元电池[15] Fig. 1 Selected application and research fields. Illustrations: linear Tm sandwich complex; energy dispersive diagram of 171Yb+ ion; luminescence spectrum of Eu3+ ion; Dy single molecule magnet; Al3Sc cell found in high performance alloys[15] |
1.1 稀土单质的性质
稀土元素具有"4f"层的特殊电子层结构。稀土元素原子的最外层电子结构非常相似,其正常的原子价是3价,其3价离子具有独特的电子结构[Xe]4fn,即具有"4f"电子层是稀土元素电子层结构的特征[16]。
某些稀土元素具有反常价态。如前所述,稀土元素最外电子层的结构基本相同,都是[ns]2[(n-1)s]2[(n-1)p]6[(n-1)d]1/0,常见原子价态位为正3价,即电离掉[ns]2、[(n-1)d]1或[4f]1,这是稀土元素的共性。根据Hund规则,当电子层结构中同一层的电子处于全空、全满或半满的状态时体系能量较低,所以4f层上电子分别为4f0(La3+),4f7(Gd3+)和4f14(Lu3+)时比较稳定。
由于各元素原子结构中K、L、M层能级不同,核内质子数及排列不同,4f层中电子数不同,因而存在特殊性。稀土元素的电子能级性质因各元素4f电子数不同、电子能级不同、激发态不同而导致在紫外、可见光、红外等区域有发射,因而某些稀土元素可用于荧光、激光、玻璃着色脱色和陶瓷釉料等领域。在稀土元素的结构中,由于元素的磁矩与轨道磁矩、自旋磁矩有关,因而某些稀土元素有特殊的磁学性质,能与过渡元素Fe,Co等组成最强的永磁合金(如Nd-Fe-B、SmCo6)。
1.2 稀土化合物的性质稀土材料中除少数直接使用稀土单质外,大多使用稀土的化合物,因为稀土单质不稳定,而稀土化合物具备更多的特殊性质,在很多领域都实现了应用。其中,稀土氧化物及复合氧化物应用最为广泛,主要是因为稀土与氧容易反应。
1.2.1 稀土氧化物稀土氧化物是一组具有混合导电性质的半导体,即电子导电与离子导电,不同的材料其2种导电的比例不同。电子导电是指半导体的电子或空穴导电;离子导电是指离子在氧空位中的移动,它随温度升高而加剧,随氧分压升高而抑制,利用这种性质可将一些稀土应用于热敏电阻和固体电解质。
Sato等研究不同焙烧温度下稀土氧化物(REOs) 的基本性能[17]。在煅烧过程中,Lu,Yb,Tm,Er,Y,Ho,Dy的氧化物晶体结构随着煅烧温度的升高发生了变化,从单斜向立方相转变,而Ce,La,Pr等的氧化物在1 100 ℃以下没有晶体结构的变化。同时他们还研究了REOs对CO2的吸附能力,结果表明吸附能力的强度取决于碱性位点的强弱,La2O3,Pr6O11,Nd2O3和Sm2O3等轻型REOs具有表面碱性位点,而Dy2O3,Ho2O3,Y2O3,Er2O3,Tm2O3,Yb2O3和Lu2O3等重型REOs具有弱碱性位点。
1.2.2 稀土氯化物稀土氯化物的应用较广,且随着社会发展,其需求量也在不断增大。稀土氯化物的制备工艺已经比较成熟,一般由碱法工艺生产制得,稀土氯化物分为有水氯化物和无水氯化物,其中RECl3·xH2O易溶、易潮解(x=6或7的结晶较为常见)。
稀土氯化物有以下3个性质: ①不能用加热水合氯化物的方法来制备无水氯化物;②无水RECl熔点高,在熔融状态下易导电;③在醇中,稀土氯化物的溶解度随碳链增长而下降,在乙酸、磷酸三丁酯和甲酸中的溶解度较大。因此,稀土氯化物可以用来制取混合稀土金属和促进石油裂解的催化剂,并可作为提取单一稀土产品的原料。
1.2.3 稀土氢化物稀土金属能够吸收大量的氢气,经X射线物相分析,证明了稀土二氢化物的形成,但是大多数还可以继续反应生成三氢化物及非整比氢化物。稀土氢化物均是导体(除了EuH2和YbH2),常温下,在空气中较稳定,但是遇到酸或水则很快分解并放出氢气。稀土氢化物加热到900 ℃以上时会分解,在真空中加热到1 000 ℃可以制得高纯度的稀土金属单质粉末。
稀土氢化物的结构: ①La,Ce,Pr,Nd的氢化物REH2具有立方面心结构;② Eu和Yb的REH2属于交晶系结构;③其余稀土氢化物REH2具有氟化钙型结构,而REH3具有立方晶体结构。由于稀土元素具有很强的化学活性,很容易发生氧化现象,即使是稀土与氢气反应形成的氢化物,其化学活性依然很强,因此,稀土氢化物难以制备,稀土氢化物被广泛应用于储氢电池、光学器件、氢传感器和压力致动器等领域。稀土在光、电、磁等方面的特殊性质使其在电子技术、医疗、机械和能源等领域发挥着不可代替的作用。
1.2.4 其他其它稀土化合物(如稀土硫氧化物、氟化物和硼化物等) 相对于上述稀土化合物应用较少,但它们也是制备稀土新材料和稀土金属单质的重要原材料。如稀土硫氧化物具有良好的光吸收和传能效率,被广泛应用于彩色发光和生物医学等领域[18]。稀土氟化物具有较好的热稳定性,在发光基质材料上有广泛的应用,是制备稀土金属单质的主要原材料。稀土硼化物具有绝缘体[19-20]、巨磁阻[21-22]和超导[23]等特性,被广泛用于雷达、航空航天及核电等多个领域。
综上所述,稀土化合物多种多样,其应用比稀土金属单质广泛得多。稀土新材料的合成主要由稀土或稀土化合物经过一系列工艺技术而形成复合稀土材料,稀土化合物正在向着高纯化、复合化和超细化的方向发展。
2 稀土材料的制备方法 2.1 离子交换法离子交换法是一种应用广泛的材料制备方法,主要借助于固体离子交换剂中的离子和溶液中的离子进行交换,以达到制备材料的目的。
Cai等通过离子交换法成功制备了Mo3+掺杂的六方相NaREMoF4,发现Mo3+在样品中均匀分布[24]。和未掺杂的样品相比,掺杂了10 mol%Mo3+的β-NaREMoF4纳米线在980 nm处近红外激发下的上转换发光强度增加了一个数量级,且具有出色的发光性能和拉伸强度。Zhang等通过离子交换法制备了立方相的NaYF4空心纳米球,并开拓了一种新的水热离子交换法[25]。在碱性条件下,将稀土硝酸盐加入NaOH溶液中,先得到纳米管,然后将纳米管放入含有氢氟酸和氟化钠的溶液中,最后在120 ℃的条件下反应12 h得到六角稀土氟化物纳米管NaREF4。总之,虽然用离子交换法制备稀土材料耗时长,对环境污染比较大,但是它具有制备材料质量高、尺寸均匀且生产工艺成熟等优点,应用相对较广。
2.2 热分解法热分解法是一种比较常见的制备稀土材料的方法,即反应物在高温下分解,然后生成产物。通常是以有机酸盐等作为前驱体,以长烃链极性基团作为表面活性剂,通过控制反应物比例、表面活性剂的量、反应时间、反应温度等参数,合成形貌、尺寸和晶相可控的纳米晶。
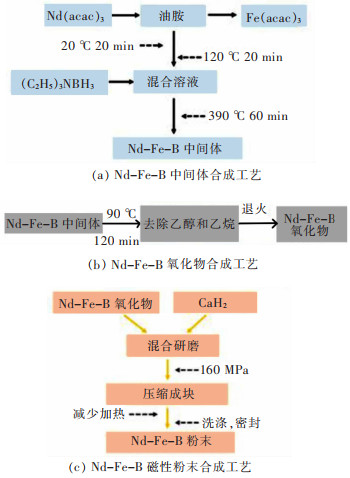
王芬提到热分解法的优点是能够合成超细、大小均匀、分散性好的纳米晶,但这种方法对反应温度要求较高、操作复杂、费用较高、会产生有毒物质[26]。Si等在油酸/油胺/十八烯体系中加入单一的前驱体RE(CF3COO)3,在保护气氛下利用热分解法制备了分散性好、形貌均匀、尺寸集中的LaF3纳米晶[27]。Nyk等用热分解法合成了REF3,REOF,RE2O3,α-NaREF4(RE=Y, Pr, Lu) 等分散性好的纳米晶[28]。张希艳探索了另外一种新热分解法,以NaF/RE(oleate)3为前驱体,通过改变NaF的量来调控纳米晶的尺寸,通过掺杂影响其发光性能,合成了单分散的β-NaYF4,β-NaGdF4纳米晶[29]。郭耀祖创新了一种新型的热化学制备方法,如图 2所示,Nd-Fe-B磁性材料的制备分为3个步骤,首先是Nd-Fe-B中间体的制备,然后将Nd-Fe-B中间体去乙醇和乙烷合成Nd-Fe-B氧化物,再将Nd-Fe-B氧化物经过研磨等制成Nd-Fe-B磁性粉末[30]。这种方法可在溶液中晶粒形核生长时调控晶粒尺寸和形貌,以获得粒径均匀、分布较窄的球状晶粒,通过热处理,最后获得良好的纳米级球状单晶颗粒。
综上所述,热分解法制备效率高,可以很好地控制产品的结构、形貌、性能,但同时也存在耗能大,操作环境较恶劣等问题。
2.3 水热/溶剂热法水热/溶剂热法是在高温高压的条件下,以水或者是有机物为溶剂来制备材料,是目前最常用的稀土材料制备方法之一。
Wang等在高温高压下采用水热法来制备稀土材料,由于材料是在密闭环境中进行反应,所以不易被氧化,这种方法常常用于常温下难以合成的材料[31]。Heer等以二元醇为分散介质,采用高压水热法进行了铈锆复合物的合成研究,获得了纳米级(10~20 nm) 的铈锆晶体,它的比表面积为121.0 m2/g[32]。Wang等用六次甲基四胺为溶剂,N2为保护气,通过回流,可得到层状的EuxGd1-x(OH)2.5Cl0.5,高温焙烧后即可得到立方相或单斜相的层状(EuxGd1-x)2O3[33]。Boyer等以三氟乙酸酯作为前驱体,通过水热分解反应合成了立方NaYF4,溶解的前驱体被缓慢地添加到反应中,在不锈钢套管中溶解,形成具有高发光性能的纳米晶体[34]。
Wang等用丙烯酸替代了有毒的丙烯酰胺,也能得到尺寸均匀的球状CeO2,且CeO2的比表面积可达211 m2/g[35]。Dai等利用水热法可以制备大多数不溶于水的稀土纳米晶,如稀土氟化物、稀土钨酸盐等[36]。Wang等以水和乙醇为溶剂、硝酸钇和氟化铵为反应物,制备了盘状YF3纳米晶[37]。Du等以丙烯酰胺作为模板剂,合成了形貌规整、尺寸为1~3 μm的微米球,这些微米球是由纳米片组成的,纳米片的厚度为20~30 nm[38]。Qu等以聚乙二醇为溶剂,用水热法合成了不同的NaCeF4六角纳米晶,但纳米晶的尺寸不均一[39]。Wang等以聚乙二醇为模板剂,采用溶剂热法合成了尺寸均一的CeO2纳米棒,并推测了纳米棒的形成机理[40]。Ma等以聚乙二醇为表面活性剂、氨水为沉淀剂,用溶剂热法制备了纳米球,该方法的优点是合成温度较低,且时间较短,但合成的纳米球有部分聚集[41]。Xu等在水热法的基础上,优化了制备方法,合成了均匀的β-NaREF4纳米材料,研究发现优化后的水热法制备的纳米材料颗粒更小,粒径分布更均匀[42]。Ying等用水热法制备了一种Eu3+掺杂的新型水合稀土硼酸盐K2O·CaO·4B2O3·12H2O : Eu,并研究了其晶体结构和发光性能[43]。研究表明此法主要是通过自发结晶的方式获得单晶,制备的产物在353 nm激发时显示出较强的红光发射峰。
陶锋制备出Ce的前躯体,将其在有机溶剂中进行热解,即可得到分散均匀、尺寸均一的CeO2纳米晶粒,平均尺寸仅2.2 nm[44]。姜桂铖等在采用水热法制备CeO2纳米粉的研究中,得到了粒径为20~50 nm的CeO2,不足的是灼烧时团聚较严重[45]。Li等在十二烷基硫酸钠的调控下,研究了水热法合成纳米CeO2的工艺参数,他们通过控制变量,制备出了粒度较小、尺寸均匀、比表面积大且稳定性较好的CeO2纳米颗粒[46]。陈雪桥等应用温和水热法合成了一种稀土磷酸盐,水热温度为100 ℃,合成的稀土磷酸盐为微米级空心球结构,且这些微米级的空心球是由纳米颗粒组装而成[47]。综上所述,水热/溶剂热法制备材料具有应用范围广、生产效率高,可控制材料的结构、形貌等,是一种比较有发展前景的材料制备方法,但存在对原材料要求高、设备昂贵、操作复杂等问题。
2.4 共沉淀法共沉淀法是指在多种阳离子溶液中,加入沉淀剂后经沉淀反应得到成分均匀的新材料,它是制备多种金属元素的复合氧化物粉末的重要方法,因此被广泛应用于各种纳米材料的制备。
张军等研究共沉淀法制备粉体材料,首先将可溶性的盐溶解搅拌一段时间使其混合均匀,然后将沉淀剂加入到混合溶液里,经过一定时间的沉淀,取出不溶物,最后经高温处理或清洗干燥得到粉体材料[48]。廖金生等用沉淀法制备了性能稳定的La2O3: Eu3+红色荧光粉,研究了Eu3+的掺杂浓度对产物发光性能的影响,研究表明: 产物的最大发射和激发波长分别为626 nm和396 nm,荧光寿命达到0.754 ms[49]。Zhang等利用稀土离子和Al3+的硝酸盐与碳酸氢铵反应,通过对析出的沉淀物进行干燥处理,最后得到了钇铝石榴石纳米粉体[50]。Wang等以乙二胺为稳定剂,用共沉淀法合成了分散性好且具有小尺寸的立方相NaYF4: Yb/Er (Tm) 纳米晶[51]。Grzyb等研究氢氧化铈的相转化点及灼烧温度对粒度和比表面积的影响,将稀土氢氧化物沉淀、灼烧制备出了高比表面积的CeO2,发现较高的灼烧温度会使产物的粒度变大,比表面积变小[52]。李天旻等以草酸为沉淀剂,进行了沉淀温度、焙烧时间及升温速率对制备超细稀土氧化物的粒度、比表面积及形貌影响的实验研究,并获得了Gd2O3、Y2O3等稀土氧化物粉体[53]。Donato等用一步共沉淀法制备稀土磷酸盐,并研究了退火温度、陶瓷负载对稀土前驱体性能的影响,发现随着退火温度和陶瓷负载量的增加更有利于形成晶相[54]。张雪梅采用共沉淀法制备了粒径在1~1.5 μm的La,Ce,Pr,Nd等多元素组分的复合稀土氧化物[55]。
Danki团队采用共沉淀法合成层状的稀土羟基硝酸盐荧光粉,并通过调节pH值来控制稀土基荧光材料的形貌和结构,得到了结构有序、致密的荧光材料[56]。Xue等用共沉淀法将稀土和乙酰丙酮化合物在SiO2基体上混合制备出了Y2O3和Nd的复合纳米氧化物吸附层,和单一的Y2O3相比,其氧交换能力提高了近一倍[57]。Zhao等用柠檬酸络合共沉淀法进行了LaCoO3的制备研究,获得了比表面积大于40 m2/g的超细粉体[58]。他们用共沉淀法制备了一系列的稀土材料,不同研究领域的结合可以促进稀土行业的发展,共沉淀法的优点在于通过溶液中的各种化学反应可以直接得到化学成分均一的纳米粉体材料,其缺点是所制备的产物纯度不高。
2.5 溶胶-凝胶法溶胶-凝胶法是将无机盐经水解后形成溶胶,凝胶里的溶质通过聚合而凝胶化,然后将凝胶以干燥、焙烧的方式去除有机成分,最后得到无机材料。
刘峰生等用溶胶-凝胶法合成了一系列的(1-x) Sr2SiO4: xTb3+(x=0,0.01,0.02,0.03,0.04,0.05,0.06) 绿色荧光粉,并研究了其发光性能[59]。如图 3所示,研究发现所制备的发光材料形貌良好且粒径分布均匀,在547 nm处观察到最强发射峰,且随着Tb3+掺杂量增大,发射强度先增大后减小,当Tb3+掺杂量为x=0.03时,样品的发光强度最大。
 |
| 图 3 不同Tb3+掺杂量的(1-x)Sr2SiO4: xTb3+荧光粉的SEM图片及不同Tb3+掺杂量的(1-x)Sr2SiO4: xTb3+荧光粉的发射光谱图[59] Fig. 3 SEM images of (1-x) Sr2SiO4: xTb3+ phosphors with diferent Tb3+ doping contents and emission spectra of (1-x) Sr2SiO4: xTb3+ phosphors with different Tb3+ doping contents[59] |
Bogdan等用溶胶-凝胶法进行了CeO2纳米晶体的合成研究,他们发现Ce的硝酸盐同碱在液体混合系统中形成溶胶后,在高剪切力作用下沉淀流体会被切割成纳米基元的颗粒,他们用这种方法制备出了粒径分布均匀且具有良好晶体结构的CeO2纳米晶体[60]。梁凯旋用溶胶-凝胶法将金属的醇盐通过水解制备了Y2O3,ZrO2,CeO2,Al2O3的粉体,将无机盐水解制备了SnO2纳米微粒等[61]。Janifer用溶胶-凝胶法合成了立方结构的多晶钇铁石榴石,发现样品具有良好的导电性,并通过各种分析方法进行测试证明晶界主导导电性[62]。Ye等以多孔阳极氧化铝膜作为模板,用溶胶-凝胶法合成了形貌规整的稀土基氧化铝一维纳米管,其外径为50~80 nm,管壁厚5 nm。这种方法简单且产品质量高,适合合成无机材料,特别是多元的无机非金属材料[63]。
总之,离子交换法、热分解法、水热/溶剂热法、共沉淀法、溶胶-凝胶法等制备方法已经基本成熟,其中水热/溶剂热法具有制备材料范围广、产品粒度均匀且形貌规则等优势,是较为常用的一种材料制备方法,其他方法在各个领域也表现出独特的优势。但仍需优化和改良制备工艺,并不断开发新的制备方法,以适应新材料的新要求。表 1主要总结了各种方法的优缺点,这些方法存在的主要问题是安全性差、操作环境差、产品纯度低、设备要求高以及生产效率低等。在材料制备的过程中,单一的方法很难制备出优异的产品,需要几种方法结合使用才能达到更好的制备效果。
| 表 1 稀土材料制备方法的优缺点 Table 1 Advantages and disadvantages of preparation methods of rare earth materials |
 |
| 点击放大 |
3 稀土材料的应用
根据"十三五"期间《稀土行业发展规划》指出,我国稀土材料产量的年均增长率在15%以上,主要应用在发光、磁性、催化、储氢等方面,这有利于保护稀土资源、压缩过剩产能、发展稀土高端材料及器件[64]。
3.1 磁性材料稀土磁性材料分为稀土永磁材料、磁致伸缩材料及磁制冷材料。稀土永磁材料具有极优异的磁性能,在新一代信息技术、航空航天、新能源汽车等领域应用宽广,Nd-Fe-B颗粒是制备高性能永磁材料的关键[65-66]。朱明刚等指出我国目前已突破高性能稀土烧结Nd-Fe-B磁体产业化关键技术,为稀土资源的利用和Nd-Fe-B磁体的发展提供了全新的方向[67]。SmCo6永磁材料由于居里温度较高,在高温领域表现出了优良的性能,且具有耐腐蚀性强、抗氧化性好的特点,在国防、军工和航天领域具有不可替代的作用[68]。
王春梅等发现稀土磁致伸缩材料室温下的磁致伸缩系数比传统压电陶瓷伸缩材料高10倍以上,且具有响应速度快、功率密度高的特点[69]。目前美国航空航天局已成功将稀土磁致伸缩材料制造的高精度伺服阀、高速开关阀应用到卫星变轨系统中。
稀土磁制冷材料是利用磁热效应达到制冷的目的,与传统制冷材料相比具有噪音小、可靠性好、效率高等优点,且不会破坏臭氧层,被誉为绿色制冷材料[70]。磁制冷材料包括Gd系和La系合金,而La(Fe,Si)13基合金是最具发展前景的磁热材料之一。Ouyang等制备的La-Fe-Si薄板可以保持较大的磁热效应,在对La-Fe-Si合金的退火演化研究中发现,退火过程中样品磁熵变大,且具有明显的各向异性热导率,这将有利于电磁冰箱的发展[71]。
稀土永磁、磁致伸缩、磁制冷材料的发展大大扩宽了稀土的应用领域,特别是稀土永磁材料的发展最为迅速,同时,磁致伸缩和磁制冷材料也在快速发展,也将是未来稀土发展的重要支柱。
3.2 发光材料稀土材料在发光领域研究成果颇多,稀土元素在现代发光材料高新技术领域具有很重要的地位,这主要是由它的电子结构所决定[72]。稀土发光材料已发展成为高品质显示器和绿色照明领域的关键材料之一,在社会发展和技术革新中发挥着不可代替的作用[73]。王振华等将稀土发光材料应用于节能灯,研究发现稀土发光材料作为荧光粉应用于节能灯时发光效率高,节约能源[74]。罗满强调目前我国已经掌握了高品质铝酸盐系列荧光粉批量制备技术,产品性能及批次稳定性都达到了国际水平,且国产高显色用纯镥铝酸盐绿粉已成功进入海外市场[75]。
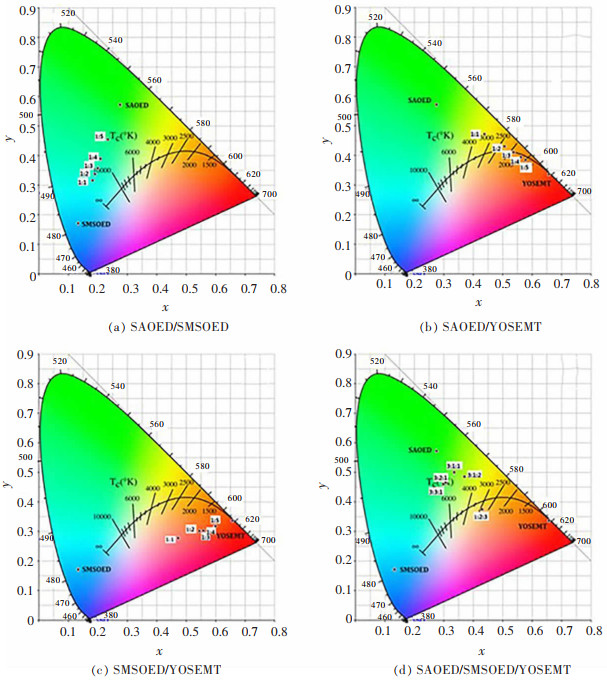
Zhang等按照三基色制备了3种稀土发光材料SAOED(SrAl2O4: Eu2+, Dy3+)、SMSOED(Sr2MgSi2O7: Eu2+, Dy3+)和YOSEMT (Y2O2S : Eu3+, Mg2+, Ti4+),并将其按一定比例混合形成不同的混合物,研究了其发光性能[76]。图 4所示为不同发光材料混合物的国际照明委员会(CIE) 色度,发现3种发光材料混合后的光色趋于白光,从混合物的变化规律和颜色特征可以看出稀土发光材料的浅色混合基本符合加色规律,稀土发光材料表现出了优良的光学、力学性能和良好的热性能。我国稀土发光材料行业紧跟国际稀土发光材料研发和应用的发展潮流,且与下游产业之间建立了良好的纽带,稀土发光材料已经成为节能照明和电子信息产业发展过程中不可或缺的基础材料。
3.3 催化材料
稀土作为高催化活性的催化材料主要原因是其具有优异的扩散通道,多的活性位点[77]。稀土可以直接作为催化剂使用,也可以作为助催化剂来提高催化剂的活性、抗老化能力和抗中毒能力[78]。Nagai等在铈基材料上负载Pt的研究中发现,Pt颗粒在高温含氧气氛下以氧化物形式存在,与Ce产生强相互作用而形成Pt-O-Ce键,Pt-O-Ce键在高温老化过程中可以发挥"锚"的作用[79]。在此基础上,通过模拟这种作用发生的条件,发现对于负载于铈锆载体上的贵金属Pd,在温度高于800 ℃时,小颗粒的贵金属氧化物会分解成单质并烧结长大,这主要是将稀土引入载体的作用[80-81]。如图 5所示,Balwinder等将CeO2引入甲醇氧化还原的电催化剂中,发现将CeO2引入催化剂中,能有效的防止贵金属CO中毒,提高其耐久性[82]。
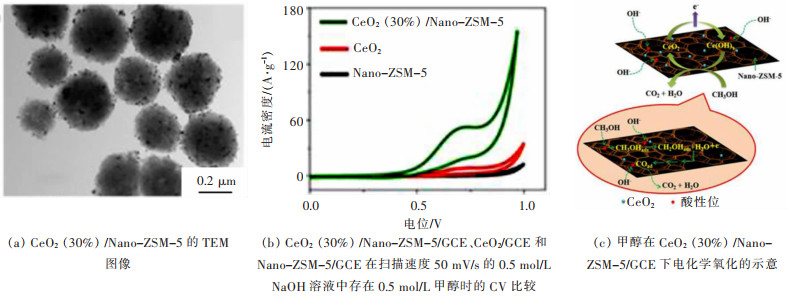 |
| 图 5 CeO2引入甲醇氧化还原催化剂的催化性能[82] Fig. 5 Catalytic performance of CeO2 incorporated into methanol redox catalyst[82] |
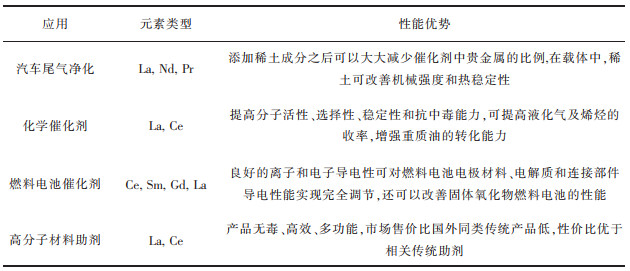
稀土催化剂在环境保护中的应用格外引人注目,且已工业化应用。如在汽车尾气净化催化剂中添加部分La和Ce,可以有效提高其催化活性和稳定性,增加催化剂抗Pb和S中毒性能,还可以通过降低贵金属的含量来降低成本[83]。Wang团队指出具有可变氧化态和氧空位的稀土氧化物具有良好的氧化还原性能,使其对CO、汽车尾气和烟尘等的氧化具有催化活性,与传统的贵金属催化剂相比,稀土催化剂在资源丰度、成本、制备工艺等方面都有优势[84]。目前主要被应用在汽车尾气处理、石油裂化、燃料电池等领域。表 2总结了稀土在不同应用领域的催化性能特点,在未来的环境保护和高科技领域中,稀土催化材料将有很大的市场和发展潜力。
| 表 2 稀土元素在不同领域内的催化性能特点 Table 2 Catalytic properties of rare earth elements in different fields |
 |
| 点击放大 |
3.4 储氢材料
新型储氢材料层出不穷,应用领域也在不断扩大,在电池领域的产业化更是激起了人们的高度重视,目前国内外企业的制备技术、工艺水平没有明显的差距。John等指出稀土钙钛矿型氧化物具有良好的储氢性能,他们研究了稀土钙钛矿型氧化物在碱性溶液和不同温度下的储氢性能,认为稀土钙钛矿型氧化物是一种很有前途的镍/氧化物电池材料[85]。稀土储氢材料可分为La-Ni系的AB5和La-Mg-Ni系的AB3.5(A=La,Ce,Pr,Nd,Ti等;B=Ni,Co,Mn,Fe等) 2种类型,且均已实现商业化应用[86]。图 6所示为是AB5和AB3.5型稀土储氢材料的结构及其应用举例。
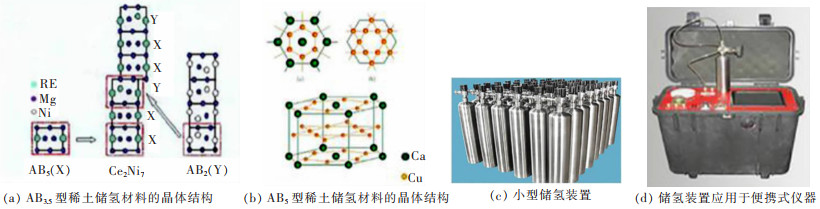 |
| 图 6 AB3.5和AB5型稀土储氢材料的晶体结构及应用[86] Fig. 6 Crystal structure and application of AB3.5 and AB5 rare earth hydrogen storage materialst[86] |
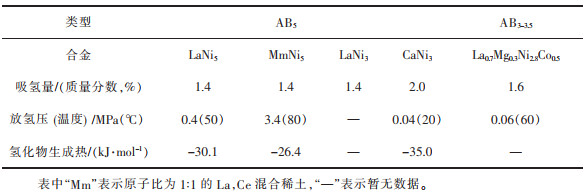
Hong表明稀土储氢材料主要使用La,Ce为原料,并对LaNi5储氢材料进行了研究[87]。稀土储氢材料的组织结构对储氢性能有重要影响,且因其成分、制备工艺及热处理工艺不同而不同。刘小芳等通过改变真空度及电流等参数,用真空感应炉制备出了结构优异的稀土镁合金,并进行储氢动力学测试[88]。结果表明稀土的加入能显著改善Mg-RE合金的加氢脱氢动力学,特别是添加Sm元素后可以使其合金的储氢量达到最大值,Mg-RE合金储氢性能的提高主要是由于稀土纳米粒子促进了合金的氢化和脱氢反应。Hu等将La、Ce混合稀土金属用于镍氢电池、氢燃料电池,电池表现出良好的电化学性能[89]。稀土储氢材料的分类及储氢性能详见表 3。
| 表 3 不同类型稀土储氢材料的储氢特性 Table 3 Hydrogen storage characteristics of different types of rare earth hydrogen storage materials |
 |
| 点击放大 |
3.5 高纯材料
在国家科技部的支持下,有研稀土和湖南稀土金属材料研究院合作开发出了一种高纯稀土金属提纯技术和装备,并具有了小批量生产能力。《中国稀土2019年度十大科技新闻》指出高纯稀土金属及合金靶材作为溅射薄膜材料已成为众多稀土功能材料及其器件的关键核心材料,被广泛应用于集成电路、新型显示、移动通讯等高新技术领域[90]。图 7是几种高纯稀土及其靶材制备生产线,这为满足我国高新技术产业对高端稀土金属、合金靶材的迫切需求提供了技术路线。
 |
| 图 7 几种高纯稀土材料的样品图及制备生产线[90] Fig. 7 Sample drawings and production lines of several high-purity rare earth materials[90] |
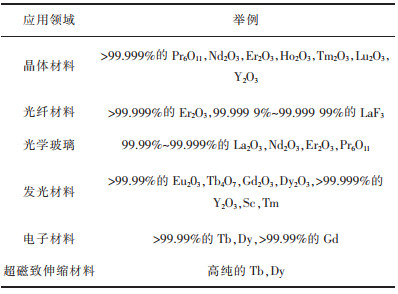
我国高纯稀土金属及靶材的研发和生产起步相对较晚,目前高纯稀土金属生产及应用主要集中在日本和美国[91]。未来高纯稀土材料的研究方向在于重点开发小尺寸的高纯稀土靶材,以及满足第三代半导体及新型通讯器件需求的高端靶材[92]。目前,高纯稀土主要的应用领域集中在电子材料、超磁致伸缩材料和发光材料领域,表 4总结了高纯稀土在不同领域内的应用,随着高新科技的发展,高纯稀土将会有更好的发展前景。
| 表 4 高纯稀土在不同领域的应用 Table 4 Application of high purity rare earth in different fields |
 |
| 点击放大 |
4 结束语与展望
随着科学技术的飞速发展,人类对稀土材料的需求量会越来越大,且对产品的纯度、质量等要求也越来越高。因此,本文总结了稀土材料的制备方法和国内外应用的最新进展,稀土材料的制备方法主要有离子交换法、热分解法、水热/溶剂热法、共沉淀法、溶胶-凝胶法等。其中水热/溶剂热法相较于其他制备方法应用较为广泛,但是很多时候需要各种方法结合使用才能制备出符合需求的产品。随着稀土材料的相关研究不断深化,应用领域将会越来越广阔,国外对稀土应用的研究较为深入,应用领域较广,且已将稀土材料应用到各个领域,但我国稀土材料的高端应用方面还有所欠缺,部分领域还处于起步阶段,特别是稀土发光材料、纳米催化材料和高纯材料等需要更加重视。稀土材料的种类繁多,用途极广,它必将成为未来社会发展的重要支柱。
稀土元素在众多新材料中扮演着十分重要的角色,我国的稀土储量、产量和出口量均处于世界前列,稀土的分离技术在世界上已遥遥领先,但是与美国、日本等发达国家相比,我国在稀土材料的开发及高端应用方面还存在一定的距离。因此,未来稀土的研究将主要集中在开发新型稀土材料制备技术、不断优化稀土生产工艺、发展稀土的高端应用领域,把稀土资源优势转化为技术和经济优势,这样才能推动我国稀土行业持续健康的向高端发展。
| [1] |
廖秋敏, 陈玲, 高艺. 中国稀土行业存在"资源诅咒"吗?——基于企业层面和城市层面的分析[J].
有色金属科学与工程, 2020, 11(6): 73–78.
|
| [2] |
JIMENEZ J A, LYSENKO S, LIU H, et al. Luminescence of trivalent samarium ions in silver and tin co-doped aluminophosphate glass[J].
Optival Materials, 2011, 33(8): 1215–1220. DOI: 10.1016/j.optmat.2011.02.013. |
| [3] |
LI J, WEI R, LIU X, et al. Enhanced luminescence via energy transfer from Ag+ to RE ions (Dy3+, Sm3+, Tb3+) in glasses[J].
Optics Express, 2012, 20(9): 10122–10127. DOI: 10.1364/OE.20.010122. |
| [4] |
BONDIA L F, BONAI I C, LEON E C, et al. Nano-sized CeO2 powders obtained by flux method[J].
Materials Research Bulletin, 1999, 34(14): 21592–21661. |
| [5] |
姚疆, 孙聆东, 钱程, 等. 稀土纳米复合氧化物RE2O3: Eu(RE=Y, Gd) 的制备及特性[J].
中国稀土学报, 2001, 1(5): 426–429.
DOI: 10.3321/j.issn:1000-4343.2001.05.010.
|
| [6] |
董相廷, 闫景辉, 于薇. 水热晶法制备CeO2纳米晶[J].
稀有金属材料与工程, 2002, 31(4): 312–314.
DOI: 10.3321/j.issn:1002-185X.2002.04.017.
|
| [7] |
王成云, 苏庆德, 钱逸泰. 非水溶剂水热法制备CeO2纳米粉[J].
化学研究与应用, 2001, 13(4): 402–405.
DOI: 10.3969/j.issn.1004-1656.2001.04.014.
|
| [8] |
王晓峰, 宋希文, 安胜利, 等. 纳米CeO2粉末的制备及表征[J].
包头钢铁学院学报, 2002, 21(2): 127–129.
DOI: 10.3969/j.issn.2095-2295.2002.02.007.
|
| [9] |
YUAN W H, BI H Q, WEI C H. Structure characterization of nanosized cerium oxide particles prepared by homogeneous precipitation[J].
Journal of South China University of Technology, 2004, 32(4): 52–56. |
| [10] |
王介强, 陶珍东, 孙旭东. 无机溶胶凝胶法制取Y2O3纳米微粒[J].
中国稀土学报, 2003, 21(1): 15–18.
DOI: 10.3321/j.issn:1000-4343.2003.01.004.
|
| [11] |
董相廷, 刘桂霞, 孙晶, 等. Yb2O3纳米晶的制备及其若干性质的研究[J].
稀有金属材料与工程, 2001, 30(1): 73–76.
DOI: 10.3321/j.issn:1002-185X.2001.01.019.
|
| [12] |
QIN F X, BINGHAM N S, WANG H, et al. Mechanical and magnetocaloric properties of Gd-based amorphous microwires fabricated by melt-extraction[J].
Acta Materialia, 2013, 61(4): 1284–1293. DOI: 10.1016/j.actamat.2012.11.006. |
| [13] |
MARDEGAN J R L, ADRIANO C, VESCOVI R F C, et al. Magnetic structure of R2CoGa8 (R=Gd, Tb, and Dy): structural tuning of magnetic properties in layered Ga-based intermetallic compounds[J].
Physical Review B, 2014, 89(11): 115101–115103. DOI: 10.1103/PhysRevB.89.115101. |
| [14] |
SONG X Y, ZHANG J, YUE M, et al. Technique for preparing ultrafine nanocrystalline bulk material of pure rare earth metals[J].
Advanced Materials, 2006, 18(9): 1210–1215. DOI: 10.1002/adma.200502619. |
| [15] |
ZABULA A V, DEY S, ROBINSON J R, et al. Screening of molecular lanthanide corrosion inhibitors by a high-throughput method[J].
Corrosion Science, 2019, 165(1): 377–382. |
| [16] |
YU Z Z, CHAN W K, TAN T T Y. Neodymium sensitized nanoconstructs for near infrared enabled photomedicine[J].
Small, 2020, 16(1): 265–271. |
| [17] |
SATO S, TAKAHASHI R, KOBUNE M, et al. Basic properties of rare earth oxides[J].
Applied Catalysis, 2009, 356(1): 57–63. DOI: 10.1016/j.apcata.2008.12.019. |
| [18] |
JIA G, YOU H, LIU K, et al. Highly uniform YBO3 hierarchical architectures: facile aynthesis and tunable luminescence Properties[J].
Chemistry-A European Journal, 2010, 16(9): 2930–2937. DOI: 10.1002/chem.200902834. |
| [19] |
SUN L, QI W. Pressure-induced exotic states in rare earth hexaborides[J].
Reports on Progress in Physics, 2016, 79(8): 84503–84512. DOI: 10.1088/0034-4885/79/8/084503. |
| [20] |
TAKIMOTO T. SmB6: a promising Candidate for a topological insulator[J].
Journal of the Physical Society of Japan, 2011, 80(12): 123710–123714. DOI: 10.1143/JPSJ.80.123710. |
| [21] |
AMARA, GALERA M, AVIANI R M, et al. TbB6 antiferromagnetic state: a macroscopic and microscopic investigation[J].
Physical Review B-Condensed Matter and Materials Physics, 2010, 82(22): 98–104. |
| [22] |
SUELLOW S, PRASAD I, ARONSON M C, et al. Structure and magnetic order of EuB6[J].
Physical Review. B, Condensed Matter, 1998, 57(10): 5860–5869. DOI: 10.1103/PhysRevB.57.5860. |
| [23] |
QI K C, LIN Z L, CHEN W B, et al. Formation of extremely high current density LaB6 field emission arrays via e-beam deposition[J].
Applied Physics Letters, 2008, 93(9): 93503–93506. DOI: 10.1063/1.2977616. |
| [24] |
CAI G Y, WANG K J, XIONG Q Y, et al. Enhanced luminescence of Mo3+-doped β-NaREF4 nanowires prepared via coprecipitation-solvothermal ion-exchange method and their application in upconversion polyurethane composite[J].
Journal of Materials Science Materials in Electronics, 2020, 31(8): 8359–8369. |
| [25] |
ZHANG F, ZHAO D Y. Synthesis of uniform rare earth fluoride (NaMF4) nanotubes by in situ ion exchange from their hydroxide[M(OH)3] parents[J].
ACS Nano, 2009, 3(1): 159–164. DOI: 10.1021/nn800533v. |
| [26] |
王芬. 纳米稀土磷酸盐, 硼酸盐发光材料的合成及性能研究[D]. 武汉: 湖北大学, 2009.
|
| [27] |
SI R, ZHANG Y W, ZHOU H P, et al. Controlled-synthesis, self-assembly behavior, and surface dependent optical properties of high-quality rare earth oxide oanocrystals[J].
Chemistry of Materials, 2007, 19(1): 18–27. DOI: 10.1021/cm0618392. |
| [28] |
NYK M, KUMAR R, YEHO T, et al. High contrast in vitro and in vivo photoluminescence bioimaging using near infrared to near infrared up-conversion in Tm3+ and Yb3+ doped fluoride nanophosphors[J].
Nano Letters, 2008, 8(11): 3834–3838. DOI: 10.1021/nl802223f. |
| [29] |
张希艳.
稀土发光材料[M]. 北京: 国防工业出版社, 2005.
|
| [30] |
郭耀祖. 新型化学法制备Nd-Fe-B磁粉的工艺及其反应机理的研究[D]. 沈阳: 沈阳工业大学, 2019.
|
| [31] |
WANG F, LIU X G. Recent advances in the chemistry of lanthanide doped up-conversion nanocrystals[J].
Chemical Society Reviews, 2009, 38(4): 976–989. DOI: 10.1039/b809132n. |
| [32] |
HEER S, KOEMPE K, GUEDEL H U, et al. Highly efficient multicolour upconversion emission in transparent colloids of lanthanide-doped NaYF4 nanocrystals[J].
Advanced Materials, 2004, 16(23): 2102–2105. |
| [33] |
WANG X, ZHUANG J, PENG Q, et al. A general strategy for nanocrystal synthesis[J].
Nature, 2005, 437(7055): 121–124. DOI: 10.1038/nature03968. |
| [34] |
BOYER J C, CUCCIA L A, CAPOBIANCO J A. Synthesis of colloidal upconverting NaYF4: Er3+/Yb3+ and Tm3+/Yb3+ monodisperse nanocrystals[J].
Nano Letters, 2007, 7(3): 847–852. DOI: 10.1021/nl070235+. |
| [35] |
WANG L, LI Y D. Controlled synthesis and luminescence of lanthanide doped NaYF4 nanocrystals[J].
Chemistry of Materials, 2007, 19(4): 87–101. |
| [36] |
DAI Q L, SONG H W, WANG M Y, et al. Size and concentration effects on the photoluminescence of La2O2S: Eu3+ nanocrystals[J].
Journal of Physical Chemistry C, 2008, 112(49): 19399–19404. DOI: 10.1021/jp808343f. |
| [37] |
WANG S J, XU H L, CHEN X S, et al. Solvothermal synthesis of disk-like YF3 superstructures[J].
Journal of Crystal Growth, 2008, 310(22): 4697–4700. DOI: 10.1016/j.jcrysgro.2008.09.003. |
| [38] |
DU Y P, ZHANG Y W, SUN L D, et al. Luminescent monodisperse nanocrystals of lanthanide oxyfluorides synthesized from trifluoroacetate precursors in high-boiling solvents[J].
The Journal of Physical Chemistry C, 2008, 112(2): 405–415. DOI: 10.1021/jp076717r. |
| [39] |
QU X S, YANG H K, PAN G H, et al. Controlled fabrication and shape dependent luminescence properties of hexagonal NaCeF4, NaCeF4: Tb3+ nanorods via polyol mediated solvothermal route[J].
Inorganic Chemistry, 2011, 50(8): 3387–3393. DOI: 10.1021/ic1022467. |
| [40] |
WANG Z, LIU C H, WANG Y C, et al. Solvent-assisted selective synthesis of NaLaF4 and LaF3 fluorescent nanocrystals via a facile solvothermal approach[J].
Journal of Alloys and Compounds, 2011, 509(6): 1964–1968. |
| [41] |
MA M, YANG L W, REN G Z, et al. Solvothermal synthesis, cubic structure and multicolor upconversion emission of ultrasmall monodisperse lanthanide-doped BaYF5 nanocrystals[J].
Journal of Luminescence, 2011, 131(4): 1842–1846. |
| [42] |
XU C F, MA M, YANG L W, et al. Lanthanide doping facilitated growth of ultrasmall monodisperse Ba2LaF7 nanocrystals with excellent photoluminescence[J].
Journal of Colloid and Interface Science, 2012, 368(1): 49–55. DOI: 10.1016/j.jcis.2011.10.072. |
| [43] |
YING B, SHENG W G. Preparation and luminescent properties of a rare earth borate red light-emitting material[J].
Materials Science Poland, 2018, 36(3): 359–363. DOI: 10.2478/msp-2018-0057. |
| [44] |
陶锋. 水热法中发光材料的形貌控制合成[D]. 合肥: 中国科学技术大学, 2007.
|
| [45] |
姜桂铖, 韦先涛, 王林香, 等. 下转换材料β-NaYF4: Tb3+, Yb3+的水热法合成和发光性质研究[J].
光谱学与光谱分析, 2011, 31(2): 331–334.
DOI: 10.3964/j.issn.1000-0593(2011)02-0331-04.
|
| [46] |
LI J F, LU G Z, WANG Y Q, et al. A high activity photocatalyst of hierarchical 3D flowerlike ZnO microspheres: synthesis, characterization and catalytic activity[J].
Journal of Colloid and Interface Science, 2012, 377(1): 191–196. DOI: 10.1016/j.jcis.2012.04.008. |
| [47] |
陈雪桥, 王小卉, 于印霄, 等. 一种金纳米球复合稀土Eu3+功能纳米材料的制备及光热监测应用[J].
发光学报, 2019, 40(11): 1380–1385.
|
| [48] |
张军, 孙聆东, 廖春生, 等. 氧化锌微晶的制备和形貌控制[J].
无机化学学报, 2002, 18(1): 72–74.
DOI: 10.3321/j.issn:1001-4861.2002.01.015.
|
| [49] |
廖金生, 柳少华, 周单, 等. 红色荧光粉La2O3: Eu3+的合成及发光性质[J].
有色金属科学与工程, 2013, 4(6): 19–23.
|
| [50] |
ZHANG F, ZHAO D Y. Synthesis of uniform rare earth fluoride (NaMF4) nanotubes by in situion exchange from their hydroxide[M(OH)3] parents[J].
ACS Nano, 2009, 3(1): 159–164. DOI: 10.1021/nn800533v. |
| [51] |
WANG F, HAN Y, LIM C S, et al. Simultaneous phase and size control of up-conversion nanocrystals through lanthanide doping[J].
Nature, 2010, 463(7284): 1061–1065. DOI: 10.1038/nature08777. |
| [52] |
GRZYB T, LIS S. Structural and spectroscopic properties of LaOF: Eu3+ nanocrystals prepared by the sol-gel pechini method[J].
Inorganic Chemistry, 2011, 50(17): 8112–8120. DOI: 10.1021/ic2005453. |
| [53] |
李天旻. 草酸沉淀法/碳酸氢铵沉淀法制备稀土氧化物粉末[D]. 上海: 华东理工大学, 2013.
|
| [54] |
DONATO G, GROSVENOR A P. Crystallization of rare earth phosphate borosilicate glass composites synthesized by a one-step coprecipitation method[J].
Crystal Growth and Design, 2020, 1(4): 87–92. |
| [55] |
张雪梅. 两种稀土Sc氧化物的制备及发光性质研究[D]. 重庆: 西南大学, 2018.
|
| [56] |
DANKI K, ALESHIN M A, MASHKOVTSEV Y A, et al. Fabrication of (Y0.95Eu0.05)2O3 phosphors with enhanced properties by coprecipitation of layered rare earth hydroxide[J].
Journal of Alloys and Compounds, 2019, 805(15): 258–266. |
| [57] |
XUE D F, ZHANG H J, LIU Y N, et al. Editorial: advances in rare earth resource utilization and functional materials[J].
Materials Research Bulletin, 2017, 96(1): 1–12. |
| [58] |
ZHAO P P, YANG F, ZHAO Z G, et al. A simple preparation method for rare earth phosphate nano materials using an ionic liquid-driven supported liquid membrane system[J].
Journal Ofindustrial and Engineering Chemistry, 2017, 54(25): 369–376. |
| [59] |
刘峰生, 舒庆, 张彩霞, 等. 溶胶-凝胶法制备Sr2SiO4: Tb3+绿色荧光粉及其发光性能研究[J].
有色金属科学与工程, 2018, 9(1): 68–74.
|
| [60] |
BOGDAN N, VETRONE F, OZIN G A, et al. Synthesis of ligand-free colloidally stable water dispersible brightly luminescent lanthanide-doped upconverting nanoparticles[J].
Nano Letters, 2011, 11(2): 835–840. DOI: 10.1021/nl1041929. |
| [61] |
梁凯旋. 稀土离子掺杂NaLn(SO4)2的制备及性能研究[D]. 青岛: 青岛科技大学, 2017.
|
| [62] |
JANIFER M A, ANANA S, PAULINE M V S, et al. Investigation of rare earth garnet and its physical properties synthesized by facile sol-gel method science direct[J].
Materials Today, 2019, 8(1): 337–345. |
| [63] |
YE J, LIU H G, XIONG J. Preparation and properties of fluorescent cellulosic papervia surface coating of anionic cellulose ethers/rare earth metal ions composites[J].
Industrial and Engineering Chemistry Research, 2019, 58(6): 2370–2378. DOI: 10.1021/acs.iecr.8b03430. |
| [64] |
工业和信息化部. 稀土行业发展规划(2016—2020年)[J].
稀土信息, 2016, 1(1): 1–13.
|
| [65] |
陈建军, 杨庆山. 稀土功能材料综述[J].
湖南有色金属, 2007, 23(5): 30–44.
DOI: 10.3969/j.issn.1003-5540.2007.05.010.
|
| [66] |
KUCHI R, KIM D.
Rare earth metal recovery for green technologies[M]. Korea: Springer International Publishing, 2020.
|
| [67] |
朱明刚, 李卫. 中国稀土永磁科技及产业发展现状与出路[J].
稀土信息, 2016, 1(10): 10–13.
|
| [68] |
贾增民, 王有轩, 刘永峙, 等. 稀土材料在激光隐身技术中的研究与发展[J].
激光与红外, 2015, 45(2): 125–126.
|
| [69] |
王春梅, 刘玉柱, 赵龙胜, 等. 我国稀土材料与绿色制备技术现状与发展趋势[J].
中国材料进展, 2018, 37(11): 5–11.
|
| [70] |
WANG X C, ZHOU X P, CAO Y X, et al. Insight into a novel rare earth free red-emitting phosphor Li3Mg2NbO6: Mn4+: Structure and luminescence properties[J].
Journal of the American Ceramic Society, 2019, 102(11): 6724–6731. DOI: 10.1111/jace.16527. |
| [71] |
OUYANG Y, ZHANG M X, YAN A, et al. Plastically deformed La-Fe-Si: microstructural evolution, magnetocaloric effect and anisotropic thermal conductivity[J].
Acta Materialia, 2020, 187(1): 1–11. |
| [72] |
王芳凝, 罗贞礼. 我国稀土材料产业现状及可持续发展对策分析[J].
新材料产业, 2010, 1(8): 77–81.
DOI: 10.3969/j.issn.1008-892X.2010.08.018.
|
| [73] |
黄小卫, 张永奇, 李红卫. 我国稀土资源的开发利用现状与发展趋势[J].
中国科学基金, 2011, 1(3): 134–137.
|
| [74] |
王振华, 赵龙妹, 周襄瑶, 等. 稀土材料与可持续发展战略[C] // 中国工程院化工. 冶金与材料工程学部第五届学术会议论文集, 海南: 中国工程院化工, 2012, 1(1): 547-549.
|
| [75] |
罗满. 我国稀土材料与绿色制备技术现状与发展趋势[J].
中国金属通报, 2019, 37(10): 5–7.
DOI: 10.3969/j.issn.1672-1667.2019.10.003.
|
| [76] |
ZHANG J S, ZHANG Y Z, TAO J, et al. Study on the light color mixing of rare earth luminescent materials for anti-counterfeiting application[J].
Materials Research Express, 2018, 5(4): 146–201. DOI: 10.1088/2053-1591/aab7da. |
| [77] |
游晓莉, 彭蜀晋, 张丹, 等. 稀土材料应用简介[J].
化学教育, 2011, 1(9): 3–6.
DOI: 10.3969/j.issn.1003-3807.2011.09.002.
|
| [78] |
ZHANG F F, YANG J C, HUANG L. Research and application of rare earth tungsten electrode materials[J].
Materials Science Forum, 2016, 847(9): 65–71. |
| [79] |
NAGAI Y, DOHMAE K, IKEDA Y, et al. In situ redispersion of platinum autoexhaust catalysts: an on-line approach to increasing catalyst lifetimes[J].
Angewandte Chemie International Edition, 2008, 120(48): 9443–9446. |
| [80] |
CAO Y D, RAN R, WU X D, et al. Comparative study of ageing condition effects on Pd/Ce0.5Zr0.5O2 and Pd/Al2O3 catalysts: Catalytic activity, palladium nanoparticle structure and Pd-support interaction[J].
Applied Catalysis A General, 2013, 457(24): 52–61. |
| [81] |
ZHANG L, LI L L, CAO Y, et al. Getting insight into the influence of SO2 on TiO2/CeO2 for the selective catalytic reduction of NO by NH3[J].
Applied Catalysis B Environmental, 2015, 165(1): 589–598. |
| [82] |
BALWINDER K, KAUR R, RAJENDRA V, et al. Highly efficient CeO2 decorated nano-ZSM-5 catalyst for electrochemical oxidation of methanol[J].
ACS Catalysis, 2016, 6(4): 2654–2663. DOI: 10.1021/acscatal.6b00525. |
| [83] |
ZHANG J S, ZHANG Y Z, TAO J. Study on the light-color mixing of rare earth luminescent materials for anti-counterfeiting application[J].
Materials Research Express, 2018, 5(4): 820–828. DOI: 10.1088/2053-1591/aab7da. |
| [84] |
WANG X Q, LIU Y, WU Z B. Highly active NbOPO4 supported Cu-Ce catalyst for NH3-SCR reaction with superior sulfur resistance[J].
Chemical Engineering Journal, 2020, 382(4): 56–67. |
| [85] |
JOHN H, OSCAR S, MAURA C D, et al. Hydrogen storage in a rare earth perovskite-type oxide La0.6Sr0.4Co0.2Fe0.8O3 for battery applications[J].
Rare Metals, 2018, 37(1): 1003–1013. |
| [86] |
张沛龙. 稀土储氢材料的应用现状与发展前景[J].
稀土信息, 2017(11): 8–12.
|
| [87] |
HONG F, CHENG H M, SONG Y, et al. Room-temperature synthesis, optimized photoluminescence and warm-white LED application of a highly efficient non-rare earth red phosphor[J].
Journal of Alloys and Compounds, 2019, 775(1): 1365–1375. |
| [88] |
刘小芳, 杨丽, 张晓雨. 稀土储氢合金未来能否迎来新的发展与突破[J].
稀土信息, 2018(7): 30–32.
|
| [89] |
HU Q, LI Z, TAN Z F, et al. Rare earth ion-doped CsPbBr3 nanocrystals[J].
Advanced Optical Materials, 2018, 6(2): 812–820. |
| [90] |
中国稀土2019年度十大科技新闻[J]. 稀土信息, 2020(2): 6-11.
|
| [91] |
CAO R P, LV X V, RAN Y P, et al. Rare earth free Li5La3Ta2O12: Mn4+ deep red-emitting phosphor: Synthesis and photoluminescence properties[J].
Journal of the American Ceramic Society, 2019, 102(10): 5910–5918. DOI: 10.1111/jace.16447. |
| [92] |
CHEN X, WANG C M, QI D D, et al. Raman spectra of rare earth double-decker complexes with porphyrinato and 2, 3-naphthalocyaninato ligands[J].
Journal of Porphyrins and Phthalocyanines, 2019, 23(3): 260–266. DOI: 10.1142/S1088424619500081. |
 2021, Vol. 12
2021, Vol. 12