| 疏水低共熔溶剂萃取金属离子研究进展 |
2003年Abbott等发现氯化胆碱(熔点=302 ℃)与尿素(熔点=133 ℃)2:1(摩尔比,下同)的混合物在室温下为液体且具有独特的溶剂性质,将这种室温液体混合物称为低共熔溶剂(deep eutectic solvent,DES)[1]。DES可以定义为2种或2种以上纯化合物(即,氢键受体和氢键供体)形成的混合物,通过混合熵、范德华相互作用和氢键作用使其熔点远低于单个组分的熔点的室温液体[2-3]。DES具有与离子液体相似的理化性质,例如蒸气压低、液体范围宽、导电性、增溶性好等[4-5]。通过改变混合物的组成、比例和含水量可以对DES的理化性质进行调整,在催化、燃油脱硫、药物释放、活性物质的提取、有机合成、金属氧化物的浸出与金属电沉积等领域具有广泛应用[6-10]。例如,Tran等利用DES能溶解氧化物的特性,将氯化胆碱与乙二醇组成DES用于废弃锂离子正极材料的浸出[11]。Hammond等利用DES具有催化功能的特性,使用氯化胆碱与尿素组成的DES催化合成纳米二氧化铈[12]。
氯化胆碱和尿素是报道最早的DES,也是近年来研究最多的一种DES[13]。后续在此基础上又开发了由氯化胆碱、甜菜碱、四烷基季铵(膦)盐等为氢键受体(Hydrogen Bond Acceptor,HBA),由醇、酸和酰胺为HBD组成的DES[14]。早期报道的DES,由于起始组分亲水且内部氢键的增溶作用,可与水混溶,只能应用于非水介质且难以循环[15]。2015年,Van Osch等以季铵盐为HBA,癸酸为HBD设计了一类DES,其在水中的溶解度可以低至11 mg/g[16]。疏水DES的引入扩展了DES运用范围,在萃取分离的各个领域获得了广泛关注[17-19]。疏水DES对金属离子的萃取于2016年首次报道。Tereshatov等以四庚基氯化铵或薄荷醇为HBA,羧酸为HBD设计了4种疏水DES用于从盐酸体系中萃取铟[20]。由于DES与离子液体一样具有可设计性;且制备工艺更加简单,原料来源更广[21-22]。国内外关于萃取金属离子的疏水DES报道迅速增加。本文概述了2016年以来用于萃取分离金属离子的疏水DES结构设计现状,分析了疏水DES理化性质与其组成的关系,介绍了近年来疏水DES萃取金属离子的研究进展,总结了目前疏水DES用于工业分离过程存在的问题,展望了疏水DES用于金属萃取分离的未来研究方向。
1 疏水DES分子结构DES制备过程不需要溶剂,也不需要发生传统意义上的反应。最常用的制备方法为将一定摩尔比的HBA和HBD在惰性气氛下加热搅拌,直到形成均匀的液体。液体在室温下保存24 h未有固体析出,表明DES已制备成功[23]。DES在制备过程中不会发生化学反应,与组成DES的起始组分相比,只有分子间作用力的改变。核磁共振光谱仪和红外光谱仪检测表明,组成DES后,HBA或HBD分子内的氢键消失或减弱,HBA和HBD分子间的氢键形成并占主导地位[16, 24-27]。
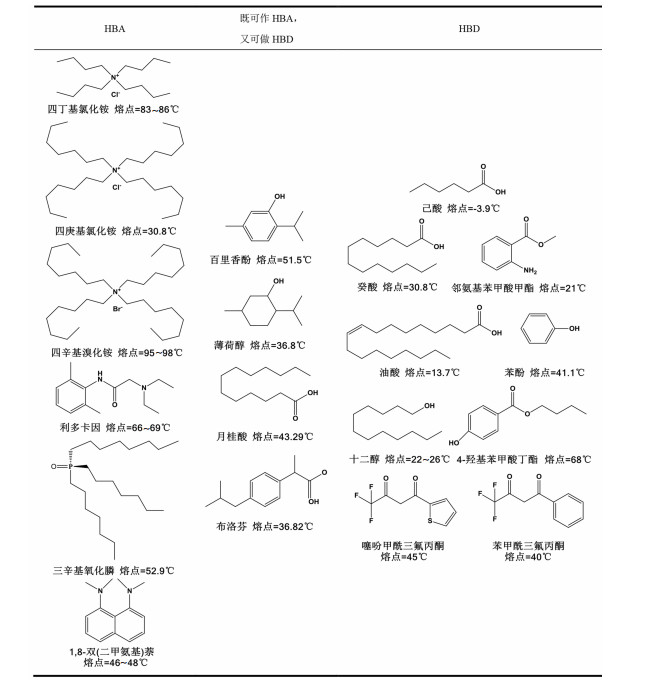
在DES的其它萃取领域,已有3组分DES用于萃取的报导[28-29]。但萃取金属离子的疏水DES仍由单一HBA和单一HBD 2种组分组成。DES组分中,HBA与HBD需根据物质的酸度系数pKa值的大小判断。pKa大的组分作为HBA,pKa小的组分作为HBD。表 1列出了一些已被设计用于金属离子萃取的疏水DES组分的结构与熔点。如表 1所列,用于萃取金属离子的疏水DES,起始组分熔点均小于100 ℃,且多数含有能与金属离子配位的官能团。常见疏水DES的组合包括:
| 表 1 用于金属离子萃取DES组分的结构与熔点 Table 1 Structure and melting point of components of DES used for metal ion extraction |
 |
| 点击放大 |
1) 以叔胺或烷基季铵(膦)盐为HBA,羧酸为HBD[20-21, 25, 27, 30-31];
2) 以三辛基氧化膦为HBA,醇或酚为HBD[32-34];
3) 以醇或酚为HBA,羧酸为HBD[20, 35-36]。
此外,HBA与HBD之间通过酸度差异也能形成DES[21, 37]。例如,辛酸、壬酸、癸酸和月桂酸以一定比例混合可以形成DES[26]。三辛基氧化膦与β-二酮类化合物之间也可以组成DES(图 1)[24]。
 |
| 图 1 三辛基氧化膦(TOPO)与噻吩甲酰三氟丙酮(HTTA)混合后形成的DES[24] Fig. 1 DES formed by the mixture of trioctyl phosphine oxide (TOPO) and thiophenoyl trifluoroacetone(HTTA) |
2 疏水DES理化性质
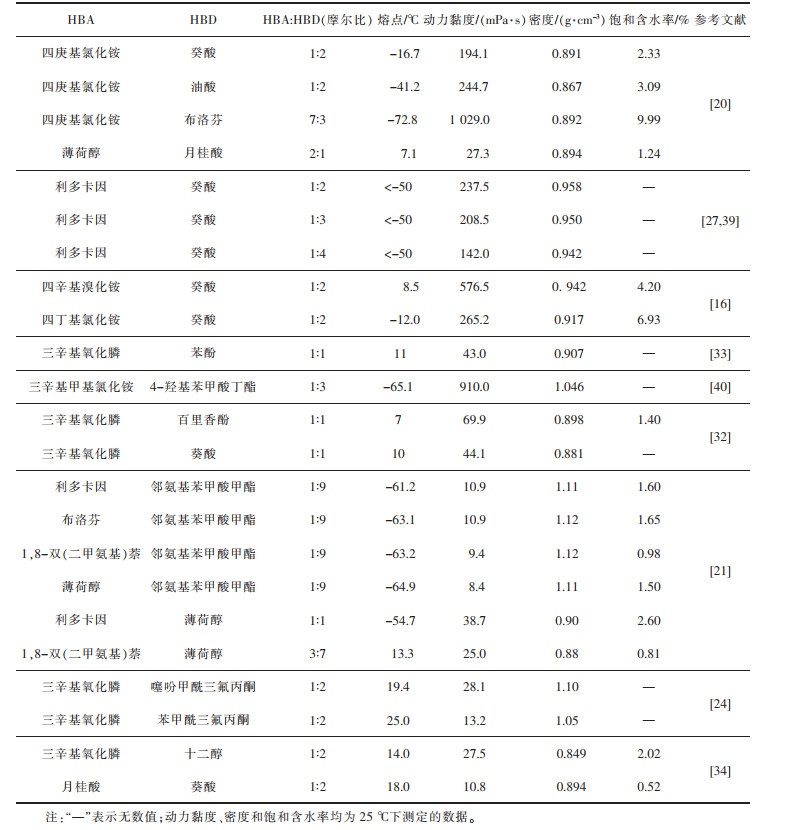
疏水DES是一种新型的溶剂,分析其理化性质能更直观地了解疏水DES。表 2列举了一些用于萃取金属离子的疏水DES的常见理化性质。疏水DES在萃取的同时充当稀释剂与萃取剂,在液-液萃取的工业规模应用中,稀释剂和萃取剂的密度,黏度,疏水性是溶剂与萃取剂选择的关键因素。黏度大不利于有机相和水相的传质;有机相与水相密度相近会导致分相困难;有机相疏水性不强不仅会使萃取剂流失,而且会污染萃取后的水相[19, 38]。
| 表 2 用于萃取金属离子的疏水DES的常见理化性质 Table 2 Common physicochemical properties of hydrophobic DES for extraction of metal ions |
 |
| 点击放大 |
疏水DES的密度与分子的堆积及其组分之间的相互作用有关,但存在显著的规律。例如,三辛基氧化膦和苯酚组成的DES密度介于单一组分之间,密度大组分相对含量增加,密度变大[33]。由三辛基甲基氯化铵与4-羟基苯甲酸酯组成的DES随着4-羟基苯甲酸酯相对含量的增加,密度变大[40]。薄荷醇与饱和脂肪酸组成的DES密度随着一元羧酸烷基链的增加而降低,与一元羧酸的密度变化规律相同[41]。季铵盐与癸酸组成的DES密度随季铵烷基链长度的增加而减小,密度大小依次为:四丁基氯化铵: 癸酸>四庚基氯化铵: 癸酸 > 四辛基氯化铵: 癸酸[16]。温度上升会使DES的密度呈线性下降[16, 33, 39]。此外,由于DES具有一定的吸水能力,在与水预饱和后,DES的密度会向水的密度偏移[26, 39]。
疏水DES的黏度不仅取决于HBD和HBA的自身的化学性质,HBD和HBA之间的氢键强度也会对黏度产生影响[42]。例如,百里香酚与饱和脂肪酸的共晶混合物的黏度介于纯组分的黏度之间[41]。利多卡因和癸酸组成的DES黏度随癸酸相对含量增加而减小[27]。组成DES的烷基链越短,黏度越低[26, 41]。叔胺或季铵盐与羧酸形成的DES,由于其内部的静电相互作用强,空隙体积小,离子尺寸大,往往具有较高的黏度(142~1 029 mPs·s)[7]。需要指出的是,同一HBA与不同HBD在固定摩尔比下的黏度没有直接的正相关关系。DES黏度随温度变化明显,温度的升高导致黏度的大幅下降[20, 26, 33]。DES吸水后黏度下降[21, 31]。
疏水DES的疏水性能可以通过HBD和HBA结构及组成进行推测,主要可以分为3种类型。第1类是由季胺(膦)盐和羧酸组成的疏水DES,由于内部存在离子型氢键,其在水中的溶解度会大于单一组分的溶解度[16, 20, 25]。第2类是由叔胺为HBA组成的DES,由于叔胺在酸性条件下会质子化,在萃取金属后叔胺会转移到水相中[21, 27, 30]。剩余的DES可以归于第3类。这类DES内部通过非离子型氢键结合,使这类DES溶解度会小于单一组分的溶解度。例如,三辛基氧化膦和苯酚组成的DES后,三辛基氧化膦的溶解度由0.15 g/L下降至0 g/L,苯酚的溶解度由88 g/L下降至1 g/L[33]。百里香酚和饱和脂肪酸组成疏水DES后,百里香酚的在水中的溶解度下降了一个数量级[41]。
3 疏水DES用于金属离子的萃取疏水DES在金属离子萃取领域的发展迅速,已被用于分离提取各种金属离子。按照主要发挥萃取作用的组分结构来划分,用于萃取金属离子的疏水DES主要有4种类型:第1类是由四烷基季铵(膦)盐为主要萃取组分的DES;第2类是由叔胺为主要萃取组分的DES;第3类是以羧酸为主要萃取组分的DES;第4类是以三辛基氧化膦为主要萃取组分的DES。
3.1 季胺(膦)盐型DES三辛基甲基氯化铵和三己基十四烷基氯化膦是性能优异季铵(膦)离子液体,通过阴离子交换可提取金属含氧酸根阴离子(TcO4-,ReO4-,HCrO4-,HV2O5-和HWO4-等),或者利用金属阳离子在高盐(Fe3+,Re3+,In3+,Zn2+,Cu2+,Co2+,Mn2+,Fe2+,VO2+)体系具有阴离子化的特性,可与溶液中的阴离子(Cl-,NO3-,SO42-)形成络阴离子被季铵(膦)离子液体萃取[43]。两者的结构如图 2所示。季胺(膦)盐型DES具有和季铵(膦)离子液体相似的官能团,已被用于从水溶液中萃取各种金属含氧酸根阴离子与金属络阴离子。
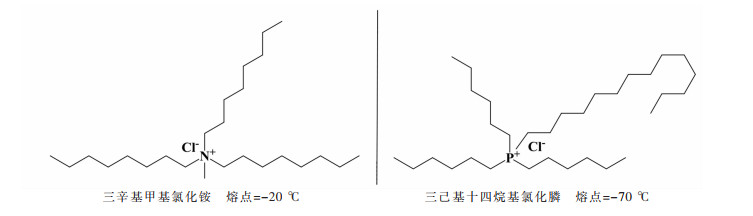 |
| 图 2 季铵(膦)离子液体的分子结构 Fig. 2 Molecular structure of quaternary ammonium (phosphine) ionic liquid |
Tereshatov等报道了3种疏水DES从盐酸体系萃取In(Ⅲ)的方法,四庚基氯化铵: 布洛芬(代表HBA: HBD,下同)(7:3),四庚基氯化铵: 油酸(1:2),四庚基氯化铵: 癸酸(1:2)3种DES对In(Ⅲ)的萃取能力分别为四庚基氯化铵: 布洛芬(7:3) > 四庚基氯化铵: 油酸(1:2)≈四庚基氯化铵: 癸酸(1:2)。在水相HCl浓度为6 mol/L,3种疏水DES均可以完全提取In(Ⅲ)。DES萃取铟的机理主要是因为离子对的形成,萃取机理如式(1)所示。负载In(Ⅲ)的DES相用0.1 mol/L二乙烯三胺五乙酸,可成功反萃取至水相[20]。
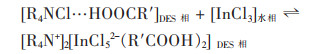
|
(1) |
Phelps等开发了三己基十四烷基氯化膦: 癸酸(1:2),四辛基溴化铵: 癸酸(1:2),四辛基溴化铵: 己酸(1:2)3种疏水DES从水溶液中萃取痕量99mTcO4-。在水相初始pH值为5时,3种DES均可以在含有大量Cl-,NO3-,HCO3-,H2PO4-,SO42-的体系中定量(> 99%)去除99mTcO4-,但负载99mTcO4-的DES再生比较困难[25]。其萃取机理如式(2)所示。
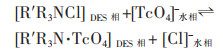
|
(2) |
Ruggeri等演示了四丁基氯化铵: 癸酸(1:2)的DES从水介质中萃取Cr(Ⅵ),在弱酸性条件下,疏水DES可以将水溶液中的Cr(Ⅵ)去除至0.3 mg/L以下,提取的Cr(Ⅵ)在DES相中会自动被还原为Cr(Ⅲ),萃取其他金属如铜(Ⅱ)和镍(Ⅱ)会导致DES的胶凝[31]。Shi等研究了三辛基甲基氯化铵: 4-羟基苯甲酸丁酯(1:1)的DES用于从废水中去除Cr(Ⅵ),水溶液中离子强度的增加会使Cr(Ⅵ)萃取效率降低,影响次序依次为NO3- > Cl- > SO42-[40]。DES可以在金属离子(Cd2+、Cu2+)与有机化合物((C6H10O5)n、C6H12O6·H2O)共存浓度为Cr (Ⅵ)的2 000倍时选择性提取Cr(Ⅵ)。选择性萃取的原理为在酸性条件下Cr(Ⅵ)主要以HCrO4-形式存在,HCrO4-与三辛基甲基氯化铵中的N+(R3R)通过静电相互作用使Cr (Ⅵ)从水相中转移到DES相中[31]。季铵(膦)盐型DES提取Cr(Ⅵ)的机理如式(3)所示:
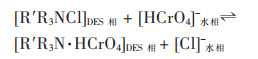
|
(3) |
Chen等使用四丁基氯化铵: 油酸(1:3)与TBP协同萃取Li(I),在DES添加量为30%,相比=1、氨水为1.5 mol/L的较优萃取条件下,协同萃取体系对Li+单次萃取率可达76.8%,βLi/Na值为20.5。Li(I)和DES之间的阳离子交换以及Li(I)与TBP之间膦氧键的配位作用导致了Li(I)的选择性萃取。使用1 mol/L的盐酸可以反萃97%的锂,有机相循环使用5次,萃取效率仍在60%以上[44]。
与季铵(膦)离子液体相比,季胺(膦)盐型DES在黏度上表现出更优异的性能。298.15 K下季胺(膦)盐型DES黏度在194.1~1 029 mPa·s之间,而未稀释的三辛基甲基氯化铵和三己基十四烷基氯化膦离子液体的黏度分别为2 391.4 mPa·s与2 729.1 mPa·s[45-46]。季胺(膦)盐型DES与季铵(膦)离子液体对金属含氧酸根离子具有一致的萃取规律,对水合能较小的金属含氧酸根阴离子均表现出高萃取能力。对于高盐体系下金属阳离子的萃取,季胺(膦)盐型DES的萃取能力明显偏弱。四庚基氯化铵和羧酸组成的DES需在6 mol/L HCl体系才能完全提取In(Ⅲ),而季铵(膦)离子液体在2 mol/L HCl条件下即可完全提取In(Ⅲ)。多数季胺(膦)盐型DES的稳定性较差,四辛基溴化铵: 癸酸(1:2),四辛基溴化铵: 己酸(1:2)在萃取99mTcO4-后会有固体析出;四丁基氯化铵: 癸酸(1:2)在萃取铜(Ⅱ)和镍(Ⅱ)后DES会胶凝;四丁基氯化铵: 油酸(1:3)在碱性条件下会与Li(I)进行阳离子交换,四丁基氯化铵会进入水相。
根据不同的萃取机理,季铵(膦)离子液体的反萃有多种方式。可用的反萃试剂包括水,酸和碱,其中碱是最有效的反萃试剂[47-50]。多数金属含氧酸根阴离子与季铵(膦)类化合物的稳定常数大,需用强碱进行反萃。季胺(膦)盐型DES的反萃受HBA的限制,以羧酸为HBA的季胺(膦)盐DES在强碱性下结构可能受到破坏。季铵(膦)离子液体提取金属络阴离子后,一般使用水或者稀酸进行反萃,三己基十四烷基氯化膦萃取In(Ⅲ)后可通过0.1 mol/L盐酸完全反萃[51]。而四庚基氯化铵: 油酸(1:2)在萃取In(Ⅲ)后使用0.2 mol/L盐酸反萃率仅有25%。就目前而言,季胺(膦)盐型DES相比与季铵(膦)离子液体在金属离子萃取领域并无的优势。
3.2 叔胺型DES用于金属离子萃取N235是工业上常用的叔胺萃取剂,其主要成分为三辛癸烷基叔胺。与季铵(膦)离子液体类似,N235在酸化后可萃取各种含氧酸根阴离子和金属络阴离子[52-55]。由N235与P507的协同萃取体系,还可用于无皂化提取稀土[56-57]。不同于N235,以利多卡因和1,8-双(二甲氨基)萘为HBA的叔胺型DES不具备在酸性体系萃取金属的能力。根据Edgecomb等的研究,利多卡因: 邻氨基苯甲酸甲酯(1:9),利多卡因: 薄荷醇(1:1),1,8-双(二甲氨基)萘: 邻氨基苯甲酸甲酯(1:9),1,8-双(二甲氨基)萘: 薄荷醇(3:7)4种DES的HBA在酸性条件下都会大量进入水相。水相平衡pH < 4时,4种DES的HBA在水相中的溶解度均大于0.3 mol/L[21]。目前叔胺型DES的开发主要围绕如何提升叔胺型DES的疏水性能,并附带了一些对金属离子萃取的测试。
Van Osch等研究了利多卡因: 癸酸组成的DES从水溶液中萃取过渡金属和碱金属。利多卡因: 癸酸可在自然pH条件下萃取水溶液中的Co(Ⅱ),Fe(Ⅱ),Mn(Ⅱ),Ni(Ⅱ),Zn(Ⅱ)与Cu(Ⅱ),但对碱金属Na(I),K(I)和Li(I)的萃取效果较差,DES中利多卡因的相对含量越高,对金属离子的萃取能力越强[27]。其萃取机理与N235和P507的非皂化协同萃取类似,利多卡因夺取了癸酸的氢离子使癸酸的萃取能力变强,在萃取金属离子后,质子化的利多卡因会和金属离子发生阳离子交换转移到水相中。Ola和Matsumoto将利多卡因: 癸酸(2:1)溶于正庚烷进行了进一步研究,在初始pH值为1.5,Fe(Ⅲ)和Mn(Ⅱ)均为0.01 mol/L时,通过调节有机相中的DES浓度,可以依次从溶液中分离Fe(Ⅲ)和Mn(Ⅱ)[30]。但仍未解决利多卡因在提取金属后进入水相的问题。基于利多卡因: 癸酸组成的DES其萃取实质如式(4)所示:
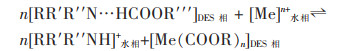
|
(4) |
Edgecomb等基于活性药物和食品级成分开发出4种的疏水性和低黏度DES用于萃取In (Ⅲ)。利多卡因: 邻氨基苯甲酸甲酯(1:9),利多卡因: 薄荷醇(1:1),1,8-双(二甲氨基)萘: 邻氨基苯甲酸甲酯(1:9),1,8-双(二甲氨基)萘: 薄荷醇(3:7),4种DES均能实现高效的In (Ⅲ)提取,在提取In (Ⅲ)后,DES中的HBA仍会进入水相[21]。作者对DES萃取In(Ⅲ)的机理推测如式(5):
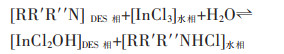
|
(5) |
叔胺型DES的开发还处在早期阶段,研究人员做过很多尝试。通过更换HBA或HBD的结构,或将其溶于有机溶剂中以减少叔胺质子化后的损失。但均未取得突破性的进展。即使在中性的萃取环境中,在提取金属离子后叔胺型DES中的HBA仍会进入水相。就目前而言,叔胺类DES还不适合进行金属离子的萃取。
3.3 羧酸型DES用于金属离子萃取目前,工业上常用的羧酸类萃取剂包括环烷酸和叔碳酸(versatic 10)。环烷酸广泛用于稀土料液中铝的去除和钇的提纯[58-59]。versatic 10是红土镍矿硫酸浸出液的钴镍提取的特效萃取剂[60]。长链脂肪酸(碳链大于10)熔点高,油溶性差,在工业上不适合做萃取剂。羧酸型DES的出现解决了长链脂肪酸油溶性差和熔点高的问题。且羧酸型DES的起始原料绿色环保,价格低廉,生物相容性好,具有较好的商业化前景。
Tereshatov等研究了薄荷醇: 月桂酸(2:1)的DES对In(Ⅲ)的萃取。DES对In(Ⅲ)的萃取率随pH值的升高而增加,与癸酸在煤油中萃取In(Ⅲ)的规律一致[20]。马尚文等研究了不同碳数双脂肪酸疏水DES的合成,并考察了其对水溶液中铜离子的萃取效能。当月桂酸与癸酸物质的量比为1:2时,可以在室温下组成DES。将其用于含铜废水处理,在相比为1,水相pH值为4.1~4.7,铜离子浓度为10 mg/L,震荡时间为60 min时,对铜离子的去除率可达93.24%[61]。
陈倩文开发了薄荷醇: 癸酸(1:1)、薄荷醇: 油酸(1:1)、百里酚: 癸酸(1:1)和百里酚: 油酸(1:1)4种DES,并用于从含钍放射性废渣浸出液中回收Th(IV)。4种DES对Th的萃取能力强弱依次为百里酚: 癸酸(1:1)>百里酚: 油酸(1:1)>薄荷醇: 癸酸(1:1)>薄荷醇: 油酸(1:1)。在水相初始pH值为3,相比为1,平衡时间为10 min条件下,使用百里香酚: 癸酸(1:1)从含钍放射性废渣模拟浸出液中萃取分离Th(Ⅳ)/REEs(Ⅲ),经单级萃取-洗涤-反萃后,Th(Ⅳ)最终的回收率为96.4%,纯度为94.2%,萃余液中Th(Ⅳ)的浓度低于2 mg/L,Th(IV)/REEs(Ⅲ)的分离系数达到3 223[35]。
Schaeffer等研究了以薄荷醇/百里香酚和饱和脂肪酸(链长分别为8,10,12,14,16和18)组成疏水DES对过渡金属离子的萃取能力。DES对过渡金属离子的萃取能力随脂肪酸链长增加而减弱,随脂肪酸相对含量增加而增加。水相加入0.1 mol/L的Na2SO4可使DES的萃取效率提高10%。百里香酚: 葵酸(3:7)的DES对过渡金属Fe(Ⅱ)、Cu(Ⅱ)和Fe(Ⅲ)具有较好的萃取能力,对Cr(Ⅲ)、Mn(Ⅱ)、Co(Ⅱ)和Ni(Ⅱ)的萃取能力不佳(图 3)。在pH=4.9,T=20℃,相比=1时,对Cu(Ⅱ)/Co(Ⅱ)和Cu(Ⅱ)/Ni(Ⅱ)的分离系数分别达到500和154。使用0.1 mol/L硫酸反萃Cu(Ⅱ)可以再生DES[36]。
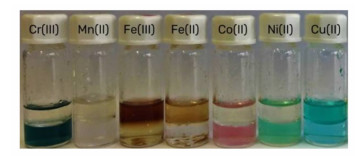 |
| 图 3 百里香酚: 葵酸(3∶7)的DES对常见金属的萃取[36] Fig. 3 Extraction of common metals by DES of thyme: truvic acid(3∶7)[36] |
Ni等使用月桂酸: 葵酸(2:1)的DES对废SmCo磁体浸出液中的Cu(Ⅱ)、Co(Ⅱ)进行了分离。对Co(Ⅱ)含量为21.90 g/L、Cu(Ⅱ)含量为2.51g/L的浸出液进行单级萃取,并对负载有机相进行三级洗涤和反萃。Co(Ⅱ)、Cu(Ⅱ)纯度均可达到98.50%以上。Co(Ⅱ)、Cu(Ⅱ)的回收率分别为99%、96.47%。月桂酸: 葵酸(2:1)萃取铜的机理为阳离子交换,通过调节水相的pH可以选择性的萃取或者反萃金属离子。疏水DES中没有与铜配位的部分起溶剂的作用[34]。
羧酸型DES对金属离子的萃取机理可以定义如式(6):
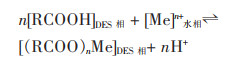
|
(6) |
羧酸型DES具有优异理化性质。黏度低,与水的密度相差大,疏水性能强,可以很好的萃取以及反萃金属离子,具有优异的循环性能,但熔点仍偏高。与常规萃取体系相比,羧酸型DES可看成一种无稀释剂的协萃体系,其萃取能力与起始组分羧酸酸性和含量直接相关,内部的氢键降低其对某些金属离子的萃取动力学和萃取能力。羧酸型DES内部的氢键作用对萃取能力的影响明显强于羧酸酸性对萃取能力的影响,预计通过改变HBD的结构,可调节羧酸型DES对不同金属的选择性。目前羧酸型DES对金属分离的研究集中在一些易于分离的金属离子,无法充分发挥DES的选择性和可设计性,应加深对性质相近金属的分离研究。
3.4 三辛基氧化膦型DES用于金属离子萃取三辛基氧化膦是美国氰胺公司开发的一种中性膦氧类萃取剂。其P=O(磷酰基)基团电子云密度大,萃取能力强,对镧系元素,锕系元素,贵金属,三价铁和六价铬等金属离子具有较好的配位能力[62-65]。在常规液液萃取中,三辛基氧化膦常作为协萃剂,与β-二酮类萃取剂组成的协萃体系可在中性条件下萃取锂[66]。但三辛基氧化膦在烃类溶剂中的溶解度相对较低,其萃取效率受溶解度的限制。将三辛基氧化膦与HBD液化组成DES可以充分发挥三辛基氧化膦萃取效率。
Gilmore等报道了三辛基氧化膦: 苯酚(1:1)的疏水DES用于萃取铀酰离子(UO22+)。DES相中三辛基氧化膦的浓度为1.875 mol/L,远大于三辛基氧化膦在煤油中的溶解度。在硝酸浓度为0.01~1 mol/L时,使用三辛基氧化膦: 苯酚(1:1)的DES均可以使水相中的UO22+从250 mg/L降低至0.5 mg/L以下。通过红外光谱分析和紫外光谱分析表明,苯酚的存在不参与UO22+的络合萃取,在萃取过程中只起到液化三辛基氧化膦的作用[33]。
Schaeffer等研究了三辛基氧化膦与百里香酚/癸酸组成的疏水DES在盐酸体系分离铂族金属和常见过渡金属的能力。2种DES对金属离子的选择性与内部氢键强度有关。三辛基氧化膦: 百里香酚(1:1)内部氢键强度大于三辛基氧化膦: 癸酸(1:1)内部氢键强度,因此表现出更好的选择性与更低的萃取能力。在盐酸浓度为2 mol/L时,2种DES都对金属的萃取强弱规律均为Pt(Ⅳ)≈Fe(Ⅲ) > Pd(Ⅱ) > > Cr(Ⅲ)≈Cu(Ⅱ)≈Co(Ⅱ)≈Ni(Ⅱ),Pd(Ⅱ)与Cr(Ⅲ)、Cu(Ⅱ)、Co(Ⅱ)、Ni(Ⅱ)之间的分系数均大于100[32]。
Ni等基于三辛基氧化膦: 十二醇(1:2)设计一个流程用于选择性回收废SmCo磁体盐酸浸出液中的Sm(Ⅲ)与Fe(Ⅲ)。浸出液中分别含10.05 g/L Fe(Ⅲ)、21.93 g/L Co(Ⅱ)、2.58 g/L Cu(Ⅱ)和9.87 g/L Sm(Ⅲ),在相比为4,通过两级逆流萃取,可以优先萃取超过99%的Fe(Ⅲ)和Sm(Ⅲ),仅0.16%的Co(Ⅱ)和2.89%的Cu(Ⅱ)被共萃取。负载Fe(Ⅲ)和Sm(Ⅲ)的DES相用1.5 mol草酸反萃,可分别得到高纯草酸铁溶溶液和草酸衫沉淀。所开发的DES对Sm(Ⅲ)与Fe(Ⅲ)的饱和负载量超过18 g/L(图 4),且在5次循环使用过程中DES的性能未发生变化[34]。
 |
| 图 4 三辛基氧化膦: 十二醇(1∶2)饱和负载Fe(Ⅲ)和Sm(Ⅲ)后DES的外观变化[34] Fig. 4 Trioctyl phosphine oxide: dodecanol (1∶2) saturated loading Fe(Ⅲ) and Sm(Ⅲ) on the appearance of DES[34] |
三辛基氧化膦型DES对金属阳离子的萃取机理如式(7)所示:
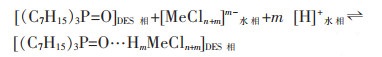
|
(7) |
Hanada等研究中性膦类萃取剂与β-二酮类萃取剂组成的协同DES用于萃取Li(I),三辛基氧化膦与苯甲酰三氟丙酮在摩尔比为1:2时可在室温下组成DES。DES对Li(I)的饱和负载量达到4.4 g/L,是常规锂萃取体系的2倍以上。通过调节溶液的pH值可以从盐湖卤水中选择性萃取Li(I),Li (I)与Na(I)的分离系数达到2 000。使用HCl溶液可从DES相中反萃90%以上的Li(I),DES在5个循环内使用对Li(I)的萃取和反萃未发生变化。与三辛基氧化膦与苯甲酰三氟丙酮在煤油中的协萃体系相比,由于协同DES不含稀释剂,DES相中萃取剂的浓度更高,萃取能力也相应更高,但对Li (I)与Na(I)选择性会稍有降低[24]。
三辛基氧化膦型DES的综合性能与羧酸类DES类似,同样具有低黏度,强疏水性以及较高的熔点。对金属离子的萃取和反萃性能与三辛基氧化膦在稀释剂中的性能一致。不同三辛基氧化膦型DES的特点是内部氢键的强度的不同。三辛基氧化膦: 百里香酚和三辛基氧化膦: 癸酸这2种DES内部表现出强的氢键相互作用,当DES组分中三辛基氧化膦的摩尔分数低于0.3时对Pd(Ⅱ)没有萃取能力。由于内部氢键的影响,在盐酸浓度为0.05 mol/L和1mol/L时三辛基氧化膦: 百里香酚(1:1)与三辛基氧化膦: 癸酸(1:1)这2种DES对Fe(Ⅲ)的萃取次序发生了变化,会优先萃取Pt(Ⅳ)和Pd(Ⅱ)。三辛基氧化膦: 十二醇和三辛基氧化膦: 苯甲酰三氟丙酮这2类DES中的氢键相互作用比较弱,在萃取时未有明显的抑制现象。DES内部的氢键对金属离子具有明显反协同作用,可以继续深入研究。
4 结论与展望疏水DES用于金属离子的萃取分离研究已经有5年时间,虽然还在起步阶段,但已在金属离子的萃取分离方面展现了良好工业应用前景,有很大的潜力取代传统的稀释剂和萃取剂。通过改变HBA与HBD的组成,可以调节对特定金属离子的选择性。与传统液萃取体系相比,疏水DES可同时充当稀释剂与萃取剂,不仅具有较大的负载能力,且对环境造成的影响比较小。但笔者认为疏水DES用于实际运用还有一些关键问题需深入研究:
1) 疏水DES自身的理化性质已有很多的数据,但疏水DES负载金属以后的理化性质和相变化性质报道的很少。由于疏水DES在萃取过程中同时充当稀释剂和萃取剂,在与金属离子结合以后DES相的成分发生了很大的变化,其负载金属以后的理化性质可能会变化很大。应当加强对疏水DES萃取金属后理化性质的表征。
2) 疏水DES的机理应该需要更深入的研究。大多数研究侧重于分析DES中发挥萃取作用的成分与金属离子的作用机制,但对另一组分对过程萃取的影响分析的很少。研究非萃取组分对萃取过程的影响可能有助于更好的设计疏水DES。
3) 疏水DES理化性质还有待改进。季胺盐型DES大多都水溶性大,黏度大,虽然具有极佳的选择性,但萃取多数金属离子都难以反萃。叔胺盐型的DES在萃取过程中的流失会使DES结构受到破坏,难以循环使用。基于羧酸或者三辛基氧化膦为主要萃取组分的疏水DES选择性好,可循环使用,但DES的熔点仍偏高。对DES结构的设计应该进一步加强。
4) 羧酸型DES目前测试还是一些比较容易分离的金属,未充分展示的DES的选择性与可设计性。对工业上某些性质相近金属分离研究应当继续加强。
| [1] |
ABBOTT A P, CAPPER G, DAVIES D L, et al. Novel solvent properties of choline chloride/urea mixtures[J].
Chemical Communications, 2003(1): 70–71. DOI: 10.1039/b210714g. |
| [2] |
KOLLAU L J, VIS M, VAN DEN BRUINHORST A, et al. Quantification of the liquid window of deep eutectic solvents[J].
Chemical Communications, 2018, 54(95): 13351–13354. DOI: 10.1039/C8CC05815F. |
| [3] |
MARTINS M A, PINHO S P, COUTINHO J A. Insights into the nature of eutectic and deep eutectic mixtures[J].
Journal of Solution Chemistry, 2019, 48(7): 962–982. DOI: 10.1007/s10953-018-0793-1. |
| [4] |
DIETZ C H, CREEMERS J T, MEULEMAN M A, et al. Determination of the total vapor pressure of hydrophobic deep eutectic solvents: experiments and perturbed-chain statistical associating fluid theory modeling[J].
ACS Sustainable Chemistry & Engineering, 2019, 7(4): 4047–4057. |
| [5] |
SMITH E L, ABBOTT A P, RYDER K S. Deep eutectic solvents (DESs) and their applications[J].
Chemical Reviews, 2014, 114(21): 11060–11082. DOI: 10.1021/cr300162p. |
| [6] |
FRANCISCO M, VAN DEN BRUINHORST A, ZUBEIR L F, et al. A new low transition temperature mixture (LTTM) formed by choline chloride+lactic acid: characterization as solvent for CO2 capture[J].
Fluid Phase Equilibria, 2013, 340: 77–84. DOI: 10.1016/j.fluid.2012.12.001. |
| [7] |
ZHANG Q H, VIGIER K D O, ROYER S, et al. Deep eutectic solvents: syntheses, properties and applications[J].
Chemical Society Reviews, 2012, 41(21): 7108–7146. DOI: 10.1039/c2cs35178a. |
| [8] |
耿笑, 汝娟坚, 华一新, 等. 低共熔溶剂电化学回收废铅膏可控制备铅粉的研究[J].
有色金属科学与工程, 2021, 12(2): 8–13.
|
| [9] |
雷震. 低共熔溶剂处理含锌烟尘的研究[D]. 昆明: 昆明理工大学, 2017.
|
| [10] |
王英磊, 李文欢, 宋晓静, 等. 低共熔溶剂中2-氨基-7-羟基-3-氰基-4-芳基-4H-色烯的绿色合成[J/OL]. 化学试剂, 2021-04-06.
|
| [11] |
TRAN M K, RODRIGUES M-T F, KATO K, et al. Deep eutectic solvents for cathode recycling of Li-ion batteries[J].
Nature Energy, 2019, 4(4): 339–345. DOI: 10.1038/s41560-019-0368-4. |
| [12] |
HAMMOND O S, EDLER K J, BOWRON D T, et al. Deep eutectic-solvothermal synthesis of nanostructured ceria[J].
Nature Communications, 2017, 8(1): 14150. DOI: 10.1038/ncomms14150. |
| [13] |
朱俊芳, 王咸英, 冯树波. 憎水性薄荷醇-乳酸低共熔溶剂的合成及其理化性质表征[J].
化学研究与应用, 2018, 30(2): 219–225.
DOI: 10.3969/j.issn.1004-1656.2018.02.008.
|
| [14] |
HANSEN B B, SPITTLE S, CHEN B, et al. Deep eutectic solvents: a review of fundamentals and applications[J].
Chemical Reviews, 2021, 121(3): 1232–1285. DOI: 10.1021/acs.chemrev.0c00385. |
| [15] |
DWAMENA A K. Recent advances in hydrophobic deep eutectic solvents for extraction[J].
Separations, 2019, 6(1): 9–15. DOI: 10.3390/separations6010009. |
| [16] |
VAN OSCH D J, ZUBEIR L F, VAN DEN BRUINHORST A, et al. Hydrophobic deep eutectic solvents as water-immiscible extractants[J].
Green Chemistry, 2015, 17(9): 4518–4521. DOI: 10.1039/C5GC01451D. |
| [17] |
熊大珍, 张倩, 樊静, 等. 疏水性低共熔溶剂及其在含水体系萃取分离中的应用[J].
中国科学: 化学, 2019, 49(7): 933–939.
|
| [18] |
冯树波, 马尚文, 宋弥新, 等. 憎水性低共熔溶剂的合成及在萃取分离领域中的应用研究进展[J].
化学研究与应用, 2020, 32(2): 177–186.
DOI: 10.3969/j.issn.1004-1656.2020.02.002.
|
| [19] |
VAN OSCH D J, DIETZ C H, WARRAG S E, et al. The curious case of hydrophobic deep eutectic solvents: a story on the discovery, design, and applications[J].
ACS Sustainable Chemistry & Engineering, 2020, 8(29): 10591–10612. |
| [20] |
TERESHATOV E, BOLTOEVA M Y, FOLDEN C. First evidence of metal transfer into hydrophobic deep eutectic and low-transition-temperature mixtures: indium extraction from hydrochloric and oxalic acids[J].
Green Chemistry, 2016, 18(17): 4616–4622. DOI: 10.1039/C5GC03080C. |
| [21] |
EDGECOMB J M, TERESHATOV E E, ZANTE G, et al. Hydrophobic amine-based binary mixtures of active pharmaceutical and food grade ingredients: characterization and application in indium extraction from aqueous hydrochloric acid media[J].
Green Chemistry, 2020, 22(20): 7047–7058. DOI: 10.1039/D0GC02452J. |
| [22] |
CUNHA S C, FERNANDES J O. Extraction techniques with deep eutectic solvents[J].
TrAC Trends in Analytical Chemistry, 2018, 105: 225–239. DOI: 10.1016/j.trac.2018.05.001. |
| [23] |
ESPINO M, DE LOS ÁNGELES FERNáNDEZ M, GOMEZ F J V, et al. Natural designer solvents for greening analytical chemistry[J].
TrAC Trends in Analytical Chemistry, 2016, 76: 126–136. DOI: 10.1016/j.trac.2015.11.006. |
| [24] |
HANADA T, GOTO M, ENGINEERING. Synergistic deep eutectic solvents for lithium extraction[J].
ACS Sustainable Chemistry & Engineering, 2021, 9(5): 2152–2160. |
| [25] |
PHELPS T E, BHAWAWET N, JURISSON S S, et al. Efficient and selective extraction of 99mTcO4-from aqueous media using hydrophobic deep eutectic solvents[J].
ACS Sustainable Chemistry & Engineering, 2018, 6(11): 13656–13661. |
| [26] |
FLORINDO C, ROMERO L, RINTOUL I, et al. From phase change materials to green solvents: hydrophobic low viscous fatty acid-based deep eutectic solvents[J].
ACS Sustainable Chemistry & Engineering, 2018, 6(3): 3888–3895. |
| [27] |
VAN OSCH D J G P, PARMENTIER D, DIETZ C H J T, et al. Removal of alkali and transition metal ions from water with hydrophobic deep eutectic solvents[J].
Chemical Communications, 2016, 52(80): 11987–11990. DOI: 10.1039/C6CC06105B. |
| [28] |
EL-DEEN A K, SHIMIZU K. A green air assisted-dispersive liquid-liquid microextraction based on solidification of a novel low viscous ternary deep eutectic solvent for the enrichment of endocrine disrupting compounds from water[J].
Journal of Chromatography A, 2020, 1629: 461498. DOI: 10.1016/j.chroma.2020.461498. |
| [29] |
JIANG W, JIA H, LI H, et al. Boric acid-based ternary deep eutectic solvent for extraction and oxidative desulfurization of diesel fuel[J].
Green Chemistry, 2019, 21(11): 3074–3080. DOI: 10.1039/C9GC01004A. |
| [30] |
OLA P D, MATSUMOTO M. Use of deep eutectic solvent as extractant for separation of Fe (Ⅲ) and Mn (Ⅱ) from aqueous solution[J].
Separation Science Technology, 2019, 54(5): 759–765. DOI: 10.1080/01496395.2018.1517796. |
| [31] |
RUGGERI S, POLETTI F, ZANARDI C, et al. Chemical and electrochemical properties of a hydrophobic deep eutectic solvent[J].
Electrochimica Acta, 2019, 295: 124–129. DOI: 10.1016/j.electacta.2018.10.086. |
| [32] |
SCHAEFFER N, CONCEIçãO J H F, MARTINS M A R, et al. Non-ionic hydrophobic eutectics-versatile solvents for tailored metal separation and valorisation[J].
Green Chemistry, 2020, 22(9): 2810–2820. DOI: 10.1039/D0GC00793E. |
| [33] |
GILMORE M, MCCOURT É N, CONNOLLY F, et al. Hydrophobic deep eutectic solvents incorporating trioctylphosphine oxide: advanced liquid extractants[J].
ACS Sustainable Chemistry & Engineering, 2018, 6(12): 17323–17332. |
| [34] |
NI S, SU J, ZHANG H, et al. A cleaner strategy for comprehensive recovery of waste SmCo magnets based on deep eutectic solvents[J].
Chemical Engineering Journal, 2021, 412: 128602. DOI: 10.1016/j.cej.2021.128602. |
| [35] |
陈倩文. 脂肪酸基绿色萃取剂在稀土和钍回收中的应用[D]. 赣州: 江西理工大学, 2020.
|
| [36] |
SCHAEFFER N, MARTINS M A R, NEVES C M S S, et al. Sustainable hydrophobic terpene-based eutectic solvents for the extraction and separation of metals[J].
Chemical Communications, 2018, 54(58): 8104–8107. DOI: 10.1039/C8CC04152K. |
| [37] |
ABRANCHES D O, MARTINS M A R, SILVA L P, et al. Phenolic hydrogen bond donors in the formation of non-ionic deep eutectic solvents: the quest for type V DES[J].
Chemical Communications, 2019, 55(69): 10253–10256. DOI: 10.1039/C9CC04846D. |
| [38] |
VAN OSCH D J G P, DIETZ C H J T, VAN SPRONSEN J, et al. A search for natural hydrophobic deep eutectic solvents based on natural components[J].
ACS Sustainable Chemistry & Engineering, 2019, 7(3): 2933–2942. |
| [39] |
GRIFFIN P J, COSBY T, HOLT A P, et al. Charge transport and structural dynamics in carboxylic-acid-based deep eutectic mixtures[J].
The Journal of Physical Chemistry B, 2014, 118(31): 9378–9385. DOI: 10.1021/jp503105g. |
| [40] |
SHI Y Y, XIONG D Z, ZHAO Y Y, et al. Highly efficient extraction/separation of Cr (VI) by a new family of hydrophobic deep eutectic solvents[J].
Chemosphere, 2020, 241: 125082. DOI: 10.1016/j.chemosphere.2019.125082. |
| [41] |
MARTINS M A R, CRESPO E A, PONTES P V A, et al. Tunable hydrophobic eutectic solvents based on terpenes and monocarboxylic acids[J].
ACS Sustainable Chemistry & Engineering, 2018, 6(7): 8836–8846. |
| [42] |
FAN C, LIU Y, SEBBAH T, et al. A theoretical study on terpene-based natural deep eutectic solvent: relationship between viscosity and hydrogen-bonding interactions[J].
Global Challenges, 2020: 2000103. |
| [43] |
STOJANOVIC A, MORGENBESSER C, KOGELNIG D, et al: Quaternary ammonium and phosphonium ionic liquids in chemical and environmental engineering[M]. Intech, 2011.
|
| [44] |
CHEN W, LI X, CHEN L, et al. Tailoring hydrophobic deep eutectic solvent for selective lithium recovery from the mother liquor of Li2CO3[J].
Chemical Engineering Journal, 2020: 127648. |
| [45] |
CUI L, CHENG F, ZHOU J. Behaviors and mechanism of iron extraction from chloride solutions using undiluted Cyphos I L 101[J].
Industrial Engineering Chemistry Research, 2015, 54(30): 7534–7542. DOI: 10.1021/acs.iecr.5b01546. |
| [46] |
LITAIEM Y, DHAHBI M. Measurements and correlations of viscosity, conductivity and density of an hydrophobic ionic liquid (Aliquat 336) mixtures with a non-associated dipolar aprotic solvent (DMC)[J].
Journal of Molecular Liquids, 2012, 169: 54–62. DOI: 10.1016/j.molliq.2012.02.019. |
| [47] |
BAL Y, BAL K, COTE G. Kinetics of the alkaline stripping of vanadium (V) previously extracted by Aliquat 336[J].
Minerals Engineering, 2002, 15(5): 377–379. DOI: 10.1016/S0892-6875(02)00044-4. |
| [48] |
ZHU Z, YOKO P, CHENG C Y. Recovery of cobalt and manganese from nickel laterite leach solutions containing chloride by solvent extraction using Cyphos I L 101[J].
Hydrometallurgy, 2017, 169: 213–218. DOI: 10.1016/j.hydromet.2017.02.002. |
| [49] |
WANG Y, HE Y, YIN S, et al. Research on extraction of zinc from spent pickling solution using Aliquat 336[J].
Hydrometallurgy, 2020, 193: 105322. DOI: 10.1016/j.hydromet.2020.105322. |
| [50] |
NAYL A, ALY H. Solvent extraction of V (V) and Cr (Ⅲ) from acidic leach liquors of ilmenite using Aliquat 336[J].
Transactions of Nonferrous Metals Society of China, 2015, 25(12): 4183–4191. DOI: 10.1016/S1003-6326(15)64021-3. |
| [51] |
NAYAK S, DEVI N. Studies on the solvent extraction of indium (Ⅲ) from aqueous chloride medium using Cyphos IL 104[J].
Materials Today: Proceedings, 2020, 30: 258–261. DOI: 10.1016/j.matpr.2020.01.380. |
| [52] |
范艳青, 蒋训雄, 汪胜东, 等. 富钴结壳浸出液中钴镍的N235萃取分离[J].
有色金属, 2006(3): 70–72.
|
| [53] |
陈子杨, 叶国华, 左琪, 等. 有机胺类萃取剂构效关系及其萃钒的研究进展[J].
钢铁钒钛, 2020, 41(3): 8–15.
|
| [54] |
刘葵, 成亚飞, 韦梦梅, 等. 用N235从盐酸溶液中萃取Fe~(3+)[J].
湿法冶金, 2020, 39(1): 41–45.
|
| [55] |
龙禹辰, 张贵清, 曾理, 等. N235/异辛醇体系从仲钨酸铵结晶母液中萃取钨的研究[J].
稀有金属与硬质合金, 2021, 49(1): 1–6.
|
| [56] |
罗洋, 刘松彬, 吴龙, 等. P507-N235无皂化体系负载钕有机相草酸直接沉淀工艺研究[J].
有色金属科学与工程, 2016, 7(5): 131–136.
|
| [57] |
杨幼明, 张胜其, 黄振华, 等. P507-N235载酸有机相分解稀土的试验研究[J].
有色金属科学与工程, 2016, 7(1): 114–118.
|
| [58] |
韩旗英, 李景芬, 白炜. 环烷酸分离提纯钇工艺技术优化[J].
材料研究与应用, 2010, 4(2): 137–141.
|
| [59] |
刘骏, 张磊, 代晓彬, 等. 环烷酸萃取分离混合氯化稀土溶液中的铝[J].
有色金属(冶炼部分), 2017(5): 41–43.
|
| [60] |
ROBINSON D, DONALD R, ZHANG W, et al. Developments in the hydrometallurgical processing of nickel laterites[J].
Proceedings of COM, 2017, 30(8): 66–69. |
| [61] |
马尚文, 底梦飞, 杨嵘晟, 等. 双脂肪酸憎水性低共熔溶剂的合成及富集水中铜离子的研究[J].
煤炭与化工, 2020, 43(6): 121–128.
|
| [62] |
RHO B J, SUN P P, CHO S Y. Recovery of neodymium and praseodymium from nitrate-based leachate of permanent magnet by solvent extraction with trioctylphosphine oxide[J].
Separation Purification Technology, 2020, 238: 116429. |
| [63] |
NEJAD H H, KAZEMEINI M. Optimization of platinum extraction by trioctylphosphine oxide in the presence of alkaline-metal salts[J].
Procedia Engineering, 2012, 42: 1302–1312. |
| [64] |
KOJIMA T. A study of the mechanism for the extraction of uranium, water, and nitric acid with trioctylphosphine oxide using a binary molten mixture of biphenyl and naphthalene as the solvent[J].
Bulletin of the Chemical Society of Japan, 1984, 57(1): 198–203. |
| [65] |
NAWAZ R, ALI K, ALI N, et al. Removal of chromium (VI) from industrial effluents through supported liquid membrane using trioctylphosphine oxide as a carrier[J].
Journal of the Brazilian Chemical Society, 2016, 27(1): 209–220. |
| [66] |
ZHANG L, LI L, SHI D, et al. Selective extraction of lithium from alkaline brine using HBTA-TOPO synergistic extraction system[J].
Separation Purification Technology, 2017, 188: 167–173. |
 2021, Vol. 12
2021, Vol. 12


