| 硫酸法处理高钛渣制取硫酸氧钛 |
硫酸氧钛作为一种中间产物应用广泛。硫酸氧钛在酸性溶液中溶解性较好,可用于制取钛白;与H2O2能很好络合形成过氧钛酸[1],从而制取超细钛材料;也可用于制取手术刀上的TiO2薄膜[2];制取光催化性能良好的TiO2[3-4];高效催化糠醛生产的催化剂[5];脱砷沉淀剂[6]等。但是目前除用钛精矿制备硫酸氧钛外,其他制备方法研究较少。中国高钛渣产量巨大[7-11],现有回收利用技术主要有硫酸浸出法[12-16]、盐酸浸出法[17-20]、碱熔盐法[21-22]、热还原法[23-25]。高钛渣主要用于生产钛白粉或钛合金,用于生产硫酸氧钛这种中间产物的研究较少。实验首先通过热力学数据计算,确定高钛渣转型成硫酸氧钛的可行性。然后以金红石型二氧化钛高钛渣为原料,采用硫酸法将高钛渣一步转型成硫酸氧钛,通过单因素实验确定较优的反应条件,为高钛渣的资源化利用提供一种新途径。
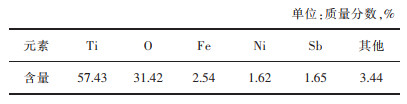
1 试验原料高钛渣取自阜新久星钛业公司;X射线荧光光谱(XRF)分析结果见表 1,X射线衍射(XRD)分析结果如图 1所示。结果表明:高钛渣中,Ti质量分数为57.43%,且含少量Cu,Fe,Ni,Sb等杂质;高钛渣中的钛以金红石型TiO2物相存在。
| 表 1 高钛渣的XRF分析结果 Table 1 XRF analysis results of high titanium slag |
 |
| 点击放大 |
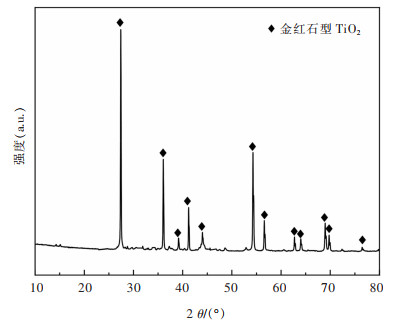 |
| 图 1 高钛残渣的XRD分析结果 Fig. 1 XRD analysis result of high titanium residue |
2 试验原理与方法
高钛渣中的二氧化钛与浓硫酸可能发生如下反应:
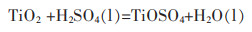
|
(1) |
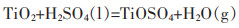
|
(2) |
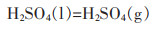
|
(3) |
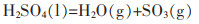
|
(4) |
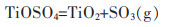
|
(5) |
不同条件下的热力学计算反应平衡质量如图 2所示。图 2(a)的初始反应投入量为1 mol TiO2和2 mol浓H2SO4。由图 2(a)看出:若反应温度低100 ℃,反应平衡时产物质量为1 mol TiOSO4、1 mol H2O(l)、1 mol H2SO4(l),表明该过程为1 mol TiO2与1 mol H2SO4(l)反应生成了1 mol TiOSO4、1 mol H2O(l),剩余1 mol H2SO4(l), 发生式(1)反应;若反应温度由100 ℃升到150 ℃,产物1 mol H2O(l)变成1 mol H2O(g),发生式(2)反应;若温度由300 ℃升到375 ℃,1 mol H2SO4(l)变成1 mol H2SO4(g),发生式(3)反应;若温度由375 ℃升到430 ℃,1 molH2SO4(g)变成1 mol SO3(g)和1 mol H2O(g),发生式(4)反应;当温度大于1 125 ℃,1 mol TiOSO4变成1 mol TiO2和1 mol SO3(g),发生式(5)反应。由此热力学计算得出:二氧化钛被浓硫酸转型成硫酸氧钛是可行的,但反应温度不宜高于375 ℃,以避免浓硫酸热分解生成SO3(g);同理,图 2(b)为恒温350 ℃,向1 mol TiO2中加入不同量H2SO4(l)热力学理论计算,结果表明TiO2与浓硫酸反应的理论物质的量比为1∶1。
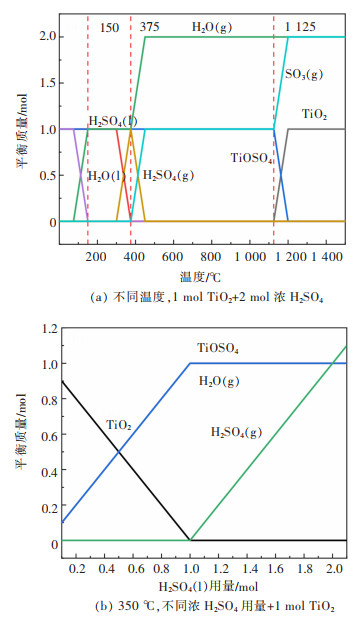 |
| 图 2 平衡反应 Fig. 2 Equilibrium reaction |
实验时,用量筒取一定体积浓硫酸(95%~98%)于100 mL烧杯中,将烧杯置于电磁炉的石棉网上开始加热,待浓硫酸加热到设定温度,并保温2 min后。向烧杯中投入5 g高钛渣后盖上表面皿,反应一段时间后,物料结块。将产物块破碎成粉末,取2 g加入到盛有50 mL稀硫酸(2 mol/L)的烧杯中,水浴加热溶解,然后用电感耦合等离子光谱发射(ICP)法测定浸出液中钛元素浓度,此测定的钛浓度为可溶性硫酸氧钛浓度。而产物中总钛量或产物中钛质量分数的测定方法为:取产物和硫酸铵各1 g,混合加入到盛有10 mL浓硫酸(95%~98%)的烧杯中后盖上表面皿,将烧杯置于电磁炉的石棉网上煮沸溶解。待溶液清晰可见,不存在粉末样品时,停止加热。待溶液自然冷却下来,用蒸馏水稀释定容于1 000 mL容量瓶中。后用ICP测定溶液中钛元素浓度,此钛元素浓度为产物中总钛浓度,便可算出产物中钛质量分数。因此,硫酸氧钛产率计算公式如下为:
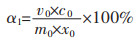
|
(6) |
式(6)中:α1为硫酸氧钛产率,%;v0为浸出液体积,L;c0为浸出液中钛质量浓度,g/L;m0为产物质量,g;x0为产物中钛质量分数,%。
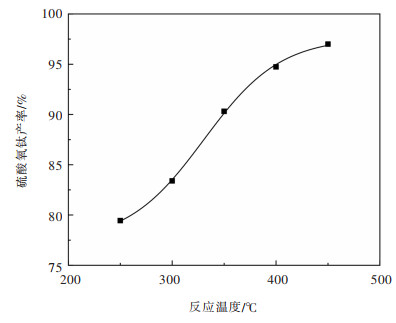
3 结果与讨论 3.1 反应温度对硫酸氧钛产率的影响固定液固体积质量比5∶1,反应时间120 min,研究反应温度对硫酸氧钛产率的影响,试验结果如图 3所示。
 |
| 图 3 反应温度对硫酸氧钛产率的影响 Fig. 3 The effect of reaction temperature on the yield of titanyl sulfate |
由图 3看出:反应温度对高钛渣转型成硫酸氧钛有显著影响。随着反应温度的增加,硫酸氧钛的产率也随之上升。一般认为,温度影响浓硫酸分子运动速度,进而影响其与高钛渣的有效碰撞次数。反应温度越高,有效碰撞次数越多,硫酸氧钛产率越高。但考虑到浓硫酸沸腾热解[26]行为。因此,反应温度选取350 ℃较为合适。
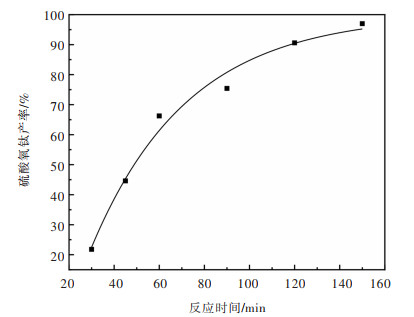
3.2 反应时间对硫酸氧钛产率的影响固定液固体积质量比5∶1,反应温度350 ℃,研究反应时间对硫酸氧钛产率的影响,试验结果如图 4所示。
 |
| 图 4 反应时间对硫酸氧钛产率的影响 Fig. 4 The effect of reaction time on the yield of titanyl sulfate |
由图 4得出:反应时间越长,硫酸氧钛产率越高,且反应时间对高钛渣转型成硫酸氧钛行为影响较大。时间从30 min增大到150 min时,硫酸氧钛产率从20%增加到95%。但考虑到生产效率问题,反应时间为150 min较为合理。
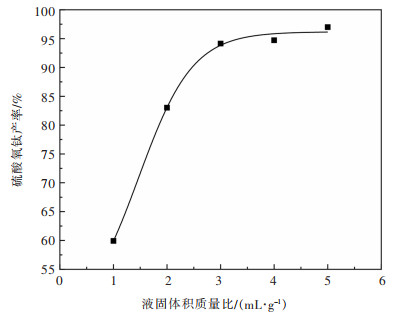
3.3 液固体积质量比对硫酸氧钛产率的影响固定反应温度350 ℃,反应时长150 min,研究液固体积质量比对硫酸氧钛产率的影响,试验结果如图 5所示。
 |
| 图 5 液固体积质量比对硫酸氧钛产率的影响 Fig. 5 The influence of liquid-solid product mass ratio on the yield of titanyl sulfate |
由图 5可发现:随着液固体积质量比增大,硫酸氧钛产率开始逐步升高。但液固体积质量比大于3∶1时,硫酸氧钛产率基本稳定在95%。可能的原因是高钛渣与浓硫酸之间形成硫酸氧钛介质层。当高钛渣被转型生成的硫酸氧钛介质层完全包裹时,后续再向体系中增加浓硫酸,硫酸氧钛产率仍然不变。因此,确定液固体积质量比为3∶1。
3.4 产物分析采用X射线衍射(XRD)对高钛渣与较优条件下产物进行对比分析,如图 6所示。结果表明:高钛渣中金红石型TiO2在较优条件试验下,成功转型成硫酸氧钛。且渣中原有的金红石型TiO2特征峰,在转型后基本消失,产物仅检测到强烈的TiOSO4特征峰。表明转型程度较高,生成的硫酸氧钛晶型良好。
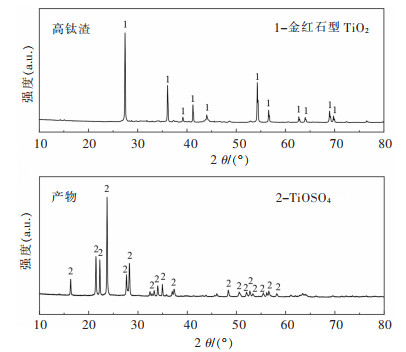 |
| 图 6 高钛渣与产物硫酸氧钛XRD对比 Fig. 6 XRD comparison of high titanium slag and product titanyl sulfate |
采用SEM对产物进行分析,结果如图 7所示。结果表明:产物硫酸氧钛外貌在图 7(a)、图 7(b)、图 7(c)低倍观测条件下,为团聚无特殊结构块状物,且表面凹凸不平,呈现多包隆起之势。而在图 7(d)高倍条件下观察,多包隆起为多层片状叠聚物。
 |
| 图 7 产物SEM Fig. 7 SEM of product |
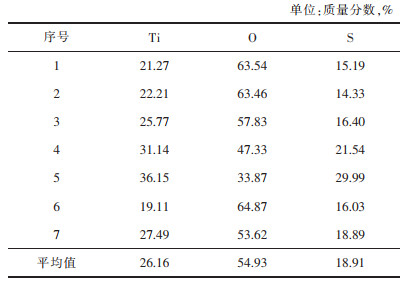
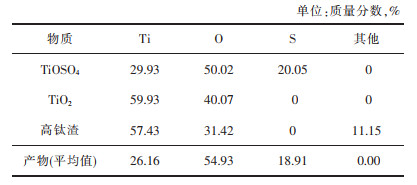
采用EDS对产物进行分析,取点为图 7中7个标记点,获得结果如表 2所列。并对比分析TiOSO4,TiO2,高钛渣,产物中Ti,O,S元素含量,结果如表 3所列。发现产物与TiOSO4中元素含量相近,却与高钛渣和TiO2差异较大。因此,产物XRD,EDS分析结果,证实金红石型TiO2高钛渣确实被浓硫酸转型成硫酸氧钛。
| 表 2 产物EDS分析结果 Table 2 Product EDS analysis results |
 |
| 点击放大 |
| 表 3 各物质元素质量分数对比 Table 3 Theoretical calculation and elemental mass fraction of titanium slag |
 |
| 点击放大 |
4 结论
以高钛渣为原料,采用硫酸法一步转型制备硫酸氧钛,通过热力学分析和单因素条件试验研究,得出以下结论:
1)热力学计算表明:金红石型TiO2高钛渣与浓硫酸反应生成硫酸氧钛是可行的。反应温度一般不高于375 ℃,以避免浓硫酸热分解生成SO3(g)而带来的不利影响。
2)高钛渣与浓硫酸反应的单因素条件试验结果得出:在温度350 ℃、时间150 min、液固体积质量比3∶1条件下,硫酸氧钛产率可达95%。
3)采用XRD、SEM-EDS对产物硫酸氧钛检测表明:产物TiOSO4晶型良好,为多层片状叠聚物。
| [1] |
王英杰, 蓝德均, 崔旭梅. 过氧钛酸的制备及其应用研究进展[J].
科技通报, 2017, 33(12): 9–14.
|
| [2] |
曹开斌. 过氧钛酸溶胶法制取TiO2薄膜及在手术刀上的应用[D]. 杭州: 浙江理工大学, 2010.
|
| [3] |
李爽, 张青红, 李耀刚. 过氧钛酸水热合成锐钛矿相二氧化钛纳米棒溶胶[J].
无机材料学报, 2009, 24(4): 675–679.
|
| [4] |
戈磊, 徐明霞, 方海波, 等. 过氧钛酸溶胶前驱体制取TiO2薄膜及其光催化性能[J].
硅酸盐学报, 2005, 49(3): 330–334.
|
| [5] |
喻贵良. 糠醛生产新的高效催化剂-硫酸氧钛[J].
生物质化学工程, 1984, 24(8): 256–259.
|
| [6] |
NIE H P, CAO C F, XU Z F, et al. Novel method to remove arsenic and prepare metal arsenic from copper electrolyte using titanium(IV) oxysulfate coprecipitation and carbothermal reduction[J].
Separation and Purification Technology, 2020, 231(1): 115919. |
| [7] |
蒙钧, 韩明堂. 高钛渣生产现状和今后发展的看法[J].
钛工业进展, 1998, 15(1): 3–5.
|
| [8] |
逯冉, 贾翃. 我国高钛渣生产技术现状及发展分析[J].
中国金属通报, 2014, 22(10): 43–45.
|
| [9] |
徐程浩, 刘代俊. 高炉渣制取高钛渣的新工艺研究[J].
四川化工, 2005, 12(5): 7–9.
|
| [10] |
马光强, 张云, 邹敏. 从攀钢高炉渣中提取分离TiO2制取高钛渣研究[J].
四川理工学院学报(自然科学版), 2007, 20(6): 95–97.
|
| [11] |
许莹, 李单单, 杨姗姗. 含钛高炉渣综合利用研究进展[J].
矿产综合利用, 2020, 41(6): 1–8.
|
| [12] |
杨娜, 王鸿雁. 硫酸法金红石型颜料生产钛白试验研究[J].
山东冶金, 2019, 41(5): 34–37.
|
| [13] |
王浩然, 张延玲, 安卓卿, 等. 攀钢含钛高炉渣湿法提钛工艺[J].
有色金属科学与工程, 2016, 7(3): 21–24.
|
| [14] |
魏绍东, 黄伟. 新型硫酸法钛白生产酸解工艺[J].
现代制造技术与装备, 2018, 54(9): 128–129.
|
| [15] |
曹波, 崔艳. 浅析硫酸法钛白粉清洁生产工艺[J].
当代化工研究, 2017, 17(6): 127–128.
|
| [16] |
NIE W L, WEN S M, FENG Q C, et al. Mechanism and kinetics study of sulfuric acid leaching of titanium from titanium-bearing electric furnace slag[J].
Journal of Materials Research and Technology, 2020, 9(2): 175–178. |
| [17] |
杨显猴, 唐勇, 周高明, 等. 盐酸浸出钛铁矿制人造金红石的技术研究[J].
四川冶金, 2020, 42(1): 25–28.
|
| [18] |
陈书锐, 杨绍利, 马兰. 盐酸浸出钛石膏试验研究[J].
无机盐工业, 2020, 52(2): 65–68.
|
| [19] |
邓科. 气液固三相流态化盐酸连续浸出钛精矿制取人造金红石的工艺研究[J].
氯碱工业, 2018, 54(10): 29–36.
|
| [20] |
唐勇, 邓科, 张定明. 盐酸法人造金红石生产技术[J].
氯碱工业, 2014, 50(6): 22–26.
|
| [21] |
刘建华. 碱熔盐法钛渣制备钛白清洁工艺中杂质分离的研究[D]. 北京: 中国科学院研究生院, 2011.
|
| [22] |
王强, 张庆武. 熔盐法处理富钛渣制取金红石型TiO2[J].
应用化工, 2008, 37(2): 140–141.
|
| [23] |
李慈颖, 李亚伟, 高运明. 高钛渣提取碳氮化钛的研究[J].
钢铁钒钛, 2006, 27(3): 5–9.
|
| [24] |
高启瑞, 宋波, 杨占兵, 等. 含钛高炉渣碳化及超重力分离碳化钛的研究[J].
有色金属科学与工程, 2017, 8(2): 1–7.
|
| [25] |
李江, 薛向欣, 姜涛, 等. 配料组成和氮气流量对高钛渣合成TiN/β'-sialon粉体的影响[J].
功能材料, 2008, 39(6): 1003–1007.
|
| [26] |
周玉琴, 高志正, 汪满清.
硫酸生产技术[M]. 北京: 冶金工业出版社, 2013: 9-15.
|
 2021, Vol. 12
2021, Vol. 12


