| 废轮胎热解炭黑灰渣中锌提取工艺 |
2. 遂川和创金属新材料有限公司, 江西 吉安 343900
2. Suichuan Hechuang Materials Co., Ltd., Ji'an 343900, Jiangxi, China
随着我国经济的快速发展, 工业化和城市化进程的加快, 环境污染和资源短缺问题日益显现, 工业和城市产生的大量固体废弃物, 对大气环境、水环境、土壤环境等造成了极严重的污染, 已对人类生存环境造成了极大的危害[1-2]。废轮胎作为一种典型的固体废物, 其产量相当可观。据美国橡胶制造商协会(RMA)统计, 全世界年产废轮胎量达到15亿条, 相当于1 700万t, 且仍以惊人的数字增长[3-6], 我国废轮胎的产生量己经由2006年的1.5亿条增长到2008年的1.9亿条, 仅次于美国, 为废轮胎第二大生产国[7], 由于废轮胎的处理非常复杂, 得以回收利用的仅约占15%~20%, 大量废旧轮胎的堆积, 存在较大的环境风险, 如何高效地处理废轮胎, 已成为目前亟待解决的一个环境问题。废轮胎在物理、化学和生物方面具有极强的耐受性, 是一种可资源化的高分子材料, 对废旧轮胎进行循环再生利用, 已引起世界各国的关注。废轮胎热解技术由于热解过程操作条件相对温和[8], 可产生大量的高品质燃料油, 同时, 能副产高热值热解气和热解炭黑, 并回收金属钢丝, 成为废轮胎资源化回收的有效手段之一, 热解技术不仅能消除废轮胎所带来的环境污染, 实现资源再生, 并且对缓解日趋紧张的能源问题具有重要意义[9-12]。
目前, 国内外对废轮胎热解炭黑的处理主要集中在热解炭黑的商用价值研究上[13-14], 然而, 很少有人关注从废轮胎热解炭黑中回收有价金属。由于在生产轮胎过程中, 会添加超过100多种不同的添加剂用以改善轮胎的性能, 其中含有大量的铁、铜、锌、钴等重金属元素[15], 这些重金属在废轮胎焚烧后的灰分中大量富集, 尤其作为硫化活性剂的ZnO含量较高, 据估计, 每年从废轮胎中回收的ZnO量可达7 000 t[16]。研究发现, 热解炭黑各金属含量中锌的含量最高, 且主要以ZnO和ZnS的形式存在, 表明热解炭黑中的灰分大多为轮胎在制备过程中添加的无机盐成分, 也说明了对其进行二次金属资源的提取是一项很有前景的研究[12-20]。
通常对于二次金属资源的提取, 主要有火法冶金和湿法冶金技术, 与火法冶金技术相比, 湿法冶金技术更为环保和经济, 被广泛地应用在废轮胎有价金属的回收[21]。Kinoshita等利用湿法冶金技术从废轮胎焚烧过程中产生的飞灰和底灰中选择性地提取锌, 飞灰中锌含量为45%, 经酸溶后过滤, 采用5种不同的萃取剂对滤液进行萃取, 萃取后利用去离子水反萃取, 最终发现利用三正辛胺(TOA)为萃取剂经萃取和反萃取之后, 锌的回收率达到67% [16]。Yamaguchi等利用聚氯乙烯和废轮胎焚烧后的飞灰进行热处理, 在200 ℃热处理温度下, 飞灰中的氧化锌会转变成水溶性的氯化锌, 采用水洗可以将90%的锌溶解, 而基本不含其他重金属元素, 与传统的酸溶方法相比, 具有更高的锌溶解性和选择性, 但过程并未对含锌溶液进一步处理[22]。Baba等利用HCl溶液在酸浓度8.06 mol/L、液固比10 L/g、80 ℃条件下对废轮胎灰进行酸溶处理, 之后通过调节滤液pH值至3.0除去Ag+、Sn2+、Mn2+等离子, 用电沉积法脱除Pb2+离子, 再用氨溶液调整pH值至3.5脱除Fe3+离子, 最终的滤液中主要含有Zn2+, 采用含CYANEX272 0.032 mol/L的煤油溶液进行萃取, Zn2+萃取率达到93.42%, 之后利用浓度0.1 mol/L的盐酸溶液进行反萃取, 反萃率达到92% [23]。
上述过程对锌的回收主要采用酸溶、萃取和反萃取等步骤, 过程相对复杂, 对萃取剂的选择较为严格, 过程中会消耗大量酸和萃取剂。由此, 本文在酸溶基础上, 利用分步沉淀法对回收锌元素进行相关研究。利用煤油对废轮胎浸渍预处理, 热解后得到比表面积和孔隙率更高的热解炭黑[12, 14, 24-25], 有利于后续的灰渣脱灰过程。灰渣脱灰分别采用HCl、HNO3、H2SO4及醋酸进行浸出, 得出HCl溶液具有较好的浸出效果, 在此基础上, 采用单因素实验, 分别考察了酸浓度、液固比(炭黑质量/酸体积)、浸出时间、酸解温度等因素对锌离子浸出效果的影响, 从能耗和环保的角度找出较佳的操作条件, 并对此条件下的滤液采用分步沉淀法以氧化锌的形式回收锌元素。该方法工艺较为简单, 操作条件更加温和, 为废轮胎中锌资源的回收提供了一种新的思路。
1 实验部分 1.1 实验样品及试剂废轮胎由上海金匙环保科技有限公司提供。灰渣的制备包括以下过程:废轮胎经煤油溶胀预处理后, 在600 ℃进行常压热解, 热解气经碱液吸收脱除H2S等组分后直接外排; 焦油经冷凝气液分离后收集待检测; 热解后炭黑取出粉碎碾磨至55 μm以下, 在马弗炉中850 ℃煅烧下约12 h后生成灰渣, 待冷却后灰渣放入干燥器中备用。
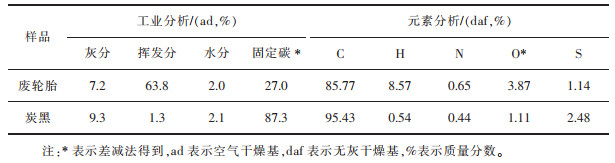
将研磨处理的热解炭黑, 按照GB/T 3780.10-2009灰分测定方法, 对试样进行灰分测定, 得到炭黑中灰分含量为9.3%, 利用X射线荧光光谱分析(XRF)对灰分进行定性定量分析, 发现灰分中各元素质量分数为:锌(Zn)40.04%、铁(Fe)5.75%、钙(Ca)3.29%、铝(Al)0.26%、镁(Mg)0.23%、钴(Co)0.08%、铜(Cu)0.06%等。废轮胎和热解后炭黑元素分析和工业分析列于表 1, 热解后炭黑中固定碳含量和灰分含量增加, 挥发分显著降低, 通过元素分析可知, 碳含量增加, 而氢含量减少。
| 表 1 废轮胎和炭黑工业分析和元素分析 Table 1 Proximate and ultimate analyses of scrap tire and carbon black |
 |
| 点击放大 |
实验过程所用试剂详列于表 2中, 其中, 无机酸分别为HCl、HNO3、H2SO4及醋酸, 乙二胺四乙酸二钠(EDTA)、二甲基酚橙和氟化钾等用于氧化锌含量的测定。
| 表 2 实验试剂一览表 Table 2 Experimental reagents |
 |
| 点击放大 |
1.2 实验仪器
本实验所使用的仪器如表 3所示, 分光光度计用于测定锌离子浓度, ICP用于测定滤液中各离子浓度, XRF测定灰渣中无机矿物质含量, 马弗炉用于煅烧炭黑制备灰渣及沉淀物制备氧化锌, pH计用于测定试验过程中溶液的酸度值。
| 表 3 实验仪器一览表 Table 3 Experimental equipments |
 |
| 点击放大 |
1.3 实验工艺
废轮胎灰渣中提取锌的工艺流程图如图 1所示, 准确称取10 g炭黑经煅烧后产出灰渣, 灰渣在一定的操作条件下进行酸溶, 酸溶后残渣经过滤后测定剩余量, 滤液经分光光度法测定锌离子浓度, 最后将滤液利用分步沉淀法制备氧化锌。
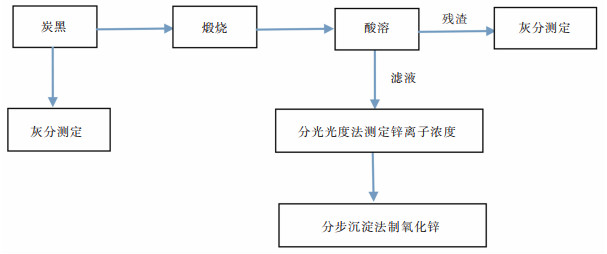 |
| 图 1 灰渣中锌提取工艺流程 Fig. 1 Extraction process of zinc from the ash |
1.3.1 标准曲线的测定
为建立锌离子的测定标准工作曲线, 采用分光光度法进行实验, 将配制好的不同浓度的氯化锌溶液进行标定, 得到标注工作曲线作图 2所示。
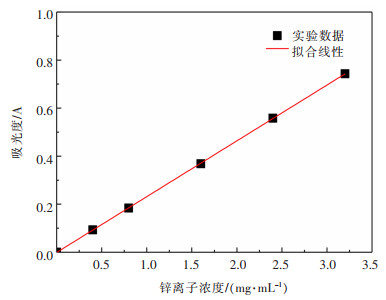 |
| 图 2 锌离子浓度标准曲线 Fig. 2 Standard curve of zinc ion concentration |
从直线中得到一数据公式:A=0.232c, 其中A为吸光度, c为锌离子溶度(mg/mL), 相关系数R2达到0.999。如要测定锌离子含量时, 对待测溶液进行吸光度的测定, 得到待测溶液的吸光度后, 代入所得的公式, 即可计算出待测溶液中锌离子的浓度。
1.3.2 实验方法1) 浸出剂比选
根据对废轮胎成分的分析, 灰渣中的锌部分以硫化物的形式存在, 硫化锌不易溶于碱, 故在实验中选取酸作为酸解试剂。酸解常用的试剂为无机酸, 包括盐酸、硝酸、硫酸、醋酸和氢氟酸等。氢氟酸根据《危险化学品安全管理条例》受公安部门管制。且氢氟酸易挥发不易保存, 对常规实验用玻璃仪器具有较强的腐蚀性。考虑到以上因素, 本论文在进行的实验没有采用氢氟酸。
在20 ℃下, 分别以盐酸、硝酸、硫酸和醋酸作为浸出剂, 对灰渣进行酸解, 在试剂浓度1 mol/L、酸解时间60 min、液固比6:1(液体体积/炭黑质量, mL/g)的实验条件下, 考查在相同实验条件下不同试剂对对锌离子的浸出浓度以及灰分的酸解率。
实验步骤如下:将10 g炭黑煅烧后, 将灰渣倒入150 mL烧杯中, 按照6:1的液固比分别加入60 mL浓度为1 mol/L的HCl、HNO3、H2SO4及醋酸, 将转子放入烧杯中后置于磁力搅拌器上调整转速, 浸渍60 min后, 用真空泵抽滤, 并用60 mL蒸馏水进行洗涤, 收集滤液, 并贴好标签。按照灰分测定的方法对剩余灰分进行测定, 初步判定最佳酸对灰分的酸解效果。并分别对滤液用分光光度法测量其吸光度, 计算出其中Zn2+的含量, 进一步确认浸出锌离子效果最佳的酸。
2) 单因素实验
通过比选得出以盐酸为酸溶试剂的基础上, 考察了酸浓度、液固比、酸解时间、酸解温度等因素对酸解灰分效果及锌离子浸出量的影响, 得出各因素对酸解灰分效果及锌离子的浸出量的影响规律。
锌离子浸出量的计算方法如下:
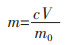
|
(1) |
式中:m为锌离子浸出量, kg/t(炭黑);
c为锌离子浸出浓度, mg/mL;
V为滤液体积, mL;
m0为炭黑起始质量10 g。
3) 氧化锌的提取
a.将单因素实验最佳条件下所得滤液用ICP进行检测, 得到滤液中各金属离子的含量, 计算各金属离子沉淀的pH值。
b.配置NaOH溶液:称取20 g NaOH粉末, 加蒸馏水溶解后, 移入500 mL容量瓶中, 配置成1 mol/L的NaOH溶液。
c.用500 mL烧杯取100 mL滤液, 校准pH计, 将pH计探头置于烧杯溶液中, 滴加1mol/L NaOH溶液调节滤液pH至6.7, 使杂质金属离子沉淀后, 将含有絮凝状的浑浊溶液进行抽滤。
d.对抽滤后的滤液再次用pH计调节pH至8.02, 使Zn2+沉淀后, 将含有絮凝状的Zn(OH)2溶液进行抽滤。
e.初步鉴定:将含有絮凝状的Zn(OH)2溶液进行抽滤, 将得到白色膏状物质。取少量白色膏状物质放入烧杯中, 滴加1 mol/L HCl溶液, 观察现象后, 再滴加1 mol/L NaOH至pH值为7.5, 观察现象, 最后调整pH至11, 观察现象。
f.将白色膏状物质放入烘箱中烘干, 将得到的烘干物质进行称量, 取一坩埚称量其质量后, 将烘干物质倒入坩埚中, 再次称量质量, 放入马弗炉中, 在150 ℃下煅烧60 min, 温度降低后, 再次称量坩埚和成品质量。
g.氧化锌含量的测定:根据国标HG/T 2572-2006中的工业活性氧化锌含量的测定方法, 称取0.120 g试样, 置于250 mL锥形瓶中, 加10 mL盐酸溶液, 加热试样至全部溶解, 冷却后加50 mL蒸馏水、5 mL氟化钾溶液、5滴二甲基酚橙指示剂, 摇匀, 用氨水调节至试剂溶液恰好成红色, 加10 mL硫脲饱和溶液、20 mL乙酸-乙酸钠缓冲溶液、4 g碘化钾, 摇匀。用EDTA标准滴定溶液(浓度为0.05 mol/L)滴定至溶液呈黄色即为终点, 记录消耗的EDTA体积。
氧化锌含量以氧化锌(ZnO)的质量分数ω计, 数值以%表示, 按如下公式计算:
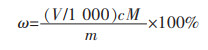
|
(2) |
式中:
V为滴定所消耗的EDTA溶液体积, mL;
c为EDTA溶液溶度, mol/L;
m为试样质量数值, g;
M为氧化锌的摩尔质量数值, g/mol(M=81)。
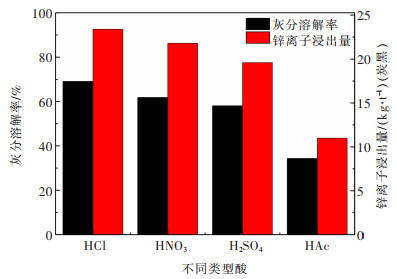
2 实验结果与讨论 2.1 浸出剂的比选采用盐酸、硝酸、硫酸和醋酸为酸溶试剂, 在20 ℃、酸浓度1 mol/L、酸解时间60 min和液固比6:1的实验条件下, 对灰渣进行酸溶处理, 测定滤液中锌离子的浓度及灰渣的灰分残余量的变化, 实验结果如图 3所示。
 |
| 图 3 不同类型酸对灰渣酸溶效果 Fig. 3 Effect of different kinds of acids on acid dissolution of ash |
对实验过程现象进行观察, 发现不论采用何种试剂, 酸解后滤液为淡黄色, 且颜色的深浅依次为盐酸 > 硝酸 > 硫酸 > 醋酸, 醋酸酸洗后滤液的颜色接近为无色。除此以外, 由于灰分中含有硫元素, 采用盐酸和硫酸酸洗时, 有强烈的臭鸡蛋气味, 即有H2S气体放出; 硝酸酸洗时, 没有明显的臭鸡蛋气味, 表明没有明显的H2S气体排出, 主要是由于硝酸具有较强的氧化性能, 将H2S氧化为SO42-离子, 防止H2S气体的排出; 醋酸酸洗时, 由于醋酸本身具有强烈的刺激性气味, 强烈的酸味无法分辨出是否有臭鸡蛋气味出现。
对实验结果进行分析, 从图 3中发现灰分溶解率和锌离子浸出量的变化趋势皆为盐酸 > 硝酸 > 硫酸 > 醋酸, 盐酸浸出的锌离子的量为23.4 kg/t(炭黑)、对应锌离子浸出率为62.8%, 硝酸浸出的锌离子的量为21.8 kg/t(炭黑)、对应锌离子浸出率为58.5%, 硫酸浸出的锌离子的量为19.6 kg/t(炭黑)、对应锌离子浸出率为52.65%, 醋酸浸出的锌离子的量为11.0 kg/t(炭黑)、对应锌离子浸出率为29.5%;对应的灰分溶解率分别为69.06%, 61.78%, 58.03%和34.26%。由于醋酸酸性最弱, 对灰分和锌离子溶解能力最低; 而盐酸、硝酸和硫酸酸解效果的不同, 主要是由于分子尺寸不同引起的, 在酸解过程随着矿物质的溶解, 会形成大量的微孔和介孔, 由于盐酸分子尺寸相对较小, 产生的扩散阻力相对较低, 而硝酸和硫酸由于分子尺寸较大导致扩散阻力较大, 影响酸解效果, 尤其硫酸酸解过程, 扩散影响更甚。
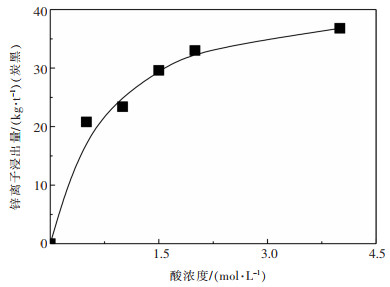
2.2 单因素实验 2.2.1 酸浓度的影响实验在20℃、酸解时间60 min和液固比6:1的实验条件下, 分别考察了不同盐酸浓度0.5, 1, 1.5, 2 mol/L和4 mol/L对灰渣脱灰效果的影响, 测定滤液中锌离子的浓度变化规律, 实验结果如图 4所示。
 |
| 图 4 不同酸溶度对灰渣酸溶效果 Fig. 4 Effect of acid concentrations on acid dissolution of ash |
从图 4中可以看出, 随着盐酸浓度的增加, 灰渣酸解后浸出的锌离子量也随之升高, 当浓度达到2 mol/L时, 浸出锌离子量达到33.0 kg/t(炭黑), 继续增加浓度, 锌离子增加量有所减缓。从动力学角度分析, 酸浓度升高, 反应速率增加; 同时, 反应物量增加, 有助于反应向正反应进行, 使浸出的锌离子量更多。另一方面, 浓度的增加, 扩散推动力增加, 有利于提升扩散速率。由此, 可知酸浓度的增加, 浸出锌离子的量也会增加, 但随着反应的进行, 反应逐渐达到完全, 因此, 当浓度增加到2 mol/L后, 浸出锌离子量逐渐趋近于平衡。
2.2.2 液固比的影响实验在20 ℃、盐酸浓度为2 mol/L和酸解时间60 min操作条件下, 考察了不同液固比4:1, 6:1, 8:1和10:1对灰渣中锌离子浸出效果的影响, 实验结果如图 5所示。
 |
| 图 5 不同液固比对灰渣酸溶效果 Fig. 5 Effect of ratios of solid to liquid on acid dissolution of ash |
从图 5中可以看出, 随着液固比的增加, 酸解后浸出的锌离子量逐渐升高。当液固比4:1升高至6:1时, 浸出锌离子增加量较为明显, 浸出锌离子量由13.2 kg/t(炭黑)增至33.0 kg/t(炭黑), 即锌离子浸出率由35.4%增至88.6%。继续增大液固比, 浸出锌离子量增加趋势相对较为平缓, 液固比从6:1升高到10:1时, 浸出锌离子量仅由33.0 kg/t(炭黑)增至36.6 kg/t(炭黑), 锌离子浸出率只增加10%左右。由此可以看出, 液固比超过6:1时, 对浸出锌离子量影响不大, 综合考虑锌离子的浸出效果和酸试剂用量经济性这两个因素, 选择液固比6:1进行后续实验。
2.2.3 浸出时间的影响实验在20 ℃、酸浓度2 mol/L、液固比6:1时, 考察了不同酸溶时间30, 60, 90, 120 min和150 min对锌离子浸出效果的影响, 实验结果如图 6所示。
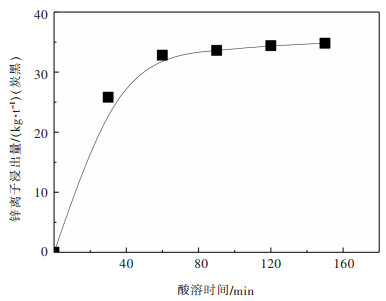 |
| 图 6 不同酸溶时间对灰渣酸溶效果 Fig. 6 Effect of reaction times on acid dissolution of ash |
从图 6可知, 随着酸溶时间的增加, 酸解浸出的锌离子量也随之增加, 当酸溶时间达到60 min时, 反应基本达到平衡, 随着酸溶时间进一步的延长, 浸出锌离子增量基本维持不变。在酸溶过程中, 随着反应时间的增加, 灰渣表面的矿物质逐渐被消耗, 当时间达到60 min时, 表面矿物质基本被消耗殆尽, 再增加反应时间对酸溶效果的影响将不再明显。
2.2.4 酸溶温度的影响实验在酸浓度2 mol/L、液固比6:1、酸溶时间60 min条件下, 考察不同温度20, 40, 60 ℃和80 ℃对锌离子浸出效果的影响, 实验结果如图 7所示。
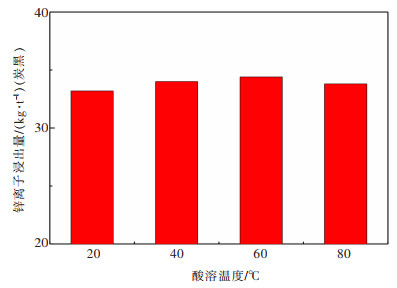 |
| 图 7 不同酸溶温度对灰渣酸溶效果 Fig. 7 Effect of reaction temperatures on acid dissolution of ash |
从图 7可知, 随着酸解浸出温度的增加, 酸解浸出锌离子量呈现先增加后减少的趋势, 在60 ℃时达到最大值约为33.4 kg/t(炭黑)。酸溶温度由20 ℃升高至60 ℃时, 酸解浸出的锌离子量逐渐增加, 主要是由于温度升高, 反应速率会随之增加, 同时, 可以提高反应物离子的扩散速率增加, 扩散阻力降低。继续升高酸溶温度至80 ℃, 盐酸会发生挥发现象[23], 导致浓度有所降低, 因此, 浸出锌离子量反而减少, 从总体趋势来说, 温度对锌离子的浸出效果影响不显著。从节能的角度出发, 常温下进行酸解即可。综合上述研究, 根据单因素实验, 较为合理的操作条件为20 ℃、酸浓度2 mol/L、液固比6:1、酸溶时间60 min, 该条件下锌浸出率达到91.4%左右, 锌离子浸出量约为34.0 kg/t(炭黑)。
2.3 氧化锌的提取 2.3.1 滤液中各金属离子沉淀pH值确定实验过程中在20 ℃、酸溶度2.0 mol/L、液固比6:1和酸解时间60 min下, 所得的滤液用ICP进行测定测得滤液中各金属离子的含量, 结果列于表 4, 根据结果可以看出, 滤液中除Zn2+外, 还含有Ca2+、Al3+、Fe3+和Mg2+等, 其中Zn2+浓度过高无法用ICP测定得到结果, 其浓度由分光光度法测定得到, 浓度值为2.83×103 mg/L。
| 表 4 ICP测得各金属离子的含量 Table 4 The content of metal ions measured by ICP |
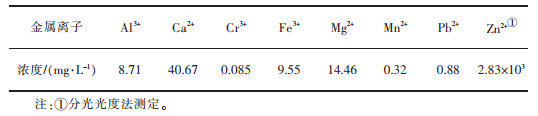 |
| 点击放大 |
对所得的数据进行计算处理, 根据各重金属离子溶度积常数, 计算其沉淀pH值, 得到溶液中主要存在的金属离子开始沉淀的pH值和完全沉淀的pH值, 如表 5所列。
| 表 5 溶液中主要存在的金属离子沉淀pH值 Table 5 The precipitation pH of the main metal ion in solution |
 |
| 点击放大 |
从表 5中可知, 可以通过调节pH值使各金属离子生成沉淀而进行分离, 由于Zn2+含量最高, 对于其分离回收具有重大的经济价值。根据计算结果, 可以通过两步沉淀法实现溶液中锌离子的有效分离和回收。首先将pH值控制在6.7, 此时, Al3+、Cr3+、Fe3+、Pb2+会生成絮状沉淀而分离, 对应的Zn2+基本不会发生沉淀现象, 留在溶液当中, 由于沉淀量较少, 且含有各种金属离子, 纯度不高, 因此, 对该部分沉淀没有进一步深入分析; 为了回收锌, 进一步将滤液pH值控制在8.02, 此时Zn2+基本沉淀完全, 且以Zn(OH)2的形式生成絮状沉淀, 经过滤后得到白色膏状Zn(OH)2, 实现锌的有效回收。
2.3.2 Zn(OH)2进行初步鉴定实验所得到的白色膏状Zn(OH)2进行初步鉴定实验。取少量白色膏状物, 滴加1 mol/L HCl溶液后调节pH至5, Zn(OH)2全部溶解, 再滴加1 mol/L NaOH至pH为7.5, 又出现白色絮状沉淀, 最后调整pH至10, 白色絮状沉淀全部溶解, 溶液变澄清。另取实验所得白色沉淀经干燥煅烧后, 称重质量达0.32 g。
2.3.3 氧化锌的含量的测定在氧化锌的含量(ω)检测过程中, 共消耗EDTA溶液29.09 mL, 经计算得到:
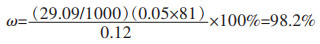
|
故实验制得的氧化锌含量为98.2%, 分析原因, 可能是由于制得的氧化锌量不是很多, 实验过程中即使是看作完全沉淀, 可是依然会有少量的金属离子残留在其中, 如Al3+、Cr3+、Fe3+、Pb2+等杂质离子, 会随着锌离子沉淀, 从而导致制得的氧化锌纯度没有达到100%。经核算, 锌离子沉淀率(η):
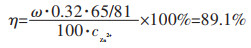
|
有锌离子沉淀率和浸出率, 通过计算可以得到锌的最终收率, 其值约为81.4%。
3 结论1) 4种不同酸对灰渣酸解效果以及锌离子浸出效果依次为:盐酸 > 硝酸 > 硫酸 > 醋酸。
2) 盐酸为酸溶试剂, 进行单因素实验。在对酸溶温度、酸浓度、浸出时间和液固比的考察中, 得到较佳的操作条件为酸浓度2 mo1/L、温度20 ℃、浸出时间60 min和液固比6:1, 该条件下Zn2+的浸出率达到91.4%左右。
3) 根据分步沉淀法得到氧化锌产品, 其产品中氧化锌含量为98.2%, 锌离子最终收率约为81.4%。
| [1] |
张政法, 李娜, 刁博文, 等. 我国再生资源回收利用现状研究[J].
现代商贸工业, 2016, 37(32): 66–67.
|
| [2] |
ERIKSSON O, BISAILLON M, HARALDSSON M, et al. Integrated waste management as a mean to promote renewable energy[J].
Renewable Energy, 2014, 61: 38–42. DOI: 10.1016/j.renene.2012.04.024. |
| [3] |
杨广巍. 我国废轮胎循环利用现状研究[J].
中国轮胎资源综合利用, 2018(1): 43–47.
|
| [4] |
PARTHASARATHY P, CHOI H S, PARK H C, et al. Influence of process conditions on product yield of waste tyre pyrolysis-A review[J].
Korean Journal of Chemical Engineering, 2016, 33(8): 2268–2286. DOI: 10.1007/s11814-016-0126-2. |
| [5] |
WANG W C, BAI C J, LIN C T, et al. Alternative fuel produced from thermal pyrolysis of waste tires and its use in a di diesel engine[J].
Applied Thermal Engineering, 2016, 93: 330–338. DOI: 10.1016/j.applthermaleng.2015.09.056. |
| [6] |
ZHANG L, ZHOU B, DUAN P G, et al. Hydrothermal conversion of scrap tire to liquid fuel[J].
Chemical Engineering Journal, 2016, 285: 157–163. DOI: 10.1016/j.cej.2015.10.001. |
| [7] |
任志伟, 孔安, 高全胜. 我国废旧轮胎的回收利用现状及前景展望和利用[J].
中国资源综合利用, 2009, 27(6): 12–14.
|
| [8] |
SIPRA A T, GAO N B, SARWAR H. Municipal solid waste (MSW) pyrolysis for bio-fuel production: a review of effects of MSW components and catalysts[J].
Fuel Processing Technology, 2018, 175: 131–147. DOI: 10.1016/j.fuproc.2018.02.012. |
| [9] |
MARTÍNEZ J D, VESES A, MASTRAL A M, et al. Co-pyrolysis of biomass with waste tyres: upgrading of liquid bio-fuel[J].
Fuel Processing Technology, 2014, 119: 263–271. DOI: 10.1016/j.fuproc.2013.11.015. |
| [10] |
KUMAR SINGH R, RUJ B, JANA A, et al. Pyrolysis of three different categories of automotive tyre wastes: product yield analysis and characterization[J].
Journal of Analytical and Applied Pyrolysis, 2018, 135: 379–389. DOI: 10.1016/j.jaap.2018.08.011. |
| [11] |
ZHANG X, LI H X, CAO Q, et al. Upgrading pyrolytic residue from waste tires to commercial carbon black[J].
Waste Management & Research, 2018, 36(5): 436–444. |
| [12] |
OUYANG S B, XIONG D L, LI Y, et al. Pyrolysis of scrap tyres pretreated by waste coal tar[J].
Carbon Resources Conversion, 2018, 1(3): 218–227. DOI: 10.1016/j.crcon.2018.07.003. |
| [13] |
SALEH T A, GUPTA V K. Processing methods, characteristics and adsorption behavior of tire derived carbons: a review[J].
Advances in Colloid and Interface Science, 2014, 211: 93–101. DOI: 10.1016/j.cis.2014.06.006. |
| [14] |
OUYANG S B, XIONG D L, XIE Y M, et al. Thermogravimetric kinetic analysis and demineralization of chars from pyrolysis of scrap tire pretreated by waste coal tar[J].
Energy Sources, Part A: Recovery, Utilization, and Environmental Effects, 2019: 1–17. |
| [15] |
UZUN B B, YAMAN E. Thermogravimetric characteristics and kinetics of scrap tyre and Juglans regia shell co-pyrolysis[J].
Waste Management & Research, 2014, 32(10): 961–970. |
| [16] |
KINOSHITA T, YAMAGUCHI K, AKITA S, et al. Hydrometallurgical recovery of zinc from ashes of automobile tire wastes[J].
Chemosphere, 2005, 59(8): 1105–1111. DOI: 10.1016/j.chemosphere.2004.12.015. |
| [17] |
MOULIN L, DA SILVA S, BOUNACEUR A, et al. Assessment of recovered carbon black obtained by waste tires steam water thermolysis: an industrial application[J].
Waste and Biomass Valorization, 2017, 8(8): 2757–2770. DOI: 10.1007/s12649-016-9822-8. |
| [18] |
HELLEUR R, POPOVIC N, IKURA M, et al. Characterization and potential applications of pyrolytic char from ablative pyrolysis of used tires[J].
Journal of Analytical and Applied Pyrolysis, 2001, 58/59: 813–824. DOI: 10.1016/S0165-2370(00)00207-2. |
| [19] |
ROY C, CHAALA A, DARMSTADT H. Vacuum pyrolysis of used tires end-uses for oil and carbon black products[J].
Journal of Analytical and Applied Pyrolysis, 1999, 51(1): 201–221. |
| [20] |
王梦雅.废轮胎胎面和胎侧热解碳特性探究[D].大连: 大连理工大学, 2018.
|
| [21] |
BABA A A, ADEKOLA A F, BALE R B. Development of a combined pyro-and hydro-metallurgical route to treat spent zinc-carbon batteries[J].
Journal of Hazardous Materials, 2009, 171(1/2/3): 838–844. |
| [22] |
YAMAGUCHI K, KINOSHITA T, AKITA S. Thermal treatment of waste tire fly ash with polyvinyl chloride: selective leaching of zinc with water[J].
Industrial & Engineering Chemistry Research, 2006, 45(3): 1211–1216. |
| [23] |
BABA A A, ADEKOLA F A. Dissolution kinetics and Zinc(Ⅱ) recovery from spent automobile tyres by solvent extraction with Cyanex 272[J].
World Review of Science, Technology and Sustainable Development, 2011, 8(2/3/4): 182. DOI: 10.1504/WRSTSD.2011.044215. |
| [24] |
陈文飞, 欧阳少波, 兰嫒, 等. 废轮胎溶胀特性及其半焦热重分析实验[J].
有色金属科学与工程, 2018, 9(6): 31–37.
|
| [25] |
刘兵权, 毛胜强, 欧阳任萍, 等. 两种不同类型废轮胎热分解特性及其溶胀性能[J].
有色金属科学与工程, 2020, 11(2): 51–58.
|
 2020, Vol. 11
2020, Vol. 11


