| 乙酸根配位浸出硫酸铅的热力学分析 |
2. 福建省长汀金龙稀土有限公司,福建 龙岩 366300
2. Fujian Changting Golden Dragon Rare-Earth Co., Ltd., Longyan 366300, Fujian, China
乙酸根与铅具有显著的配位作用,因而常用于处理含铅的物料,尤其是含硫酸铅的物料,将铅溶解浸出。在分析化学中,可利用硫酸铅沉淀富集铅而与其它元素分离,然后再利用乙酸-乙酸钠缓冲溶液溶解硫酸铅以进行下一步的滴定操作[1-5]。在处理铅酸蓄电池产出的废铅膏时,也可利用乙酸盐溶解其中的硫酸铅,已被研究过的乙酸盐包括乙酸铵、乙酸钠和乙酸钾[6-10]。另一方面,硫酸铅也是电解锰阳极泥中铅的主要物相,同样也可利用乙酸盐脱铅。与铅膏不同的是,电解锰阳极泥中的硫酸铅被各种形态的氧化锰包裹而难以直接浸出,需要进行预处理[11]。张宏波采用高温焙烧使其中二氧化锰转化为三氧化二锰从而打破原有致密结构,再研究了乙酸、乙酸钠和乙酸铵溶液对硫酸铅的浸出行为[12]。罗进波采用硫酸对电解锰阳极泥溶解洗涤后,再采用乙酸-乙酸钠来溶解酸洗不能脱除的硫酸铅[13]。此外,乙酸-乙酸钠溶液也可高效浸出以氧化铅和硫酸铅为主要物相的卡尔多炉炉渣[14];采用乙酸可浸出双氧水氧化方铅矿所得的硫酸铅[15]。上述研究均说明了乙酸根对硫酸铅的溶解作用,但是与该体系相关的理论研究开展的较早,限于当时的计算能力,热力学分析不够全面[16-18]。例如,硫酸铅溶解的优势物种是什么?pH值对铅溶解的影响规律如何?这些与工艺相关的理论问题缺少系统研究。因此,有必要对乙酸根配位浸出硫酸铅进行系统的热力学分析。
1 热力学数据的选取乙酸根配位浸出硫酸铅溶液体系涉及的沉淀和配合反应的种类较多,本文优先选取文献[19]提供的热力学数据。溶液体系可能发生的化学反应及其平衡关系式列于表 1。对于多元复杂溶液体系,目前缺少有效方式获取各离子的活度系数,因而,本文的计算均以浓度代替活度。
| 表 1 乙酸根配位浸出硫酸铅体系可能存在的化学反应及其平衡关系式(25 ℃) Table 1 Possible chemical reactions and equilibrium relationships in acetate coordination leaching of lead sulfate(25 ℃) |
 |
| 点击放大 |
2 Pb(OH)64-的存在对Pb(OH)2-H2O体系热力学计算结果的影响
有关Pb2+与OH-配位的数据,3种配合物Pb(OH)+、Pb(OH)2(aq)和Pb(OH)3-的形成常数在文献[19]和文献[20]中是一致的。不同之处,文献[20]没有列出Pb(OH)64-的形成常数。此外,文献[21]也只列出前3种配合物的形成常数。因此,有必要先通过Pb(OH)2-H2O体系的热力学分析来考查Pb(OH)64-存在与否对计算结果的影响,并评价该物种热力学数据的合理性。
对于Pb(OH)2-H2O体系,如果考虑Pb(OH)64-存在,各溶解物种浓度同时满足方程(3)、(7)~(11)、(14);如果不考虑Pb(OH)64-存在,则各溶解物种浓度同时满足方程(3)、(7)~(10)、(14)。根据上述平衡关系,可分别计算并绘制2种情形下Pb(OH)2-H2O体系各溶解物种的lgc-pH图,分别如图 1和图 2所示。由图 1可见,不考虑Pb(OH)64-的存在,随着pH值增加,Pb(OH)2的溶解度呈现先减小后增加的趋势,这与Pb(OH)2两性化合物的性质是一致的。而由图 2可见,考虑Pb(OH)64-存在的热力学计算结果表明,受Pb(OH)64-物种平衡浓度的影响,Pb(OH)2在水溶液中拥有非常大的溶解度,显然违背了Pb(OH)2的化学性质。因此,Pb(OH)64-形成常数的可靠性存疑,后续热力学计算不采用该项数据。
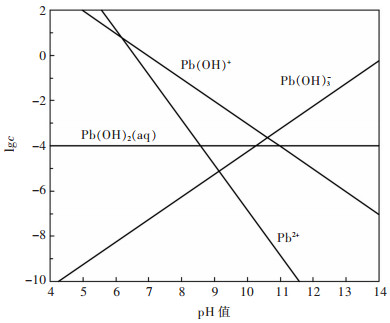 |
| 图 1 不考虑Pb(OH)64-存在时,Pb(OH)2-H2O体系各溶解物种的lgc-pH图(25 ℃) Fig. 1 lgc-pH diagram of dissolved species in Pb(OH)2-H2O system in the absence of Pb(OH)64-(25 ℃) |
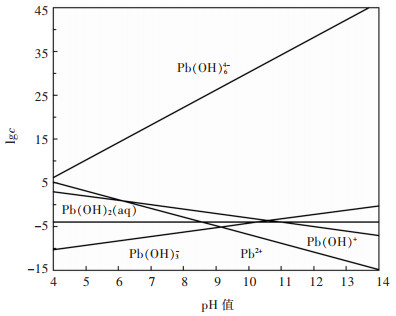 |
| 图 2 考虑Pb(OH)64-存在时,Pb(OH)2-H2O体系各溶解物种的lgc-pH图(25 ℃) Fig. 2 lgc-pH diagram of dissolved species in Pb(OH)2-H2O system in the presence of Pb(OH)64-(25 ℃) |
3 乙酸根配位浸出硫酸铅的热力学计算 3.1 广泛pH条件下浸出平衡的热力学计算
乙酸根配位浸出硫酸铅溶液体系溶解物种主要有:Pb2+、Pb(OH)+、Pb(OH)2(aq)、Pb(OH)3-、Pb(Ac)+、Pb(Ac)2(aq)、Pb(Ac)3-、Pb(Ac)42-、SO42-、HSO4-、Ac-、HAc、OH-和H+。硫酸铅浸出平衡后,当体系中固体只有硫酸铅而无其他沉淀生成时,进入溶液的铅和硫均由硫酸铅提供,溶液中总铅浓度[Pb]T和总硫浓度[S]T之比应等于硫酸铅中铅与硫的化学计量比,则有:
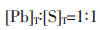
|
(15) |
根据同时平衡原理,此时,溶液中各溶解物种满足方程(1)、(4)~(10)、(12)~(15)。随着溶液pH值增加,硫酸铅可转变为氢氧化铅沉淀,且在发生转变的边界pH值,溶液中各溶解物种满足方程(1)、(3)~(10)、(12)~(15)。在硫酸铅与氢氧化铅的共存区,溶液中各溶解物种满足方程(1)、(3)~(10)、(12)~(14)。根据以上平衡关系,可以计算和绘制25 ℃总乙酸根浓度[Ac]T为1 mol/L时乙酸根配位浸出硫酸铅体系各溶解物种的lgc-pH图,如图 3。在此基础上,还可获得该条件时含铅物种和含乙酸根物种的分布分数与pH值的关系图,分别如图 4和图 5所示。如图 3所示,pH值大于10.0时,硫酸铅开始转化为氢氧化铅;而pH值小于10.0时,铅与乙酸根的配合物尤其Pb(Ac)的平衡浓度变化与游离乙酸根平衡浓度变化趋势一致,从而导致硫酸铅的溶解。参看图 4,1 mol/L总乙酸根浓度下,Pb(Ac)42-是溶解铅的主要物种。从图 5可以看出,在乙酸根配位浸出硫酸铅趋势较大的区间,pH值为6~10,Pb(Ac)42-和游离的Ac-是主要和次要物种,表明硫酸铅浸出平衡需要维持一定的Ac-浓度。
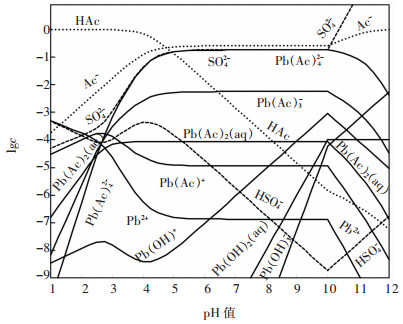 |
| 图 3 乙酸根配位浸出硫酸铅体系各溶解物种的lgc-pH图(25 ℃,[Ac]T=1 mol/L) Fig. 3 lgc-pH diagram of dissolved species in acetate coordination leaching of lead sulfate (25 ℃, [Ac]T=1 mol/L) |
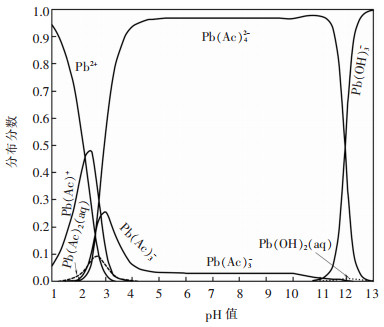 |
| 图 4 含铅物种分布分数与pH值的关系图(25 ℃,[Ac]T=1 mol/L) Fig. 4 Distribution fraction of lead-containing species versus pH values (25 ℃, [Ac]T=1 mol/L) |
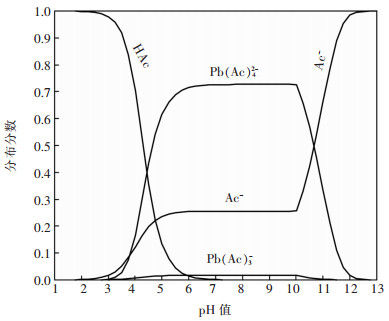 |
| 图 5 含乙酸根物种分布分数与pH值的关系图(25 ℃,[Ac]T=1 mol/L) Fig. 5 Distribution fraction of acetate-containing species versus pH values (25 ℃, [Ac]T=1 mol/L) |
改变总乙酸根浓度可以计算获得不同[Ac]T的lg[Pb]T-pH图,如图 6。由图 6可见,随着体系乙酸根含量增加,硫酸铅的溶解度明显增加,配位浸出产生lg[Pb]T平台的pH值范围也逐渐拓宽,表明乙酸根对硫酸铅浸出的热力学趋势显著。总体来看,在不同[Ac]T浓度下pH值6~9范围对乙酸根浸出硫酸铅是比较有利的。选择pH=8.5,进一步计算含乙酸根物种的分布分数与[Ac]T的关系图,如图 7。由图 7可见,[Ac]T大于0.192 mol/L以后,Pb(Ac)42-的浓度高于游离Ac-的浓度,并且二者浓度差逐渐扩大,表明浸出硫酸铅的乙酸根利用率随着[Ac]T增大而增大。
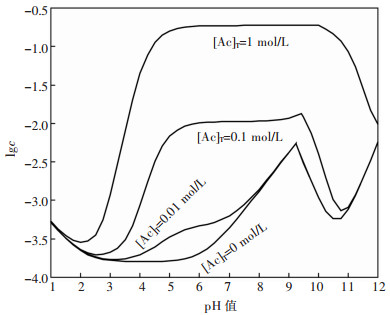 |
| 图 6 不同总乙酸根浓度下的lg[Pb]T-pH图(25 ℃) Fig. 6 lg[Pb]T-pH diagram at different total acetate concentration (25 ℃) |
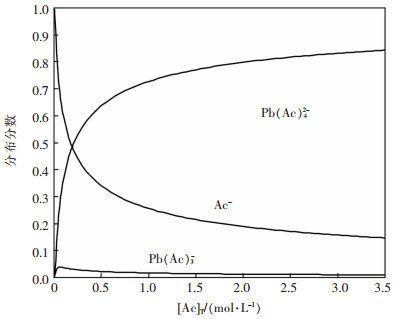 |
| 图 7 含乙酸根物种的分布分数与总乙酸根浓度的关系图(25 ℃) Fig. 7 Distribution fraction of acetate-containing species versus total acetate concentrations (25 ℃) |
3.2 HAc-NaAc混合溶液浸出硫酸铅的热力学计算
如果采用HAc和NaAc混合溶液浸出硫酸铅,平衡后的pH值仅在较小的区域内,且处于硫酸铅的单独稳定区。若浸出前HAc和NaAc按一定比例配制成初始液,根据电中性原则,溶液中各离子浓度满足以下方程:
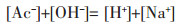
|
(16) |
方程(13)、(14)、(16)联立,可计算不同HAc和NaAc比例下初始液的pH值。当初始液与硫酸铅混合后,溶液各离子浓度仍然遵循电中性原则,因而要满足以下方程:
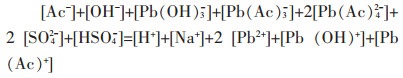
|
(17) |
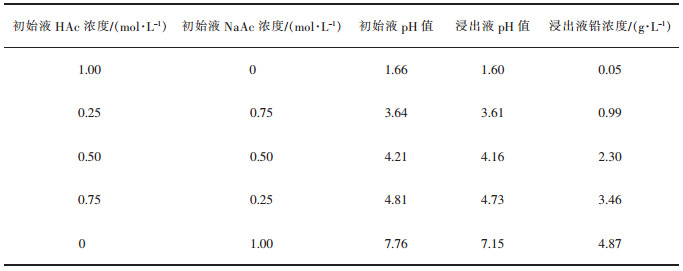
根据同时平衡原理和质量守恒原则,浸出达到平衡后,方程(1)、(4)~(10)、(12)~(15)、(17)联立可计算出[Ac]T为1 mol/L不同HAc和NaAc比例下初始液浸出硫酸铅平衡后各溶解物种的lgc-[Na]/[Ac]T图,如图 8所示。在此基础上,绘制初始液[H+]、浸出液[H+]和[Pb]T的-lgc-[Na]/[Ac]T图,如图 9。由图 9可见,NaAc溶液更有利于硫酸铅的浸出,浸出总铅浓度随着初始液[Na]/[Ac]T降低而降低。通过对比浸出前后溶液pH值的变化,可以发现浸出后pH值有所下降,这表明初始液与硫酸铅混合后部分HAc将电离出Ac-参与Pb2+的配位反应。
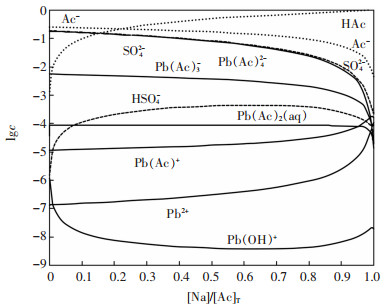 |
| 图 8 HAc-NaAc混合溶液浸出硫酸铅各溶解物种的lgc-[Na]/[Ac]T图(25 ℃,[Ac]T=1 mol/L) Fig. 8 lgc-[Na]/[Ac]T diagram of dissolved species in the leaching of lead sulfate by HAc-NaAc mixed solution (25 ℃, [Ac]T=1 mol/L) |
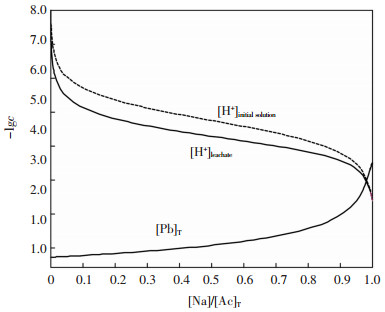 |
| 图 9 初始液[H+]、浸出液[H+]和[Pb]T的-lgc-[Na]/[Ac]T图(25 ℃,[Ac]T=1 mol/L) Fig. 9 -lgc-[Na]/[Ac]T diagram for [[H+] of initial solution, [H+] and [Pb]T of leachate (25 ℃, [Ac]T=1 mol/L) |
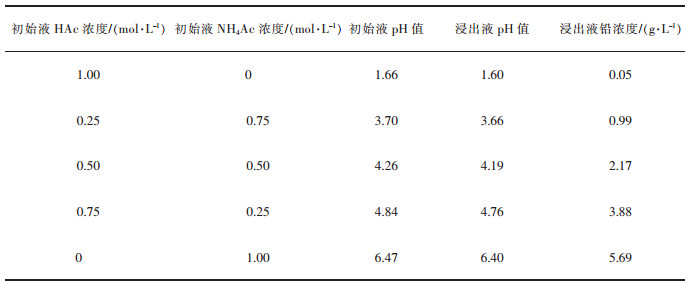
为了验证上述热力学分析的合理性,分别配制了HAc-NaAc混合溶液和HAc-NH4Ac混合溶液浸出硫酸铅。所用药剂均为分析纯(国药集团化学试剂有限公司出厂)。浸出温度为35 ℃,浸出时间为120 h,所得结果分别如表 2和表 3所示。由表 2可见,硫酸铅浸出后溶液pH值均略有下降;并且,随着NaAc比例增加,铅的浸出率逐渐增大,表明该实验结果与热力学计算结果的趋势是一致的。由表 3可见,与HAc-NaAc混合溶液的数据类似,硫酸铅的浸出率也是随着NH4Ac比例增加而增加。关于HAc-NH4Ac浸出硫酸铅体系的热力学计算,常用的热力学数据手册缺少Pb2+与NH3配位的相关数据,而从文献[22]中可找出Pb(NH3)2+形成常数,lgK为1.55,表明Pb2+与NH3配位反应能力较弱,因此,即便是考虑Pb(NH3)2+形成常数,该体系的热力学计算结果应与HAc-NaAc浸出体系接近。
| 表 2 HAc和NaAc混合溶液浸出硫酸铅的实验数据 Table 2 Experimental data of lead sulfate leaching by mixed solutions of HAc and NaAc |
 |
| 点击放大 |
| 表 3 HAc和NH4Ac混合溶液浸出硫酸铅的实验数据 Table 3 Experimental data of lead sulfate leaching by mixed solutions of HAc and NH4Ac |
 |
| 点击放大 |
以文献[11]的数据为例。当采用6 mol/L乙酸浸出卡尔多炉炉渣,铅浸出率不到25%;而固液比及其他反应条件相同的情况下,采用2 mol/L乙酸钠溶液时,铅浸出率可达75%,若采用2 mol/L乙酸钠和1 mol/L乙酸的混合溶液浸出,便可达到98%的铅浸出率。由此可见,乙酸钠浓度对铅的配位浸出的影响比乙酸浓度更显著。根据3.1热力学分析所得的优势物种Pb(Ac)42-,分别列出硫酸铅与乙酸钠及乙酸的配位反应方程式如(18)和(19)所示。可以看出,乙酸钠配位浸出硫酸铅不产酸,而纯乙酸溶液浸出硫酸铅后将产酸。因此,采用纯乙酸溶液浸出含硫酸铅的物料,若被浸出物料中无碱性物质与酸中和,则可引起pH值下降至对配位浸出不利的范围,从而抑制硫酸铅的溶解。
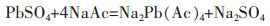
|
(18) |
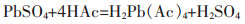
|
(19) |
1) 通过对Pb(OH)2-H2O体系热力学计算结果的分析,评价了《兰氏化学手册》中Pb(OH)64-形成常数的合理性。计算时考虑Pb(OH)64-存在所得结果明显不符合Pb(OH)2的化学性质,因此,不建议在计算过程中采用该项数据。
2) 通过对乙酸根配位浸出硫酸铅的热力学平衡图的分析,明确了铅与乙酸根的配位状态。在不同总乙酸根浓度下,pH值6~9的范围对乙酸根浸出硫酸铅比较有利,Pb(Ac)42-是该pH值区域中铅的主要物种。并且,总乙酸根浓度越高,浸出液中Pb(Ac)42-与游离Ac-的浓度比越高,表明浸出硫酸铅的乙酸根利用率随之增大。
3) 根据电中性原则、质量守恒原则和同时平衡原理,计算并绘制了不同HAc和NaAc比例的初始液浸出硫酸铅平衡后各溶解物种的lgc-[Na]/[Ac]T图。通过对不同HAc和NaAc比例的初始液浸出硫酸铅pH值变化和理论铅溶解度的热力学分析,表明浸出总铅浓度随着初始液[Na]/[Ac]T升高而升高,NaAc溶液更有利于硫酸铅的浸出。并且,浸出后pH值有所下降,说明初始液与硫酸铅混合后部分HAc将电离出Ac-参与Pb2+的配位反应。验证性实验结果与热力学计算结果在趋势上是一致的。
| [1] |
中华人民共和国质量监督检验检疫总局, 中国有色金属学会铅精矿化学分析方法铅量的测定酸溶解-EDTA滴定法, GB/T 8152.1-2006[S].北京: 中国标准出版社, 2006.
|
| [2] |
中华人民共和国质量监督检验检疫总局, 中国有色金属学会铜矿石、铅矿石和锌矿石化学分析方法第2部分: 铅量测定, GB/T 14353.2-2010[S].北京: 中国标准出版社, 2010.
|
| [3] |
范丽新, 陆青. EDTA滴定法测定粗锡中铅[J].
冶金分析, 2017, 37(5): 68–72.
|
| [4] |
袁永海, 尹昌慧, 唐沈, 等. EDTA滴定法测定铅矿石中铅含量时铋的干扰及消除[J].
理化检验(化学分册), 2016, 52(12): 1397–1399.
|
| [5] |
李先和, 万双. 硫酸铅分离-EDTA滴定法测定铜闪速冶炼烟尘中的铅[J].
中国无机分析化学, 2020, 10(2): 15–19.
|
| [6] |
MA C, SHU Y, CHEN H. Preparation of high-purity lead oxide from spent lead paste by low temperature burning and hydrometallurgical processing with ammonium acetate solution[J].
RSC Advances, 2016, 6(25): 21148–21155. DOI: 10.1039/C5RA23559F. |
| [7] |
丁龙, 杨建广, 南天翔, 等. 基于隔膜电积的硫酸铅渣湿法提铅新工艺及电化学机理[J].
中国有色金属学报, 2020, 30(7): 1677–1690.
|
| [8] |
周文芳.废铅膏湿法回收高纯氧化铅实验研究[D].湘潭: 湘潭大学, 2016.
|
| [9] |
ZHU X F, XIONG H, YANG J K, et al. Leaching of spent lead acid battery paste components by sodium citrate and acetic acid[J].
Journal of Hazardous Materials, 2013, 250/251: 387–396. DOI: 10.1016/j.jhazmat.2013.02.018. |
| [10] |
ZHU X F, ZHANG W, ZHANG L, et al. A green recycling process of the spent lead paste from discarded lead-acid battery by a hydrometallurgical process[J].
Waste Management & Research, 2019, 37(5): 508–515. |
| [11] |
蔡启果, 王海峰, 王家伟, 等. 电解锰阳极渣矿物学特征分析与研究[J].
矿产综合利用, 2019(1): 74–77.
|
| [12] |
张宏波.电解锰阳极泥中铅的迁移行为研究[D].武汉: 武汉工程大学, 2016.
|
| [13] |
罗进波.电解锰阳极渣杂质形态及去除机理研究[D].贵阳: 贵州大学, 2016.
|
| [14] |
吕建军, 肖连生, 张启修, 等. 用乙酸-乙酸钠浸出及亚硫酸钠沉淀分离回收卡尔多炉渣中的铅[J].
矿冶工程, 2013, 33(1): 92–96.
|
| [15] |
AYDOGAN S, ARAS A, UCAR G, et al. Dissolution kinetics of galena in acetic acid solutions with hydrogen peroxide[J].
Hydrometallurgy, 2007, 89(3): 189–195. |
| [16] |
GIORDANO T H. Anglesite (PbSO4) solubility in acetate solutions: The determination of stability constants for lead acetate complexes to 85℃[J].
Geochimica et Cosmochimica Acta, 1989, 53(2): 359–366. DOI: 10.1016/0016-7037(89)90387-6. |
| [17] |
BURNS E A, HUME D N. Acetato complexes of Lead in aqueous solution[J].
Journal of the American Chemical Society, 1956, 78(16): 3958–3962. DOI: 10.1021/ja01597a025. |
| [18] |
黄德发. 硫酸铅在醋酸钠溶液中溶解情况的试验[J].
怀化学院学报, 1985(1): 66–69.
|
| [19] |
SPEIGHT J G.
Lange's Handbook of Chemistry (16th Edition)[M]. New York: McGraw-Hill Professional, 2005.
|
| [20] |
郭伟强, 张培敏, 边平凤.
分析化学手册第一分册基础知识与安全知识[M]. 3版. 北京: 化学工业出版社, 2016.
|
| [21] |
SMITH R M, MARTELL A E.
Critical stability constants, vol. 4, inorganic complexes[M]. New York: Plenum Press, 1980.
|
| [22] |
MULLA F, MARSICANO F, NAKANI B S, et al. Stability of ammonia complexes that are unstable to hydrolysis in water[J].
Inorganic Chemistry, 1985, 24(19): 3076–3080. DOI: 10.1021/ic00213a042. |
 2020, Vol. 11
2020, Vol. 11


