| NaCl-KCl-NaF-WO3熔盐体系W6+的电化学行为 |
2. 中南大学冶金与环境工程学院,长沙 410006
2. School of Metallurgy and Environment, Central South University, Changsha 410006, China
钨的熔点高(3 410 ℃),硬度大,耐腐蚀性能好,钨被称为“工业牙齿”或“工业食盐”,在国民经济的应用十分广泛,涉及的领域包括冶金、机械设备、化工、矿业、金属加工、重型制造业等.
熔盐电解法制备金属钨目前是一个较热的研究方向,并且已经证实技术上可行.钨离子在阴极被还原,生成超细钨粉,与传统的高温热还原法制备钨粉相比,工艺流程短,产品纯度高.冯乃祥等[1, 2]在NaCl-KCl-Na2WO4-WO3熔盐体系中通过电解氧化钨,制得了平均粒度为0.96 μm的高纯超细钨粉. Nakajima[3]、Nitta等[4]在ZnCl2-NaCl-KCl-KF-WO3熔盐体系中进行电解,获得了4.2 μm厚度的钨膜.廖春发等[5-7]对钨酸盐熔盐电解直接制备钨粉的可行性进行分析讨论,并以钨酸钠、钨酸钙熔盐为原料,通过电解NaCl-CaCl2-CaWO4/Na2WO4熔盐制得纯度达99 %、平均粒度小于2 μm的钨粉. Sun[8]和fan等[9, 10]也在不同的熔盐体系中通过电化学方法获得颗粒尺寸在16 μm以下的金属钨.
当前有关熔盐电解法制备钨技术的基础理论尚无系统的研究报道,因此,本实验致力于钨电解过程的阴极行为研究,探明W(Ⅵ)离子在钨电极上还原的电化学行为,以及电极过程动力学参数,为熔盐电解制备钨的应用研究提供理论基础.
1 实验实验装置及化学试剂.实验采用三电极体系:工作电极为钨丝(d 1.0 mm,99.95 %),参比电极为铂丝(d 1.0 mm,99.99 %),铂丝和钨丝均套上刚玉管进行密封,只露出伸入熔盐的部分,以减少高温环境下的损伤.石墨作对电极,高纯石墨坩埚作为电解槽.在实验前对钨丝和铂丝打磨、清洗,实验前将配好的料置于干燥箱(120 ℃)烘12 h.电解实验过程电解槽充满惰性气体氩气,避免其它氧化性气体对实验的干扰.电化学工作站测试仪为AUTOLAB·PGSTA302,由荷兰AUTOLAB科学仪器技术有限公司生产,实验数据由计算机自动采集并进行存储.
实验采用5 %WO3(指质量分数)作为原料,35 %NaCl-40 %KCl-25 %NaF(摩尔分数)为电解质的熔盐体系,实验化学试剂及其部分参数见表 1.
| 表 1 化学试剂 Table 1 Chemical rengent |
 |
| 点击放大 |
温度为973 K时NaCl-KCl-NaF熔盐体系中,电解质的理论分解电压见表 2[11].
| 表 2 电解质973 K对应的理论分解电位 Table 2 The theoretical decomposition potential corresponding to electrolyte 973 K |
 |
| 点击放大 |
从表 2可以看出,NaCl的分解电势更正,因此,单独对该电解质体系电解时,金属钠先在阴极上析出;当加入WO3后,体系中会形成含钨络合阴离子,这种阴离子放电电位更正,会在阴极沉积出金属钨.
2 结果和讨论 2.1 NaCl-KCl-NaF-WO3熔盐体系的循环伏安法为更好地研究钨离子在熔盐体系中的还原机理,首先对不含原料的NaCl-KCl-NaF电解质体系在973 K以0.3 V/s速率进行循环伏安测试,结果如图 1所示.
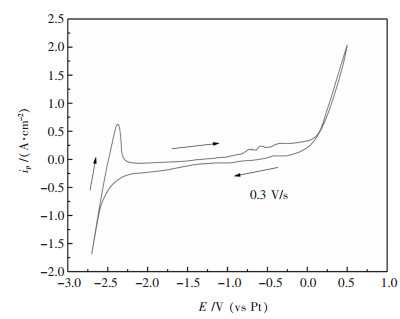 |
| 图 1 973 K时35 %NaCl-40 %KCl-25 %NaF熔盐体系的循环伏安曲线 Fig. 1 Cyclic voltammogram of 35 %NaCl-40 %KCl-25 %NaF molten system at 973 K |
从图 1看出,在阴极电位增加至-2.7 V时,电流开始迅速增加,表明此时金属钠开始在电极上析出,与回扫过程中出现的氧化峰相对应.在-2.7~0.5 V范围内没有出现其它的氧化还原峰,说明在该电位区间,熔盐电解质的电化学性质较稳定,不存在氧化还原反应,试剂中微量的杂质对实验结果无影响.
图 2所示为973 K时在NaCl-KCl-NaF加入5 %(质量分数)WO3后的循环伏安图,扫描范围为-0.3~-2.7 V;从图 2可看出,在约-0.69 V左右出现了一个比较明显的还原峰A,在-1.1 V左右出现了不明显的还原峰B.也可以视为在-0.5~-1.2 V的电位区间内出现了一个范围较大的还原峰.
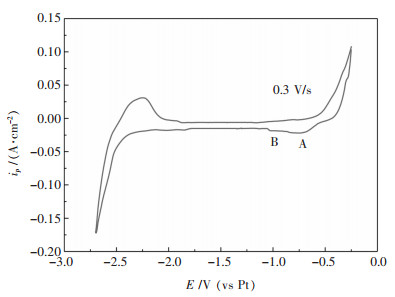 |
| 图 2 973 K时35 % NaCl-40 %KCl-25 %NaF- 5 %WO3熔盐体系的循环伏安曲线 Fig. 2 Cyclic voltammogram of 35 % NaCl-40 %KCl-25 %NaF-5 %WO3 molten system at 973 K |
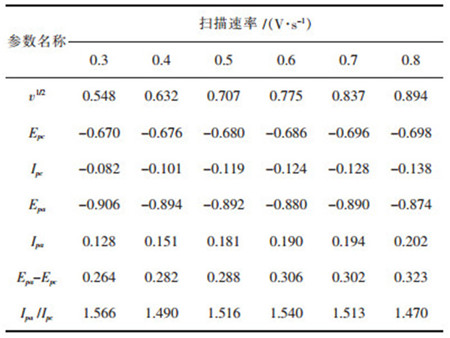
在NaCl-KCl-NaF-WO3熔盐体系不同扫描速率下的循环伏安曲线如图 3所示,扫描范围为-0.2~-1 V.从图 3中可以看出,阴极扫描过程中出现一对显著的氧化还原峰A’/A,并且随着扫描速率增大,还原峰A峰电流增大,峰电位逐渐向负向移动,氧化峰A’的峰电流逐渐增大,峰电位逐渐向正向移动. 图 3中循环伏安曲线的参数见表 3.
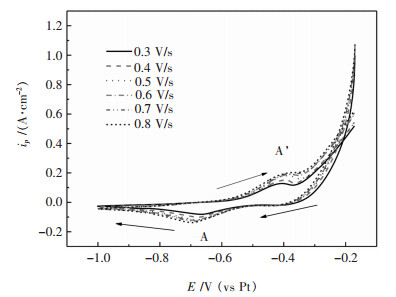 |
| 图 3 35 % NaCl-40 KCl-25 %NaF-5 %WO3熔盐体系973 K在不同扫描速率下的循环伏安曲线 Fig. 3 Cyclic voltammograms at different scan rates in 35 % NaCl-40 %KCl-25 %NaF-5 %WO3 molten system at 973 K |
| 表 3 氧化峰A’和还原峰A氧化峰的电化学参数 Table 3 Electrochemical parameters of oxidation peak A' and reduction peak A |
 |
| 点击放大 |
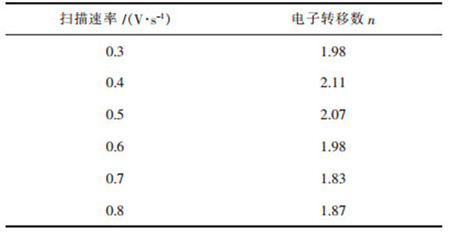
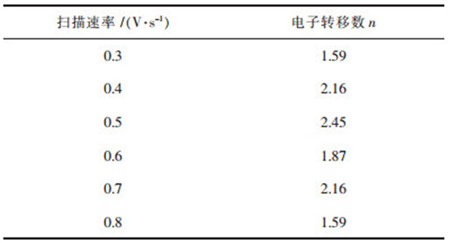
从表 3可以看出,随着扫描速率的增大,发现阴极还原峰电位逐渐向负方向移动,还原峰电流增大,这是由于扫描速率的增大使得阴极极化作用增强. |Ipa/Ipc|≠1,Epa-Epc>2.3RT/(nF)=0.0964.判断W(Ⅵ)的第1步还原过程为准可逆反应过程,利用公式(1)计算出还原峰A和氧化峰B不同扫描速率下的电子转移数分别见表 4和表 5[12].
| 表 4 不同扫描速率下还原峰A的电子转移数 Table 4 Number of electron transfer of reduction peak A at different scanning rates |
 |
| 点击放大 |
| 表 5 不同扫描速率下氧化峰A’的电子转移数 Table 5 Number of electron transfer of reduction peak A' at different scanning rates |
 |
| 点击放大 |
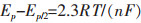
|
(1) |
其中Ep为峰电位,Ep/2为半峰电位(半峰电流对应的电位称为半峰电位),R为气体常数8.314 J/(kmol),T为工作温度(973 K),n为电子转移数,F为法拉第常数96 485 C/mol.
电子转移数约为2,则W(Ⅵ)在工作电极钨电极上,第1步还原为两电子的反应,还原峰A的电极反应方程式:
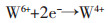
|
(2) |
氧化峰A’的电极反应方程式:
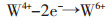
|
(3) |
图 4所示为还原峰A的峰电流密度ip和v1/2的关系曲线,对图 3中的曲线进行拟合,得到的直线方程为Y=0.15686x-0.0146,相关系数R2=0.99417.可以看出ip与v1/2呈良好的线性关系,符合Randles-Sevcik方程, 表明W6+在钨电极上的还原过程受扩散控制[13, 14].
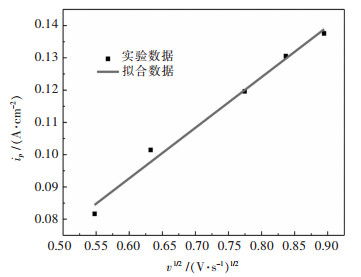 |
| 图 4 峰电流Ipc与扫描速率平方根v1/2图 Fig. 4 The plot of peak current and square root of scan rate |
为了研究W(Ⅵ)的第2步还原过程的可逆性. 图 5所示为973 K温度下在NaCl-KCl-NaF-WO3熔盐体系不同扫描范围的循环伏安曲线.曲线a的扫描范围为-0.25~-1.25V,曲线b的扫描范围为-0.2~-1 V,对比两曲线,在扫描至-1.25 V后回扫的过程中氧化峰上升的趋势与曲线a不同.说明氧化过程因为扫描至还原峰B的电位,电流受到影响.还原峰B对应的反应为W(Ⅵ)还原的第2步电化学还原过程是准可逆的.
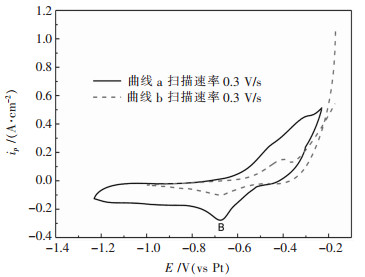 |
| 图 5 35 % NaCl-40 %KCl-25 %NaF-5 %WO3熔盐体系973 K在不同扫描范围的循环伏安曲线 Fig. 5 Cyclic voltammograms at different scan ranges in 35 % NaCl-40 %KCl-25 %NaF-5 %WO3 molten system at 973 K |
2.2 方波伏安法
方波伏安法比循环伏安法更为灵敏.为进一步研究W(Ⅵ)的第1步还原反应转移的电子数,并判断是否为可逆反应.首先研究图 2中的还原峰A,图 6所示为NaCl-KCl-NaF-WO3熔盐体系不同扫描频率的方波伏安曲线,扫描范围为-0.5~-0.9 V.在-0.68 V左右出现一个还原峰电流,与循环伏安曲线还原峰A峰的电位一致,电子转移数的计算公式为:
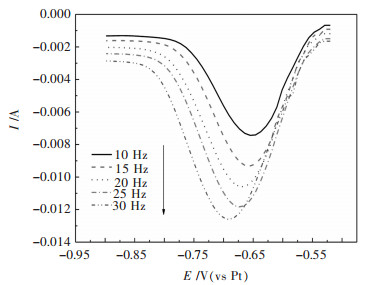 |
| 图 6 35 %NaCl-40 %KCl-25 %NaF-5 %WO3熔盐体系973 K在不同扫描频率的方波伏安曲线 Fig. 6 Square wave voltammetry curves at different scan frequencies in 35 %NaCl-40 %KCl-25 %NaF-5 %WO3 molten salt at 973 K |
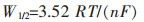
|
(4) |
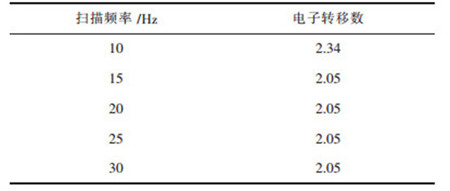
其中,W1/2为还原峰一半的峰距离,W1/2的取法如图 7所示,左半部分的峰型更符合高斯峰,计算结果更为准确.根据公式(4)计算出图 6中不同扫描频率下的还原峰的电子转移数如表 6所列.
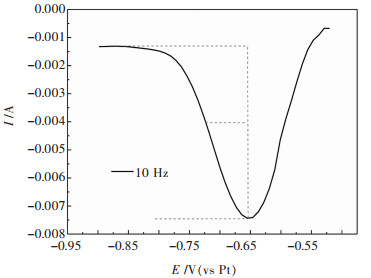 |
| 图 7 半峰宽W1/2的做法示意 Fig. 7 Schematic diagram of the half-width W1/2 |
| 表 6 扫描范围为-0.5 ~ -0.9 V的不同扫描频率的电子转移数 Table 6 Number of electron transfer at different scanning frequencies with a scan range of -0.5 to -0.9 V |
 |
| 点击放大 |
从图 6可以看出,随着扫描频率的增大,峰电位向负移,峰电流逐渐增大,与循环伏安得到的结果一致.
从表 6可知,还原峰A的电子转移数约为2,结合循环伏安曲线可以分析出,W(Ⅵ)在W电极上第1步电化学还原过程为2电子的反应,析出电位约为-0.5 V,电极反应为:
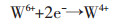
|
(5) |
如图 8所示为峰电流(Ip)与扫描频率的二分之一次方(f1/2)的关系
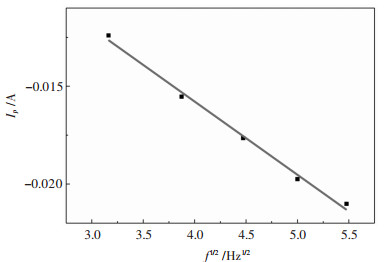 |
| 图 8 峰电流(Ip)与扫描频率的二分之一次方(f1/2)的关系曲线 Fig. 8 Peak current (Ip) versus the frequency of the scan frequency (f1/2) |
对图 8实验数据进行拟合,得到的关系式为Y=-0.00375x-7.98542×10-4,相关系数R2=0.99724. Ip与f1/2呈良好的线性相关性,与循环伏安曲线得到的结论一致.进一步验证W(Ⅳ)的还原过程受扩散控制.
在对图 2中还原峰A的方波伏安曲线研究后,研究图 2中还原峰B的方波伏安曲线. 图 9所示为不同扫描频率的方波伏安曲线,扫描范围为-0.67~-2.7 V.
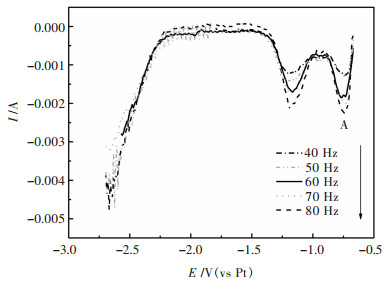 |
| 图 9 35 %NaCl-40 %KCl-25 %NaF-5 %WO3(质量分数)熔盐体系973 K在不同扫描频率的方波伏安曲线 Fig. 9 Square wave voltammetry curves at different scan frequencies in 35 %NaCl-40 %KCl-25 %NaF-5 %WO3 molten salt at 973 K |
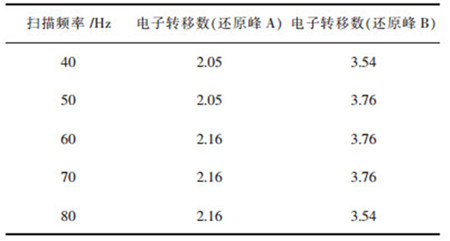
计算的还原峰A和还原峰B的电子转移数见表 7.从表 7计算出对应的-0.75V左右的电位出现还原峰对应的电子转移数约为2,说明了W(Ⅵ)第1步是两电子转移的还原反应,即W(Ⅵ)→W(Ⅳ).第2个还原峰对应还原电位-1.25 V左右,转移电子数为4,即W(Ⅳ)→W(0).
| 表 7 方波伏安扫描范围为-0.67~-2.7 V的不同频率的电子转移数 Table 7 Number of electron transfer at different frequencies for square wave voltammetry scanning range from -0.67 to -2.7 V |
 |
| 点击放大 |
2.3 计时电流法
在研究W(Ⅵ)离子在NaCl-KCl-NaF-WO3熔盐中钨电极上还原的电子转移历程和速率控制步骤后,采用计时电流法研究W(Ⅵ)离子在W电极上还原的成核生长机制. 图 10所示是973 K条件下NaCl-KCl-NaF-WO3熔盐体系在-1.2 V电位下的计时电流曲线.
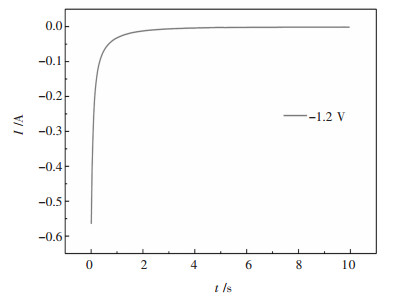 |
| 图 10 -1.2 V电位下的计时电流曲线 Fig. 10 Timing current diagram at -1.2 V potential |
从图 10中可以看出,向工作电极施加一个电位,在2 s内,电流阶跃到一个定值而保持恒定.这是由于W(Ⅵ)发生还原反应,导致W(Ⅵ)浓度降低,电极附近局部电阻增大,所以电流在这段降低的比较快,这是熔盐电解质中的W(Ⅵ)向电极表面的扩散速率小于电极反应速率的结果,所以判断在此阶段W(Ⅵ)反应受扩散控制,与前面所得的结论一致.当W(Ⅵ)向电极表面的扩散速率与电极反应速率平衡,反应受到电化学反应-扩散混合控制,电流趋于一定值.
计时电流中常用Cottrell方程[15]计算扩散系数:
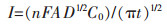
|
(6) |
式(6)中:I为极化电流(A),n为电子转移数,F法拉第常数(96 485 C/mol),A为电极面积(0.41 cm2),C0为电活性物质的浓度(0.015 28 mol/cm3),t为极化时间(s).
图 11所示为973 K温度下施加-1.2 V的电位极化电流I与t-1/2的关系曲线.对图 11中实验数据进行拟合,得到的关系式为Y=0.04409x-0.02459.相关系数R2=0.99897.忽略误差造成的影响,由Cottrell方程,则有斜率0.04409=(nFAD1/2C0)/π1/2,求得扩散系数为1.05×10-9 cm2/s.
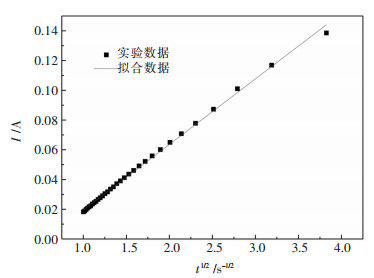 |
| 图 11 -1.2 V电位下极化电流I与t-1/2的关系曲线 Fig. 11 Relationship between polarization current I and t-1/2 at -1.2 V potential |
W离子在钨电极上的沉积有2种不同的成核过程[16]:
对于瞬时成核:
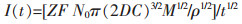
|
(7) |
对于渐进成核:
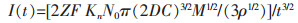
|
(8) |
式(7)、式(8)中:I(t)为时间为t时的极化电流(A),Z为化合价,F为法拉第常数96 485(C/mol),D为扩散系数(cm2/s),C为沉积离子的体积浓度(mol/cm3),M为沉积物质的原子量(g/mol),ρ为沉积物质的密度(g/cm3),t为极化时间(s),Kn为晶核常数.
图 12所示为973 K温度下恒电位为-1.2 V时极化电流I与t1/2或t2/3的关系曲线.分别拟合得到的直线方程为Y=0.0643x-0.0819、Y=0.02776x-0.04468,相关系数分别为R2=0.99669,R2=0.97263.通过图形对比,I与t1/2拟合的效果较与t3/2的更好.则电结晶过程是瞬时成核过程.
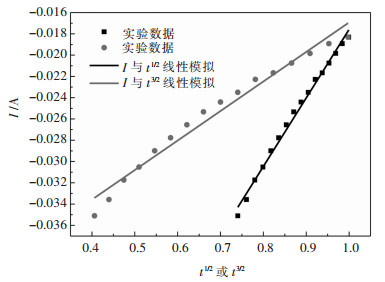 |
| 图 12 -1.2 V电位下极化电流I与t1/2或t3/2关系曲线 Fig. 12 Polarization current I and t1/2 or t3/2 curve at -1.2 V potential |
2.4 计时电位法
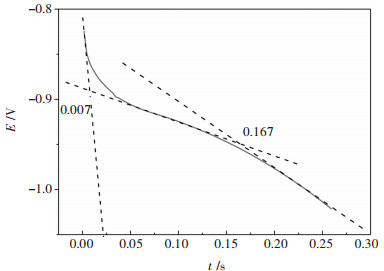
在探明W(Ⅵ)离子在W电极上还原的成核生长机制后,研究W(Ⅵ)离子在钨电极上还原的电化学动力学过程. 图 13所示为973 K条件下NaCl-KCl-NaF-WO3熔盐体系计时电位曲线.
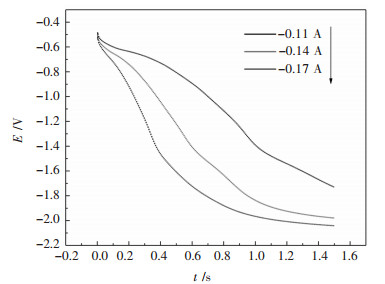 |
| 图 13 973 K时35 %NaCl-40 %KCl-25 %NaF- 5 %WO3熔盐体系计时电位曲线 Fig. 13 Chronopotentiograms in 35 %NaCl- 40 %KCl-25 %NaF-5 %WO3 molten systen at 973 K |
在AB段表示双电层充电过程.在-0.7 V左右出现的平台a对应的反应与循环伏安曲线和方波伏安曲线还原峰A相同,此时电极附近的W(Ⅵ)离子还原,CD段为电极表面浓度降到一定的时候,还原反应得到的电子和外电路给电子速度不一致,电位下降,双电层充电.在-1.4 V左右的一个拐点b,出现的平台不是很明显,对应的为W(Ⅳ)离子还原,电极表面发生还原反应得到的电子大于外电路给电子速度,电位下降.当达到电解质Na(Ⅰ)的还原电位,Na(Ⅰ)离子还原得电子与外电路给电子达到平衡,对应平台c.随着电流增大,电化学反应速率增大,于是电极表面W(Ⅵ)浓度降低的更快,浓差极化增大,计时电位曲线平台不断向负方向移动.
无论电极反应可逆与否,根据Sand方程[17]:
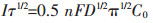
|
(9) |
式(9)中,τ为过渡时间,τ的选择如图 14所示,n为电子转移数,F为法拉第常数(96 485 C/mol),A为电极面积(0.41 cm2),C0为电活性物质的浓度(0.01528 mol/cm3),t为时间(s),D为扩散系数(cm2/s). Iτ1/2的值约为0.105.经计算得到的扩散系数为1.62×10-9 cm2/s,与计时电流计算出的扩散系数的数量级一样.
 |
| 图 14 τ的取值示意 Fig. 14 Schematic diagram of τ |
3 结论
1)在973 K条件下NaCl-KCl-NaF-WO3熔盐体系中W(Ⅵ)的还原分2步完成. W(Ⅵ)第1步还原过程为两电子转移,电极反应方程式为W6++2e-→W4+; 第2步还原过程为四电子转移过程,电极反应方程式为W4++4e-→W,且都为准可逆反应.
2)W(Ⅵ)在钨电极上的电化学还原过程受扩散控制,且计算出W(Ⅵ)在NaCl-KCl-NaF-WO3熔盐体系中的扩散系数约为1.05×10-9 cm2/s.
3)NaCl-KCl-NaF-WO3熔盐体系中钨的电结晶过程为瞬时成核过程,
| [1] |
冯乃祥, 刘希诚, 孙阳. 用熔盐电解法制备超细钨粉[J].
材料研究学报, 2001, 15(4): 459–462.
DOI: 10.3321/j.issn:1005-3093.2001.04.015.
|
| [2] |
冯乃祥, 孙阳, 葛贵军. NaCl-Na2WO4-WO3系熔盐电解法制备超细钨粉的研究[J].
稀有金属, 2001, 25(5): 374–377.
DOI: 10.3969/j.issn.0258-7076.2001.05.013.
|
| [3] |
NAKAJIMA H, NOHIRA T, HAGIWARA R, et al. Electrodeposition of metallic tungsten films in ZnCl2-NaCl-KCl-KF-WO3 melt at 250℃[J].
Electrochimica Acta, 2007, 53(1): 24–27. DOI: 10.1016/j.electacta.2007.04.082. |
| [4] |
NITTA K, NOHIRA T, HAGIWARA R, et al. Electrodeposition of tungsten from ZnCl2-NaCl-KCl-KF-WO3 melt and investigation on tungsten species in the melt[J].
Electrochimica Acta, 2010, 55(3): 1278–1281. DOI: 10.1016/j.electacta.2009.10.021. |
| [5] |
廖春发, 杨文强, 王旭, 等. 由钨酸盐熔盐电解直接制备钨粉的可行性分析[J].
有色金属科学与工程, 2011, 2(4): 4–6.
|
| [6] |
王旭, 廖春发, 杨文强, 等. CaWO4-NaCl-CaCl2体系熔盐电解制备钨粉的表征与电化学分析[J].
中国有色金属学报, 2012, 22(5): 1482–1487.
|
| [7] |
王旭, 廖春发, 汪浩. NaCl-CaCl2-Na2WO4体系电解制备钨粉过程表征[J].
北京工业大学学报, 2012, 38(6): 938–941.
|
| [8] |
SUN N B, ZHANG Y C, JIANG F, et al. Preparation of tungsten coatings on graphite by electro-deposition via Na2WO4-WO3 molten salt system[J].
Fusion Engineering and Design, 2014, 89(11): 2529–2533. DOI: 10.1016/j.fusengdes.2014.05.027. |
| [9] |
FAN J, ZHANG Y, SUN N, et al. Effect of direct current density on microstructure of tungsten coating electroplated from Na2WO4-WO3-NaPO3 system[J].
Applied Surface Science, 2014, 317: 867–874. DOI: 10.1016/j.apsusc.2014.09.031. |
| [10] |
JIANG F, ZHANG Y, SUN N, et al. Effect of pulse current parameters on microstructure of tungsten coating electroplated from Na2WO4-WO3-NaPO3[J].
Applied Surface Science, 2015, 331: 278–284. DOI: 10.1016/j.apsusc.2015.01.031. |
| [11] |
张明杰, 王兆文.
熔盐电化学原理与应用[M]. 北京: 化学工业出版社, 2006: 231-238.
|
| [12] |
王川, 陈晓明, 何佩鑫, 等. 可逆、准可逆和不可逆表面反应循环伏安法的数字模拟[J].
高等学校化学学报, 1991, 7(12): 875–878.
|
| [13] |
BARD A J, FAULKNER L R.
Electrochemical fundamentalsand applications (2nd Edition)[M]. New York: John Wiley and Sons INC, 2003: 225-227.
|
| [14] |
LI M, SUN T T, LIU B, et al. Elec-trochemical behavior of Dy(Ⅲ) and the selective formation of Dy-Ni intermetallic compounds in LiCl-KCl eutectic melts[J].
Acta Physico-Chimica Sinica, 2015, 31(2): 309–314. |
| [15] |
PAUL M S MONCK.
Fundamentals of electroanalytical chemistry[M]. Beijing: Chemical Industry Press, 2001: 100-101.
|
| [16] |
王岗.超细钨粉及碳化钨粉制备工艺研究[D].上海: 上海交通大学, 2009.
|
| [17] |
MACDONALD D D.
Transient techniques in electrochemistry[M]. New York: Plenum Press, 1979.
|
 2019, Vol. 10
2019, Vol. 10


